5. Парадоксы человеческого генома
5. Парадоксы человеческого генома
Тогда я задумался над вопросами глубокими и фундаментальными, над тем, отчего эта первая клетка, должная развиться в плаценту, оказывает такое влияние на репликацию вируса. Я размышлял над этим и над подобными же вещами следующие тридцать лет.
Луис Вильярреал [27]
Честно говоря, для всех нас явилось шоком удивительное, почти невероятное достижение, представленное в феврале 2001 года сразу двумя конкурирующими группами. Тогда впервые были обнародованы результаты полной расшифровки человеческого генома. Несомненно, для биологии это достижение воистину потрясающее, исполинское и обреченное войти в историю как величайшее человеческое достижение двадцать первого столетия — достойный преемник славы открытия ДНК в двадцатом столетии и построения дарвиновской теории в девятнадцатом.
Но для обычной, далекой от науки публики парадоксальность великого открытия целиком потерялась среди журналистского визга и профессиональной терминологии. Ведь даже ученым это расшифровка генома не разъяснила целиком и полностью, как же именно работают гены и хромосомы, и тем паче не разъяснило, отчего и почему один человек так отличается от другого.
Я уже упоминал об удивлении, сопровождавшем открытие того факта, что наша библиотека генов относительно невелика: всего двадцать тысяч томов. Наш набор протеинов, куда более многочисленный, отнюдь не кодируется посредством взаимно однозначного соответствия с определенным геном. Каждый белок кодируется набором определенных участков гена, известных как «экзоны», разделенных загадочными не участвующими в кодировании белков участками ДНК, известными как «интроны». Более того, контроль над процессом кодирования белков оказался на удивление сложным. В ДНК присутствуют определенные «бюрократические» участки, соседствующие с каждым геном либо окаймляющие его, и эти участки решают, как и когда данный ген активируется. Другое собрание «бюрократов» решает, какие именно экзоны задействовать и соединить в единое целое посредством процесса, называемого «альтернативным сплайсингом». Для иллюстрации того, до каких крайностей может дойти этот удивительный механизм, рассмотрим ген мухи-дрозофилы, называемый Dscam. Этот ген способствует росту нервов у эмбриона мухи-дрозофилы[28]. Он составлен из двадцати четырех экзонов. С трудом поддается воображению, как генетические «бюрократы» смогли выбрать и состыковать в нужном порядке экзоны из разных участков ДНК — и при том, что пришлось выбирать из 38 000 различных комбинаций. И это все для кодирования единственного белка!
В открытом человеческом геноме оказалось много поразительного: от сложнейшей системы контроля до таинственно бездействующих интронов, играющих, однако, немаловажную роль в странной лотерее построения белков. Но страннее всего оказалось распределение частей человеческого генома, какими они предстали после работы по дешифровке. Было довольно-таки обескураживающим обнаружить, что «позвоночная» часть нашего генома, то, что делает нас теплокровными животными и людьми, — занимает не более полутора процентов генома. В то же время человеческие эндогенные вирусы, HERV, занимают почти девять процентов! Более того, огромные куски генома соответствуют вовсе уж непонятным образованиям, например, таким, как LINE (занимает 21 процент) и SINE (занимает 13 процентов), а также включает большое число образований, известных как Alu-повторы.
Перед нами лежит во всем гаргантюанском великолепии парадокс нашего существования, наследство миллиардов лет эволюции. Но если б мы только понимали, что же именно перед нами…
Как в матрешке, здесь за одной тайной скрываются все новые и новые. Так начнем же штурмовать их простым вопросом: что такое человеческие эндогенные вирусы, или HERV, и отчего они занимают столь значительную часть человеческого генома?
Боюсь, тянущееся десятилетиями упорное нежелание рассматривать вирусы в качестве симбионтов привело к целому ряду недоразумений и непониманий. И теперь, чтобы двигаться вперед, необходимо их разрешить.
В 1959 году выдающийся генетик, нобелевский лауреат Сальвадор Лурия предположил: вирусы-фаги — это мобильные сегменты генетического кода бактерии-носителя, чья функция — переносить ДНК от одной бактерии к другой. По-видимому, его мнение повлияло на исследования выдающегося биолога и тоже нобелевского лауреата Говарда Темина, одного из открывателей принципиально важного для ретровирусов энзима, обратной транскриптазы. Открытие обратной транскрипции Темином и Дэвидом Балтимором пошатнуло главную догму генетики того времени. Это открытие показало: генетическая информация не обязательно идет от ДНК через РНК к белку. В определенных обстоятельствах, прежде всего с участием ретровирусов, генетическая информация может передаваться от РНК к ДНК. Это был революционный прорыв, давший возможность понять природу ретровирусов. В 1970 году Темин экстраполировал свое открытие, предположив, что ретровирусы — это отпрыски генома носителя. Если принять во внимание ограниченность знаний того времени и сложность взаимодействия вирусов с носителями, заключение кажется вполне логичным. В 1949 году выдающийся французский эксперт по бактериофагам, нобелевский лауреат Андре Львов предложил термин «профаг» для обозначения генома фага, интегрированного в ДНК клетки, но бездействующего, спящего в бактерии-носителе. Называя стадию внедрения генома ретровируса в геном позвоночных «провирусом», Темин имел в виду именно этот термин Львова. Гипотеза Темина о происхождении ретровирусов из элементов генома носителя стала известна как «гипотеза провируса». Если бы Лурия и Темин оказались правы, две из важнейших групп вирусов оказались бы лишенными эволюционной истории, свойственной другим формам жизни. Эти вирусы оказались бы поздними гостями без родословной, без эволюционного древа и истории. Однако большинство современных вирусологов придерживаются другого взгляда на природу ретровирусов, их происхождение и роль в эволюции. Эту роль можно наглядно проиллюстрировать на весьма ярком, хоти и не слишком приятном примере.
Коалы населяют прибрежные области Восточной и Южной Австралии от Аделаиды на юге до южных районов мыса Кейп-Йорк. Коала — символ штата Квинсленд, любимец детишек всего мира из-за внешней схожести с плюшевым медвежонком. Но, как любой австралиец знает с детства, коала вовсе не медведь, а единственный выживший представитель целого семейства сумчатых млекопитающих с эволюционной историей, насчитывающей от двадцати пяти до сорока миллионов лет. Факт подобного выживания предполагает, что коала выработали уникальные способности, позволяющие спокойно переносить жаркий и временами очень сухой климат их естественной среды обитания. Лишь три животных — коала, большая сумчатая летяга и кольцехвостый опоссум — приспособились жить, питаясь малокалорийными листьями эвкалипта. А коала даже умудряется получать из них и большую часть необходимой воды. Несмотря на внешность ожиревшего лентяя-обжоры, коала почти не имеет запасов жира. У него медленный метаболизм, и потому он кажется ленивым и апатичным. Эти прекрасные, воистину уникальные животные выжили, несмотря на интенсивную охоту и занятие людьми их среды обитания, но увы — сегодня перед коалами встал новый и, возможно, более страшный враг.
Последние сорок лет австралийские ветеринары наблюдают все более частые случаи лимфомы и лейкемии — рака различных клеток крови — у коал. Встревожившись, ветеринары провели более тщательное исследование и выяснили: уровень заболеваемости растет и в популяциях диких коал, и среди обитателей зоопарков Юго-Восточного Квинсленда. Распространение заболеваний указывало на их вирусную природу, и, принимая во внимание сходные случаи рака у людей, кошек и обезьян, наиболее вероятной причиной болезней признали ретровирус. Предположение было подтверждено Хангером и его коллегами с факультета зоологии университета Квинсленда: в крови больных коал и в пораженных раком тканях обнаружили ретровирус[29]. Его разглядели и сфотографировали под электронным микроскопом, подвергли генетическому анализу, выделили характерные ретровирусные последовательности и подтвердили: да, это новый вызывающий эпидемию вирус. Его назвали «ретровирус коалы», или KoRV. Генетические последовательности вируса обнаруживают сходство с последовательностями вируса, заражающего гиббонов и других человекообразных обезьян. То есть вирус мог перейти от них к коалам в недалеком прошлом.
Была открыта и странная особенность поражающего коал вируса. Он ведет себя не так, как ВИЧ и HTLV. Эти последние передаются от индивидуума к индивидууму, заражают и потому известны как «экзогенные» вирусы («экзо» и значит «внешний» — зараза, пришедшая извне). А ретровирус коал — внутренний, эндогенный. Он переходит к потомству с геномом, унаследованным от родителей. Лимфому и лейкемию вызывает вирус, гнездящийся в хромосомах коалы.
Это еще не конец истории про рак у коал — но мы к ней вернемся чуть позже. А сейчас я предлагаю немного отступить и рассмотреть жизненный цикл ретровирусов.
Как все прочие вирусы, они заражают некий биологический вид или несколько близких видов. Далее они попадают в кровь носителя, где выискивают подходящие клетки либо ткани. В случае ВИЧ-1 первичная цель вируса — лимфоциты, хотя вирус проникает во многие другие клетки и ткани тела. Нормальная же среда обитания вируса — геном носителя и его ближайшие окрестности. Вирус гнездится в хромосомах с их лабиринтом генов, сложной машинерией, позволяющей синтезировать белки, и неимоверно сложным контролирующим, «бюрократическим» генетическим аппаратом. Заметим походя, что вирусы — единственные организмы, настолько малые и примитивные, что способны обитать в геноме. Но как благодаря этому ничтожные по размерам вирусы столь могучи с эволюционной и болезнетворной точки зрения? Попадая в клетку, вирус немедленно вторгается в ядро, впрыскивает туда свой геном, объединяет его с геномом клетки, завладевает контрольными механизмами и заставляет чужой геном производить копии вируса.
Здесь стоит задержаться и задуматься хорошенько над возможными последствиями такого явления. Каждый день и каждый час в мире живого происходят разнообразнейшие взаимодействия вирусов с носителями, и в этих взаимодействиях сливаются геномы существ, принадлежащих к разным царствам живого, находящихся на самых разных ветвях эволюционного древа, от мельчайших и примитивнейших бактерий и археев до рыб-клоунов, морских слизней, орлов, парящих над морями и океанами, мартышек, горилл и орангутангов, населяющих тропические дождевые леса, и, в конце концов, до Гомо сапиенс, который хоть и оставил давным-давно африканскую прародину, тем не менее несет ее в своих генах. Возможно, нам повезло в том, что большинство таких слияний происходит в периферических тканях и органах и не оказывает существенного влияния на ход эволюции. Но иногда слияние происходит в жизненно важных органах и тканях и непосредственным образом сказывается на эволюционном процессе. Только представьте себе потенциал эволюционных изменений, несомых столь примитивным организмом, как вирус: он, приспособленный порабощать геном хозяина, может поселиться в половых клетках носителя, в сперматозоидах, в яйцеклетках — и передаваться по наследству! Эволюционные возможности подобного симбиоза на самом глубинном, генетическом уровне трудно недооценить.
Процесс передачи ретровируса по наследству получил название «эндогенизация». Эндогенизация превращает свободно блуждающий и заражающий клетки экзогенный ретровирус в упакованный в геном эндогенный вирус, отдавший свободу за долгую жизнь, возможно — и бессмертие в качестве составной части нового генома. С точки зрения симбиоза создается новый голобионтический геном, результат динамики взаимодействия ранее раздельных геномов вируса и носителя. На примере коал мы видим первый шаг этого поразительного взаимодействия, наблюдаем, как происходит эндогенизация в наших млекопитающих родичах.
В 2009 году австралийский ветеринар и вирусолог Рэйчел Тарлингтон была приглашена поработать на факультете ветеринарии Ноттингемского университета, и я воспользовался возможностью побеседовать с нею. В начале карьеры она была практикующим ветеринаром, но затем переключилась на исследовательскую работу в тематическом парке «Мир грез» в курортной зоне «Золотой берег» штата Квинсленд, где находится большой зоопарк со ста двадцатью коалами, которые свободно размножаются. В популяции наблюдалась очень высокая заболеваемость летальными формами лейкемии и лимфомы, и это побудило тамошнего ветеринара Джона Хангера предположить возможность ретровирусной эпидемии. Эта эпидемия и стала темой диссертационной работы Тарлингтон.
— Джон Хангер обнаружил, что это эндогенный ретровирус, то есть, конечно, унаследованный вирус, сделавшийся частью генома животного, — сказала мне Тарлингтон. — Обычно эндогенные вирусы не могут работать как вирусы — по крайней мере, так считалось традиционно. Считалось, что они — остатки прежних вирусных инфекций, сумевших внедриться в половые клетки. Перед нами встала непростая задача: вирус нашелся, но это был унаследованный вирус.
— В самом деле, странно, — согласился я. — Насколько я знаю, никто раньше не наблюдал процесс эндогенизации вируса. Думаю, это чрезвычайно важное наблюдение. Но откуда он взялся, этот вирус?
— Скорее всего, перешел от грызуна. Близкородственный вирус выделен у гиббонов. Обычно близкородственные вирусы переходят на близкородственные виды. Но есть ранние работы Джоанны Мартин и Майкла Тристема, проделавших большую работу по филогенезу ретровирусов мышиной лейкемии. Они, по сути, идентифицировали ретровирус коал или по крайней мере его часть, а также указали на два исключения из общего правила «близкородственного» перехода.
Мартин и Тристем хорошо знали, что ретровирусы способны переходить от одного носителя к другому между представителями одного вида, но иногда они переходят и к другим видам плацентарных млекопитающих. Их заинтересовала возможность преодоления ретровирусами гораздо большей эволюционной дистанции — например, между разными классами. Подобный «прыжок» для вируса — нечто совершенно экстраординарное. Подтип черепные, включающий класс млекопитающих, включает также семь других классов: костных рыб, птиц, рептилий и прочих. Для проверки возможности перехода между классами Мартин и Тристем стали искать эндогенные ретровирусы, родственные вирусу мышиной лейкемии, — он может быть как эндогенным, так и экзогенным у грызунов.
Результаты оказались весьма показательными[30]. Оказалось, что, хотя вирусы редко одолевают большие с эволюционной точки зрения расстояния, тем не менее они на это способны. Эндогенные вирусы, близкородственные вирусу мышиной лейкемии, широко распространены в геноме четырех классов наземных животных. Они встречаются, например, у таких амфибий, как прудовая лягушка, камышовая жаба, таких рептилий, как африканская гадюка и боа-констриктор, африканский карликовый крокодил и комодский дракон; у таких птиц, как шалашник, дрозд-белобровик, куропатка, крапивник, фазан и курица; у таких млекопитающих, как мыши, коты, коалы, опоссумы и ехидны. Большинство эндогенизировавшихся вирусов — последствия давних инфекций. Но обнаружились и два случая совсем недавней эндогенизации. В первом случае вирус встречается у многих видов птиц; он настолько схож с вирусом, найденным у ехидны — яйцекладущего млекопитающего, — что это подразумевает недавний переход вируса от млекопитающего к птицам. Во втором случае вирусом-путешественником оказался ретровирус коалы, который (что подтвердил Хангер) обнаружил чрезвычайное сходство с вызывающим лейкемию вирусом гиббонов, известным как GaLV. Вирусы коалы и GaLV отличаются не более чем разновидности GaLV у гиббонов, что приводит к выводу о недавнем переходе экзогенного вируса к коалам и последующей эндогенизации.
При дальнейшей работе Тарлингтон и ее коллег с вирусом коалы открылся целый ряд пугающих деталей — например, то, как именно внедрялся вирус в геном коалы. Количество фрагментов и место их внедрения в хромосомы могли очень сильно меняться от животного к животному[31]. Агрессивность вируса тоже сильно отличалась от обычно наблюдаемой у эндогенных вирусов, давно уже вошедших в геном носителя. Исследователи отметили это, заявив, что «KoRV по агрессивности больше походил на экзогенный, чем на эндогенный вирус». Они заново проверяли и перепроверяли данные, проводили тесты спермы, исследовали семейные группы, чтобы подтвердить эндогенность вирусов, их наследование от зараженных животных. И тут они обнаружили явление, удивившее их более всего.
В популяциях коалы в Квинсленде, занимающем северо-восток Австралии, вирус был распространен равномерно. Но в коалах юго-востока процент зараженных был меньше и по мере удаления от Квинсленда уменьшался. В Балларате рядом с Мельбурном лишь 60 процентов животных носили вирус, а далее на запад вдоль южного побережья, в сторону Кенгуриного острова, у двадцати шести исследованных животных не нашлось ни единого случая заражения. Далее исследователи проверили кровь 225 животных на острове — и тоже не обнаружили и следа заражения.
Отыскивая логическое объяснение находке, Тарлингтон с коллегами изучили историю австралийских популяций коалы от начала двадцатого столетия. Тогда коалы находились на грани вымирания, их интенсивно промышляли из-за пользовавшегося спросом меха. Поскольку в южной части Австралии в это время коал осталось мало, кто-то расселил коал в особых изолированных местах наподобие Кенгуриного острова. Этих коал использовали, чтобы пополнить популяции материковых коал.
— Вы полагаете, что вирус относительно новый и заражает коал лишь последнюю сотню лет или около того? — спросил я Тарлингтон.
— Насколько мы смогли выяснить, вирус начал интегрироваться в геном коал около сотни лет назад. И этот факт мы установили на основании того, что у коал южных популяций его нет. Отсюда можно установить время, когда вирус еще не начал распространяться. Кенгуриный остров был населен коалами где-то в 1920-х. Но эти коалы пришли с другого острова, где популяция была изолирована с конца девятнадцатого столетия.
Таким образом, австралийские биологи установили: вирусу австралийских коал всего век — в масштабах типичной эволюции время симбиотического взаимодействия попросту ничтожное.
Я попробовал прощупать глубже:
— Вы предполагаете, что этот вирус явился как экзогенный? Есть ли доказательства его экзогенности?
— Над этим работает аспирант Грег Симмондс. Установлено: несколько видов грызунов Юго-Восточной Азии являются носителями сходного вируса, но экзогенный он или эндогенный, пока еще неясно. Грег делает работу по грызунам Юго-Восточной Азии. Он еще не опубликовал ее, но можно уже предположить с большой степенью вероятности: коалы подхватили вирус от грызунов.
Мне становилось все более ясным: имеет место наблюдение агрессивного симбиоза в реальном времени, от агрессивного начального взаимодействия между экзогенным вирусом и носителями и «выбраковки» до партнерства на самом глубинном симбиогенетическом уровне, с последующим слиянием геномов.
— Вы обнаружили высокую вариативность вируса среди животных. Вариативность эта относится к индивидуумам, или к малым группам в популяции, или к популяциям? — спросил я.
— К индивидуумам. Мы исследовали несколько популяций, но в основном наша работа была сосредоточена на популяции «Мира грез». Там животные привыкли к людям, образцы крови и ткани можно забирать безо всяких проблем — тамошние коалы почти как домашние кошки. С диким животным такое обращение немыслимо. Но мы исследовали и диких животных, пользуясь возможностями больницы Квинслендской службы национальных парков. Это некоммерческая ветеринарная больница, лечащая больных животных.
— Я полагаю, коалы в «Мире грез» размножаются?
— Активно.
— То есть они — родственники?
— Да, хотя кто кому и какой родственник, понять непросто.
— Я имел в виду не одну семью, но кровнородственную группу, — пояснил я.
— Конечно, они в большей степени родственники, чем коалы дикой популяции, но они вовсе не чистая линия, как у лабораторных мышей.
— Но вы обнаружили высокую изменчивость в присоединении вируса к геному — колоссальную, по правде говоря. По-моему, это говорит о протекании активного эволюционного процесса. Вирус заражает разных животных различным образом — словно происходит исследование вирусом генома.
— Я бы сказала, тут происходят два различных процесса. Скорее всего, коалы обмениваются еще и экзогенной версией вируса.
— Но это, наверное, нелегко доказать — например, было очень трудно обнаруживать ВИЧ-1 на ранних стадиях развития СПИДа.
— Конечно, эндогенные вирусы легко обнаружить — они уже сидят в геноме. Доказательство экзогенной передачи намного труднее.
— Некоторые беспокоятся, что из-за эпидемии коалы могут вымереть.
— Этого не стоит опасаться. Популяция Квинсленда весьма успешна — только в Брисбене больше четырех миллионов коал. Вы можете представить такое в большом городе?
— Хорошо, я верю — коалы не вымрут. Но возможно, эпидемия создаст «бутылочное горлышко» выживания или наподобие того?
— Очень сомневаюсь. Популяции в Квинсленде и Новом Южном Уэльсе процветают. Они в безопасности, причем нет даже и тени угрозы. А у популяции Южной Австралии дела еще лучше.
Эпидемия ретровируса коалы весьма наглядно демонстрирует, как быстро могут распространяться передаваемые половым путем болезни — и как быстро экзогенный вирус может превратиться в эндогенный, соединившись с геномом носителя. Эта стремительность подталкивает к выводу, что эндогенизация — свойство адаптивной стратегии вирусов. А этот вывод, в свою очередь, указывает: ретровирусы, как и бактериофаги, — настоящие «чемпионы» среди природных симбионтов. Как всегда в беседе с высококвалифицированным, опытным ученым, я узнавал много нового — и это способствовало развитию моих собственных идей. По заверениям Рэйчел, коалам вымирание не грозит, они даже и близко не подойдут к вымиранию — но заразится почти каждое животное. И я не думаю, что эндогенизируется в конце концов некая «более слабая» версия вируса — попросту те носители, кто не смог выдержать агрессивного симбиоза с вирусом, вымрут. Тут уместно упомянуть еще одно — и очень важное — обстоятельство.
До недавнего времени вирусологи полагали: подгруппа ретровирусов, известная как «лентивирусы» (включающая ВИЧ-1 и ВИЧ-2), — не подвержена эндогенизации, поскольку не было найдено ни единого примера эндогенизации лентивирусов. Но в 2007 году были опубликованы результаты совместного исследования ученых из Оксфордского и Стэндфордского университетов: у европейского кролика, Oryctolagus cuniculus, был обнаружен эндогенный лентивирус[32]. Затем в декабре 2008 года тот же коллектив сообщил об обнаружении первого случая эндогенизации лентивируса у примата, серого мышиного лемура Microcebus murinus, обитающего на Мадагаскаре[33].
В свете таких находок, а также учитывая пандемичность СПИДа и обилие вирусных остатков в человеческом геноме, напрашивается вывод о весьма важной роли ретровирусов в человеческой эволюции — причем роли, играемой прямо здесь и сейчас.
Изучая стремительно растущий корпус работ по эндогенным вирусам человека, я наткнулся на чрезвычайно оригинальные идеи Луиса Вильярреала, профессора Центра исследования вирусов и факультета молекулярной биологии и биохимии Калифорнийского университета. К моему удивлению и радости, я обнаружил: он был соавтором главы по эволюции вирусов в «Вирусологии» Филдса — настольной книги всех вирусологов. Более того, его исследовательские интересы были сосредоточены на явлениях самого глубинного уровня — молекулярной биологии и генетике вирусов, то есть там, где происходят интимнейшие явления генетического симбиоза. Но была еще одна, и даже более важная, причина, по какой я стал искать встречи с Луисом Вильярреалом. Вся его научная работа была посвящена детальному анализу эволюционного взаимодействия вирусов с их носителями, и, в частности, тому, как вирусы меняют эволюцию носителей. Несомненно, именно в этом направлении следует искать ключ к парадоксальной загадке, откуда столько вирусов в человеческом геноме. Я уверен, что ответ нельзя найти, рассматривая человечество само по себе, — его следует рассматривать исключительно как органичную часть всего живого на Земле.
Наш первый разговор мы начали с самых основ: когда и откуда явились вирусы?
— Тут есть, по мнению некоторых людей, дилемма, — заметил Вильярреал. — Вирус — паразит клетки. Следовательно, по их мнению, пока не образовались клетки, вирусов быть не могло. Но на самом деле вирусы могут паразитировать на любой способной к репликации системе, включая другие вирусы. В общих чертах, как только у вас появилось нечто способное к размножению, его может заразить вирус. В истории живого нет фиксированного момента, о котором можно сказать: «До него вирусов не было, а после — были». И в пребиотическом мире наверняка были генетические паразиты, паразиты всего, способного воспроизводить себя.
Мне стало любопытно, что же думает Вильярреал о распространенном убеждении многих генетиков и биологов о заимствовании современными вирусами генетического материала у носителей?
Вильярреал сказал, что придерживающиеся такого взгляда люди не понимают самой сути вирусов. Большинство вирусных генов не найдено ни у бактерий, ни у животных, ни у растений — да и ни в каком другом носителе. А это значит: вирусы способны сами по себе производить сложные гены. Большей частью их геномы — это коллекция разнородных частей, заимствованных у других вирусов. Океаны кишат подобными вирусами. По сути, прямо перед нашими глазами непрерывно происходит генетическое творение, причем в гигантских масштабах, — нечто вроде биологического «Большого взрыва».
Я спросил Луиса, что именно побудило его заподозрить возможную важность роли вирусов в эволюции их носителя.
— Я начал подозревать это, хотя довольно-таки смутно, еще в бытность мою студентом. Я тогда начал работать над персистентностью[34] вирусов.
Тридцатилетняя работа Вильярреала привела к убеждению: в тех случаях, когда персистентная стратегия доминировала в поведении вирусов, это радикально изменяло динамику взаимодействия вируса с носителем. Причем изменения были настолько сильными, что классическая модель взаимодействия хищник — жертва, известная как «модель Лотки-Вольтерра», оказывается неприменима. Мне идеи Вильярреала открыли новый взгляд на происхождение ретровирусов, составляющих столь значительную часть человеческого генома. Чтобы понять суть этих идей, нужно внимательно проанализировать, что значит дарвиновская концепция естественного отбора в применении к персистентным вирусам.
— Когда говорят о естественном отборе среди вирусов при их взаимодействии с носителями, почти всегда упускают из виду временной фактор, — сказал Вильярреал. — Что можно сказать об эволюционной приспособленности вируса, заселившего целый биологический вид, но сделавшего это через передачу по наследству? Традиционное понимание «приспособленности» тут не годится. Традиционное понимание опирается на представление об успешном размножении, репликации, но это представление никак не включает время. Следует задать себе вопрос: «Что значит „приспособленность“ для существа, ставшего практически бессмертным?»
Надо сказать, идея такого бессмертия показалась мне неоднозначной — хотя и заманчивой. В самом деле, это радикально новое объяснение поведения более чем двух сотен различных групп вирусов, вторгшихся в наш геном и геномы наших предков, — предположить, что эти вирусы обменяли возможность свободного горизонтального перехода между носителями на некий вид бессмертия. Геномы этих вирусов, их «эгоистичные» гены, их «бюрократы-контролеры» стали воспроизводить себя, только когда воспроизводил себя носитель, то есть когда воспроизводился голобионтический геном. Но ведь в таких экстраординарных условиях меняется и носитель. Невозможно полагать (как до сих пор делает большинство эволюционных биологов), что носитель до и после эндогенизации вируса — идентичен. Результат соединения вируса и носителя следует воспринимать с симбиотической точки зрения как новый голобионтический организм с новым генетическим кодом, рожденным объединением двух геномов: вируса и позвоночного. И это объединение — не просто механическая сумма. Объединение генома позвоночного с геномом вируса, приспособленного управлять геномом позвоночного, несомненно, в эволюционном смысле может быть куда плодотворнее, чем простая сумма двух геномов.
Поразмыслив, я пришел к мысли применить идеи Луиса Вильярреала к случаю с коалами. Прямо сейчас ретровирус коалы истребляет членов популяции, не могущих сосуществовать с ним. Репродуктивная стратегия этого вируса подразумевает вторжение в геном половых клеток коалы, причем осуществляемое разнообразными способами. Результатом этого становится эволюционная гибкость, недостижимая в случае раздельного развития и вируса, и носителя. Более того, эволюция симбиотического союза может быть подстегнута большой скоростью эволюционных изменений, присущей вирусам. В геноме нет антител, нет иммунной системы, нет препятствий для репликации вируса, хотя есть внутренние генетические и эпигенетические механизмы, способные, в принципе, препятствовать вирусному вторжению и репликации вируса. Сложное и агрессивное симбиотическое взаимодействие вируса с носителем происходит у сумчатых прямо сейчас и сопровождается жесткой селекцией, выбраковкой неспособных ужиться с вирусом. И кажется мне, результат здесь очевиден: за исключением изолированных популяций останутся лишь способные ужиться с вирусом, явится новое голобионтическое партнерство коалы и вируса.
Выходит, мы наблюдаем рождение нового вида не посредством линейного вертикального ветвления, как полагает неодарвинизм, а через соединение раздельных геномов, участвующих в симбиогенезе. По сути, возможность именно такого горизонтального видообразования долгое время исследовалась многими исследователями — например, Линн Маргулис, изучавшей симбиоз с бактериями-носителями. Трудно вообразить более жесткий и эффективный отбор, чем выбраковка посредством активного симбиотического вируса, передающегося через самый процесс размножения носителя?
В то время, когда состоялся наш первый разговор с Вильярреалом, мы оба были заняты написанием книг по материалам наших исследований. В том же году была опубликована моя книга «Слепое пятно Дарвина»[35]. В ней я сравнивал симбиотическую эволюцию с воззрениями современного дарвинизма, основанного на синтезе эволюционных идей тридцатых годов. В книгу я включил и две главы о вирусах. В одной я рассуждал о симбиозе «с точки зрения вирусов» и строго определил такой симбиоз, а в другой описал известные на то время примеры симбиоза с вирусами. Вильярреал же свою книгу «Вирусы и эволюция жизни» опубликовал несколькими годами позже. В ней он описал роль вирусов в эволюции живого от самого начала жизни до нынешнего ее разнообразия[36].
Вильярреал признался мне: у него есть трудности с формулировкой понятия симбиоза, когда речь заходит о вирусах. Я не слишком удивился. Моя предыдущая книга «Вирус X» заинтересовала некоторых вирусологов, но не убедила их в симбиотической природе вирусов. Среди же симбиологов книга вовсе не вызвала интереса. Так что, в сущности, трудности Вильярреала был следствием известного скептицизма, присущего и вирусологам, и симбиологам. Никто ранее не брался за разработку достаточно строгого и формального определения симбиоза с вирусами одновременно с симбиологической и вирусологической точек зрения, причем такого определения, чтобы оно было понятно и приемлемо для ученых из обеих этих областей. Тогда я объяснил Вильярреалу, что работаю над такой формулировкой, в частности, стараюсь определить вирусный симбиогенез с точки зрения генетики. Когда «Слепое пятно Дарвина» было опубликовано, я послал экземпляр Вильярреалу. Объяснение симбиоза с точки зрения вирусологии показалось ему полезным для исследователей, в особенности концепция «агрессивного симбиоза». Еще большее удовольствие доставило мне его приглашение провести серию семинаров на эту тему в его институте. Это было первым формальным признанием концепции вирусов как симбионтов в сообществе вирусологов.
С моей стороны я всецело приветствовал возможности, открывшиеся для меня вследствие редкого в научном мире плодотворного сотрудничества, основанного на взаимной симпатии, энтузиазме и бескорыстном интересе. Кроме того, мне многому можно было научиться у старшего — и выдающегося — коллеги.
Вильярреал обладает поразительно обширными и подробными знаниями о взаимодействии вирусов с их носителями. Одним из предметов его исследований были ретровирусы. Он предположил, что ретровирусы описали очень длинную эволюционную траекторию: от вирусов, селившихся в морских беспозвоночных, до вирусов морских предков позвоночных и, в конце концов, нынешнего человека. Исследования привели его к замечательному и многое объясняющему открытию: при каждом крупном эволюционном изменении — при возникновении хордовых, затем млекопитающих и приматов — возникало и множество новых видов ретровирусов. Это важная подсказка для задачи объяснения парадоксальной структуры человеческого генома. Вильярреал получил и еще один важный и позволяющий многое понять результат. Прежнее поколение генетиков-эволюционистов изучало странные элементы генома, известные как LINE и SINE, согласно принципам современного дарвинизма рассматривая их как отдельные, наличествующие у многих форм жизни сущности, произошедшие из генома и затем развивавшиеся в геноме. Но Вильярреал сопоставил и сравнил эти развивающиеся сущности с параллельной эволюцией ретровирусов, заразивших этих же носителей, и обнаружил значительную общность между тем и другим. Его данные и сделанные на их основе выводы позволили существенно углубить понимание того, как естественный отбор действует на ретровирусы в симбиозе с геномом, и понимание эволюционных истоков элементов LINE и SINE.
Линн Маргулис назвала внезапные и кардинальные изменения, происходящие вследствие симбиотического объединения геномов вируса и носителя, «эволюционным эквивалентом удара молнии». Но чтобы понять, каков будет эффект этого «удара молнии» в долгосрочной перспективе, и в особенности чтобы понять, каким образом это сыграло ключевую роль в формировании человеческого генома, нам следует изучить подробнее работу естественного отбора для ряда голобионтических партнерств вируса и носителя.
Можно узнать многое о механике подобного генетического союза на примере важнейшего симбиотического партнерства, способствовавшего созданию человеческого генома, — древнего эволюционного переворота, давшего нашим клеткам митохондрии, а нам — возможность дышать кислородом.
Цитируя Льюиса Томаса: «Нас сдают внаем, нас разделили и заняли. Внутри наших клеток живут, даруя энергию, позволяющую нам радоваться солнечному дню и стремиться к совершенству, сотни и тысячи созданий, в строгом смысле нам не принадлежащих, обитающих в цитоплазме — части клетки, лежащей между ядром и оболочкой»[37]. Большинство биологов принимают эволюционное объяснение их существования, впервые выдвинутое Маргулис в конце шестидесятых годов двадцатого века: более миллиарда лет назад дышащие кислородом бактерии вступили в голобионтическое партнерство с одноклеточным протистом (раньше их называли «протозоа»), который и стал предком всех животных, растений, грибов и дышащих кислородом протистов, населяющих сегодня Землю. Снова цитируя Томаса: «Они настолько же симбионты, насколько и ризобиальные бактерии, живущие в корневой системе бобовых и позволяющие накапливать азот. Без митохондрий мы бы не могли двинуть ни единым мускулом, не могли бы согнуть палец и думать не могли бы».
Чем же можно доказать подобное утверждение?
Доказательств известно несколько. Геном митохондрий составлен из типичных бактериальных генов, и они, в отличие от наших ядерных генов, соединены в кольцо, что характерно для бактерий. Размножаются митохондрии независимо от ядра, типичным для бактерий процессом почкования. Геномы митохондрий всех современных имеющих митохондрии форм жизни настолько генетически схожи, что они, несомненно, произошли от общего предка. Как ни удивительно, генетический анализ показывает: ближайший из современных родственников предка всех митохондрий — это бактерия Rickettsia prowazeki, возбудитель печально известного заболевания — разносимого вшами эпидемического тифа. Теперь нам известно: этот возбудитель тифа не может существовать самостоятельно, он чрезвычайно интенсивно (и зачастую агрессивно) взаимодействует с клетками носителя, геном его естественным отбором редуцирован и рудиментарен и не позволяет бактерии жить вне клеток-носителей.
Если изучить, как естественный отбор влиял на геном наших митохондрий в течение длящегося миллиард лет голобионтического симбиоза с ядерными клетками, обнаружится, что геном предка митохондрий претерпел радикальные изменения — был разрушен, упрощен. Большое число изначально присутствовавших генов исчезло, было выброшено за ненадобностью, а около трехсот генов переместились от митохондрии в ядро, где, в подобии уже обсуждавшегося здесь сожительства Elysia chlorotica с чужими хлоропластами, эти перенесенные гены продолжают работать согласованно с остатком генов митохондрии. Но не может не удивлять то, что за миллиард лет симбиоза геном митохондрии сохранил отчетливо бактериальный характер. Как мы увидим далее, понимание симбиотического происхождения человеческих митохондрий важно для изучения заболеваний, обусловленных нарушениями митохондриального генома.
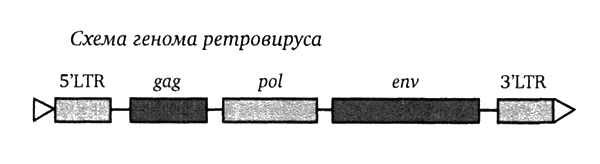
Приведенный выше рисунок иллюстрирует структуру генома типичного ретровируса — такого, как вызывающий СПИД ВИЧ-1, или KoRV, вызывающий лейкемию у коал, или любой из 30–50 семейств HERV, входящих в обширную коллекцию вирусных компонентов человеческого генома.
При взгляде на этот рисунок видно: геном начинается и кончается с областей, обозначенных как «LTR» — это сокращение английского выражения «длинный концевой повтор» (long terminal repeat), и эти области — не гены как таковые, но «бюрократы» с чрезвычайно мощными «управленческими» способностями. Такие «бюрократы» встречаются только у вирусов, именно они несут способность манипулировать генетическим аппаратом носителя. Собственно вирусные гены, управляющие жизненным циклом ретровируса, содержатся в трех областях, обозначенных как gag, pol и env (эти обозначения принято писать курсивом). В области gag содержатся гены, кодирующие белки матрицы вируса (специфичные антигены), область pol кодирует важнейший для ретровируса энзим, обратную транскриптазу, и другие важные энзимы, включая «интегразу», позволяющую вирусной ДНК залезть в хозяйскую хромосому, область же env кодирует белки оболочки вируса.
С традиционной дарвиновской точки зрения, любое вторжение вируса в геном хозяина можно интерпретировать как «эгоистическое» действие с целью выживания этого вируса, и, вполне возможно, естественный отбор будет действовать во многом индивидуально для вируса и носителя. Однако, как мы уже видели на примере СПИДа, даже в разгар жесточайшей эпидемии можно наблюдать и отбор, работающий в значительной мере на уровне симбиоза. Во время активного распространения эпидемии логично ожидать неприятных последствий агрессивного симбиоза и «выбраковки» значительной части вида-носителя. Но, судя по эпидемии у коал, эта стадия может длиться не так уж много времени. «Выбраковка» приводит к созданию нового партнерства между вирусом и носителем, остатки вида размножаются снова, и эти остатки, активно взаимодействующие с вирусом, будут иметь эволюционное преимущество. Если экзогенная инфекция летальна для носителя, то совокупление носителя эндогенного вируса с теми, кто не носит эндогенный вирус, приведет к их гибели. А носители эндогенного вируса останутся заразными в течение очень долгого времени. Вирусные же элементы в геноме размножатся, внедрив себя в хромосомы, предоставив геному носителя уже готовые гены и мощные средства управления ими, — и это способно радикально изменить эволюционную траекторию новой сущности, нового голобионтического организма.
Вполне логично ожидать, что за сотню миллионов лет голобионтического партнерства млекопитающих и вирусов естественный отбор сделает с эндогенными вирусами то же, что и с митохондриями: выбросит ненужные вирусные гены и «бюрократические» управляющие элементы — но вирусов в геноме так много, что некое активное меньшинство будет присутствовать всегда. Оно всегда будет играть важную роль в голобионтической эволюции. Следует также ожидать, что вирусы даже после внедрения в наш геном и превращения в его часть по-прежнему останутся в сути своей вирусами. Если принять во внимание, что такое голобионтическое партнерство и естественный отбор у человека и его предков происходили с сотнями вирусов (в процессе чего и был создан человеческий геном), то понятной становится структура произошедших от вирусов частей человеческого генома.
Вильярреал полагает, что LINE и SINE, вместе составляющие тридцать четыре процента человеческого генома, либо являются производными ретровирусов, либо контролируются ими. Вывод обескураживающий и поразительный. Это значит: вирусы вместе с их производными и тесно связанными структурами составляют как минимум сорок три процента человеческого генома — и со временем, по мере дальнейшего исследования еще не расшифрованных частей генома, этот процент, скорее всего, увеличится. Скептики вполне резонно могут потребовать доказательств. И как же доказать столь созидательную роль симбиоза с вирусами в происхождении нашего генома? Для этого нужно искать доказательства естественного отбора на голобионтическом уровне при взаимодействии вируса с носителем. Более того, нужно продемонстрировать и важность геномных ретровирусов и их производных в человеческой генетике, развитии эмбриона, физиологии — и, конечно же, в возникновении человеческих заболеваний.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Глава VIII Парадоксы Галена
Глава VIII Парадоксы Галена Образ Галена предстает перед нами в окружении парадоксов.Он проложил путь и сам же перегородил его стеной. Не будь его, труды греческих врачей, вероятно, безвозвратно канули бы в вечность. А вместе с тем его практическая деятельность более чем на
Еще одна группа спонсоров человеческого генома (ДНК-транспозоны)
Еще одна группа спонсоров человеческого генома (ДНК-транспозоны) В результате секвенирования ДНК человека был раскрыт еще один секрет генома. Кроме вирусов, проникших в наш геном извне и со временем сильно размножившихся там, заметную часть генома человека составляют и
1. ПАРАДОКСЫ МОЗГА
1. ПАРАДОКСЫ МОЗГА Нищета человеческого мозга начинается с необычности его морфофункциональной организации. В эволюционных корнях конструкции и метаболизма нервной системы заложены фундаментальные ограничения интеллектуальной деятельности, которые влияют как на
Еще одна группа спонсоров человеческого генома (ДНК-транспозоны)
Еще одна группа спонсоров человеческого генома (ДНК-транспозоны) В результате секвенирования ДНК человека был раскрыт еще один секрет генома. Кроме вирусов, проникших в наш геном извне и со временем сильно размножившихся там, заметную часть генома человека составляют и
Дональд Джохансон, Мейтленд Иди Люси. Истоки рода человеческого
Дональд Джохансон, Мейтленд Иди Люси. Истоки рода человеческого Перевод с английского канд. биол. наук Е. 3. ГодинойМосква«Мир»1984LUCYThe Beginnings of HumankindDonald C. JohansonandMaitland A. EdeyWarner BooksA Warner Communications
11.8. Парадоксы психики человека
11.8. Парадоксы психики человека Быстрое развитие когнитивных способностей в ходе антропогенеза имело не только позитивный эффект, но и сопровождалось целым рядом негативных последствий. Эта взаимосвязь породила многочисленные парадоксы человеческой психики.Большой
Во сколько раз современный телескоп «зорче» человеческого глаза?
Во сколько раз современный телескоп «зорче» человеческого глаза? Чем больше света «соберет» оптический прибор, тем менее яркие и более далекие объекты он «увидит». Именно поэтому зеркала телескопов становятся все больше и больше. Рабочая (эффективная) площадь главного
Как оценивал степень совершенства человеческого глаза немецкий физик Гельмгольц?
Как оценивал степень совершенства человеческого глаза немецкий физик Гельмгольц? При всем своем совершенстве человеческий глаз все же не лишен недостатков. Немецкий физик Герман Людвиг Фердинанд Гельмгольц (1821–1894), изучавший оптику глаза, как-то сказал: «Если бы
Насколько равномерно распределяется кровь между различными органами человеческого тела?
Насколько равномерно распределяется кровь между различными органами человеческого тела? Распределение крови в организме человека характеризуется резко выраженной неравномерностью. На 100 килограммов веса кровоток в почках составляет 420 миллилитров в минуту, в сердце –
Парадоксы магнитного поля Земли
Парадоксы магнитного поля Земли То, что наша Земля является большим магнитом, впервые определил английский ученый-Вильям Гильберт, издавший в 1600 г. в Лондоне трактат «О магните, магнитных телах и о большом магните – Земле, новая физиология, доказанная множеством
Величайшее изобретение человеческого ума
Величайшее изобретение человеческого ума — Итак, с чего же мы начнем, мистер Сайрес? — спросил Пенкроф на следующее утро. — С самого начала, — ответил Сайрес Смит. Жюль Верн Началом всех начал для жизни человека является хлеб. К хлебу человек так привык, что без него
Формирование человеческого языка
Формирование человеческого языка Человеческий язык, как это имело место и в отношении материальной культуры, прошел долгий путь развития, и звуки, сопровождающие первые трудовые действия, еще не могли быть подлинными словами, обозначающими отдельные объекты, их
Инстинкты как «серые кардиналы» человеческого поведения
Инстинкты как «серые кардиналы» человеческого поведения Здоровая нация столь же не замечает своей национальности, как здоровый человек не замечает своего позвоночника. Бернард Шоу Подавляющему большинству людей свойственно не замечать своих инстинктов. Инстинкты