Глава 8 Механизмы саморегуляции
Для своего роста (увеличения биомассы) и размножения бактериальная клетка должна получать из окружающей среды, как минимум, источники углерода, энергии и различные химические элементы. Источником углерода и энергии могут быть одна и та же молекула (чаще всего глюкоза) или же различные молекулы, например СО2 как источник углерода, а NH3 – источник энергии. Клетки, у которых отсутствуют какие-либо биосинтетические процессы, должны получать их конечные продукты, т. е. «факторы роста», из внешней среды. Если же клетка может получать некоторые конечные продукты извне, она будет их использовать преимущественно, «выключив» их эндогенный синтез. Для осуществления реакций окисления среда должна обеспечить клетку конечным акцептором водорода (электронов): для аэробов им является О2, а для анаэробов им могут быть или органические вещества, или органические субпродукты расщепления углеводов, или неорганические соединения (NO3–, SО42– и т. п.). Например, многие бактерии растут за счет расщепления глюкозы как источника углерода, энергии и акцептора водорода. Благодаря обмену источников углерода бактерии синтезируют промежуточные продукты, необходимые для образования основных биополимеров. Окисление источников энергии приводит к накоплению АТФ, что позволяет бактериям обеспечивать себя энергией, необходимой для биосинтеза субъединиц биополимеров и их активации. Активированные субъединицы полимеризуются и образуют макромолекулы, которые саморегулируются, формируя субклеточные и клеточные структуры. В результате биомасса клетки удваивается за определенный срок (клеточный цикл), и она размножается путем бинарного деления. В одно и то же время в бактериальной клетке совершается огромное количество биохимических процессов, завершающихся, в конечном счете, увеличением ее биомассы. Это предполагает наличие у нее совершенных механизмов саморегуляции, чутко реагирующих на все изменения условий ее жизни. В настоящее время представляется возможным условно разделить эти механизмы на две основные группы: а) группа неспецифических механизмов регуляции роста и размножения; б) группа специфических механизмов саморегуляции.
К неспецифическим механизмам относится совокупность действия различных физико-химических факторов, регулирующих общую скорость всех основных процессов жизнедеятельности. К ним относятся: температура, рН, rH2, концентрация ионов, степень обеспечения среды кислородом, давление и др. Неспецифический характер этой формы регуляции заключается в том, что она влияет прежде всего на общую кинетику биосинтетических процессов. Обеспечивая оптимальное соотношение всех указанных факторов, можно получить максимальную скорость размножения бактерий и максимальный выход биомассы в соответствующих производствах. Однако действие физико-химических факторов опосредуется через специфические механизмы клеточной саморегуляции. Она носит многоступенчатый характер и отличается выраженной универсальностью, вытекающей из того, что специфическая саморегуляция связана прежде всего с ферментами, катализирующими биохимические реакции, а все ферменты имеют одинаковую химическую природу. Взаимодействие на уровне фермент – субстрат является важнейшим пусковым моментом всей клеточной системы саморегуляции. Именно на этом уровне происходит интеграция неспецифических и специфических механизмов саморегуляции клетки. Специфичность взаимодействия фермента с субстратом детерминирована генетически – она обусловлена последовательностью расположения аминокислот в белковой молекуле и определяемой ею вторичной, третичной и четвертичной структурой молекулы фермента. В связи с этим никаких дополнительных механизмов регуляции на уровне фермент – субстрат не требуется. Синтезированный фермент готов в любой момент, если не изменена его аллостерическая структура, вступить в реакцию с соответствующим субстратом. Как известно, скорость ферментативной реакции можно выразить уравнением:
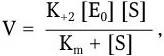
где E0 – начальная концентрация фермента; S – концентрация субстрата.
При увеличении концентрации [S], когда [S] > Km, скорость ферментативной реакции (V) будет стремиться к некоторой постоянной величине Vмакс– максимальной скорости реакции:
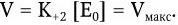
Поэтому зависимость между скоростью ферментативной реакции и концентрацией субстрата можно выразить следующим уравнением Михаэлиса – Ментен:
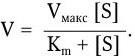
Из уравнения следует, что при малых величинах концентрации субстрата скорость реакции будет находиться в линейной зависимости от [S], а при очень высокой концентрации субстрата скорость реакции (V) будет стремиться к максимальной (Vмакс) и мало зависит от дальнейшего увеличения концентрации [S]. В свою очередь, при условии, когда [S] > (E), скорость реакции будет пропорциональна концентрации фермента. Основными кинетическими константами уравнения Михаэлиса являются максимальная скорость реакции (Vмакс) и константа Михаэлиса (Km). Величина последней определяется соотношением трех констант скорости. В случае, когда K+2 < K– 1, Km ? K– 1/K+1 = Ks.
Константа Ks получила название константы субстрата и служит мерой сродства фермента к субстрату. Поскольку скорость реакции, катализируемой ферментом, зависит от относительного сродства фермента к субстрату, константа (Ks) является важной характеристикой фермента. Поэтому уравнение Михаэлиса – Ментен может быть выражено следующим образом:
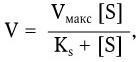
где Vмакс – предел, к которому стремится скорость реакции с повышением концентрации субстрата; Ks – константа, численно равная концентрации субстрата при V=Ммакс/2.
Колебание температурного режима оказывает на ферментативные реакции влияние таким же образом, как и на другие химические реакции. Отношение констант реакций при более высокой (Т2) и более низкой (Т1) температурах получило название температурного коэффициента: Q = K2/K1. Значение его обычно дается для интервала в 10 °C (Q10). Величину Q10 легко вычислить для любого температурного интервала ?T по формуле:
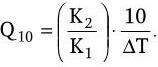
Скорость ферментативных реакций зависит также от концентрации водородных ионов. Величина оптимальной рН и ее границы варьируют в зависимости от типа и свойств ферментов. Даже изоферменты, имеющие одинаковую субстратную специфичность, могут различаться по оптимуму рН.
Отличаясь высокой специфичностью действия, ферменты, вместе с тем, обладают многими общими свойствами, вытекающими из их белковой природы. Благодаря последним создаются условия, которые позволяют использовать опять-таки универсальные механизмы для контроля активности ферментов.
В частности, существует специфический механизм саморегуляции скоростей отдельных биохимических реакций, вытекающий из аллостерической природы белков-ферментов: конечный продукт реакции (в случае накопления некоторого избытка его), взаимодействуя с молекулой фермента, так изменяет ее конформацию, что она временно утрачивает свою активность. Этот принцип саморегуляции, получивший название регуляции по типу отрицательной обратной связи, или торможения конечным продуктом, носит универсальный характер. С его помощью создаются идеальные условия для саморегуляции, так как он не требует никакой дополнительной затраты энергии и вещества. Запуск реакций, ведущих к превращению субстрата, осуществляется самим субстратом, а их остановка – конечным продуктом. Как только содержание конечного продукта достигает определенного уровня, дальнейший синтез его прекращается. Конечный продукт выступает в роли регулятора собственного синтеза. Так осуществляется саморегуляция многих биохимических процессов и, как следствие, координация их, так как многие из них взаимозависимы по участвующим в реакциях различным продуктам. Помимо этого уровня саморегуляции, определяющего кинетику единичных ферментативных реакций, а также общую скорость и координацию большинства биохимических процессов, существует высшая форма клеточной саморегуляции, осуществляемая на генетическом уровне. В соответствии с химическими сигналами, поступающими как из внешней среды, так и эндогенным путем, клетка автоматически запускает (индуцирует) или подавляет (репрессирует) синтез соответствующих ферментов. Нетрудно видеть, что, хотя эффекты индукции и репрессии противоположны по своим проявлениям, они представляют собой две стороны одного и того же процесса, а именно – регуляции образования ферментов. Благодаря механизмам индукции и репрессии, осуществляемым с помощью соответствующих генов (регуляторов, операторов, промоторов, аттенуаторов и т. п.) и белков (репрессоров, активаторов, апорепрессоров и т. п.), клетка, в соответствии с химическими сигналами, осуществляет автоматический контроль биосинтеза необходимых ей в данное время ферментов.
Одним из проявлений регуляции синтеза ферментов на уровне генома служит так называемая постоянная или временная катаболитная репрессия. Суть ее состоит в том, что некоторые источники углерода, принимающие участие в энергетическом обмене, например глюкоза, способны подавлять биосинтез определенных ферментов. Существует предположение, что синтез биосинтетических ферментов контролируется по механизму отрицательной обратной связи – репрессией конечным продуктом, а биосинтез ферментов, участвующих в катаболизме, контролируется механизмом индукции и катаболитной репрессии.
Бактерии, как и все живые организмы, не могут существовать в природе, не получая информации из внешней среды и от себе подобных. Обмен информацией (коммуникацию) они осуществляют разными способами, например путем непосредственого контакта при конъюгации (с помощью донорных ворсинок), при формировании колоний и при других процессах. Особое значение имеет способность бактерий вступать в контакт с клетками организма человека и животных. Распознавание клеток и присоединение к ним – важнейший начальный этап реализации бактериями патогенных свойств. Другой важной формой межклеточной коммуникации служат УФ (митогенетическое излучение), электромагнитные волны светового и инфракрасного диапазонов. Дистантное взаимодействие существенно важно в регуляции переходных процессов или в стрессовых ситуациях, когда клетке надо «решить», как вести себя в необычных условиях. Важную информацию бактерии получают через посредство физико-химических факторов внешней среды (температура, pH среды и т. п.), а также специальных химических сигналов. Установлено, что бактерии синтезируют и выделяют во внешнюю среду много биологически активных соединений, которые координируют их коллективное поведение, физиологическое состояние и т. п.
У бактерий обнаружены различные системы, способные воспринимать из внешней среды физические и химические сигналы. У многих патогенных бактерий (E. coli, Y. pestis, Y. pseudotuberculosis и др.) обнаружены термоиндуцибельные системы, контролирующие синтез факторов патогенности. Например, у E. coli при температуре 18 – 20 °C практически не происходит синтеза факторов адгезии (пилей). Повышение температуры до 37 °C индуцирует их образование. Такой же температурозависимый контроль синтеза факторов патогенности обнаружен у возбудителей чумы (Y. pestis), дизентерии (Shigella flexneri) и других заболеваний. Целесообразность действия этих систем очевидна: факторы патогенности необходимы бактериям для обеспечения их существования в организме человека или животных, т. е. при температуре 37 °C. В иных условиях эти системы бактериям не нужны. Другим примером того, как бактерии реагируют на физические сигналы, является феномен «теплового шока», описанный еще в 1952 г. Ф. Ритоссой. Он лучше всего изучен у E. coli. Суть его заключается в том, что нагревание среды до 42 °C активизирует работу ряда генов, вследствие чего в 5 – 20 раз увеличивается синтез почти 20 белков, играющих ключевую роль в жизни клеток. Главную роль в системе теплового шока играет ген (позитивный регулятор) htpR (англ. – heat temperature protein regulator), картированный на 76-й минуте хромосомной карты E. coli. Он является представителем особой группы генов, продукты которых необходимы для роста только при температуре выше 35 °C. Продукт гена htpR – ?-белок, который играет роль ?-субъединицы РНК-полимеразы. Последняя и определяет выбор промоторов тех генов, которые входят в систему теплового шока.
Интересно, что генетический контроль споруляции также реализуется через изменение ?-субъединицы РНК-полимеразы. Фактором, запускающим споруляцию у B. subtilis, служит аденозин-бис-трифосфат р3Ар3. Его синтез осуществляет фермент аденозин-бис-трифосфат-синтетаза. В нормальных условиях синтез этого фермента репрессирован. Когда же клетка получает соответствующий химический сигнал из внешней среды (например, об истощении источника энергии), репрессия синтеза фермента снимается, накапливается р3Ар3, и это каким-то образом приводит к замене ?-субъединицы РНК-полимеразы. В результате этого последняя начинает распознавать промоторы генов, продукты которых и обусловливают спорообразование.
Помимо системы теплового шока у бактерий обнаружена система и «холодового шока»: снижение температуры роста с 37 до 10 °C у E. coli вызывает увеличение в 3 – 300 раз синтеза 13 белков, изменяющих ход ее биосинтетических процессов в новых условиях роста. Обе эти системы связаны друг с другом и с другими системами, в том числе с системой, регулирующей клеточное деление, и через RecA белок с жизненно важной системой генов – SOS-системой (см. часть 2 «Генетика бактерий»).
Восприятие химических сигналов бактериями осуществляется с помощью так называемых сенсорно-регуляторных систем. Простейшая схема их такова (рис. 35). Вначале сигнал воспринимается рецептором клеточной мембраны и передается мембранным ферментам. Затем образуется вторичный посредник (мессенджер – англ. messenger – посыльный), который через системы киназ и фосфатаз взаимодействует с эффекторным аппаратом клетки, в том числе с ее генами. Этот процесс передачи сигнала обычно включает в себя обратимую посттрансляционную модификацию белков посредством их фосфорилирования. В простейшем случае сенсорно-регуляторная система состоит из белка-рецептора (сенсора), который располагается, как правило, но не всегда, в мембране, и белка-регулятора, локализованного в цитоплазме. Примером такой системы является система осмотической регуляции у E. coli: ее сенсором является белок EnvZ, а регулятором – белок OmpR (система EnvZ/OmpR). Белок EnvZ получает информацию из периплазмы, в которой располагается его N-концевой домен. С-концевой домен располагается в цитоплазме и обладает ауто- и протеинкиназной активностью. В присутствии АТФ С-домен аутофосфорилируется, а затем передает фосфорильную группу белку-регулятору – OmpR. В свою очередь белок OmpR контролирует работу двух генов – оmpC и оmpF, кодирующих синтез белков-поринов наружной мембраны – OmpC и OmpF. Белок OmpF имеет больший диаметр пор, чем белок OmpC. Регулятор ответа – белок OmpR – также состоит из двух доменов: N-концевой домен фосфорилируется белком-сенсором, а С-концевой домен взаимодействует с промоторами генов ompC и ompF с различной активностью в зависимости от того, фосфорилирован ли этот белок (OmpR). Таким образом, от активности транскрипции генов ompC и ompF будет зависеть соотношение белков-поринов OmpC и OmpF в наружной мембране, а следовательно, и степень проницаемости мембраны для воды и низкомолекулярных гидрофильных соединений. По такому же принципу устроены и работают и другие сенсорно-регуляторные системы. С-концевые домены разных сенсорных белков имеют сходное строение, а N-концевые домены регуляторных белков также оказались гомологичными. Поэтому механизмы взаимодействия между белками-сенсорами и соответствующими им белками-регуляторами, вероятно, одинаковы. У бактерий уже обнаружено около 30 таких сенсорно-регуляторных систем, воспринимающих различные химические сигналы и обеспечивающих на них адекватный ответ. Специфичность их зависит от передачи сигнала на соответствующий эффекторный аппарат (на гены). Функции, выполняемые регуляторами ответа, – получение сигнала от сенсора, взаимодействие с промоторами соответствующих генов и активация их транскрипции – разделены между доменами белка-регулятора. Сходство в механизме функционирования этих систем указывает на то, что их функции также должны быть скоординированы.
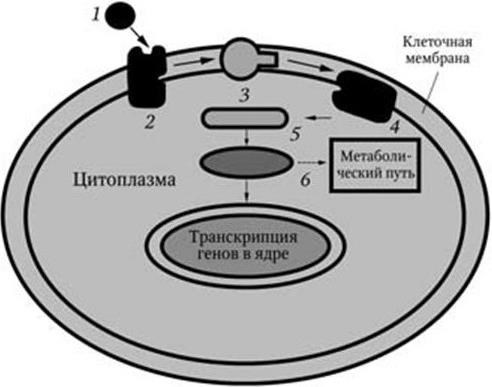
Рис. 35. Этапы внутриклеточной передачи сигналов (по Д. Эриксону. В мире науки. 1993, вып. 1):
1 – связывание внеклеточного сигнального агента; 2 – клеточный рецептор; 3 – белок-передатчик; 4 – мембранный фермент; 5 – вторичный мессенджер; 6 – киназы и фосфатазы
Важнейшим механизмом восприятия информации из внешней среды служит изменение топологического состояния ДНК, степени ее суперспирализации, от которой зависит работа генов бактерий, в том числе систем теплового и холодового шока. В отличие от сенсорных систем этот механизм реагирует не на специальные химические сигналы, а на разнообразные изменения физико-химического состояния внешней среды и поэтому выполняет роль общего регулятора экспрессии генов.
Таким образом, при большом количестве взаимодействующих систем для их согласованности, т. е. для саморегуляции жизненных процессов клетки, решающее значение имеет соблюдение трех основных условий: во-первых, согласованность скоростей реакций; во-вторых, строгое регулирование последовательностей их включения; в-третьих, регулирование количественного и качественного состава самих ферментов в строгом соответствии с сигналами, поступающими из окружающей среды. Приспособляемость, если под ней понимать корреляцию между степенью физиологической активности клетки и условиями среды, возникает как неизбежное следствие установления взаимосвязи между динамическими системами клетки. Внешние условия – наличие необходимых субстратов, температуры, рН, rН2 и других факторов – индуцируют одни системы и лимитируют активность других систем. Целесообразность поведения живой системы складывается из совокупности согласованно протекающих в ней саморегулируемых и взаимосвязанных реакций, т. е. она обусловлена самой организацией живой системы. Конечным результатом регуляции протекающих в клетке биосинтетических и катаболических процессов является произведение потомства, а показателем сбалансированности функционирующих систем служит скорость роста бактерий.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.