Цикл трикарбоновых кислот
Ацетил-СоА поступает в цикл трикарбоновых кислот, который является вторым этапом клеточного дыхания. Впервые предположение о существовании такого цикла для окисления пирувата в животных тканях было высказано в 1937 г. Гансом Кребсом. Эта идея родилась у него, когда он исследовал влияние анионов различных органических кислот на скорость поглощения кислорода суспензиями измельченных грудных мышц голубя, в которых происходило окисление пирувата. Грудные мышцы отличаются чрезвычайно высокой интенсивностью дыхания, что делает их особенно удобным объектом для изучения окислительной активности. Незадолго до описываемых работ Кребса Альберт Сент-Дьёрдьи в Венгрии обнаружил, что некоторые четырехуглеродные дикарбоновые органические кислоты, присутствующие в животных тканях (янтарная, фумаровая, яблочная и щавелевоуксусная), способны усиливать поглощение кислорода мышечной тканью. Кребс подтвердил это наблюдение и показал, что перечисленные органические кислоты стимулируют также окисление пирувата. Кроме того, он нашел, что окисление пирувата мышечной тканью стимулируется шестиуглеродными трикарбоновыми кислотами – лимонной, цис-аконитовой и изолимонной, а также пятиуглеродной ?-кетоглутаровой кислотой. Испытаны были и некоторые другие встречающиеся в природе органические кислоты, но ни одна из них не обнаружила подобной активности. Обращал на себя внимание сам характер стимулирующего действия активных кислот: даже малого количества любой из них было достаточно для того, чтобы вызвать окисление во много раз большего количества пирувата.
Цикл трикарбоновых кислот выполняет несколько функций.
Во-первых, цикл трикарбоновых кислот представляет собою конечный общий путь для окисления топливных молекул. Большинство топливных молекул вступают в цикл в виде ацетил-СоА.
Во-вторых, образующиеся в реакциях цикла трикарбоновых кислот активные восстановительные эквиваленты, такие как NADH и FADH2, затем поступают в третий этап – окислительное фосфорилирование, в результате которого образуется основная масса молекул АТФ. Именно поэтому цикл трикарбоновых кислот является одним из основных путей энергетического обмена.
В-третьих, цикл трикарбоновых кислот служит также источником строительных блоков для процессов биосинтеза.
Цикл трикарбоновых кислот осуществляется в митохондрии, где располагаются ферменты, катализирующие реакции этого цикла. Большая часть ферментов располагается в матриксе митохондрии. Исключение – ?-кетоглутаратдегидрогеназа и сукцинатдегидрогеназа, располагающиеся во внутренней мембране митохондрии.
Несмотря на то, что реакции замкнуты в цикл, их можно подразделить на два этапа: окисление ацетил коА до СО2 и регенерация оксалоацетата (последовательность реакций цикла трикарбоновых кислот представлена на рисунке 8).
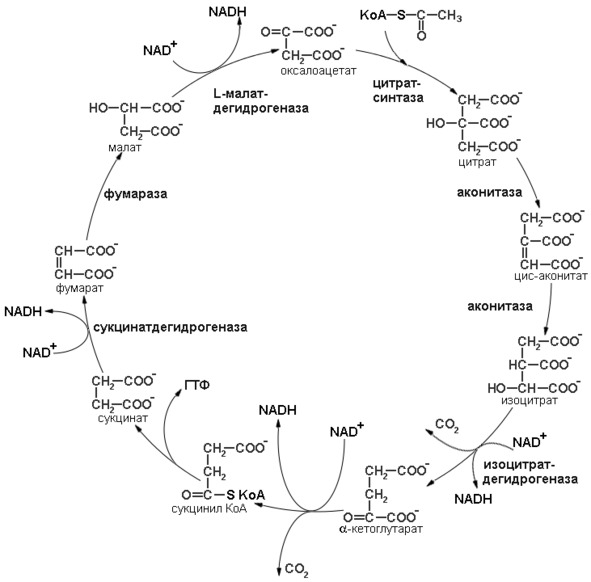
Рисунок 8: Схема реакций цикла трикарбоновых кислот.
Первая стадия окисления ацетил-СоА начинается с начальной реакции цикла. Начальная реакция – конденсация ацетил-СоА и оксалоацетата, приводящая к образованию цитрата, катализируется конденсирующим ферментом, цитратсинтазой, при этом происходит образование связи углерод-углерод между метильным углеродом ацетил-СоА и карбонильным углеродом оксалоацетата. За реакцией конденсации, приводящей к образованию цитрил-СоА, следует гидролиз тиоэфирной связи, сопровождающийся потерей большого количества свободной энергии в форме теплоты; это определяет протекание реакции слева направо до ее завершения. Превращение цитрата в изоцитрат катализируется аконитазой (аконитатгидратазой), содержащей ион железа в Fe2+-состоянии. Ион железа является кофактором, обеспечивающим правильную организацию каталитического центра. Аконитаза относится классу лиаз, а не изомераз, как могло бы показаться на первый взгляд. Эта реакция осуществляется в две стадии: сначала происходит дегидратация с образованием цис-аконитата (часть его остается в комплексе с ферментом), а затем – гидратация и образование изоцитрата. Реакция ингибируется фторацетатом, который сначала превращается во фторацетил-СоА; последний конденсируется с оксалоацетатом, образуя фторцитрат. Непосредственным ингибитором аконитазы является фторцитрат; при ингибировании накапливается цитрат.
Среди простых соединений самым «смертельным» ядом является фторацетат натрия. LD50 (доза, летальная для 50% получивших ее животных) для крыс составляет всего лишь 0,2 мг/кг – почти в 10 раз меньше летальной дозы нервного яда диизопропилфторфосфата. Широко употребляемый (хотя и отзывы о его действии противоречивы) как яд для грызунов «1080», фторацетат был также обнаружен в листьях некоторых ядовитых растений, встречающихся в Африке, Австралии и Южной Америке. Примечательно, что дифторацетат НСР2—СОО- вообще нетоксичен. Биохимическими исследованиями установлено, что сам фторацетат не оказывает на клетки токсического действия. Токсичность проявляется лишь после метаболического превращения фторацетата в фтороцитрат, являющийся высокоспецифичным ингибитором аконитазы. Этот факт весьма примечателен, поскольку изомерный фторцитрат, образующийся в реакции фтороксалоацетата с ацетил-СоА, оказывает на тот же фермент лишь слабое ингибирующее действие, хотя как раз у этого изомера атом фтора находится на том участке, который атакуется аконитазой. Атом фтора имеет небольшой ван-дер-ваальсов радиус (0,135 нм), сравнимый с ван-дер-ваальсовым радиусом водорода (0,12 нм); на это обстоятельство часто ссылаются, когда говорят о способности фторсодержащих соединений «обманывать» ферменты. Однако более вероятно, что высокая электроотрицательность фтора и его способность к участию в водородных связях делают его в метаболическом отношении более сравнимым с – ОН-группой. В случае с фторцитратом предполагают, что ингибирующий изомер связывается с аконитазой «неправильным способом», при котором атом фтора оказывается координационно-связанным с атомом железа в активном центре аконитазы.
Эксперименты с использованием промежуточных соединений, меченных изотопом С14, показывают, что аконитаза взаимодействует с цитратом асимметрично: она всегда действует на ту часть молекулы цитрата, которая образовалась из оксалоацетата. Это сначала было трудно объяснить, так как лимонная кислота является внешне симметричным соединением. Однако положение в пространстве двух групп – СН-СООН лимонной кислоты относительно групп – ОН и – СООН неидентично. Об асимметричном действии аконитазы свидетельствует «судьбах меченого ацетил-СоА (т. е. положение атомов С14) в интермедиатах цикла лимонной кислоты. Возможно, что цис-аконитат не является обязательным интермедиатом между цитратом и изоцитратом и образуется на боковой ветви основного пути.
Образовавшийся изоцитрат окисляется под действием изоцитратдегидрогеназы до оксалосукцината или ?-кетоглутарата. Окислению подвергается гидроксильная группа изоцитрата, образующаяся в результате кето-группа дестабилизирует карбоксильную группу во втором положении, это приводит к декарбоксилированию. Карбоксильная группа отщепляется в виде молекулы углекислого газа. Это первая молекула СО2, образующаяся при окислении ацетил-СоА. Важным компонентом реакции декарбоксилирования являются ионы Мn2+ (или Mg2+). Акцептором протонов и электронов является молекула NAD+, в результате образуется NADH. Описаны три различных формы изоцитратдегидрогеназы. Одна из них, NAD+-зависимая, найдена только в митохондриях. Две другие формы фермента являются NADP+-зависимыми, причем одна из них также находится в митохондриях, а другая в цитозоле. Окисление изоцитрата, связанное с работой дыхательной цепи, осуществляется почти исключительно NAD+-зависимым ферментом.
Образовавшийся в результате окисления изоцитрата ?-кетоглутарат подвергается окислительному декарбоксилированию, сходному с окислительным декарбоксилированием пирувата. Окислительное декарбоксилирование ?-кетоглутарата катализируется ?-кетоглутарат-дегидрогеназным комплексом, сходным по структуре с пируват-дегидрогеназным комплексом. В состав ?-кетоглутарат-дегидрогеназного комплекса входят три вида ферментов: ?-кетоглутарат-дегидрогеназный, транссукцинилазный и дигидролипоил-дегидрогеназный компоненты. Ядро комплекса составляет транссукцинилаза (аналогично трансацетилазе). ?-Кетоглутарат – дегидрогеназный компонент и транссукцинилаза отличаются от соответствующих ферментов пируват-дегидрогеназного комплекса. В то же время дигидролипоил-дегидрогеназные части обоих комплексов идентичны. Видно, что пируват- и ?-кетоглутарат-дегидрогеназные комплексы представляют собою гомологичные ассоциации ферментов. Структурные и механистические особенности, обеспечивающие координированный катализ на входе в цикл трикарбоновых кислот, вновь используются позднее в процессе функционирования этого цикла. Равновесие реакции настолько сильно сдвинуто в сторону образования сукцинил-СоА, что ее можно считать физиологически однонаправленной. Как и при окислении пирувата, реакция ингибируется арсенатом, что приводит к накоплению субстрата (?-кетоглутарата). Реакция окисления ?-кетоглутарата с образованием сукцинил-СоА является реакцией окислительного декарбоксилирования с образованием параллельно молекул СО2 и NADH. Это последняя реакция первого этапа цикла.
Все последующие реакции относятся ко второму этапу цикла – регенерации оксалоацетата.
Продолжением цикла является превращение сукцинил-СоА в сукцинат, катализируемое сукцинаттиокиназой (сукцинил-СоА-синтетазой). Одним из субстратов реакций является ГДФ (или ИДФ), из которого в присутствии неорганического фосфата образуется ГТФ (ИТФ). Это – единственная стадия цикла лимонной кислоты, в ходе которой генерируется высокоэнергетическая фосфатная связь на субстратном уровне; при окислительном декарбоксилировании ?-кетоглутарата потенциальное количество свободной энергии достаточно для образования NADH и высокоэнергетической фосфатной связи. В реакции, катализируемой фосфокиназой, АТФ может образовываться как из ГТФ, так и из ИТФ.
Сукцинаттиокиназа – фермент, располагающийся в печени. В альтернативной реакции протекающей во всех других тканях кроме печени и катализируемой сукцинилСоА-ацетоацетат-СоА-трансферазой (тиофоразой), сукцинил-СоА превращается в сукцинат сопряженно с превращением ацетоацетата в ацетоацетил-СоА. В данной реакции нуклеозидтрифосфаты не образуются, но эта реакция используется для активации ацето-ацетата, что важно для обмена липидов, который будет подробно рассмотрен ниже.
Далее сукцинат дегидрогенируется с образованием фумарата. Дегидрогенирование катализируется сукцинатдегидрогеназой, связанной с внутренней поверхностью внутренней митохондриальной мембраны. Это единственная дегидрогеназная реакция цикла лимонной кислоты, в ходе которой осуществляется прямой перенос водорода с субстрата на флавопротеин без участия NAD+. Фермент содержит FAD+ и железо-серный (Fe-S) белок. В рзультате окисления сукцината до фумарата образуется FADH2. Добавление малоната или оксалоацетата ингибирует сукцинатдегидрогеназу, что приводит к накоплению сукцината.
Фумараза (фумаратгидратаза) катализирует присоединение воды к фумарату с образованием малата. Фумараза специфична к L-изомеру малата, она катализирует присоединение компонентов молекулы воды по двойной связи фумарата в транc-конфигурации. Образовавшийся малат окисляется с образованием оксалоацетата, в результате происходит замыкание цикла трикарбоновых кислот.
Реакцию окисления малата осуществляет малатдегидрогеназа. Малатдегидрогеназа катализирует превращение малата в оксалоацетат, реакция идет с участием NAD+. Хотя равновесие этой реакции сильно сдвинуто в направлении малата, реально она протекает в направлении оксалоацетата, поскольку он вместе с NADH постоянно потребляется в других реакциях.
Ферменты цикла лимонной кислоты, за исключением ?-кетоглутарат и сукцинатдегидрогеназы, обнаруживаются и вне митохондрий. Однако некоторые из этих ферментов (например, малатдегидрогеназа) отличаются от соответствующих митохондриальных ферментов.
Таким образом, два атома углерода поступают в цикл в виде ацетил-СоА и два атома углерода покидают цикл в виде СО2 при последовательных реакциях декарбоксилирования.
Суммарная реакция цикла трикарбоновых кислот:
Ac-СoA+3NAD++FAD++ГДФ ?2CO2+3NADH+FADH2+ГТФ
Суммарная реакция полного окисления глюкозы до CO2:
Глюкоза +2АТФ +10NAD+ +2FAD+ +4АДФ+2ГДФ? 6CO2+2АДФ +4АТФ +10NADH+2FADH2+2ГТФ
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.