Окислительно-восстановительные потенциалы и изменения свободной энергии
Окислительно-восстановительный потенциал – это электрохимическая категория. Необходимо рассмотреть для примера вещество, которое может существовать в окисленной X+ и в восстановленной форме Х. Такая пара называется окислительно-восстановительной парой (схема эксперимента для определения окислительно-восстановительного потенциала представлена на рисунке 10).
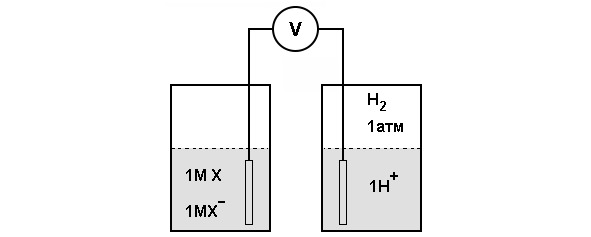
Рисунок 10: Структура эксперимента метода полукамер для определения окислительно-восстановительного потенциала
Окислительно-восстановительный потенциал такой пары можно определить, измеряя электродвижущую силу, развиваемую опытной полукамерой по отношению к стандартной контрольной полукамере. Опытная полукамера представляет собою электрод, погруженный в раствор 1 М окислителя (X+) и 1 М восстановителя (X). Стандартная контрольная полукамера состоит из электрода, погруженного в 1 М раствор Н+, находящийся в равновесии с газообразным Н2 при давлении в 1 атм. Электроды присоединяют к вольтметру и агаровым мостиком обеспечивают электропроводность между полукамерами. Происходит поток электронов oт одной полукамеры к другой. Если реакция идет в направлении
X + H+ ? X+ +1/2H2.
то в полукамерах будут происходить следующие реакции:
Х ? X+ + ?, H+ + ? ? 1/2H2
Таким образом, электроны движутся от опытной полукамеры к контрольной и, следовательно, электрод в опытной полукамере заряжен отрицательно по отношению к электроду стандартной полукамеры. Окислительно-восстановительный потенциал пары X+:X соответствует напряжению в начале эксперимента (когда концентрации X+, X и Н+ равны 1 М). Окислительно-восстановительный потенциал пары Н+:Н2 определен равным 0 В (вольт).
Значение окислительно-восстановительного потенциала теперь очевидно. Отрицательный окислительно-восстановительный потенциал говорит о том, что данное вещество имеет меньшее сродство к электронам, чем Н2 (как в вышеприведенном примере), то есть молекула является донором электронов, то есть восстановителем. Положительный окислительно-восстановительный потенциал свидетельствует о более высоком, чем у Н2, сродстве данного вещества к электронам, то есть является окислителем или молекулой, с большей легкостью присоединяющей электроны. Эти соотношения относятся к стандартным условиям, когда концентрации окислителя, восстановителя и Н+ равны 1 М и давление Н2 составляет 1 атм.
Таким образом, сильный восстановитель (например, NADH) обладает отрицательным окислительно-восстановительным потенциалом, тогда как сильный окислитель (О2) имеет положительный окислительно-восстановительный потенциал. Окислительно-восстановительные потенциалы многих биологически важных окислительно-восстановительных пар известны.
Изменение свободной энергии окислительно-восстановительной реакции можно легко вычислить из разности окислительно-восстановительных потенциалов реагирующих соединений.
Любую окислительно-восстановительную реакцию в общем виде можно представить следующим образом:
Сначала нужно ввести обозначения: окислитель+ – окисленная форма окислителя, окислитель – восстановленная форма окислителя, восстановитель – восстановленная форма восстановителя, восстановитель+ – окисленная форма восстановителя. Запишем общую реакцию, испльзуя обозначения:
окислитель+ + восстановитель ? окислитель +восстановитель+ (реакция А)
Любую окислительно-восстановительную реакцию разделяют на две полу-реакции, каждая из которых представляет собой обмен электронами между окисленной и восстановленной формами окислительно восстановительной пары, чей потенциал можно измерить в эксперименте, описанном выше:
окислитель+ + ? ? окислитель (реакция Б)
Окислительно восстановительный потенциал этой пары Е1 восстановитель+ + ?? восстановитель (реакция В)
Окислительно восстановительный потенциал этой пары Е2
Вычитая реакцию в) из реакции б), получаем желаемую реакцию а) и ?E»о
Теперь можем рассчитать ?G0» для восстановления пирувата за счет NADH. Изменение стандартной свободной энергии ?G0» связано с изменением окислительно-восстановительного потенциала ?E'о уравнением
?G0 = -nF ?E»о
где n- число переносимых электронов, F-число Фарадея (23,062 ккал • В -1 • моль -1), ?E'о выражается в вольтах, ?G0 в килокалориях на моль.
Величина окислительно-восстановительного потенциала дыхательной цепи составляет 1,14 В, что соответствует 53 ккал.
Изменение окислительно-восстановительного потенциала при переходе от системы NAD+/NADH к системе О2/Н2О составляет 1,1 В.
Движущая сила окислительного фосфорилирования – это потенциал переноса электронов, присущий NADH или FADH2. Рассчеты ?E'о и ?G0 связанные с окислением NADH под действием О2. Промежуточные частичные реакции следующие:
а) 1/2О2 +2Н+ +2 ?? Н2О
E«о = +0,82 В,
б) NAD+ + Н+ +2 ?? NADH
E«о = – 0,32 В.
Вычитая реакцию б) из реакции а), получаем
в) 1/2 О2 + NADH + Н+ ? Н2О + NAD +
?E'о = +1,14 В.
Свободная энергия окисления для этой реакции составляет
?G0 = -2—23,062.1,14 = – 52,6 ккал/моль.
Таким образом доказано, что молекула NADH является источником энергии, и, как показывают расчеты, при окислении этой молекулы с участием кислорода выделяется такое количество энергии, которое достаточно для синтеза 7 молекул АТФ. Но реакция происходит взрывообразно, и это не позволяет перевести энергию в более адекватную форму.
Чтобы обеспечить перевод энергии окисления в энергию АТФ необходима система окисления, это обеспечивает дыхательная цепь, состоящая из 4-х белковых комплексов, содержащих коферменты, участвующие в окислительно-восстановительных реакциях. В результате мы имеем с одной стороны материальную группу молекул, передающих электроны друг от друга, то есть образуется система передачи электронов от NADH к О2 по которому идут электроны, как электрическая цепь в сети, с другой стороны это последовательность окислительно-восстановительных реакций, которые происходят в составе электронтранспортной цепи, молекулы коферментов являются окислителями (акцепторами электронов) при взаимодействии с предшествующими молекулами, и являются восстановителями (донорами электронов) при взаимодействии со следующей молекулой цепи.
Из этого заключаем, что каждый следующий кофермент является большим окислителем, чем предыдущий, то есть этот кофермент «отбирает» электроны у предыдущего кофермента, а у него электроны «отбирает» следующий кофермент в электронтранспортной цепи. В данном случае наблюдается увеличение окислительно-восстановительного потенциала, следовательно, каждый следующий кофермент в электронтранспортной цепи является большим окислителем, и, как следствие, электронтранспортная цепь не только физическая часть для потока электронов, но и последовательность окислительно-восстановительных реакций.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.