Организация электронтранспортной цепи
Электронтранспортная цепь организована во внутренней мембране митохондрий и представляет собой четыре белковых комплекса, содержащих коферменты, окислительно-восстановительных реакций (общий план организации и функционирования электрон-транспортной цепи изображен на рисунке 11).
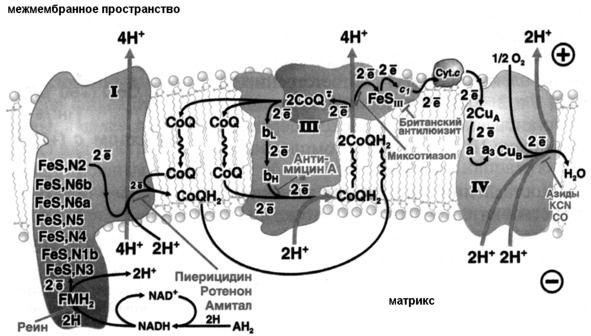
Рисунок 11: Схема общей организации дыхательной цепи (источник: Скулачев В. П., Богачев А. В., Каспаринский Ф. О. Мембранная биоэнергетика М.: Издательство МГУ, 2012)
Первый комплекс – NADH-дегидрогеназа (комплекс I), сукцинат-дегидрогеназа (комплекс II), убихинон-цитохром с редуктаза (комплекс III), цитохром оксидаза (комплекс IV).
NADH-дегидрогеназа (комплекс I) включает в себя флавинмононуклеотид (FMH) и как минимум шесть Fe-S комплексов. Известны три вида Fe-S-центров. В простейшем случае единственный атом железа тетраэдрически координирован с сульфогидрильными группами четырех цистеиновых остатков белка. Второй вид комплексов (обозначен как Fe2-S2) содержит 2 атома железа и два неорганических дисульфида, присоединенных к четырем цистеиновым остаткам. В комплексах третьего вида (Fe4-S4) содержится четыре атома железа, четыре неорганических сульфида и четыре остатка цистеина. В состав NADH-дегидрогеназы входят два кофермента класса Fe2-S2, и четыре класса Fe4-S4 (Схема организации и функционирования коферментов комплекса I представлена на рисунке 12).
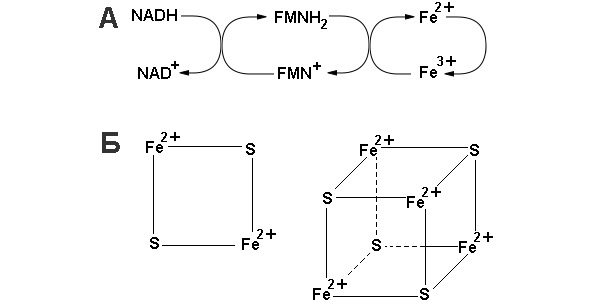
Рисунок 12: А – схема окислительно-восстановительных реакций в комплексе I; Б – структура FeS коферментов
Сукцинат-дегидрогеназа (комплекс II) состоит из 4 субъединиц с молекулярными массами 70, 30, 14 и 12 кDa и содержит в качестве окислительно-восстановительных групп флавинадениндинуклеотид (FAD), ковалентно связанный с самой тяжелой субъединицей, и 3 Fe-S-кластера (один Fe2-S2 и два Fe4-S4), ассоциированных с субъединицей с молелекулярной массой 30 кDa.
Комплекс I обеспечивает окисление молекулы NADH, а комплекс II окисляет молекулу FADH2, электроны поступают на коферменты электрон-транспортной цепи и в конце концов поступают на молекулу убихинона или кофермента Q. Кофермент Q – хиноновое производное с длинным изопреноидным хвостом. Его называют также убихиноном из-за его повсеместного распространения в биологических системах.
Число изопреновых единиц в коферменте Q зависит от вида живых организмов, У млекопитающих его наиболее распространенная форма содержит десять изопреновых единиц и обозначается как Q10. Изопреноидный хвост обуславливает высокую неполярность Q, которая способствует его быстрой диффузии в углеводородной фазе внутренней митохондриальной мембраны. Кофермент Q является компонентом митохондриальных липидов; среди других липидов преобладают фосфолипиды, являющиеся частью митохондриальной мембраны. Структура кофермента Q сходна со структурой витаминов К и Е.
Близкую структуру имеет и пластохинон, находящийся в хлоропластах. Все эти вещества имеют в своей структуре полиизопреноидную боковую цепь. Содержание кофермента Q значительно превосходит содержание других компонентов дыхательной цепи (по параметру стехиометрии); это позволяет предположить, что кофермент Q является подвижным компонентом дыхательной цепи, который получает восстановительные эквиваленты от фиксированных флавопротеиновых комплексов и передает их на цитохромы. Кофермент Q-единственный переносчик электронов в дыхательной цепи, который не связан прочно с белком и не присоединен к нему ковалентно. Кофермент Q действительно служит высокомобильным переносчиком электронов между флавопротеинами и цитохромами цепи переноса электронов.
Убихинон-цитохром с редуктаза (комплекс III) включает 11 субъединиц с молекулярным весом: 49,5, 47, 44, 28, 21,5, 13,5, 9,5, 9, 8, 7, 6,5 kDa соответственно. Третья субъединица весом 44 kDa присоединяет две молекулы гемов bH и bL. Центральную роль цитохромов в дыхании открыл в 1925 г. Дэвид Кейлин (David Keilin).
Цитохром – это переносящий электроны белок, молекула которого содержит в качестве простетической группы гем.
Гем – это модифицированная молекула тетрапиррольного кольца, в центре которой ассоцииирован ион металла (это могут быть ионы железа, меди и других металлов). В зависимости от радикалов, модифицирующих кольцо, и от ионов ассоцированных с кольцом гема, выделяют несколько классов цитохромов. Субъединица V или белок Риске содержит Fe2-S2 кластер. Субъединица VI связывает убихинон, субъединица IV координирует цитохром с. Функции остальных субъединиц не выявлены или участвуют в организации комплекса (схема функционирования убихинона и коферментов комплекса III представлена на рисунке 13).
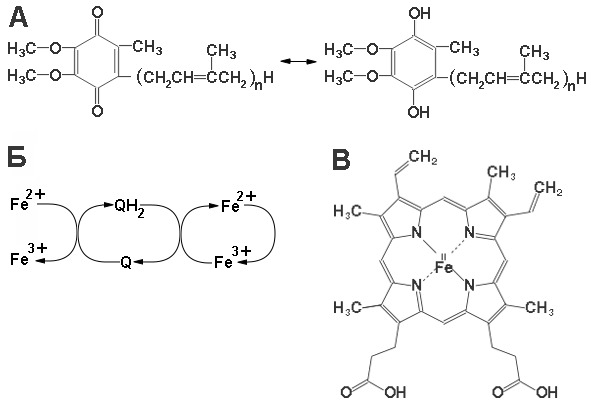
Рисунок 13: А – схема окислительно-восстановительной реакции с убихиноном; Б – схема окислетельно-восстановительных реакций между FeS белком и убихиноном, между убихиноном и гемом; В – структура гема в цитохромах
Электроны с убихинон-цитохром с редуктазы переносятся на цитохром с. Цитохром с – водорастворимый, подвижный белок с молекулярной массой 12 kDa. Этот белок мигрирует между комплексами III и IV в межмембранном пространстве.
Цитохром оксидаза (комплекс IV) содержит восемь белковых субъединиц, с ними ассоциированы два гема, содержащих ионы меди, которые называют гемы а и а3. Кроме этого содержит два иона меди CuA и СuB. Центр СuB представляет ион меди соединенный с радикалами трех остатков гистидина. Центр CuA содержит два атома меди расположенных очень близко и скоординированных с белком (схема функционирования коферментов комплекса IV представлена на рисунке 14).
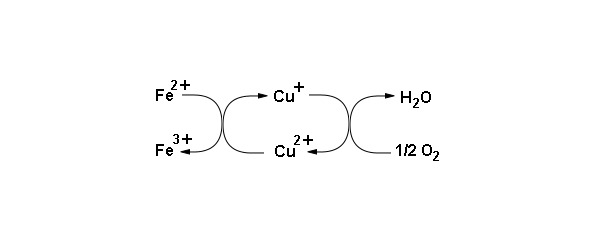
Рисунок 14: Схема функционирования коферментов комплекса IV
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.