3.1. Химические методы анализа
В основе химических методов анализа лежит проведение химической реакции с образованием соединения (или продуктов реакции) постоянного состава с последующим количественным определением содержания образующихся продуктов реакции. В настоящее время это в основном методы объемного анализа. Распространенные ранее весовые методы из-за их трудоемкости и длительности используются изредка в качестве арбитражных, когда возникают разногласия, например, при определении сульфатов, высоких концентраций нефтепродуктов, жиров.
Методы объемного анализа предусматривают взаимодействие исследуемого компонента с реактивом, который добавляется в виде раствора определенной концентрации (титрующий раствор) до того момента, когда количество прибавленного реактива не станет эквивалентно количеству определяемого компонента в растворе. Этот процесс называется титрованием, а момент окончания титрования – точкой эквивалентности. Конец титрования обычно устанавливают по изменению цвета индикатора, то есть вещества, которое изменяет свою окраску при концентрациях реагирующих веществ, близких к точке эквивалентности. Индикатор и условия титрования выбирают так, чтобы точка титрования индикатора совпадала с точкой эквивалентности или была возможно ближе к ней (Никаноров, 2008; Харитонов и др., 2012).
Чувствительность методов объемного анализа 10–3–10–4% (массовая доля), погрешность определения 0,5–1,5 %. Основным преимуществом объемного анализа являются простота, быстрота определения, а также широкие возможности использования разнообразных химических свойств веществ. Благодаря этим достоинствам методы объемного анализа в настоящее время являются основными при определении макрокомпонентов природных вод (Предеина, Решетняк, 2012).
В зависимости от типа реакций методы объемного анализа делятся на методы кислотно-основного титрования, окислительно-восстановительное титрование, осадительное титрование и титрование с образованием комплексов.
При кислотно-основном титровании в качестве титрованных растворов обычно применяют кислоты и щелочи. В гидрохимии этим методом определяют диоксид углерода и гидрокарбонаты (Руководство … 2009).
Метод определения диоксида углерода основан на количественном переводе угольной кислоты в ионы НСО-3 при титровании пробы щелочью (рН 8,2–8,4) в присутствии индикатора фенолфталеина:
Для определения гидрокарбонатных и карбонатных ионов используется их взаимодействие с сильной кислотой, в результате чего образуется Н2СО3, которая распадается на СО2 и Н2О:
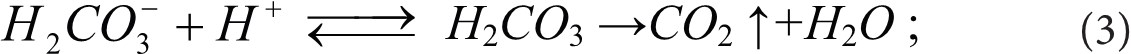
Метод предусматривает добавление избытка соляной кислоты (до рН~3), удаление образующегося диоксида углерода и последующее оттитровывание избытка кислоты раствором буры Na2B4O7 в присутствии смешанного индикатора метилового красного – метиленового голубого.
Титрование окислителями и восстановителями применяется в основном при определении растворенного кислорода и окисляемости. Определение растворенного кислорода основано на взаимодействии гидроксида марганца с растворенным в воде кислородом, в результате чего образуется нерастворимое соединение четырехвалентного марганца коричневого цвета. При подкислении раствора в присутствии избытка йодистого калия образуется йод, количество которого эквивалентно содержанию растворенного кислорода и учитывается титрованием раствора тиосульфата (Никаноров, 2008; Руководство … 2009):

Определение бихроматной окисляемости основано на окислении органических веществ бихроматом калия в кислой среде (в присутствии катализатора), избыток которого титруют раствором железо-аммонийных квасцов.
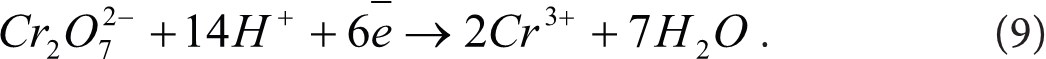
Методы осаждения используются при определении сульфатов и хлоридов. Метод определения сульфатов основан на их взаимодействии с солями свинца, в результате чего образуется слаборастворимый осадок PbSО4 в присутствии индикатора дитизона. В эквивалентной точке окраска индикатора изменяется из сине-зеленой в красно-фиолетовую (Никаноров, 2008; Руководство … 2009).
Метод определения хлоридов основан на малой растворимости хлорида серебра AgCl, который выпадает из раствора при добавлении нитрата серебра AgNO3 к воде, содержащей хлоридные ионы:
После полного осаждения хлоридов избыток ионов серебра вступает в реакцию с ионами хромовой кислоты, которую добавляют как индикатор. При этом образуется осадок хромата серебра красного цвета.
Примерами титрования с образованием комплексов могут служить реакции взаимодействия ионов кальция и магния с трилоном Б, с которым этим ионы образуют малодиссоциированные комплексы.
Таким образом, химические методы анализа (весовые и объемные аналитические методы) широко используются в мониторинге качества поверхностных вод. Весовой или гравиметрический метод анализа основан на выделении исследуемого компонента из водной среды с последующим взвешиванием на аналитических весах. Метод отличается высокой точностью, однако характеризуется длительностью и большой трудоемкостью. Используется для определения содержания взвешенных веществ в воде, нефтепродуктов при их высоком содержании. В качестве арбитражного метода применяется в анализе сульфатов. Объемный или титрометрический метод анализа природных вод является основным при определении макрокомпонентов природных вод. Основные преимущества объемного анализа: простота, быстрота определения, широкие возможности использования разнообразных химических свойств веществ (Никаноров, 2008).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.