Взаимное узнавание
Взаимное узнавание
Множество захватывающих тайн в биологии связано со способами взаимного узнавания на уровне молекул, клеток и организмов. Как одна молекула находит другую в безумной химической круговерти цитоплазмы? Как транскрипционный фактор находит среди миллиардов нуклеотидов ДНК тот единственный и неповторимый участок, к которому он должен прикрепиться? Откуда знают растущие нервные клетки, в какую сторону им необходимо выпустить отросток и с какой клеткой вступить в контакт? Как удается самцу насекомого безошибочно найти по запаху самку своего вида, особенно если концентрация химического сигнала в воздухе близка к нулю? Как ухитряется самка рыбки колюшки опять-таки по запаху выбрать себе в мужья такого самца, который приходится ей одновременно и не слишком близкой, и не слишком дальней родней?
Тема эта необозримо велика, и мы ее до сих пор почти не затрагивали. Не удастся нам подробно раскрыть ее и в этой последней главе. Но о двух удивительных и тесно взаимосвязанных открытиях я все-таки расскажу. Одно из них имеет отношение к иммунитету, другое — к формированию нервной системы в ходе индивидуального развития. Казалось бы, какая тут связь? Самая прямая: в обоих случаях главным действующим лицом оказался один и тот же белок из надсемейства иммуноглобулинов. И белок этот сам по себе заслуживает того, чтобы о нем рассказать. Известный в биологических кругах афоризм гласит: тот, кто не видел кораллового рифа, не зоолог. Примерно то же и здесь: кто не слышал о белке DSCAM, едва ли может представить себе, на что способны белки. Но начнем по порядку.
Первое открытие связано с иммунной системой насекомых[104]. Как мы помним, основная обязанность иммунной системы — безошибочно распознавать любую попавшую в организм заразу, в том числе и такую, с которой раньше не приходилось встречаться. Для этого нужно иметь очень много разных белков, избирательно связывающихся с различными чужеродными веществами (антигенами). Позвоночные животные продуцируют сотни тысяч вариантов таких защитных белков — гораздо больше, чем генов в геноме. Высокое разнообразие защитных белков достигается благодаря прижизненным перестройкам генома в клетках иммунной системы — лимфоцитах. О том, как это происходит, говорилось в главе «Управляемые мутации», а здесь я только вкратце напомню самое основное.
В геноме «зародышевой линии», то есть в том геноме, который позвоночное животное получает от папы с мамой, нет генов антител как таковых, а есть наборы заготовок — несколько «кассет» похожих, но немного различающихся фрагментов будущего гена. В зреющем лимфоците специальные ферменты (потомки прирученных транспозонов — RAG-белки) режут и перекраивают геномную ДНК, чтобы собрать из этих заготовок один функциональный ген. При этом из каждой «кассеты», состоящей из десятков похожих фрагментов, случайным образом выбирается какой-то один. В разных лимфоцитах гены антител получаются разными, а общее число теоретически возможных вариантов у человека или мыши достигает трех миллионов. Приобретенный иммунитет формируется за счет того, что те лимфоциты, чьи антитела лучше других связываются с данным инфекционным агентом, усиленно размножаются, а гены их антител вдобавок еще и «подгоняются» к антигену за счет мутирования и дополнительного отбора.
Всего этого нет у беспозвоночных. Долгое время считалось, что беспозвоночным удается как-то обходиться одним лишь врожденным, неспецифическим иммунитетом и сравнительно небольшим числом иммунных белков — рецепторов, гены которых в «явном виде» присутствуют в геноме зародышевой линии и не подвергаются прижизненным перестройкам. Учитывая быструю эволюцию и вариабельность микроорганизмов, было довольно удивительно, каким образом беспозвоночные ухитряются при этом выжить.
Однако со временем открывалось все больше фактов, показывающих, что у беспозвоночных тоже формируется приобретенный иммунитет. Вот только как им это удается без прижизненных перестроек генов, оставалось неясным.
Иммунологи из Университета Джонса Гопкинса (США) обратили внимание на один весьма необычный ген, имеющийся и у позвоночных, и у насекомых. Этот ген называется DSCAM (Down syndrome cell adhesion molecule). Некоторые его мутации у человека ассоциированы с синдромом Дауна. У насекомых он, как было известно, отвечает за регуляцию роста нервных клеток, хотя как именно он это делает, никто не знал. Ген принадлежит к надсемейству иммуноглобулинов, то есть содержит иммуноглобулиновые домены (последовательности нуклеотидов, кодирующие участки белковой молекулы, предназначенные для избирательного связывания других молекул). Иммуноглобулиновые гены есть практически у всех животных. Они выполняют разнообразные рецепторные функции, далеко не всегда связанные с иммунной защитой. Например, тот же рост аксонов направляется определенными химическими сигналами, которые кто-то должен улавливать и распознавать.
После того как на матрице гена DSCAM синтезируется его РНК-копия (мРНК), она подвергается особой процедуре редактирования — альтернативному сплайсингу (см. врезку).
—————
Альтернативный сплайсинг. Как известно, почти все гены высших организмов состоят из участков, кодирующих белок (экзонов), и вставленных между ними некодирующих фрагментов (интронов). Есть мнение, что некоторые интроны являются потомками мобильных генетических элементов, бурно размножившихся в геноме древнейших эукариот (см. главу «Великий симбиоз»). В ходе прочтения гена (транскрипции) сначала синтезируется «незрелая» матричная РНК (мРНК), представляющая собой полную копию всего гена, включая интроны. Затем интроны один за другим «вырезаются» из молекулы РНК, а экзоны соединяются друг с другом. Это и называется сплайсингом. Обычно существует несколько альтернативных вариантов сплайсинга для одной и той же мРНК. Дело в том, что часть экзонов может быть вырезана вместе с прилегающими к ним интронами. В результате из одной и той же «незрелой» мРНК, содержащей, например, 7 экзонов (1, 2, 3, 4, 5, 6, 7) могут получиться разные «зрелые» мРНК: 12357, 12467, 2345 и т. д. Экзоны могут вырезаться из молекулы РНК, но не могут меняться местами. Разные мРНК станут затем матрицами для синтеза разных белков. Таким образом, благодаря механизму альтернативного сплайсинга один и тот же ген может кодировать несколько разных белков. То, какой именно белок будет производиться данным геном в каждой конкретной ситуации, зависит от сложных регуляторных систем, о которых пока еще очень мало известно.
Между прочим, тот факт, что благодаря альтернативному сплайсингу один ген может кодировать более одного белка, является явным нарушением принципа «один ген — один белок» (или «один ген — один фермент»), который был сформулирован еще в 40-е годы XX века. Данный принцип сыграл огромную положительную роль в становлении современной молекулярной биологии. На тот момент это было величайшим достижением — догадаться, что загадочные гены, молекулярная природа которых еще не была расшифрована, занимаются не чем-нибудь, а именно кодированием белков, причем каждому белку соответствует свой собственный ген. Но сегодня этот принцип устарел, как и почти все «классические догмы» образца середины прошлого века. Вот вам и еще один пример лопнувшей «абсолютной истины»!
—————
Уникальной особенностью гена DSCAM, содержащего 21 экзон, является то, что три из них представлены не в единственном экземпляре, а в виде кассет из множества немного различающихся копий. У малярийного комара, на котором проводилось данное исследование, экзон № 4 представлен в 14 экземплярах, экзон № 6 — в 30, экзон № 10 — в 38. В ходе сплайсинга сохраняется только один вариант каждого из этих экзонов. Таким образом, за счет альтернативного сплайсинга на основе единственного гена DSCAM может быть синтезировано 14 x 30 x 38 = 15 960 разных рецепторных белков. У мушки дрозофилы число вариантов еще больше: 38 016.
Такая структура гена DSCAM до боли напоминает те кассеты заготовок, из которых в лимфоцитах млекопитающих конструируются гены антител. Поэтому мысль об участии DSCAM в иммунной защите, по правде сказать, напрашивалась давно, но доказать это удалось лишь недавно, в 2006 году. Ученые обнаружили, что в присутствии разных бактерий иммунные клетки производят разные наборы сплайс-вариантов белка DSCAM. Например, в ответ на заражение кишечной палочкой резко увеличивается частота использования 8-го варианта 4-го экзона, тогда как стафилококк стимулирует синтез белков DSCAM с использованием 1-го варианта того же экзона.
Искусственное «выключение» гена DSCAM приводит к резкому снижению способности комара сопротивляться инфекциям; кроме того, в его гемолимфе (аналог крови у насекомых) начинают бурно размножаться бактерии, в норме присутствующие там в небольших количествах. Это доказывает непосредственное участие DSCAM в иммунной защите.
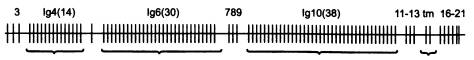
Строение гена DSCAM малярийного комара. Вертикальными отрезками показаны экзоны. Иммуноглобулиновые экзоны 4, 6 и 10 представлены кассетами из 14, 30 и 38 альтернативных вариантов. Зрелая РНК после сплайсинга будет содержать лишь по одному варианту каждого из этих трех экзонов.
Ученым удалось показать, что отключение тех сплайс-вариантов белка DSCAM, которые синтезируются в присутствии кишечной палочки, лишает комара способности бороться именно с кишечной палочкой, но не со стафилококком, и наоборот. Выяснилось также, что сплайс-варианты DSCAM, синтезируемые в ответ на заражение той или иной бактерией, лучше других «прилипают» именно к этой бактерии.
Изменения в спектре синтезируемых сплайс-вариантов DSCAM, спровоцированные контактом с бактериями, сохраняются в течение как минимум 18 часов после того, как контакт прекратился (что происходит потом, ученые просто не проверяли). Это очень похоже на явление приобретенного иммунитета!
Таким образом, различные сплайс-варианты белка DSCAM в известной мере аналогичны антителам позвоночных (хотя антитела, конечно, более избирательны и эффективны). Образование разнообразных сплайс-вариантов DSCAM осуществляется на основе того же комбинаторного принципа, что и образование антител у позвоночных. В обоих случаях используются случайный выбор и комбинирование отдельных фрагментов гена, каждый из которых представлен в геноме в виде нескольких альтернативных вариантов. Только у позвоночных это «перекраивание» генетической информации осуществляется на уровне ДНК, а у насекомых — на уровне РНК.
Это исследование, на мой взгляд, представляет собой крупный прорыв не только в изучении иммунной системы беспозвоночных, но и в понимании общих принципов иммунитета в целом. Можно ожидать, что дальнейшие исследования приведут к открытию новых черт сходства между иммунными системами далеких друг от друга групп организмов.
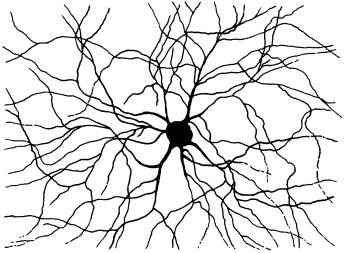
Каждая нервная клетка имеет десятки и сотни отростков, которые в ходе развития организма соединяются в строго определенном порядке. Как отростки нейронов находят друг друга и что позволяет им не ошибиться? Оказалось, что важную роль в этом играет иммунологический механизм различения «своих» и «чужих».
За рамками исследования осталось множество важных вопросов. Например, осталось неясным, каким образом осуществляется регуляция сплайсинга. Откуда комар «знает», какие варианты белка DSCAM нужно синтезировать для борьбы с кишечной палочкой, а какие — для защиты от стафилококка? В любом случае результат удивительный: целая иммунная система — в одном-единственном белке!
Второе недавнее открытие, связанное с белком DSCAM, позволило понять, какую роль играет это биохимическое чудо в развитии нервной системы.
До сих пор было известно только то, что у насекомых с мутациями в гене DSCAM нервная система развивается неправильно. Механизм участия DSCAM в индивидуальном развитии был неясен, хотя «общую идею» нетрудно было угадать. Чтобы из делящихся клеток зародыша, которые все имеют одну и ту же заложенную в них «программу поведения» (геном), сформировалась не аморфная клеточная масса, а сложный организм, эти клетки должны знать, в какую сторону им расти или переползать, к кому приклеиваться, а от кого, напротив, отделяться. Для этого им нужно как-то узнавать друг друга, понимать, кто есть кто в их окружении. Такое взаимное узнавание клеток особенно важно в ходе развития нервной системы, чтобы отростки нейронов соединялись друг с другом правильным образом и формировали «правильные» нервные контуры и сети.
Что касается белков иммуноглобулинового надсемейства, то они как раз и специализируются на выполнении задач такого рода, то есть на персональной идентификации и различении «своих» и «чужих». Поэтому можно было предвидеть, что для этих белков найдется работа не только в иммунной системе, но и в других ситуациях, когда нужно разбираться, кто есть кто в клеточном или социальном окружении[105]. Однако, повторю, до недавнего времени никто не знал, каким именно способом белок DSCAM реализует эту функцию в ходе развития нервной системы.
В 2004 году у белка DSCAM было обнаружено очередное поразительное свойство[106]. Оказалось, что каждый сплайс-вариант этого белка обладает способностью к так называемому «гомофильному связыванию». Это значит, что молекула данного сплайс-варианта «узнает» другую такую же молекулу и прочно связывается с ней. При этом она никогда не связывается с другими сплайс-вариантами того же белка. Совершеннейшая фантастика, если подумать! Всем известно, что молекулы ДНК и РНК легко «узнают» свои собственные копии и склеиваются с ними на основе принципа комплементарности. Но чтобы подобные свойства обнаружились у белков — в это даже поверить трудно. Тем не менее данный факт подтвержден весьма тщательными экспериментами, проверены сотни сплайс-вариантов. Механизм «гомофильного связывания» активно исследуется, но пока еще до конца не расшифрован.
Нетрудно догадаться, что эта удивительная особенность делает DSCAM идеальным молекулярным устройством для различения «своих» и «чужих». Оставалось выяснить, как это устройство используется при развитии нервной системы.
Биологи из Австрии и США в 2007 году получили ответ на этот вопрос при помощи генной инженерии[107]. Они создали три линии генетически модифицированных мух, в каждой из которых ген DSCAM был радикально «упрощен». Из него были вырезаны все альтернативные наборы фрагментов-заготовок, кроме одного-единственного, разного в каждой из трех линий. Модифицированные мухи, таким образом, могли синтезировать только один сплайс-вариант белка DSCAM вместо 38 016.
Внесенные в геном изменения оказались летальными. Все мухи, у которых обе копии гена DSCAM были изменены (то есть гомозиготы), погибали на стадии личинки или куколки, и у этих личинок и куколок наблюдались серьезные нарушения в развитии нервной системы. Например, у нормальных мух в обонятельном отделе мозга имеются определенным образом расположенные узлы, к каждому из которых присоединяются отростки чувствительных нейронов определенного типа. У личинок-мутантов данный отдел мозга представлял собой беспорядочную массу нейронов, и отростки чувствительных клеток крепились к нему как попало. При этом ген DSCAM у этих личинок работал, и количество производимого белка DSCAM было таким же, как у здоровых насекомых. Результат был одинаков во всех трех генетически модифицированных линиях.
Авторы сделали вывод, что жизненно важным является не только белок DSCAM сам по себе, но и разнообразие его сплайс-вариантов.
Дальнейшие исследования показали, что каждый нейрон в норме производит свой собственный уникальный набор сплайс-вариантов белка DSCAM. Таким образом создается уникальная «визитная карточка» данного нейрона, что позволяет нейрону отличать свои собственные отростки от чужих.
При помощи сложных экспериментов удалось показать, что нейроны, способные синтезировать только один сплайс-вариант DSCAM, растут неправильно, если они окружены другими такими же мутантными нейронами, однако их рост становится совершенно нормальным, если их окружают обычные нервные клетки, производящие разные сплайс-варианты. Если нейрон вообще не производит белка DSCAM, он растет неправильно в любом клеточном окружении. От того, какой именно сплайс-вариант производят мутантные клетки, как выяснилось, ничего не зависит.
Таким образом, сплайс-варианты DSCAM нужны нервным клеткам для создания уникального «молекулярного паспорта», благодаря которому нейроны отличают свои собственные отростки от чужих.
Данное открытие подтверждает идею о том, что молекулярные системы различения «своих» и «чужих», основанные на иммуноглобулиновых белках, гораздо шире распространены в живой природе, чем думали когда-то, и роль их отнюдь не сводится к одной лишь иммунной защите. Осмелюсь предположить, что скоро нас ждут новые открытия в этой области.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Взаимное обучение муравьев.
Взаимное обучение муравьев. В той или иной степени обучение происходит у всех животных, какую-то часть жизни обитающих совместно, будь то птичьи базары или стаи рыб. Чем устойчивее такое объединение, прочнее связи между его членами, тем больше возможности обучения. В этом
Взаимное подтягивание
Взаимное подтягивание Почему в эволюции вообще возникает двусторонняя (билатеральная) симметрия? Она связана с активным движением в пространстве. Некоторые одноклеточные существа всю свою жизнь проводят в толще морской воды. Строго говоря, для них не существует понятий
ГЛАВА 3 Узнавание по звуку
ГЛАВА 3 Узнавание по звуку Жужжание пчелы и стрекотание кузнечика — привычные звуки теплого дня — для нашего уха представляют собой просто приятные голоса лета. И в самом деле, до недавнего времени казалось, что в жужжании пчелы не больше смысла, чем в шуме самолета. Но
Врожденное узнавание
Врожденное узнавание Появившись на свет, животное должно быстро и верно ориентировать свои движения по отношению к разным агентам среды. Такая ориентация по отношению к жизненно важным компонентам среды с минимальной тратой энергии и времени — поистине вопрос жизни и
Врожденное узнавание и ранний опыт
Врожденное узнавание и ранний опыт В начале постнатального развития животного недопустима «роскошь» продолжительного научения. Тем не менее уже здесь проявляется общее правило, что нет чисто врожденных форм поведения, лишенных каких бы то ни было элементов научения.
Взаимное кормление, или общественный желудок
Взаимное кормление, или общественный желудок У общественных насекомых — муравьев, пчел, ос, термитов существует обычай кормить друг друга пищевыми отрыжками. Обоюдный обмен отрыжками происходит не только среди взрослых, но даже между взрослыми и личинками. Обмен
Глава 4 Мать и ребенок: взаимное воспитание
Глава 4 Мать и ребенок: взаимное воспитание У Марии Маршалл темно-карие глаза, прекрасные и обескураживающие одновременно. Там, где у других скрывается соблазн, или скромность, или живость, или любопытство, вы увидите две непроницаемые бездны. Если вы попытаетесь поймать