7.9. Физиология синапса
7.9. Физиология синапса
Структуру химического синапса можно изобразить следующим образом (рис. 7.5).
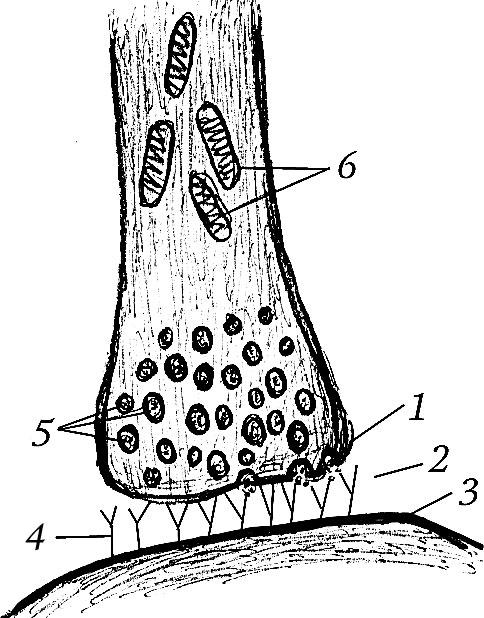
Рис. 7.5. Структура химического синапса:
1 – пресинаптическая мембрана; 2 – синаптическая щель; 3 – постсинаптическая мембрана; 4 – рецепторы; 5 – везикулы с медиатором; 6 – митохондрии
В пресинаптической мембране интенсивность стимула кодируется частотой нервного импульса, что отражается на интенсивности выделения медиатора в синаптическую щель. Медиатор хранится в пузырьках-везикулах, окруженных плазмолеммой, в булавовидном окончании аксона. В процессах формирования везикул участвует большой комплекс белков, что обусловливает многообразие их регуляции. Перемещение молекул медиатора в везикулы происходит в обмен на выход из них протонов, что осуществляется специальными Н+-АТФазами.
Когда нервный импульс доходит до конца аксона, он изменяет потенциал мембраны и открывает потенциал-зависимые Са2+-каналы. Ионы Са2+ по градиенту проникают внутрь клетки, поскольку снаружи их больше. Возрастание концентрации Са2+ в пресинаптическом окончании аксона является сигналом, запускающим движение синаптических пузырьков (везикул) с нейромедиатором к пресинаптической мембране с последующим выбросом медиатора в синаптическую щель. Выброс медиатора происходит путем экзоцитоза. Экзоцитоз возможен только в присутствии ионов Са2+, которые участвуют в работе многих других клеточных механизмов. Так, в некоторых нейронах Са2+, а не Na+, является основным ионом, вызывающим ПД.
Большинство медиаторов относятся к группам аминов и аминокислот. Наиболее важные из них – ацетилхолин, норадреналин, серотонин, дофамин, ГАМК (?-аминомасляная кислота), глутаминовая кислота.
Ацетилхолин является и возбуждающим, и тормозным медиатором. Он участвует в реализации таких важных функций, как память, обучение, регуляция движения, уровень бодрствования.
Норадреналин присутствует в основном в группировках нейронов среднего мозга. Эти обильно ветвящиеся нейроны способны изменять уровень активности нервной системы, что приводит к изменению поведения.
ГАМК является основным тормозным нейромедиатором в ЦНС. Она выявляется в 50 % всех нервных окончаний нейронов мозга (Каменская М. А., 1999). Вместе с серотонином ГАМК участвует в контроле цикла «сон – бодрствовование».
Глутаминовая кислота – главный возбуждающий медиатор мозга. С функцией глутаматергической системы тесно связаны процессы, определяющие все формы памяти. Это объясняется уникальными свойствами рецепторов глутаминовой кислоты.
Действие серотонина и дофамина мы рассмотрим позже.
Исследования последних лет показали, что в одном нейроне могут синтезироваться несколько разных медиаторов, а не один, как предполагали ранее. Также в нервных окончаниях одного нейрона могут сосуществовать разные нейропептиды (с ними мы познакомимся в следующей главе), которые участвуют в процессах регуляции. Практически все нейроны выделяют нейропептиды-модуляторы, играющие важную роль в интегративной деятельности нервной системы.
Основную роль в восприятии сигналов, передаваемых нервным импульсом, играют рецепторы постсинаптической мембраны. Это образования, которые с высокой специфичностью связывают нейромедиаторы и обеспечивают восприятие сигнала (Дамбинова С. А., 1999). Именно конкретные рецепторы определяют реакции клетки на поступающие сигналы. Одни и те же нейромедиаторы в разных синапсах могут взаимодействовать с разными рецепторами, причем иногда с прямо противоположным эффектом.
Как уже говорилось выше, рецепторы формируют структуру гликокаликса и состоят из белков и гликолипидов. Высокая скорость обновления нейрорецепторов является важнейшим фактором пластичности нервной ткани – уникального свойства, лежащего в основе явлений научения и памяти. Поэтому в нейронах хорошо развиты механизмы непрерывного синтеза компонентов рецепторов.
По механизму действия рецепторы делятся на два вида, весьма различающихся по своему функционированию.
Ионотропные рецепторы осуществляют прямую передачу. Они являются ионными лиганд-зависимыми каналами, которые активируются медиаторами, если медиатор окажется подходящим к рецептору, по принципу «ключ-замок». Открытие каналов изменяет ионный состав нейрона, в результате чего формируется постсинаптический потенциал (ПСП). Чем больше выделится медиатора, тем больше откроется каналов в постсинаптической мембране, а следовательно, больше будет постсинаптический потенциал.
Поскольку к нейрону подходят несколько тысяч нервных окончаний других нейронов, встает задача создания нужного выходного сигнала. Эта фундаментальная задача решается путем суммирования разных ПСП с помощью специальных потенциал-зависимых каналов аксонного холмика. Сигналы, приходящие от разных нейронов, могут быть как возбуждающие, так и тормозные, в зависимости от приближения или отдаления мембранного потенциала от порога для ПД. Так, два входных сигнала (одинаково увеличивающий и уменьшающий потенциал покоя) могут взаимно «нейтрализовать» друг друга. Суммирование ПСП выражается изменением частоты импульсов ПД. Чем выше показатель суммарного ПСП, тем выше частота импульсов выходного ПД.
Из ионотропных рецепторов весьма подробно изучены NMDA-рецепторы глутамата, которые локализованы, главным образом, в коре полушарий и гиппокампе. Они играют важную роль в формировании синаптической пластичности, возможно, определяющей механизмы памяти и научения. Мы еще вернемся к каналам NMDA в последующем изложении.
Метаботропные рецепторы не являются ионными каналами и осуществляют непрямую передачу. Медиатор, присоединяясь к метаботропному рецептору, вызывает образование посредников, которые воздействуют на ионный канал через ряд промежуточных биохимических реакций.
Рецепторы непрямой передачи более разнообразны. Обычно в мембране они соединены при помощи жирных кислот с G-белками, которые играют ключевую роль в механизме непрямой передачи. О роли G-белков наглядно свидетельствует тяжесть многих заболеваний, связанных с нарушением их структуры. За открытие роли G-белков в передаче сигнала в клетке американским биохимикам М. Родбеллу (1925–1998) и А. Джилмену (р. 1941) была присуждена Нобелевская премия 1994 г.
G-белки состоят из трех субъединиц, которые кодируются разными генами. Каждая субъединица имеет много разновидностей, а их комбинации позволяют создавать более 100 клеточных G-белков. Активация рецепторов медиатором передается G-белкам, что выражается их взаимодействием с ГТФ (гуанинтрифосфорная кислота).
Активированные ГТФ G-белки могут непосредственно воздействовать на ионные каналы, вызывая их активацию или ингибирование. Но чаще их воздействие более опосредованно и связано с формированием каскадных путей. В каскадах принимают участие посредники – вторичные мессенджеры, осуществляющие передачу информации внутрь клетки. Типичный биохимический каскад можно представить следующей схемой: стимул ? рецептор ? G-белок ? фермент мембраны ? вторичный мессенджер ? фермент цитоплазмы. Первичными мессенджерами считаются сами лиганды, взаимодействующие с рецептором (медиаторы или гормоны).
Вторичных мессенджеров довольно много, но наиболее важным из них, несомненно, является ц-АМФ. Роль ц-АМФ как вторичного мессенджера была показана американским биохимиком Э. Сазерлендом (1915–1974), лауреатом Нобелевской премии 1971 г.
Продуцируется ц-АМФ из АТФ под действием мембранного фермента аденилатциклазы. В свою очередь, ц-АМФ активирует фермент цитоплазмы протеинкиназу, которая фосфорилирует множество белков, изменяющих этим свою активность. Такими белками могут быть и белки ионных каналов.
Активация Са2+-связывающего белка кальмодулина аналогична активации протеинкиназ ц-АМФ, только в роли вторичного мессенджера выступают ионы Са2+.
Вторичные мессенджеры не только позволяют переводить внеклеточные сигналы во внутриклеточные, но и обеспечивают значительное усиление сигнала. С их помощью происходит чрезвычайно гибкое регулирование эффектов внешних сигналов. Возможно активное воздействие на фундаментальный процесс синтеза белков. Действие медиаторов, опосредованное непрямыми механизмами, может длиться от нескольких миллисекунд до нескольких лет (Николс Дж. [и др.], 2008).
Особый интерес для понимания механизмов памяти представляют ретроградные мессенджеры, осуществляющие обратный перенос информации – от постсинаптического к пресинаптическому нейрону. Одним из кандидатов на роль ретроградного мессенджера выступает окись азота (NO), легко проникающая через клеточную мембрану. Однако в последнее время рассматриваются и другие вещества, включая пептиды.
Одни и те же медиаторы могут участвовать и в прямой, и в непрямой передаче. В ряде синапсов непрямые механизмы осуществляют модуляцию прямой передачи.
Учитывая многообразный характер регуляции активности нейронов, можно понять разнообразие синаптических контактов между нейронами. Различают синапсы аксон-аксон, аксон-перикарион, аксон-дендрит, причем в последнем случае аксон обычно взаимодействует с выступом дендрита – «шипиком», плотно охватывая его.
При образовании нервно-мышечного соединения имеются свои особенности, хотя принципиальная схема синаптической передачи та же. Каждое мышечное волокно иннервируется веточкой аксона. Аксон не входит внутрь волокна, а лежит в канавке, образованной сарколеммой, формируя синапс. Синаптическая щель характеризуется складками сарколеммы, выступающими в саркоплазму. Основной медиатор нервно-мышечного соединения – ацетилхолин. Его выделение обусловлено поступлением Са2+. Открытие Са2+-каналов происходит под действием нервного импульса.
Ацетилхолин «открывает» лиганд-зависимые каналы сарколеммы, что приводит к распространению ПД по Т-каналам внутрь мышечного волокна. Мембраны Т-каналов взаимодействуют с мембранами саркоплазматического ретикулума, который, благодаря Са2+-насосу, постоянно запасает ионы Са2+ (против градиента). ПД открываются каналы, по которым Са2+ поступает в миофибриллы. В миофибриллах под воздействием Са2+ происходят конформационные изменения белков актиновых нитей – тропонина и тропомиозина. Эти изменения и обусловливают взаимодействие актина и миозина, приводящее к мышечному сокращению. В этом процессе, который проходит значительно сложнее, чем в приведенной схеме, еще много неясного, как и в механизме воздействия медиатора на секреторную клетку желез.
Несмотря на ключевую роль рецепторов в синапсах, роль нейромедиаторов также важна. В нейрофизиологии и нейрохимии исследуется их влияние на поведение. Показано, что нейроны, содержащие тот или иной медиатор, распределены в нервной системе не случайно, а в виде организованных групп, в соответствии с физиологическими функциями, в осуществлении которых они участвуют (Каменская М. А., 1999).
В патогенезе большинства психических и нервных заболеваний показана ведущая роль процессов, связанных с нарушением функционирования нейромедиаторов. Вызванные ими заболевания (болезнь Альцгеймера, болезнь Паркинсона, шизофрения, эпилепсия, депрессии, алкоголизм, наркомания, фобии и др.) демонстрируют радикальное изменение поведения у человека (Ещенко Н. Д., 2004).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
ЛЕКЦИЯ № 3. Физиология бактерий
ЛЕКЦИЯ № 3. Физиология бактерий 1. Рост и размножение бактерий Рост бактерий – увеличение бактериальной клетки в размерах без увеличения числа особей в популяции.Размножение бактерий – процесс, обеспечивающий увеличение числа особей в популяции. Бактерии
Глава 9. Физиология мозга
Глава 9. Физиология мозга Нет области науки более важной для человека, чем исследование его собственного мозга. Ф. Крик (1916–2004), английский генетик, лауреат Нобелевской премии 1962 г. Несмотря на значительный объем данных, полученных в исследованиях по эволюционной
ФИЗИОЛОГИЯ ГИПОТАЛАМУСА
ФИЗИОЛОГИЯ ГИПОТАЛАМУСА Гипоталамус находится в основании головного мозга человека и составляет стенки III мозгового желудочка. Стенки к основанию переходят в воронку, которая заканчивается гипофизом (нижней мозговой железой). Гипоталамус является центральной
ФИЗИОЛОГИЯ МИНДАЛИНЫ
ФИЗИОЛОГИЯ МИНДАЛИНЫ Миндалевидный комплекс представляет собой довольно крупное ядерное образование (у человека – около 10 ? 8 ? 5 мм), расположенное в глубине передней части височной доли над ростральным отделом нижнего рога бокового желудочка. Миндалина образует связи
ФИЗИОЛОГИЯ ГИППОКАМПА
ФИЗИОЛОГИЯ ГИППОКАМПА Гиппокамп располагается в медиальной части височной доли. Особое место в системе связей гиппокампа занимает участок новой коры в районе гиппокампа (так называемая энторинальная кора). Этот участок коры получает многочисленные афференты
Глава 5 ФИЗИОЛОГИЯ ДВИЖЕНИЙ
Глава 5 ФИЗИОЛОГИЯ ДВИЖЕНИЙ Двигательная функция широко представлена в мозге всех млекопитающих, в том числе и человека. Движения человека очень многообразны, и многие заболевания головного мозга человека также связаны с повреждением двигательной функции. Двигательная
ФИЗИОЛОГИЯ МОЗЖЕЧКА
ФИЗИОЛОГИЯ МОЗЖЕЧКА Мозжечок, или малый мозг, представляет собой надсегментарную структуру, расположенную над продолговатым мозгом и мостом, позади больших полушарий мозга. Мозжечок состоит из нескольких частей, различных по происхождению в эволюции позвоночных
ФИЗИОЛОГИЯ ТРОЙНИЧНОГО НЕРВА
ФИЗИОЛОГИЯ ТРОЙНИЧНОГО НЕРВА Ветви тройничного нерва осуществляют иннервацию различных тканей головы. Большинство рецепторов этой системы возбуждаются только при непосредственном контакте с раздражителем. Примером высокой специализации может служить фациальная
3.3. ПРЕНАТАЛЬНАЯ ФИЗИОЛОГИЯ
3.3. ПРЕНАТАЛЬНАЯ ФИЗИОЛОГИЯ У плацентарных животных процесс внутриутробного развития принято условно делить на три периода: 1) начальный, или пре-имплантационный, период дробления; 2) эмбриональный, или дифференциации; 3) плодный, или роста. Между этими периодами нет четкой
Физиология феромонов
Физиология феромонов Феромоны вырабатываются главным образом кожными железами и попадают во все жидкости, которые выделяются организмом в окружающую среду, – мочу, фекалии, слюну, пот и другие. Феромоны образуются достаточно сложным образом (рис. 7.27). Рис. 7.27. Кожные
Анатомия и физиология межполушарных различий
Анатомия и физиология межполушарных различий В 1968 году в результате детального посмертного исследования мозга у 100 человек Норман Гешвинд и Уолтер Левитски сообщили о заметных анатомических различиях между полушариями. В 65% случаев участок коры височной доли,
Глава 1 Физиология дыхания
Глава 1 Физиология дыхания Многие люди стараются постоянно поддерживать себя в «хорошей форме, занимаясь различными видами спорта, как-то: бег трусцой, плавание, акробатика, некоторые виды игр и так далее. В итоге они, естественно, подвергают себя более высокому ритму
1.1. Респираторная физиология
1.1. Респираторная физиология Респираторная физиология – это наука, которая имеет дело с респираторными процессами и функциями в живом теле. Базовой функцией здесь является обмен О2 и СО2 между окружающим пространством и альвеолами: О2 поглощается в соответствии с