Малярийный плазмодий о пользе точечных мутаций
Малярийный плазмодий о пользе точечных мутаций
Начиная с 1960-х годов по всему миру распространились штаммы малярийного плазмодия, устойчивые к хлорохину — лекарству, которое прежде было самым эффективным противомалярийным средством. Хлорохин впервые синтезировали в 1934 году. Благодаря своей эффективности и дешевизне он вскоре стал главным оружием медиков в борьбе с малярией, оттеснив хинин и другие препараты на второй план. Но уже через четверть века, в конце 1950-х годов, почти одновременно в двух точках земного шара — в Колумбии и Таиланде — появились штаммы возбудителя малярии Plasmodium falciparum, устойчивые к хлорохину. В течение последующих 20 лет они распространились из этих двух центров по всем территориям, где встречается малярия.
Генетики установили, что причиной устойчивости являются мутации в одном из генов паразита. Белок, кодируемый этим геном, получил название PfCRT (Plasmodium falciparum Chloroquine Resistance Transporter). Этот белок находится в мембране, окружающей пищеварительную вакуоль паразита — пузырек, в котором происходит переваривание гемоглобина. По аминокислотной последовательности белка PfCRT было ясно, что это мембранный белок, выполняющий транспортную функцию.
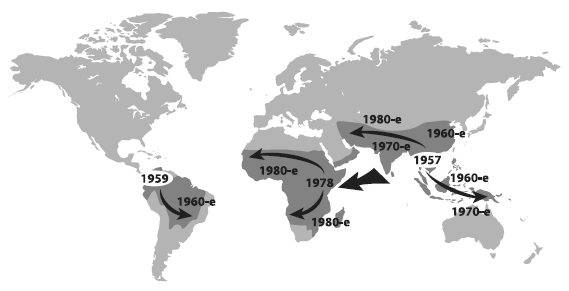
Схема распространения штаммов малярийного плазмодия Plasmodium falciparum, устойчивых к хлорохину.
У «нормальных», восприимчивых к хлорохину плазмодиев хлорохин проникает в пищеварительную вакуоль путем диффузии. Внутри вакуоли pH ниже, чем снаружи. Попав в кислую среду, молекула хлорохина присоединяет к себе дополнительный протон и приобретает положительный заряд. Это лишает ее возможности выйти обратно из вакуоли — молекула оказывается в ловушке. В результате хлорохин накапливается в вакуоли, мешая паразиту переваривать гемоглобин.
Но у паразитов, устойчивых к хлорохину, лекарство в пищеварительной вакуоли не накапливается. Поскольку устойчивость связана с изменениями в транспортном белке, логично было предположить, что благодаря этим мутациям белок PfCRT приобрел способность откачивать хлорохин из вакуоли. Чтобы проверить это предположение, ученые ввели ген PfCRT из устойчивого плазмодия в яйцеклетки лягушки и заставили его там работать (Martin et al., 2009). Новый чужеродный белок встроился в наружную мембрану яйцеклетки и занялся тем, что он умел, — стал перекачивать хлорохин из внешней среды через мембрану в цитоплазму яйцеклетки. Процесс шел, если значение pH в окружающей среде было примерно такое же, как в пищеварительной вакуоли плазмодия. Тот же белок, взятый у чувствительного к хлорохину плазмодия, не перекачивал хлорохин ни при каких условиях.
Таким образом, устойчивость паразитов к хлорохину объясняется тем, что белок PfCRT в результате мутаций приобрел новую функцию. Исходный вариант этого белка отвечал за транспорт каких-то других веществ из пищеварительной вакуоли в цитоплазму. Каких именно — пока неизвестно.
Существует несколько мутантных вариантов белка PfCRT, обеспечивающих устойчивость к хлорохину. У всех этих вариантов есть только одна общая особенность — замена лизина треонином в определенной позиции в молекуле белка. Аминокислота, стоящая в этой позиции, входит в состав активного центра, который отвечает за узнавание и связывание транспортируемой молекулы. Лизин, в отличие от треонина, имеет положительный заряд. По-видимому, два положительных заряда и у хлорохина, и у транспортера не позволяют молекулам соединиться; а если у транспортера заряд активного центра становится нейтральным, то пожалуйста — белок-транспортер начинает работу.
На примере приспособления малярийного плазмодия к хлорохину мы познакомились с одним из магистральных (наиболее вероятных, простых и часто реализуемых) путей приобретения белками новых функций. Работа большинства белков в клетке связана со специфическим распознаванием определенных молекул. Фермент безошибочно «узнает» свой субстрат — молекулу, которую он должен преобразовать. Антитело распознает свой антиген (чужеродный белок или углевод). Транскрипционный фактор[27] находит на длинной молекуле ДНК свой сайт связывания — последовательность нуклеотидов, к которой он прикрепляется, чтобы регулировать активность соседнего гена. Рецептор избирательно связывается со «своим» сигнальным веществом. Транспортный белок узнает молекулу, которую он транспортирует с одной стороны мембраны на другую… Специфическое распознавание (называемое также сродством) обеспечивается свойствами активного центра белка, который должен подходить к субстрату как замок к ключу: во-первых, по форме, во-вторых — по распределению положительных и отрицательных зарядов. Конфигурация активного центра, как правило, зависит от небольшого числа «ключевых» аминокислот.
Мутация, изменившая одну-две аминокислоты в активном центре, с большой вероятностью изменит специфичность белка, так что он начнет связываться с другими субстратами. Скорее всего, единичная мутация изменит спектр субстратов не очень сильно, т. е. новые субстраты будут похожи на старые. Способность узнавать старые субстраты при этом может сохраниться, а может и пропасть. К сожалению, мы не знаем, каковы были старые субстраты транспортного белка PfCRT и сохранил ли он сродство к ним после того, как приобрел способность связывать хлорохин. Но то, что он изменил свою специфичность и приобрел новую функцию из-за замены аминокислоты в активном центре, не вызывает сомнений. То, что эта мутация оказалась полезной для паразита в новых условиях, когда его повсеместно травили хлорохином, тоже не нуждается в пояснениях (и, к сожалению, неважно, что думает заболевший пациент или врач, прописавший ему хлорохин).
В иммунной системе позвоночных появление рецепторных белков с новыми функциями поставлено «на поток». Лимфоциты используют для создания новых антител и Т-клеточных рецепторов, необходимых для обезвреживания бактерий, вирусов и прочих паразитов, чисто «дарвиновский» механизм: внесение случайных мутаций в активный центр (так называемую вариабельную область антитела) с последующим отбором и размножением удачных вариантов. Об этом подробно рассказано в книге «Рождение сложности».
—————
Защита от биологического оружия
Множество примеров классической «эволюции по Дарвину» стало известно в ходе изучения приспособлений наших природных врагов — вирусов, болезнетворных бактерий, вредителей — к тем средствам, которые мы используем для борьбы с ними. Малярийный плазмодий — это один из таких. Но имеются и другие. К сожалению.
Травить насекомых-вредителей обычными ядами (пестицидами) — гиблое дело как в прямом, так и в переносном смысле. Во-первых, трудно разработать яд, вредный только для данного насекомого и больше ни для кого. Во-вторых, насекомые быстро приспосабливаются к ядам. Они хорошо научились этому за 300 млн лет сопряженной эволюции с растениями, которые испокон веков пытались защищаться от вредителей при помощи ядов-алкалоидов. Что же удивительного в том, что за последние 50 лет зарегистрировано более 2500 случаев адаптации насекомых-вредителей к различным пестицидам?
Более перспективным средством контроля численности вредителей (в первую очередь бабочек) считаются бакуловирусы. Эти вирусы обладают несколькими замечательными свойствами, которые делают их почти идеальным биооружием против вредителей. Бакуловирусы безопасны для всего живого, кроме насекомых определенного вида, имеют прочную белковую оболочку, устойчивы во внешней среде, и поэтому ими можно просто опрыскивать деревья при помощи обычных распылителей. Зато «свои» виды насекомых бакуловирусы прилежно заражают и доводят до смерти. До недавних пор не было случаев выработки насекомыми устойчивости к бакуловирусам. Ежегодно в мире бакуловирусами обрабатывают 2–3 млн га.
Для борьбы с яблонной плодожоркой Cydia pomonella в Западной Европе с успехом использовался мексиканский штамм вируса CpGV (Cydia pomonella granulovirus). Кстати, это одно из очень немногих инсектицидных средств, которые еще не запрещены в цивилизованных странах. Но гром все-таки грянул: начиная с 2003 года из разных садоводческих хозяйств Германии и Франции стали поступать тревожные сообщения о том, что проверенный препарат перестает действовать.
Германские генетики немедленно приступили к изучению проблемы. В 13 яблоневых садах в Южной Германии было установлено непрерывное наблюдение за ситуацией. Выяснилось, что многие популяции вредителя действительно приобрели устойчивость к вирусу. Это привело к снижению эффективности вирусного препарата в 100-1000 раз (иными словами, для достижения «исходного» уровня смертности гусениц необходимо увеличить дозировку от 100 до 1000 раз). В 2005 году уже появились популяции, устойчивость которых выросла в 100 тыс. раз по сравнению с исходной (Asser-Kaiseret al., 2007).
Одна из устойчивых популяций начиная с 2003 года подвергалась классическому генетическому анализу: бабочек скрещивали, размножали потомство от разных пар, определяли устойчивость к вирусу в разных линиях. Выяснилось, что популяция генетически неоднородна: наряду с устойчивыми особями в ней есть и какая-то доля неустойчивых. Для удобства исследований генетики выделили «чистую линию» устойчивых бабочек. Результаты скрещивания этой линии с «контролем» — бабочками, сохранившими восприимчивость к вирусу, — поначалу выглядели противоречивыми. В одних случаях устойчивость к вирусу вела себя как доминантный признак, в других — как рецессивный, в одних — как сцепленный с полом, в других — как несцепленный.
После дополнительных экспериментов и многочисленных перепроверок картина прояснилась. Оказалось, что трудности были связаны, во-первых, с тем, что доминантность признака зависит от концентрации вируса (при низких концентрациях признак доминантен, при высоких — рецессивен)[28], во-вторых, характер действия связан с полом: зараженные самцы и самки погибают на разных стадиях жизненного цикла. Поэтому, например, гусеницы, которых считали «выжившими» после 7- или 14-дневного эксперимента, в действительности могли быть уже «генетически мертвыми», так как потеряли способность к окукливанию.
В итоге стало ясно, что полезная мутация, определяющая устойчивость к вирусу, локализована в половой хромосоме Z (у бабочек, как у птиц, мужской набор половых хромосом — ZZ, женский — WZ). При низких концентрациях вируса устойчивый аллель (Zr) ведет себя как доминантный, а «нормальный», не дающий устойчивости к вирусу аллель (Zs), — как рецессивный. Это значит, что самцы, гетерозиготные по этому признаку (генотип ZrZs), при низких концентрациях вируса остаются живы. Гомозиготные самцы ZrZr, естественно, тоже выживают, ZsZs — погибают. Самки имеют только одну копию хромосомы Z, поэтому те, у которых генотип ZrW, выживают, а ZsW — погибают.
При высоких концентрациях вируса у самок все остается по-прежнему, а вот для самцов ситуация меняется. Им теперь уже не хватает для выживания одной копии «гена устойчивости», и выжить могут только гомозиготы (ZrZr), а гетерозиготы (ZrZs) погибают. Таким образом, устойчивость к вирусу из доминантного признака превращается в рецессивный.
Такой способ наследования признака создает идеальные условия для его быстрого распространения и закрепления в популяциях. На начальном этапе распространения новой полезной мутации, пока носители мутантного аллеля редки, скорость распространения мутации под действием отбора будет максимальна именно в том случае, если мутация доминантна и сцеплена с полом. Эти условия создают сами фермеры, опрыскивающие свои сады малыми концентрациями вируса. На втором этапе, когда частота мутантного аллеля уже успела увеличиться, его дальнейшее распространение будет происходить наиболее быстро, если он рецессивен. И фермеры сами делают его рецессивным: они видят, что червивых яблок становится больше, и увеличивают дозировку препарата. Таким образом, садоводы выступают в качестве фактора, ускоряющего эволюцию. Дело заканчивается полной фиксацией (закреплением) аллеля Zr и исчезновением из популяции аллеля Zs (именно это и произошло в вышеупомянутых популяциях, где устойчивость к вирусу выросла в 100 тыс. раз).
Исследователи указывают на необходимость разработки мер, препятствующих распространению генов устойчивости в популяциях вредителей. Нарождающаяся научная дисциплина, призванная заниматься разработкой таких мер, называется «прикладная эволю ционная биология». Один из многообещающих методов борьбы с выработкой устойчивости состоит в повышении генетического разнообразия применяемых вирусов. Используемые сейчас в садоводстве вирусы CpGV генетически очень однообразны. Ситуацию можно исправить, если дать возможность самим вирусам немного поэволюционировать.
—————
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Взрывы атомных бомб и «багаж» вредных мутаций
Взрывы атомных бомб и «багаж» вредных мутаций Известно, что случайный удар или иное повреждение с меньшей вероятностью причинит ущерб будильнику или ходикам, чем хронометру высшего класса точности. Так же и мутация, вновь возникшая: реже непоправимо испортит организм
Теория соматических мутаций
Теория соматических мутаций Многоклеточный организм состоит из сотен миллионов клеток, некоторые из них непрерывно и быстро делятся. Например, у человека и других позвоночных все клетки крови обновляются со скоростью десять миллионов в день. Эпителиальные клетки кожи и
«Направленные мутации» и наследование соматических мутаций
«Направленные мутации» и наследование соматических мутаций Мы описали протекающий в В-лимфоцитах процесс обратной связи V(D)J-генов, основанный на склонной к ошибкам обратной транскрипции. Он составляет основу определяемого антигеном мутирования генов антител. Все
Наследование соматических мутаций
Наследование соматических мутаций Итак, мы можем спросить, есть ли польза от антигензависимых соматических событий (мутаций и отбора) для ДНК-последовательностей V-генов зародышевой линии следующих поколений? В предьщущей главе мы уже рассказали, как много появляется
Глава 16 Хлеб для Робинзона, или Несколько слов о пользе коллекционирования
Глава 16 Хлеб для Робинзона, или Несколько слов о пользе коллекционирования Прежде всего, у меня не было закваски; впрочем, этому горю все равно пособить было нечем, и потому о закваске я не заботился. Д. Дефо Даниэль Дефо, автор известного романа «Жизнь и удивительные
4. Опыты с Myxococcus xanthus показывают, что способность защищаться от обманщиков может появляться в результате единичных мутаций
4. Опыты с Myxococcus xanthus показывают, что способность защищаться от обманщиков может появляться в результате единичных мутаций Рассмотрим еще один пример, связанный с бактерией Myxococcus xanthus. Для этих микробов характерно сложное коллективное поведение. Иногда они собираются в
Частота мутаций под контролем
Частота мутаций под контролем Ярким примером того, как живые организмы регулируют скорость мутагенеза выгодным для себя образом, является имеющаяся у бактерий система «спасения утопающих» — SOS-response. Бактерия, как и любая живая клетка, не может «рассчитать», какое именно
Секс против вредных мутаций
Секс против вредных мутаций Допустим, существует популяция микробов, не умеющих меняться генами (такие организмы называют бесполыми). Допустим, у каждого новорожденного микроба происходит одна вредная мутация. В этом случае популяция обречена на вырождение. С каждым
Секс в защиту полезных мутаций
Секс в защиту полезных мутаций С полезными мутациями ситуация очень похожая. Допустим, в популяции бесполых микробов возникло две полезные мутации. У одного микроба произошла полезная мутация в гене А, у другого — в гене Б. Что будет с потомками удачливых
Еще о пользе секса, или Лучше меньше, да лучше
Еще о пользе секса, или Лучше меньше, да лучше Рассмотрим пример, который показывает, что выигрыш от секса у раздельнополых организмов все равно перевешивает двойные потери в числе потомков. Такой пример нужно подбирать особенно тщательно, потому что нужен хороший
О пользе бабушек
О пользе бабушек Женщина обыкновенно становится бесплодной между сорока и пятьюдесятью годами, т. е. в такую пору, когда ей, на основании статистических данных, остается жить еще в среднем двадцать лет. В продолжение этого длинного периода она может выполнить в высшей
О пользе домашних собак для людей
О пользе домашних собак для людей Польза приносимая собаками, делится на две категории: 1) работа, т. е. выполнение поставленной человеком задачи, деятельность в интересах человека, «служба»; и 2) доставление человеку положительных эмоций, улучшение качества его жизни.