3. Как наблюдать жизнь микробов
3. Как наблюдать жизнь микробов
Несложно было устройство лаборатории первых микробиологов. Основное «орудие производства» — лупа или примитивный микроскоп. Стеклянные или слюдяные пластинки, на которые при помощи тонкой стеклянной трубочки помещалась капелька мутного зловонного настоя травы или сена, цветов или мяса и прочих попавших под руку животных и растительных остатков. Вот и все оборудование лаборатории ученого XVIII и первой половины XIX веков.
В капле гниющей жидкости перед взором любознательных микроскопистов открывался неведомый мир разнообразных мельчайших существ. В одном и том же поле зрения микроскопа виднелись и быстро пробегающие клетки простейших животных, и одноклеточные растения с длинными жгутиками, и медленно двигающиеся, постоянно изменяющие форму своего тела амёбы, и более мелкие, извитые наподобие штопора нити, и мельчайшие шарики и палочки, форму и строение которых уже почти не удавалось рассмотреть.
Трудно было разобраться во всем этом многообразии форм, и совсем немыслимо было изучать в этой смеси биологию каждого отдельного представителя микробного мира.
Для того, чтобы подробно изучить жизнедеятельность отдельного микробного вида, его цикл развития, его физиологические функции, необходимо было изолировать его из всей массы различных организмов и пересадить в свежую питательную среду, в которой он мог бы размножаться, как теперь говорят, в чистой культуре, т. е. без примеси других организмов.
Для этого нужно было так приготовить питательную среду, чтобы она не содержала других посторонних зародышей. Среда должна была быть обеспложена, простерилизована[3].
Микробиологи той эпохи еще не были знакомы ни с методами изолирования микробов в чистые культуры, ни с методами приготовления обеспложенных — стерильных питательных сред.
Пастер первый научил нас приготовлять вполне обеспложенные питательные среды; колбы и пробирки он закрывал ватными пробками и стерилизовал сухим жаром при 150°—170° (рис. 20). После стерилизации сосуды наполнялись питательным мясным бульоном и кипятились. После кипячения бульон оставался стерильным, так как зародыши убивались нагреванием, а ватная пробка, хорошо пропускающая воздух, являлась вместе с тем надёжным препятствием для микробов, оседавших в её толще.

Рис. 20. Сушильный шкаф для стерилизации стеклянной лабораторной посуды:
а — внешний вид; б — схема устройства
Правда, некоторые бактерии, обладающие спорами, выдерживают кипячение в течение нескольких часов. Чтобы убить споры, приходится нагревать питательные среды при более высокой температуре — 125°, которая создаётся добавочным давлением в автоклаве. Аппарат, стерилизующий под давлением, — автоклав, — который теперь применяется для обеспложивания во всех микробиологических лабораториях, был внедрён в конце прошлого столетия в бактериологическую практику русским врачом Гейденрейхом.
Существуют питательные среды, которые изменяют свой химический состав при нагревании в автоклаве. Для таких сред был разработан метод так называемой дробной стерилизации, позволяющий добиться полного обеспложивания путём трёхкратного кипячения при температуре 100° с промежутком в одни сутки. Этот метод основан на том, что споры, не убитые при первом кипячении, прорастают, теряя тем самым стойкость к нагреванию, и убиваются при повторных прогревах.
Те же жидкости, которые совершенно не выдерживают нагревания, стали обеспложивать процеживанием через мелкопористые фильтры, сделанные из угля, асбеста и каолина, инфузорной земли. Если пропустить жидкость, содержащую микробы, через такой фильтр, то даже самые мелкие бактерии прилипнут к порам фильтра и застрянут в них. Жидкость окажется обеспложенной. Только самые мельчайшие микробы — фильтрующиеся вирусы — пройдут через такой фильтр. Пройдут через фильтр также и жизнеспособные частицы бактериальной клетки, так называемые фильтрующиеся формы бактерий.
Таким образом, сейчас в распоряжении микробиолога имеется целый ряд способов получения обеспложенных стерильных питательных сред.
Как же вырастить в такой среде чистую культуру микроба, т. е. культуру, происходящую из одной единственной клетки интересующего нас вида? Как выделить нужную нам клеточку диаметром в несколько тысячных долей миллиметра из смеси миллиардов особей, населяющих разводку микробов в жидкой среде?
Было предложено разводить такую среду какой-нибудь простерилизованной жидкостью (водой, солевым раствором) до тех пор, пока в одной её капле не будет содержаться только одна клетка микроба. Такой каплей заражали стерильную питательную среду.
Но этот сложный и трудоёмкий метод не давал всё же абсолютной гарантии чистоты культуры: можно ли быть уверенным, что в капельке действительно находится только одна микробная клетка? Удостовериться в этом можно было только при помощи микроскопа. Выделение чистых культур из одной клетки производится под микроскопическим контролем: на поверхность тоненького стерильного стёклышка (так называемого покровного стекла) стерильным чертёжным пёрышком наносят ряд крошечных капелек из разведённой питательной жидкости, содержащей микробов. Покровное стекло с каплями накладывается на предметное стекло с углублением, края обмазываются вазелином, и получается невысыхающая влажная камера. Микробиолог тщательно просматривает под микроскопом содержимое капелек и отмечает те капли, где находится только по одной клетке. Затем микроскоп вместе с препаратом ставится в особый шкаф — термостат — прибор, сохраняющий постоянную температуру, в котором культивируются разводки микробов. При благоприятной температуре микробная клетка начинает делиться, и скоро в капельке разрастается целое скопление микробов — потомков одной клетки. При помощи простерилизованной над пламенем горелки платиновой иголочки или петельки, вставленной в петледержатель, такой капелькой можно заразить колбу или пробирку с питательной средой и получить в нужном количестве чистую культуру из одной клетки. В последние годы сконструированы особые приборы, так называемые микроманипуляторы, которые дают возможность под контролем микроскопа подхватить тончайшей стеклянной петелькой или пипеткой одну микробную клетку и перенести её в свежую питательную среду. Советский ученый проф. Б. В. Перфильев недавно разработал способ изготовления тончайших стеклянных капилляров. Его прибор, так называемый микроселектор, позволяет под контролем глаза выловить и затянуть в капилляр одну клеточку мельчайшей бактерии, затем автоматически стерильно отломить содержащий эту клетку кусочек капилляра и заразить им свежую питательную среду.
Но обычно в своей текущей работе микробиолог применяет более простой способ получения чистых культур — выделение их на плотных питательных средах. Оставьте в комнате на 10–15 минут тоненький ломтик картофеля и потом, предохранив его от высыхания, поместите на сутки в термостат. Вы увидите, что на поверхности ломтя появились мелкие округлые образования грязно-белого, жёлтого и красноватого цвета. Это так называемые колонии микробов, осевших из воздуха на поверхность картофеля и размножившихся там до видимых невооружённым глазом скоплений (колоний). Каждая колония — это миллиардное потомство одной особи, приставшей к влажной поверхности картофеля. Р. Кох первый обратил внимание на то, что таким путём можно легко выделить чистую культуру микроба, и предложил свой метод «пластинчатых разводок», в которых развивались отдельные колонии, происходящие из одиночных клеток. Кроме ломтей картофеля и моркови, Кох предложил применять в качестве плотной питательной среды питательный мясной бульон, к которому прибавлено 10 процентов желатины. Получается плотный студень, на котором прекрасно развиваются отдельные колонии (рис. 21). Но так как желатина разжижается при 22–26° и не может выдержать температуры термостата, при которой обычно выращивают болезнетворных микробов, то она была заменена агар-агаром, который также придает плотность питательной среде, но плавится только при 100°, а застывает при 40–45°.

Рис. 21. Колонии различных бактерий на плотной питательной среде
Кох разливал свои желатиновые питательные среды на стеклянных пластинках, которые покрывал затем стеклянными крышками. Но этот способ оказался непрактичным. Пластинки Коха легко зарастали посторонними микробами, попадавшими из воздуха. В 1885 г. уже упомянутый нами доктор Гейденрейх, которому русская микробиология обязана тщательной разработкой и усовершенствованием методов исследования микробов, предложил вместо коховских пластинок специальные двойные стеклянные чашечки с крышками, хорошо предохранявшие культуры от загрязнения. Позднее такие же чашечки были описаны в германском микробиологическом журнале зарубежным микробиологом Петри и незаслуженно получили в литературе его имя.
Теперь методика выделения чистых культур стала довольно несложным делом (рис. 22). Разливают в чашки Гейденрейха-Петри расплавленную агаровую питательную среду, которая уже через несколько минут превращается в плотную пластинку. Потом размазывают по поверхности пластинки при помощи простерилизованной платиновой петли или стеклянного шпателя материал, содержащий микробные клетки, и ставят чашку в термостат. Через сутки на поверхности агаровой пластинки вырастают отдельные колонии микробов. Из этих-то колоний с помощью стерильной петли и производится отсев чистых культур в колбы или пробирки (рис. 23), содержащие стерильную питательную среду.
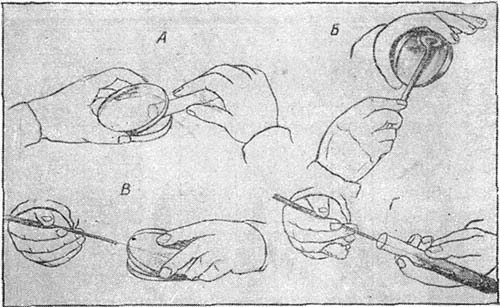
Рис. 22. Выделение чистой культуры микробов:
А — разливка агара в чашки Гейденрейха-Петри; Б — посев смеси микробов в чашку; В — отсев колоний с чашек при помощи платиновой петли; Г — пересев в пробирку на поверхность скошенного агара
Рис. 23. Бактериальный рост на поверхности скошенного агара
После введения методов чистых культур в практику лабораторных исследований микробиология стала развиваться бурным темпом. Кроме питательных сред, приготовленных из мяса, картофеля, хлеба, солода, стали применять свёрнутый яичный белок, кровяную сыворотку, цельную кровь. На этих средах прекрасно росли многие болезнетворные и гнилостные микробы.
Однако вскоре оказалось, что применявшиеся среды пригодны для выращивания далеко не всех микробов. На них хорошо росли только микробы, привыкшие и в природных условиях усваивать сложные органические соединения. Когда учёные попытались исследовать различные биохимические процессы, происходившие в почве, и выделить чистые культуры почвенных микробов, то выяснилось, что на обычных средах вырастают только гнилостные микробы. Ни за что не удавалось выделить в чистой культуре и уже известных в то время микробов, так называемых нитрификаторов, окисляющих конечный продукт гниения белков — аммиак в соли азотной кислоты. А не располагая чистыми культурами микробов, учёные не могли разобраться в физиологии этих организмов. Не удавалось выделить и другую чрезвычайно важную группу почвенных микробов — азотфиксирующих бактерий.
Открытием методов культивирования этих микробов мы обязаны «отцу почвенной микробиологии», знаменитому русскому микробиологу С. Н. Виноградскому. Микробы-нитрификаторы не растут на плотных мясных средах потому, что они не могут использовать сложные органические соединения — решил Виноградский. Чтобы их вырастить, нужно приготовить раствор из простейших минеральных солей, содержащих аммиак в качестве единственного источника азота. В такой жидкости не будут расти обычные гнилостные микробы, неспособные довольствоваться столь простыми соединениями. Опыты блестяще подтвердили предположение Виноградского: процесс нитрификации исправно шёл в этой простейшей питательной среде. Но как выделить чистую культуру этих бактерий, не растущих на плотной питательной среде? И тут Виноградский применил следующий чрезвычайно оригинальный метод: он делал высевы не из выросших колоний, а из пустых мест чашки с плотной питательной средой, на которой была засеяна смесь, содержавшая нитрифицирующие бактерии. Он совершенно правильно предположил, что там оставались неразвившиеся нитрифицирующие бактерии. Прикасаясь к пустым местам платиновой петлёй и перенося материал в минеральный раствор, он постепенно получил в этой накопительной среде чистую культуру нитрифицирующих бактерий.
Метод избирательных сред, впервые предложенный Виноградским, сейчас прочно вошёл в практику выделения чистых культур разнообразных микробов. В связи с этим чрезвычайно усложнилась микробиологическая «кухня», в которой сейчас изготовляют сотни различных по своему составу сред, каждая из которых составлена соответственно узко специализированным природным потребностям микроба. Есть микробы, для которых мы до сих пор не умеем приготовить искусственные питательные среды, — это вирусы и риккетсии. О них мы узнаем в отдельной главе.
Но мало научиться разводить микробов. Чтобы проникнуть в тайну строения этих мельчайших существ, нужно их рассмотреть, изучить их форму и внутреннее строение. Нужно понаблюдать, как ведёт себя микроб в организме человека, животного и растения.
Что мог увидеть микроскопист начала прошлого века, изучавший капельку загнившей воды под своим примитивным микроскопом? В лучшем случае только форму наиболее крупных микробов. Он не мог разглядеть деталей внутреннего строения бактерий и уж, конечно, не видел ни одного, даже самого крупного вируса.
Первое усовершенствование было внесено во второй половине XIX века и заключалось в применении методов окраски микробов. Дело в том, что тело микробов жадно воспринимает некоторые краски. Поэтому микробы становятся хорошо видимыми на бесцветном фоне препарата. Введение методов окраски микробов позволило вскрыть многие подробности и показало, что простейшие существа часто имеют сложное внутреннее строение.
Но для того, чтобы хорошо окрасить клетку, её нужно предварительно убить. Таким образом, мы рассматриваем вместо живой клетки ее труп.
Как же разглядеть внутреннее строение живой клетки? До последних лет у нас не было хороших способов для исследования внутренней структуры таких мелких живых объектов, как бактерии.
Совсем недавно на помощь микробиологу пришли физики-оптики, сконструировавшие так называемые фазоконтрастные объективы, которые создают такой резкий световой контраст между различными составными частями клетки и самой клеткой и окружающей средой, что удаётся хорошо рассматривать живых микробов без всякой окраски. Фазоконтрастные объективы еще только входят в практику и, несомненно, раскроют нам новые, ранее неизвестные подробности строения этих существ. А главное — при помощи этих объективов можно очень чётко запечатлеть на фотопластинке неокрашенные микробы. Если же вместо фотокамеры присоединить к окуляру киносъемочный аппарат, а под объективом микроскопа поместить в маленькой влажной стеклянной камере тонкий слой питательной среды с развивающимися на ней микробами, то можно изучать жизнь микроба.
Советский микробиолог проф. В. Л. Троицкий недавно заснял этим методом замечательную кинокартину из жизни бактерий и открыл при помощи киноаппарата новые факты.
Он применил способ прерывистой съёмки, снимая не 16–18 кадров в секунду, как это делается при обычных немых киносъёмках, а только несколько кадров в минуту. Отпечатанная лента демонстрировалась на экране с обычной скоростью. Таким образом, перед зрителем предстали бактерии, развитие которых оказалось ускоренным в десятки раз. На глазах у зрителей бактерии очень быстро делились и образовывали колонию. Когда в питательную среду вводился вредно действующий на бактерии антибиотик — пенициллин, то было видно, как бактерии прекращали размножаться, вырастая в огромные, занимающие весь экран, толстые нити и шары, и, наконец, лопались и погибали. Этим методом проф. Троицкий вскрыл и причину приобретения микробами нечувствительности к пенициллину, что иногда снижает эффективность его лечебного действия. Оказалось, что у некоторых разбухающих и гибнущих под влиянием пенициллина бактерий остаётся небольшая часть клетки, приобретшая стойкость к антибиотику. Эта часть способна размножаться в среде, к которой добавлен пенициллин, и передаёт по наследству потомству свои вновь приобретённые свойства. Этим интересным опытом была наглядно доказана приложимость к бактериям общебиологического закона мичуринского учения о наследовании благоприобретённых признаков. Было опровергнуто мнение американских микробиологов — вейсманистов, считавших, что нечувствительность к антибиотику зависит от выживания единичных предсуществовавших в культуре стойких микробов.
На этом примере мы видим, какую помощь в научно-исследовательской работе микробиолога может оказать микрокиносъёмка. С каждым годом в Советском Союзе этот метод находит все большее и большее применение. Во многих институтах организованы специальные отделы и лаборатории по киносъёмке микроскопических объектов.
Известно, что в микроскоп обычно рассматривают более или менее прозрачные объекты в проходящем свете. Направляемый зеркальцем микроскопа пучок света проходит через конденсор — собирательную линзу, затем через изучаемый объект и оптическую систему микроскопа и попадает в глаз наблюдателя (рис. 24 и 25).
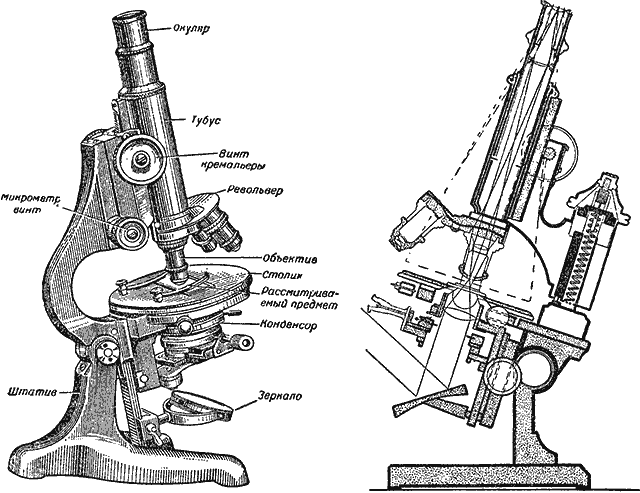
Рис. 24. Микроскоп и ход лучей в микроскопе

Рис. 25. Современный биологический микроскоп, дающий увеличение до 2000 раз
Но как рассмотреть непрозрачный объект? Как исследовать, например, живых микробов, плавающих в крови сосуда животного?
Оказывается, и эта задача была разрешена физиками, изобретшими так называемый опак-иллюминатор, или «вертикальный иллюминатор», где объект рассматривается уже не в проходящем свете, а в ярком пучке света, падающего на непрозрачную поверхность исследуемого объекта. Положив на предметный столик такого микроскопа лапки живой крысы, можно наблюдать за оживлённым движением мельчайших паразитов — микробов-трипанозом, плавающих в её крови. Сделав отверстие в скорлупе заражённого вирусом куриного яйца и удалив из него оболочки зародыша, можно изучать поражения, возникающие под влиянием развивающегося в них вируса.
Много различных усовершенствований микроскопа получила к настоящему времени наука. Тут и исследование в «тёмном поле», где только боковые лучи освещают мельчайшие частицы, взвешенные в капле жидкости (рис. 26), тут и микроскопия в невидимом ультрафиолетовом свете, вдвое увеличивающем разрешающую способность объектива, и флюоресцентная микроскопия, основанная на превращении падающих на объект ультрафиолетовых лучей в видимый свет, который излучается флюоресцирующим объектом.

Рис. 26. Один из видов спирохет — лептоспира, возбудитель инфекционной желтухи, в «тёмном поле» микроскопа. В нижней части рисунка — схематическое изображение микроба
Все эти методы широко раздвинули границы оптической микроскопии, но ни один из них не дал возможности увидеть объекты, размеры которых меньше, чем две десятых микрона (0,2 микрона). Наиболее крупный вирус — вирус оспы — не превышает 0,175 микрона. Следовательно, все вирусы оставались за пределами видимости в световые микроскопы.
Правда, действительному члену Академии медицинских наук СССР проф. М. А. Морозову удалось разглядеть в обычный микроскоп при помощи изобретённого им метода серебрения элементарные тельца вируса оспы и ряд других вирусов. Его метод вошёл в мировую практику, но этим дело и ограничилось. До начала 50-х годов двадцатого столетия вирусы оставались невидимыми, несмотря на все ухищрения учёных. О размерах вирусов приходилось судить только косвенным образом, применяя для этого мощнейшие центрифуги, делавшие десятки тысяч оборотов в минуту, в которых по скорости оседания вирусных частиц можно было вычислить их размер, или путем фильтрования через ультрафильтры-сита с порами строго определённой величины. Отчего же нельзя было увидеть в обычный световой микроскоп вирусные частицы? Оттого, что длина волн видимого света больше вирусной частицы. Встречая на своём пути столь мелкое препятствие, световая волна не отражается, а огибает эту частицу. Световые волны проходят мимо вирусов, как бы не замечая их. А если объект не мешает распространению волн, то и сам он остаётся невидимым.
Мельчайшие вирусные частицы могут служить препятствием только для очень коротких волн — в сотни раз более коротких, чем световые. Такой короткой длиной волны обладают электронные лучи, представляющие собой потоки электронов, несущихся с огромной скоростью.
Изобретение электронного микроскопа, в котором через объект проходят электронные лучи, позволило, наконец, увидеть вирусы.
Устройство электронного микроскопа в принципе аналогично устройству светового микроскопа (рис. 27): вместо электрического осветителя или дневного солнечного света в электронном микроскопе имеется так называемая электронная «пушка», из раскаленной нити которой в безвоздушном пространстве вылетают потоки электронов — мельчайших частиц материи, несущих отрицательный заряд электричества; вместо стеклянных линз — конденсора, объектива и окуляра — ряд электромагнитов, концентрирующих, собирающих и раздвигающих поток электронов. Когда собранный первой магнитной линзой (называемой конденсорной) пучок электронов достигает объекта, например, вирусной частицы, то часть электронов, сталкиваясь с атомами вещества объекта, рассеивается в стороны. Чем плотнее или толще отдельные части объекта, тем сильнее рассеяние электронов. Пройдя через исследуемую частицу, электронный поток попадает в объективную магнитную линзу. Увеличенное объективной линзой изображение предмета ещё больше увеличивается третьей линзой — проекционной, которая и отбрасывает поток электронов на светящийся под ударами этих электронов экран или на фотографическую пластинку. Те места экрана, на которые попало больше всего электронов, будут светиться ярче всего. Рассеянные вирусом электроны частично не дойдут до экрана, причём в зависимости от различий в плотности отдельных мест объекта на экран попадает различное количество электронов. Таким образом, на экране возникает контрастное, сильно увеличенное изображение вирусной частицы. При помощи электронного микроскопа можно увеличить изображение предмета в десятки и даже в сотни тысяч раз. Таким образом, можно получить увеличение в сто раз большее, чем в обычном световом микроскопе.
Конструирование советского электронного микроскопа начато в 1940 г. группой учёных под руководством академика А. А. Лебедева. За это время было изготовлено несколько моделей микроскопов, которые дают увеличение в десятки тысяч раз. Советский электронный микроскоп по праву считается лучшим в мире и значительно превосходит американские микроскопы и по качеству изображения и по совершенству конструкции (рис. 28).
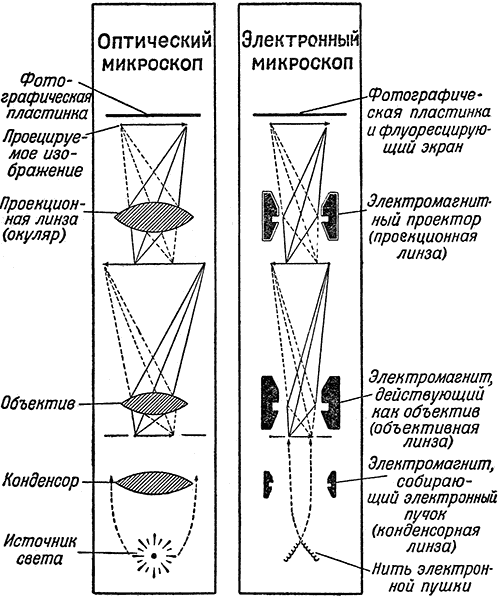
Рис. 27. Сравнительная схема устройства оптического и электронного микроскопов

Рис. 28. Советский электронный микроскоп
В электронный микроскоп учёные, наконец, увидели мельчайшие вирусы и разобрались в их форме и строении. Оказалось, что вирусы имеют разную форму. Вирус оспы, выглядевший в световом микроскопе в виде крошечных шариков, в электронном микроскопе имел слегка вытянутую в длину форму многоугольника. Вирус гриппа оказался шаровидным, а вирус табачной мозаики палочковидным. Сложно устроенным оказался бактериофаг, бактериальный вирус; в тельце бактериофага можно было различить головку размером в несколько миллионных долей миллиметра и более длинный хвостик, посредством которого он, согласно новейшим исследованиям советских ученых, прикрепляется к поверхности бактериальной клетки.
Электронный микроскоп дал возможность изучить внутреннее строение бактерий и грибов.
Правда, у электронного микроскопа имеется тот существенный недостаток, что прямолинейность потока электронов, необходимая для четкости изображения, может быть достигнута только при помощи полного вакуума — электроны должны лететь в безвоздушном пространстве. Таким образом, в электронном микроскопе можно рассматривать только полностью высушенные объекты, находящиеся в вакууме и подвергающиеся интенсивному обстрелу электронами. Конечно, при этом несколько изменяется естественное строение вируса и клетки. Кроме того, мы лишены возможности наблюдать объект в его жизнедеятельности и по существу рассматриваем только трупы микробов.
Нужно надеяться, что крупные дефекты современных электронных микроскопов будут в скором времени устранены и мы получим возможность изучать ещё более детально и притом в живом состоянии строение и жизнь бактерий и вирусов.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава 13 В здоровом теле… два фунта микробов
Глава 13 В здоровом теле… два фунта микробов Всем известно, что организму, в том числе и человеческому, для нормальной работы, вернее для процессов метаболизма, требуются сотни бактерий и микроорганизмов. Клиффорд Саймак Как уже отмечалось в главе о распространении
1. Путешествие в страну микробов
1. Путешествие в страну микробов Характерная черта науки и прогресса состоит в том, что они постепенно открывают нашему взору все новые и новые области. Л. Пастер Неизвестные сожители Было это очень давно, когда третья планета Солнечной системы получила нового обитателя
«Меню» микробов
«Меню» микробов Различные микробы предъявляют далеко не одинаковые требования к пище. Одни из них удовлетворяются более чем скромным питанием, другие чрезвычайно требовательны.Мы знаем, что люди, страдающие сахарным диабетом, не переносят пищу, содержащую много
Охота на микробов
Охота на микробов Славных микробиологов прошлого часто называли охотниками за микробами. И не без основания. Ведь им приходилось по-настоящему охотиться, чтобы найти и выделить микробы из природной среды, в которой те обычно живут. Собираясь на охоту за куропатками,
О питании микробов
О питании микробов Одно из условий существования живых организмов — наличие достаточных количеств пищи. Рост, размножение и прочие жизненные процессы не могут осуществляться без питательных веществ.Без пищи не могут обойтись и микробы. Уже при нашем первом посещении
9. Взаимоотношения микробов
9. Взаимоотношения микробов Держи, Атлант, Чудовищную ношу — Наш шар земной, Огромный и безликий… Он — кровь и глыба, Облаков хаос, Скалы обломок, Великан гранитный, Стихия и бесформенная сила, Где все перемешалось и кипит, И атомов в нем мечутся билльоны, Ни устали не
Симбиоз насекомых и микробов
Симбиоз насекомых и микробов В теле насекомых, как правило, находятся бактерии, дрожжевые и другие микроскопические грибы. Они живут в клетках особого органа, получившего название мицетом. Там они синтезируют витамины, а возможно, и другие жизненно важные вещества,
Оружие микробов
Оружие микробов В человеческом организме находятся самые разнообразные микроорганизмы. Одни безвредны, другие даже полезны. Чем же отличаются от них болезнетворные микробы? Каким оружием располагают они для нападения на человека?Некоторые болезнетворные микробы
Пастер — укротитель микробов
Пастер — укротитель микробов После того как Кох открыл и выделил чистую культуру возбудителя сибирской язвы, Пастер также заинтересовался этим микробом. Ему удалось обнаружить бациллу в теле дождевых червей, обитавших в местах захоронения животных, которые погибли от
Глава 2. Планета микробов
Глава 2. Планета микробов Древнейшие следы жизни Время появления жизни на Земле точно не известно. Ясно одно: если наша планета когда-то и была безжизненной, то не очень долго. Земля сформировалась 4,5–4,6 млрд лет назад, но от первых 700–800 млн лет ее существования в земной
1. Как человек узнал о существовании микробов
1. Как человек узнал о существовании микробов Мы не видим микробов невооружённым глазом. Это зависит от самого устройства человеческого глаза. Человеческий глаз не может различать предметы, размеры которых меньше одной десятой миллиметра. Все, что меньше этой величины,
2. Строение и жизнь микробов
2. Строение и жизнь микробов Итак, микробами называются мельчайшие живые организмы, невидимые простым глазом. Как мы узнали из предыдущей главы, к микробам относятся разнообразные формы живой материи, имеющие как клеточную, так и неклеточную организацию.Различают
11. Переделка природы микробов
11. Переделка природы микробов В этой книге мы познакомились с жизнью и деятельностью разнообразных полезных и вредных микробов. Мы узнали, какую огромную роль играют полезные микробы в различных отраслях народного хозяйства. Мы видели, что блестящие успехи медицинской
Растение, убивающее микробов
Растение, убивающее микробов Вместе с благовонным, свободным, освежительным воздухом вдохнете вы в себя безмятежность мысли, кротость чувства, снисхождение к другим и даже к самому себе. С. Т. Аксаков «Так обаятелен этот чудный запах леса после весенней грозы, запах
Короткая жизнь для человека, но длинная жизнь для человечества
Короткая жизнь для человека, но длинная жизнь для человечества Бактерии и люди многим отличаются. Если одно поколение бактерий живет двадцать минут, то между одним поколением человека и следующим проходит много лет. Если человек зарождается за счет слияния яйцеклетки и
Наследие микробов: митохондриальные заболевания
Наследие микробов: митохондриальные заболевания Митохондрии есть в каждой клетке нашего тела, и везде они выполняют ряд важнейших функций. Самая известная из этих их функций состоит в том, чтобы из кислорода и сахаров получать энергию в том виде, в котором ее используют