Гены, которые мы потеряли
Гены, которые мы потеряли
Эволюция гоминид сопровождалась не только приобретениями, но и потерями. Некоторые гены, которые у шимпанзе и других обезьян нормально работают, у человека выключились, превратились в молчащие псевдогены. В 1999 году Мэйнард Олсон из Вашингтонского Университета (Сиэтл, США) предложил гипотезу, известную под названием less is more («меньше значит больше»), согласно которой утрата генов может открывать путь для прогрессивных преобразований. Например, выключение гена MYH16, по всей видимости, привело к уменьшению жевательной мускулатуры у предков рода Homo, а это, в свою очередь, стало одной из предпосылок увеличения мозга (известно, что в эволюции млекопитающих две функции головы — жевательная и думательная — находятся в извечном конфликте).
Многие гены, выключившиеся у предков человека, связаны с обонянием и иммунитетом (Wang et al., 2006). Обонятельные гены в принципе могли отключиться просто «за ненадобностью». В борьбе за выживание хороший нюх едва ли давал нашим предкам большое преимущество, и естественный отбор не выбраковывал особей со слабым обонянием. Но как естественный отбор мог допустить потерю генов иммунной защиты? Возможно, это объясняется изменением условий жизни наших предков, а также тем, что иммунная система иногда может вредить организму излишней бдительностью. Неумеренная агрессивность иммунной системы порой ведет к опасным «аутоиммунным» заболеваниям, таким как рассеянный склероз. У мышей с искусственно выключенным иммунным геном Mbl1 реже развивается сепсис, так что отключение этого гена в определенных условиях может повышать выживаемость. Человеческий ген Mbl1, как выяснилось, выключен у 100 % лиц внеафриканского происхождения и у 89 % африканцев. «Испортившая» его мутация возникла, по-видимому, незадолго до выхода сапиенсов из африканской прародины. Носители мутации явно получили какое-то важное преимущество, потому что мутация начала быстро распространяться.
Об этом говорит анализ изменчивости прилегающих участков ДНК. Как и следовало ожидать, исходя из гипотезы о положительном отборе, вариабельность этих участков оказалась ниже у лиц с выключенным геном по сравнению с носителями исходного «рабочего» варианта[47]. Для остальных отключенных генов доказать прямое действие отбора сложнее: они замолчали раньше, и следы отбора уже стерлись. Но и одного примера достаточно, чтобы показать, что утрата генов могла быть выгодна нашим предкам.
Повышенный уровень отключения (псевдогенизации) среди обонятельных и иммунных генов может иметь и иное объяснение. Дело в том, что между обонятельной и иммунной системами существует глубокая и не до конца еще понятая связь. По-видимому, обе эти системы играют важную роль в регуляции социальных отношений и выборе брачных партнеров. Запах партнера может играть решающую роль при возникновении влечения. Компоненты иммунной системы, по-видимому, играют ключевую роль в производстве и восприятии персональных запахов у позвоночных животных (Куликов, Марков, 2009). Возможно, отключение соответствующих генов в ходе эволюции гоминид было связано с растущей ролью разумной, сознательной регуляции общественных отношений, для которой более архаичные механизмы контроля социального и полового поведения могли быть помехой. В частности, снижение остроты обоняния у ранних гоминид могло способствовать становлению нового типа общественных отношений, основанных на моногамии и низком уровне внутригрупповой агрессии (см. главу «Двуногие обезьяны»).
—————
Древняя вирусная инфекция сделала людей беззащитными перед ВИЧ
Эндогенные ретровирусы представляют собой нечто вроде археологической летописи древних вирусных инфекций, с которыми приходилось когда-то сталкиваться данному виду животных или его предкам.
Поразительные факты обнаружили молекулярные биологи из нескольких научных учреждений Сиэтла (США, штат Вашингтон) в ходе изучения эндогенного ретровируса PtERV1 (Pan troglodytes endogenous retrovirus), сотни копий которого присутствуют в геномах шимпанзе и гориллы (Kaiser et al., 2007). В человеческом геноме этого ретровируса нет. При этом, однако, у человека есть защитный антивирусный белок TRIM5? (компонент системы врожденного иммунитета), который эффективно защищает нас от не опасного для человека ретровируса, отдаленно напоминающего PtERV1, — вируса лейкемии мышей N-MLV.
Интерес к белку TRIM5? — одному из сотен бойцов противовирусного фронта — связан с тем, что у многих приматов (например, у тех же горилл) этот белок обеспечивает эффективную защиту от ВИЧ, а у человека, к несчастью, он совершенно бессилен против этой смертельной инфекции.
Эволюция TRIM5? у приматов протекала очень интенсивно. Этот белок распознает белки оболочки (капсида) ретровируса, прикрепляется к ним и способствует разрушению вирусной частицы. Та часть белка TRIM5?, которая отвечает за узнавание капсидных белков, чаще других попадала под действие отбора и претерпевала быстрые эволюционные изменения (это видно по высокой доле значимых нуклеотидных замен по сравнению с синонимичными). Как минимум один раз это произошло и в человеческой эволюционной линии после ее отделения от линии шимпанзе.
Картина, в общем, ясная: время от времени разные виды приматов сталкивались с какой-нибудь новой опасной ретровирусной инфекцией, и в результате отбирались те варианты TRIM5?, которые обеспечивали наиболее эффективную защиту от данного ретровируса.
Ученые предположили, что человеческий вариант TRIM5? был адаптирован для борьбы с древним вирусом PtERV1, который 3–4 млн лет назад поразил предков шимпанзе и горилл. Почти наверняка он представлял угрозу и для наших предков австралопитеков[48]. Возраст вируса (3–4 млн лет) был установлен по числу различий, накопившихся между разными копиями PtERV1, сохранившимися в геномах шимпанзе и горилл. Сопоставление этих копий также позволило реконструировать исходную нуклеотидную последовательность вирусного генома, а заодно и доказать, что все копии действительно происходят от единого общего предка, которым когда-то заразились гориллы и шимпанзе.
После этого ученые частично воскресили ископаемый вирус. За основу был взят вирус мышиной лейкемии, часть генома которого была заменена реконструированными последовательностями PtERV1. В частности, заменили ген, кодирующий капсидный белок — тот самый, который распознается защитным белком TRIM5?. Получившийся химерный вирус оказался вполне жизнеспособным (в дальнейшем будем называть его просто вирусом PtERV1, поскольку те части его генома, которые остались от вируса мышиной лейкемии, в контексте данного исследования ни на что не влияют).
Ученые проверяли инфекционность вирусов и эффективность защитных белков на лабораторной культуре почечных фибробластов кошки. Эти клетки не имеют никаких средств защиты от известных ретровирусов. В них, однако, можно внедрять чужеродные гены (например, ген человеческого белка TRIM5?), и тогда клетки могут приобрести устойчивость к тем или иным вирусным инфекциям.
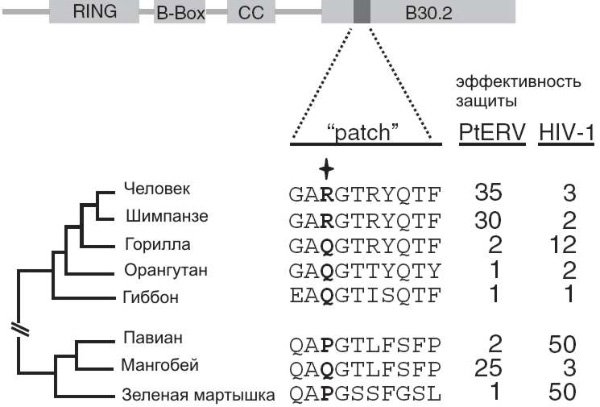
Эффективность белка TRIM5? против вирусов PtERV1 и ВИЧ (HIV-1). Вверху — схема строения белка TRIM5?, показаны основные функциональные блоки (домены). Домен В30.2 служит для узнавания капсидных белков ретровирусов. Показан ключевой участок этого домена (patch), включающий десять аминокислот. Звездочкой отмечена аминокислота, стоящая в 332-й позиции. Внизу слева — эволюционное дерево исследованных видов приматов. Две колонки цифр справа отражают эффективность защиты клеток белком TRIM5? от вирусов. Каждое число показывает, во сколько раз меньше клеток заражает вирус, если клетки производят белок TRIM5?. По рисунку из Kaiser et al., 2007.
Оказалось, что человеческий TRIM5? весьма эффективно защищает клетки от вируса PtERV1. Вирус заразил 4,1 % контрольных «беззащитных» клеток и только 0,03 % клеток, вырабатывающих человеческий TRIM5?. Таким образом, люди обладают мощным врожденным иммунитетом к доисторическому вирусу, которого давно нет в природе.
Затем исследователи решили выяснить, какие изменения в белке TRIM5? обеспечили его эффективность по отношению к PtERV1. Ранее было установлено, что важную роль в распознавании белком TRIM5? тех или иных вирусов играет маленький участок белковой молекулы длиной в десять аминокислот, с 330-й по 339-ю позицию. Внимание исследователей привлекла позиция 332. У предков человекообразных здесь стояла аминокислота глутамин (Q). Это предковое состояние сохранилось у гиббонов, орангутанов и горилл, а у человека и шимпанзе глутамин заменился аргинином (R).
Исследователи модифицировали человеческий белок TRIM5?, заменив аргинин в 332-й позиции «предковым» глутамином. Результат превзошел все ожидания: модифицированный белок стал в 30 раз хуже защищать клетки от ископаемого вируса PtERV1, но зато приобрел способность защищать их от ВИЧ!
Это навело ученых на мысль, что, возможно, белок TRIM5? так устроен, что может эффективно распознавать только один из двух типов ретровирусов: если он в ходе эволюции «настроился» на PtERV1, то не может распознать ВИЧ, и наоборот. Для проверки этого предположения они экспериментально определили эффективность белков TRIM5? разных видов приматов в отношении обоих вирусов. Предположение полностью подтвердилось. Белок TRIM5? человека, шимпанзе и мангобея (Cercocebus atys) эффективен против PtERV1, но бессилен против ВИЧ. У гориллы, павиана (Papio anubis) и зеленой мартышки (Cercopithecus aethiops) тот же белок хорошо защищает от ВИЧ, но неэффективен против PtERV1. Это показывает, что белок TRIM5?, по видимому, не может быть одновременно «настроен» на оба типа вирусов.
Судя по всему, 3–4 млн лет назад среди африканских человекообразных — предков нынешних горилл, шимпанзе и людей — разразилась эпидемия опасного заболевания, вызываемого вирусом PtERV1. Это способствовало отбору таких мутаций в гене белка TRIM5?, которые повышали устойчивость к инфекции. В частности, у австралопитеков — предков людей и пока не найденных палеонтологами предков шимпанзе — глутамин в 332-й позиции заменился аргинином. Гориллы справились с напастью как-то иначе (не следует забывать, что белок TRIM5? — это лишь один из множества барьеров, стоящих на пути вирусных инфекций). Конечно, возможны и другие варианты объяснения обнаруженных фактов, но этот представляется наиболее вероятным. Почему у шимпанзе и горилл вирус сумел проникнуть в геном половых клеток, а у человека нет — неизвестно но это вполне может быть просто случайностью.
Сегодня, когда вируса PtERV1 больше не существует, зато человечеству угрожает эпидемия ВИЧ, вектор отбора должен был измениться. Теоретически, если бы ВИЧ продолжал косить людей, скажем, еще несколько тысячелетий, злосчастный аргинин снова в результате мутаций и отбора заменился бы глутамином и другие полезные мутации генов врожденного иммунитета тоже могли бы закрепиться. Впрочем, будем надеяться, что медицина, вооруженная современными генетическими методами, справится с бедой быстрее, чем это сделала бы эволюция.
—————
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Географическое распространение животных и изменения земной поверхности, на которые оно указывает[169]
Географическое распространение животных и изменения земной поверхности, на которые оно указывает[169] Прежние взгляды на изменения материков. – Теория океанических островов. – Современное и прежнее распределение суши и моря. – Зоогеографические области. –
"Бульдоги", которые - муравьи, и "Бархатные муравьи", которые - осы
"Бульдоги", которые - муравьи, и "Бархатные муравьи", которые - осы Говорят, муравьи находятся в родстве с пчелами. Возможно ли этому поверить? Но вот, например, Понерины — муравьи-бульдоги, как их называют. Некоторые виды Понерин обнаружены и у нас в СССР, хотя вообще в
Hox -гены обрели свободу — и змеи потеряли ноги
Hox-гены обрели свободу — и змеи потеряли ноги Напоследок рассмотрим исследование, проливающее свет на роль Hox-генов в эволюции позвоночных. Как известно, важнейшая функция Hox-генов состоит в том, что они подробно размечают эмбрион вдоль передне-задней оси. Дальнейшая
Цифры, которые пугают
Цифры, которые пугают Лаборатория социальных нововведений, созданная в рамках «Французского страхования» на следующий день после Конгресса в Страсбурге для учета нужд научных исследований по предупреждению заболеваний, посчитала, что в первую очередь необходимо
ДРУГИЕ ПРОБЛЕМЫ, КОТОРЫЕ МОГУТ ВОЗНИКНУТЬ ПРИ ВЫРАЩИВАНИИ ЩЕНКОВ
ДРУГИЕ ПРОБЛЕМЫ, КОТОРЫЕ МОГУТ ВОЗНИКНУТЬ ПРИ ВЫРАЩИВАНИИ ЩЕНКОВ Проблемы с дыханиемНекоторые щенки дышат не так свободно, как их однопометники и вы можете слышать у них в груди шумы и хрипы, если поднесете их близко к себе. Причиной может служить то, что легкие не
ДОМАШНИЕ ЖИВОТНЫЕ, КОТОРЫЕ ОТЫСКИВАЮТ СВОИХ ХОЗЯЕВ
ДОМАШНИЕ ЖИВОТНЫЕ, КОТОРЫЕ ОТЫСКИВАЮТ СВОИХ ХОЗЯЕВ Если голуби действительно могут находить дорогу к дому и к своим сородичам после того, как передвижная голубятня перемещается на значительное расстояние, множество странных историй о домашних животных предстает в
„БУЛЬДОГИ", КОТОРЫЕ-МУРАВЬИ, И „БАРХАТНЫЕ МУРАВЬИ", КОТОРЫЕ — ОСЫ
„БУЛЬДОГИ", КОТОРЫЕ-МУРАВЬИ, И „БАРХАТНЫЕ МУРАВЬИ", КОТОРЫЕ — ОСЫ ГОВОРЯТ, муравьи находятся в родстве с пчелами. Возможно ли этому поверить?Но вот, например, Понерины — муравьи-бульдоги, как их называют. Некоторые виды Понерин обнаружены и у нас в СССР, хотя вообще в
«Бульдоги», которые — муравьи, и «бархатные муравьи», которые — осы
«Бульдоги», которые — муравьи, и «бархатные муравьи», которые — осы Муравьёв и пчёл считают родичами. Теория эта выглядит поначалу надуманной и особого доверия не вызывает.Другое дело, скажем, медоносные пчёлы и пчёлы индийские, пчёлы и осы, шелкопряд тутовый и дубовый,
ЖИВОТНЫЕ, КОТОРЫЕ ЛГУТ
ЖИВОТНЫЕ, КОТОРЫЕ ЛГУТ В следующей главе я докажу, насколько ошибаются те, кто считает кошку – самое гордое и самое честное из всех наших домашних животных – коварной обманщицей. Однако я вовсе не считают эту неспособность обманывать признаком превосходства кошки.
Глава 4 НЕЙРОНЫ, КОТОРЫЕ ОПРЕДЕЛИЛИ ЦИВИЛИЗАЦИЮ
Глава 4 НЕЙРОНЫ, КОТОРЫЕ ОПРЕДЕЛИЛИ ЦИВИЛИЗАЦИЮ Даже когда мы одни, как часто с болью и удовольствием думаем мы о том, что другие думают о нас, об их воображаемом одобрении или порицании; все это следует из способности к сопереживанию, основного элемента социальных
Глава 1. УСИЛИЯ, КОТОРЫЕ МЫ СОВЕРШАЕМ
Глава 1. УСИЛИЯ, КОТОРЫЕ МЫ СОВЕРШАЕМ Человек всегда чувствовал разницу между собой и всеми остальными объектами окружающего мира. Практически в любой культуре человек считает себя венцом творения. Возможно, не столь значимым, как боги, демоны, ангелы и прочие
8.2.3. Возможные космические катастрофы, которые способны уничтожить жизнь на Земле
8.2.3. Возможные космические катастрофы, которые способны уничтожить жизнь на Земле Вначале упомянем о событиях, которые могут коснуться именно Земли.Установлено, что постоянно происходит замедление вращения Земли вокруг своей оси (см. Раздел 2.2). Через пока трудно
Металлы, которые всегда с тобой
Металлы, которые всегда с тобой ТЕРЛЕЦКИЙ Ефим Давидович — инженер; наряду с основной работой нанимается научной популяризацией. Его перу принадлежит ряд научно-популярных статей в центральных газетах и журналах и книга «Лик невидимки» (М., Химия. 1982), удостоенная
Глава 5 Несколько вещей, которые хорошо известны вашему кишечнику, но которые игнорирует ваш мозг
Глава 5 Несколько вещей, которые хорошо известны вашему кишечнику, но которые игнорирует ваш мозг Стоит нам научиться убивать, как мы тут же начинаем претворять это умение в жизнь. Мы вонзали копья с каменными наконечниками в мастодонтов. Мы преследовали саблезубых
Данные, которые мы получаем
Данные, которые мы получаем Полученные данные действительно интересны. На томограммах мы видим признаки необычной активности малого участка серого вещества на вершине задней части мозга (см. рис. 1). Это сплетение нейронов с узко-специальной функцией называется задней