Гены, бактерии, вирусы
Гены, бактерии, вирусы

При слове «бактерия» у людей, далеких от биологии, возникают самые неприятные ассоциации. На памяти человечества – жуткие инфекционные напасти вроде опустошительной эпидемии «черной смерти», выкосившей в XIV столетии более 30 % населения Европы. Но это только средние цифры: в Норвегии умерли четыре пятых всего населения, а некоторые европейские страны совершенно обезлюдели. По мнению специалистов, это была вторая пандемия[10] чумы. Первая случилась в Византии, в годы правления императора Юстиниана (VI век новой эры), и потому называется юстиниановой. Третья пандемия пришлась уже на вполне исторические времена. Она началась в Гонконге в 1894 году и растянулась почти на три десятилетия, захватив большие портовые города. Именно тогда был открыт возбудитель инфекции – палочка под названием Yersinia pestis.
Микробиология делала большие успехи, но и в новые времена вспышки инфекционных болезней всегда были непременными спутниками социальных потрясений. Достаточно вспомнить хотя бы азиатскую холеру, разразившуюся в Европе в середине XIX века, или тифы – брюшной и сыпной – на фронтах Первой мировой и Гражданской войны. И даже сегодня, когда большинство грозных инфекций вроде бы давным давно канули в небытие, мы продолжаем сталкиваться с сальмонеллами, вызывающими тяжелые пищевые отравления, или с вездесущими стафилококками, прозванными чумой XX века.
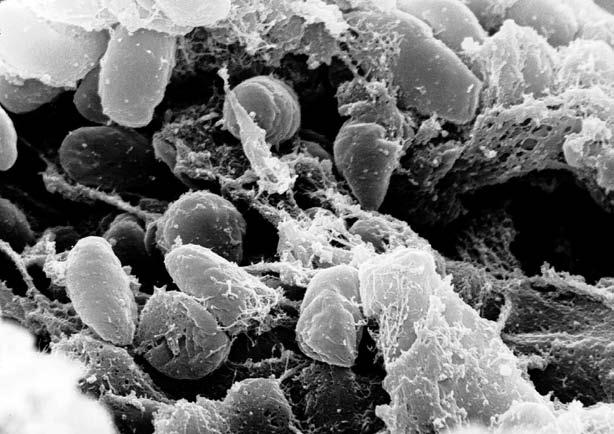
Чумная палочка под микроскопом
Однако не стоит демонизировать микробов. Уже к началу ХХ века биологи знали, что бактерии распространены повсеместно, а совокупность их маленьких тел образует тот незримый фундамент, на котором покоится весь органический мир[11]. Если этот микробный фундамент необратимо разрушить, то через короткое время рухнет и вся величественная пирамида жизни на планете Земля. Разумеется, патогенные (болезнетворные) бактерии способны доставить человеку массу неприятностей, но все же бо?льшая часть микробов приносит нам скорее пользу, чем вред.
Огромное количество различных микроорганизмов населяет почву. По некоторым оценкам, в одном грамме плодородного чернозема их содержится несколько миллиардов. На одном гектаре пахотной земли проживает около трех тонн микробов! А суммарная масса всех микробов нашей планеты примерно в 25 раз превышает массу всех животных.
Функции этих крох многообразны. Например, так называемые клубеньковые бактерии, или ризобии, селятся на корнях бобовых растений и специализируются на фиксации атмосферного азота, который растению жизненно необходим. Такое взаимовыгодное сотрудничество называется симбиозом. Растение снабжает клубеньковые бактерии питательными углеводами, а взамен получает азот, ценные витамины и некоторые вещества роста. Естественно, бобовые – не единственные растения, сумевшие «приручить» полезных азотфиксаторов, поскольку ботаникам известны по крайней мере шесть семейств высших цветковых растений, которые охотно прибегают к услугам одноклеточных накопителей азота. Правда, природа этих симбионтов пока окончательно не установлена.
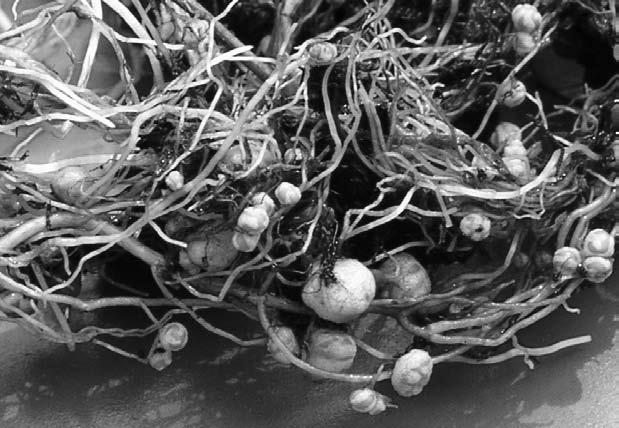
Клубеньковые бактерии (ризобии) под микроскопом
Организмы животных – от членистоногих до человека – тоже основательно «нафаршированы» разнообразной микрофлорой. Пугаться этого не стоит, ибо в абсолютном большинстве случаев это не вторжение извне безжалостного врага, а взаимовыгодный симбиоз, обеспечивающий виду эволюционное преимущество.
Например, термиты способны запросто переваривать не только древесину, но и всякие другие малосъедобные вещи. Причем исключительно благодаря постоянным обитателям их задней кишки – жгутиконосцам, спирохетам и бактериям. Состав кишечной микрофлоры термита уникален и не встречается у насекомых других видов. Если «постояльцев» кишечника термита убить (такие опыты неоднократно проделывались), и посадить искалеченное насекомое на привычную диету из древесных опилок и фильтровальной бумаги, то оно довольно быстро погибнет.
Очевидно, что секрет пищеварения этих удивительных насекомых теснейшим образом связан с естественными обитателями их кишечника. Когда ученые догадались высадить одноклеточных симбионтов термита на питательную среду, то без труда сумели получить особый фермент, эффективно разлагающий целлюлозу.
А электронно-микроскопическое исследование кишечника термитов позволило обнаружить целый зоопарк, работающий в поте лица над перевариванием пищи. Главной фигурой кишечного симбиоза оказался жгутиконосец, облепленный со всех сторон колышущимися спирохетами и палочковидными бактериями, а внутри его тела удалось разглядеть еще какие-то мелкие бактерии. Дружные усилия этой компании позволяют термиту с легкостью переваривать самые невообразимые вещи.
В человеческом организме бактерий тоже хоть отбавляй. Подсчитано, что в одном кубическом сантиметре желудочного содержимого обитает примерно 25 тысяч бактерий, а в одном грамме содержимого толстого кишечника (попросту говоря, в каловых массах) их на несколько порядков больше – до 30–40 миллиардов. По мнению специалистов, одноклеточные организмы, населяющие полости и ткани человека, представлены более чем 250 видами различных микробов.
Разумеется, все это гигантское бактериальное сообщество – отнюдь не бесполезные нахлебники, а наши верные друзья, добросовестно и неутомимо синтезирующие аминокислоты, витамины и ферменты, жизненно необходимые для нашего повседневного существования. Они выполняют и важную барьерную функцию, противодействуя вторжению патогенных микроорганизмов – дизентерийных, брюшнотифозных, гнилостных и прочих. Более того, сбалансированная и разнообразная кишечная микрофлора – бесспорный показатель здоровья.
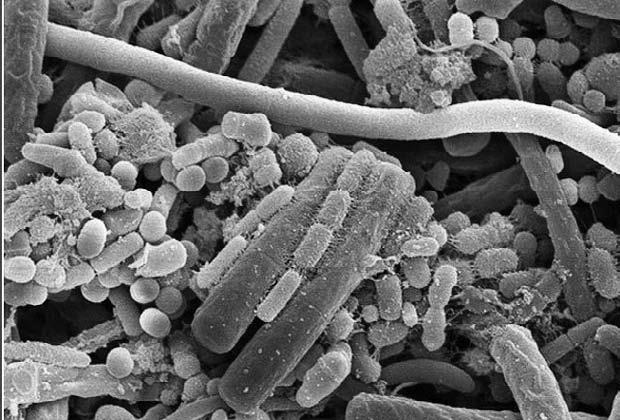
Микрофлора кишечника человека под микроскопом
К сожалению, мы часто относимся к нашим симбионтам без должного уважения. Едва ли нужно напоминать, что неумеренный прием антибиотиков по поводу и без повода, выкашивающий целые популяции полезных микроорганизмов, сплошь и рядом приводит к развитию тяжелого дисбактериоза, справиться с последствиями которого оказывается весьма и весьма непросто.
Бактерии, как мы помним, относятся к числу доядерных организмов – прокариот, ибо оформленного ядра у них нет. Их ДНК, которую принято называть нуклеоидом, или бактериальной хромосомой (хотя с хромосомами эукариотических клеток она не имеет ничего общего), представляет собой собранную в клубок двойную спираль, замкнутую в кольцо. Этот эквивалент клеточного ядра свободно плавает в цитоплазме, не имеет собственной мембраны и не содержит белков, хотя обычно зафиксирован на мембране бактериальной клетки. При этом гены внутри нуклеоида расположены в линейном порядке, как и в клетке эукариот, а сам нуклеоид в функциональном отношении полностью соответствует геному ядерной клетки. Кроме того, в клетках прокариот встречаются небольшие кольцеобразные фрагменты ДНК, никак не связанные с нуклеоидом, – так называемые плазмиды.
В бактериальных клетках нет органелл, типичных для эукариотических клеток, – ни хлоропластов, ни митохондрий, ни центриолей. А рибосомы (структуры, отвечающие за белковый синтез) свободно плавают в цитоплазме, поскольку аналог эндоплазматической сети в клетках прокариот отсутствует. Размножаются они тоже иначе – амитотически, путем простого бинарного (поперечного) деления. Сначала происходит удвоение нуклеоида, причем оно всегда начинается в точке прикрепления к цитоплазматической мембране, где локализован ферментативный аппарат, за нее отвечающий. Редупликация (удвоение) ДНК запускает механизм синтеза клеточной стенки, которая растет от периферии к центру. Образуется перетяжка, и бактерия делится пополам. Деление может осуществляться не только в одной, но и в нескольких плоскостях, и тогда возникают клеточные цепочки или скопления различной формы. Вариантом бинарного деления является почкование, когда на теле материнской клетки образуется увеличивающийся вырост. Достигнув величины материнской клетки, почка отшнуровывается. В среднем бактерии делятся каждые 20 минут.
Итак, бактерия гораздо примитивнее эукариотической клетки, но рядом с вирусом она – воплощение сложности, уникальная фабрика, нацеленная на бесперебойный выпуск сотен различных белков и ферментов. А вирус даже клеточного строения не имеет. Все, что у него есть, – это молекула нуклеиновой кислоты, упакованная в белковую оболочку. Но такая конструктивная простота имеет и отрицательную сторону: чтобы продолжить свой род, вирус должен просочиться в живую клетку и завладеть всеми ее ресурсами. Без посторонней помощи он размножаться не умеет. Вне клетки-хозяина вирус мертв и не обнаруживает никаких признаков жизнедеятельности. Вирусологи называют своих подопечных строгими (облигатными) паразитами, поскольку весь их жиз ненный цикл неотделим от клетки, в которую они стремятся проникнуть.
Вирусы гораздо мельче бактерий и вообще любых одноклеточных микроорганизмов – от грибов до простейших. Поэтому их величину измеряют не в микронах, то есть миллионных долях метра, а в нанометрах (нм) – миллиардных долях метра. Другими словами, нанометр в тысячу раз меньше микрона. Например, поперечник амебы составляет примерно 50 микрон, а размеры вируса полиомиелита находятся в пределах 27–29 нанометров, то есть «по росту» он меньше амебы почти в две тысячи раз. Понятно, что отношение объемов их тел выражается еще большей цифрой со многими нулями. Самые большие вирусы достигают величин вполне «бактериальных» – например, вирус оспы человека и животных вырастает до 300 нм.
Разнообразием форм вирусные частицы (вирионы) не отличаются: чаще всего они похожи на миниатюрные шарики с выростами на поверхности или без них, а вирусы растений часто напоминают вытянутый цилиндр. Скажем, длина цилиндра вируса табачной мозаики достигает 350 нм, но разглядеть его в оптический микроскоп все равно невозможно, поскольку толщина этого цилиндра не превышает 15 нм. Нить с практически нулевой поперечной размерностью увидеть, естественно, нельзя.
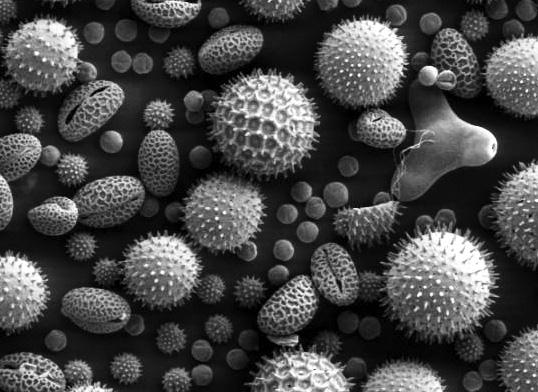
Вирусы под микроскопом
Однако ничтожные размеры большинства вирусов – далеко не самое удивительное. Гораздо интереснее тот факт, что они – единственные на Земле живые организмы, не имеющие клеточного строения. Вирус устроен настолько просто, что больше напоминает какой-то механизм, а не живое существо. В сердцевине вирусной частицы лежит нуклеиновая кислота, окруженная снаружи белковыми молекулами, которые образуют своего рода защитный чехол – капсид. Белки (или белок) оболочки вируса, как и любые другие белки, сотканы из аминокислот, уложенных в длинные цепочки. Капсид – не монолитная конструкция: он построен из отдельных субъединиц (капсомеров), которые состоят, в свою очередь, из одной или нескольких идентичных или разных полипептидных цепей. Генетический материал в центре вириона может быть представлен любой из нуклеиновых кислот – как ДНК, так и РНК, и по этому параметру вирусы подразделяются на ДНК-содержащие и РНК-содержащие.
Вирусы различаются между собой не только по размерам, форме и строению генома (вирусная ДНК или РНК есть не что иное, как геном), но и по уровню сложности своей структуры. Если наиболее мелкие и простые вирусы состоят из обособленной молекулы РНК и белка, то у крупных вирионов можно обнаружить многослойную «упаковку», в состав которой входят не только белковые молекулы, но углеводы и липиды.
Например, конструкция бактериофагов[12], по форме напоминающих головастика или гимнастическую булаву, включает в себя шаровидную головку, где помещается нуклеиновая кислота, и полый чехол в виде длинного хвоста, собранный из молекул белка. С помощью этого выроста бактериофаг прикрепляется к оболочке бактериальной клетки, прокалывает клеточную мембрану и впрыскивает, как через шприц, свою нуклеиновую кислоту в цитоплазму бактерии.
А вирус иммунодефицита человека (ВИЧ), возбудитель СПИДа, представляет собой шарик диаметром 100 нм, поверхность которого утыкана многочисленными отростками, похожими на шляпки обойных гвоздей или головки шурупов. Это вирусный белок – гликопротеид, белково-углеводный комплекс (биологи обозначают его как gp 120), от которого зависит не только адсорбция (поглощение) вируса клеточной мембраной (а следовательно, начало инфекционного процесса), но и необычайная изменчивость вируса. Гликопротеидные «гвозди» пронизывают оболочку вируса и образуют под ней сложное переплетение, своего рода вироскелет, который сохраняет форму вириона и удерживает в определенном положении вирусную «начинку» – геном вируса.
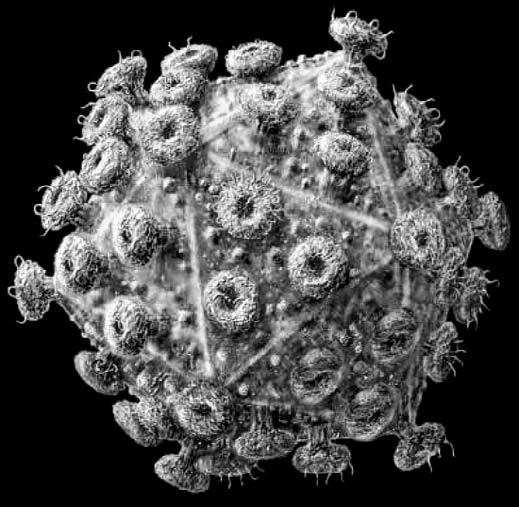
Вирус иммунодефицита человека под микроскопом
Итак, даже относительно крупные и сложно организованные вирусы несопоставимо примитивнее любой клетки и гораздо меньше ее по размерам. Но тогда немедленно возникает вопрос: почему живая клетка, это воплощение гибкости и неприхотливости, замечательно умеющая выживать в горячих водах термальных источников и на арктическом льду, уникальная миниатюрная фабрика по бесперебойному синтезу белков и ферментов, так легко сдается на милость победителя? Почему она не в силах успешно противостоять столь незначительному врагу, которого и живым-то назвать можно с очень большой натяжкой? Чтобы разрешить этот парадокс, необходимо как следует разобраться в механизме репродукции убийц-невидимок.
На заре вирусологии ученые договорились считать, что вирусы – просто очень маленькие бактерии, размножающиеся вполне традиционно, посредством элементарного поперечного деления, когда из одной клетки образуются две, из них – четыре, и т. д. Наибольшая скорость деления, доступная бактериальным клеткам, исчисляется тремя удвоениями в час, и если бы вирус вел себя аналогично, то его потомство за три часа последовательных удвоений составило бы не более тысячи вирионов.
Но когда ученые сумели наконец вычислить истинный темп накопления вирионов в клетке, от стандартной модели не осталось и следа. Опыты с бактериофагами показали, что вирионы размножаются в 100 тысяч раз быстрее бактерий, давая уже через три часа потомство в 100 миллионов вирусных частиц. Стало ясно, что механизм репродукции вирусов не имеет ничего общего с «пополамным» делением бактерий.

Д. И. Ивановский
Ученым пришлось вплотную заняться изучением жизненного цикла вирусов. Выяснилось, что на стадии вириона (или вироспоры), то есть до проникновения в клетку, вирус не обнаруживает никаких признаков жизнедеятельности. В связи с этим в науке до сих пор нет единого мнения о том, можно ли вирусы на этой стадии считать живыми. Более того, некоторые вирусы способны к кристаллизации (например, кристаллы вируса табачной мозаики впервые обнаружил еще Д. И. Ивановский), но стоит им только проникнуть в клетку, как они немедленно «оживают».
Дмитрию Иосифовичу Ивановскому (1864–1920), профессору ботаники Петербургского университета, принадлежит честь открытия вирусов. На протяжении нескольких лет он изучал так называемую мозаичную болезнь табака и в 1892 году обнародовал результаты своих исследований.
Мозаичная болезнь табака – это инфекция, поражающая табачные листья с образованием бурых пятен различной формы. Примерно за десять лет до работ Ивановского немецкий ученый А. Мейер показал, что сок больных растений вызывает такую же болезнь у здоровых, но выделить возбудитель инфекции ему не удалось. Тем не менее, он был убежден, что виновником мозаичной болезни табака является микроб, поскольку сок больного растения, процеженный через двойной слой фильтровальной бумаги, терял свои инфекционные свойства.
Д. И. Ивановский повторил опыты Мейера и обнаружил, что фильтрование через бумагу ровным счетом ничего не дает. Более того, даже пропускание сока через свечи Пастера – Шамберлена, сделанные из мелкопористой глины, которая удаляет из раствора любые видимые в микроскоп бактерии, не давало обеззараживающего эффекта. А вот кипячение делало его не опасней дистиллированной воды.
Ивановский справедливо заключил, что мозаичная болезнь табака вызывается некими патогенными агентами, размеры которых много меньше всех известных (в ту пору) микроорганизмов. Впоследствии из-за способности проходить сквозь бактериальные фильтры их стали называть фильтрующимися вирусами или просто вирусами (от лат. virus – «яд»).
Таким образом, вирусы представляют собой «переходный этап» между миром живых организмов и миром мертвой органики, а вироспора – лишь одна из форм существования вируса.
После соприкосновения с клеткой в жизненном цикле вирусов можно выделить следующие несколько фаз: фаза адсорбции (прикрепления вируса к клетке), фаза внедрения, латентная фаза, фаза образования нового поколения вирусов, фаза выхода вироспор.
Процесс начинается с избирательной адсорбции вируса на особых рецепторах, расположенных на поверхности клетки. При этом одни вирусы, имеющие в своем арсенале специальный фермент проникновения (наподобие нейраминидазы у вируса гриппа), активно внедряются внутрь, растворяя клеточную стенку мишени, а другие ведут себя пассивно и не торопят события: клетка проглотит их сама, приняв за вкусную и здоровую пищу.
Оказавшись внутри, вирус перестает существовать – это как раз и есть латентная фаза. Он истаивает, как призрак, бесследно исчезает в буквальном смысле этого слова, и отныне уже никакими самыми чувствительными методами в клетке не удается обнаружить ни цельной вирусной частицы, ни отдельных ее компонентов. Эта фаза его жизненного цикла настолько необычна, что даже получила особое название – эклипс (от греч. ekleipsis – «исчезновение, затмение»). Кажущееся исчезновение вируса объясняется просто: просочившись в клетку, вирион сбрасывает толстую белковую оболочку и освобождает свою нуклеиновую кислоту. Весьма примечательно, что процедуру «разоблачения» осуществляет сама клетка – с помощью набора ферментов, которые атакуют вирусную частицу с целью лизировать (растворить) и скушать питательный белок. По окончании «трапезы» клетка встречается лицом к лицу с вирусной нуклеиновой кислотой, и это определяет всю последовательность дальнейших событий.
Когда вирус проникает в клетку, великолепно отлаженная схема белкового синтеза немедленно дает сбой, поскольку все процессы внутриклеточного обмена ставятся под неусыпный контроль вирусной нуклеиновой кислоты. Вместо того чтобы синтезировать белки, необходимые для собственной нормальной жизнедеятельности, клетка начинает усердно тиражировать вирусные частицы. Все ресурсы, имеющиеся в наличии, пускаются на бессмысленное производство сотен тысяч вирионов, и клетка, по сути дела, превращается в автоматическую фабрику по сборке своих убийц, так как многочисленное потомство внедрившегося вируса, стремясь выйти наружу, расплавляет клеточную стенку.
Дело в том, что информация, закодированная в вирусной РНК (или ДНК, в данном случае это роли не играет), является для клетки приказом столь жестким и непреложным, что клетка не принимает во внимание сопротивление собственных нуклеиновых кислот. В ходе недавних исследований было установлено, что вскоре после проникновения вируса в клетку начинается синтез особого белка-ингибитора, который подавляет нормальное функционирование клеточной ДНК. В результате передача информации, необходимой для внутриклеточных процессов биосинтеза, сразу же приостанавливается. Практически одновременно с этим рождается фермент, бесповоротно разрывающий полисомные комплексы, где шла белковая сборка, а еще один фермент под названием полимераза (или синтетаза) окончательно берет под контроль процесс снятия копий с внедрившейся вирусной РНК.
Известный вирусолог А. А. Смородинцев отмечает:
Предполагают, что молекулы нуклеиновой кислоты для будущих вирусных частиц строятся в ядре зараженной клетки, а белковые футляры – в цитоплазме. Затем происходит формирование «полного», то есть зрелого, вируса. На внутренней поверхности клеточной оболочки завершается объединение вирусной нуклеиновой кислоты (ДНК или РНК) с белковым чехлом. Этот процесс идет одновременно во многих участках и заканчивается созреванием большой массы высокозаразных частиц.
Иногда в клетках образуется больше молекул одного биополимера, чем другого. Тогда после сборки всех полноценных вирионов вирусного потомства может остаться некоторый избыток вирусной РНК или вирусного белка. Если в зараженной клетке сформировался избыток вирусного белка, его молекулы образуют оболочку вируса, не начиненную РНК (которой для этого просто не хватило). Эти структуры, называемые «неполный» вирус, выходят из клетки, и их можно увидеть в электронном микроскопе. Они похожи на бублик с дыркой посередине. Естественно, что такой «неполный» вирус не обладает инфекционными свойствами, которые полностью зависят только от РНК.
Но бывает, что вирусы выкидывают и куда более сложные коленца. Например, семейство ретровирусов, к числу которых относятся возбудители некоторых лейкозов, так называемых медленных инфекций и знакомый всем вирус СПИДа, довело тактику скрадывания до немыслимого совершенства. Когда вирус СПИДа проникает в клетку, он сбрасывает защитный белковый чехол, а на его РНК начинается синтез другой нуклеиновой кислоты – ДНК. Все шиворотнавыворот! Этот процесс называется обратной транскрипцией (его поддерживает специальный фермент – обратная транскриптаза, или ревертаза).
Новоиспеченная вирусная ДНК встраивается в хромосому хозяйской клетки. В такой латентной (скрытой) форме она, никак себя не обнаруживая, может пребывать неограниченно долго – вплоть до естественной смерти зараженного. Но предсказать заранее, как именно поведет себя внедрившийся вирус, невозможно. Из латентной формы он с легкостью переходит в активную фазу и начинает деятельно реплицироваться. Теперь РНК синтезируется на матрице ДНК (это уже механизм прямой, а не обратной транскрипции), а на базе РНК, в свою очередь, собираются вирусные белки. Через короткое время вирус созревает и, покрывшись оболочкой, выходит в кровь. При низком уровне размножения существование паразита в организме больного только поддерживается (таких больных называют вирусоносителями), а при высоком – развивается СПИД в классической форме, рано или поздно неизбежно приводящий к смерти.
Итак, инфекционные свойства вируса связаны с его нуклеиновой кислотой, что поначалу специалистами было встречено с недоверием. Многие ученые долгое время полагали, что истинными виновниками патологического процесса являются не нуклеиновые кислоты как таковые, а белки оболочки вируса. Потребовались годы и десятилетия кропотливых экспериментов, чтобы понять, как все происходит на самом деле. Белковый чехол помогает вирусу проникнуть в клетку, и на этом его функция исчерпывается, а вот репродукция вирионов – целиком и полностью заслуга вирусной нуклеиновой кислоты. Другое дело, что в естественных условиях «голая» РНК никогда не сумеет проникнуть через неповрежденную клеточную стенку (такая задача по плечу только цельной вирусной частице), но управляет всем именно она. Причем в корне неверно рассматривать внутриклеточную репродукцию вируса в качестве самостоятельной работы клетки, хотя на первый взгляд может показаться, что дело именно так и обстоит. Но это всего лишь иллюзия, ибо в действительности всем цитоплазматическим хозяйством командует вирус, а биосинтетические системы клетки подчиняются ему, расходуя строительный материал.
Тем не менее многоклеточные организмы сумели выжить (чему примером служит наше с вами существование), значит, в клетке имеются надежные механизмы противодействия вирусной инфекции. В противном случае неутомимые агрессоры, умеющие размножаться в сотни тысяч раз быстрее любой бактерии, давным-давно истребили бы все живое на планете.
Как же работает этот загадочный механизм и какое он имеет отношение к хорошо изученным иммунным реакциям типа «антиген – антитело»?
Примерная схема работы антимикробного иммунитета в общих чертах ясна и выглядит следующим образом. Когда бактерия проникает в наш организм, ее белки распознаются иммунной системой как «не свои», чужеродные, потому что любая клетка (бактериальная или клетка нашего тела – роли не играет) несет на своей поверхности индивидуальные метки – так называемые антигенные детерминанты. Рисунок этих маркеров уникален для каждого организма, даже если они принадлежат к одному виду (единственное исключение – однояйцевые близнецы, поскольку они являются генетическими двойниками). Таким образом, бактерия-агрессор выступает в качестве антигена – вещества, стимулирующего иммунную систему к выработке антител – особых белковых молекул, которые атакуют и уничтожают эту бактерию. Это и есть реакция «антиген – антитело».
Образовавшиеся антитела в высокой степени специфичны, то есть направлены против той инфекции, которая вызвала их продукцию. Поскольку вирус заключен в белковый чехол, он тоже является антигеном, поэтому резонно предположить, что иммунная система будет отвечать на его внедрение аналогично. И действительно, человек, переболевший корью (а корь – это вирусная инфекция), никогда не заражается ею повторно, так как приобретает по отношению к ней стойкий иммунитет.
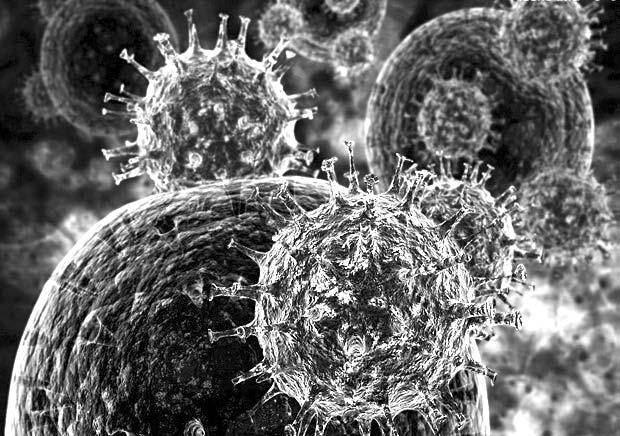
Вирус гриппа, атакующий здоровую клетку организма
Поэтому ученые долгое время считали, что и при вирусных инфекциях выздоровление обеспечивается в первую очередь специфическим иммунитетом, за счет классической реакции «антиген – антитело». Однако при этом напрочь игнорировались два весьма важных факта, которые буквально бросаются в глаза.
Во-первых, хорошо известно, что антитела образуются и поступают в кровь только через несколько дней после заражения, так как иммунной системе необходим определенный срок, чтобы идентифицировать вирус и выработать достаточное количество антител.
Но темп репродукции вируса многократно превышает скорость размножения бактериальных клеток. Картина складывается удручающая: в первые два-три дня болезни несметные полчища вирионов успевают «заселить» едва ли не все клетки потенциальной жертвы, а иммунная система безнадежно опаздывает. Антител будет слишком мало, и они просто-напросто не сумеют нейтрализовать вирус.
Во-вторых, антитела могут связывать вирус только в том случае, если он локализован вне клетки – в крови или лимфе. Проникнуть в зараженную вирусом клетку им не под силу, хотя они вполне успешно препятствуют его внедрению в чувствительную ткань.
Итак, мало того, что популяция антител оказывается весьма немногочисленной, они вдобавок должны успеть перехватить вирус в тот момент, пока он еще находится в сосудистом русле. Если вирус уже обосновался в клетке, иммунная система бессильна.
Но тогда немедленно возникает вопрос: коль скоро реакция «антиген – антитело» не поспевает за вирусом, как же наш организм побеждает инфекцию?
Все мы не по одному разу болели гриппом и, слава богу, живы-здоровы. Да что там грипп! Даже при таких тяжелейших вирусных заболеваниях, как натуральная оспа, клещевой энцефалит или желтая лихорадка, погибают далеко не все инфицированные. Очевидно, должен существовать некий механизм, который в первые часы после заражения оперативно перехватывает вирус и тормозит его внутриклеточную репродукцию, пока образование специфических антител только-только начинает набирать обороты.
Такой механизм вскоре действительно удалось обнаружить. В 1930-х годах группа американских ученых, работавших с вирусом желтой лихорадки, обратила внимание на весьма примечательный факт. Если обезьяне незадолго до заражения желтой лихорадкой ввести какой-нибудь другой, малоопасный, вирус (он может быть вирусом совершенно иного типа), то болезнь не развивается вовсе. Эксперименты на других животных – рыбах, птицах, рептилиях и млекопитающих (на человеке в том числе) – дали тот же результат.
Сомнений больше не оставалось: в клетках нашего организма присутствует некий «фактор икс», таинственный противовирусный агент с широким спектром действия, способный при инфицировании вирусом одного типа вызывать устойчивость к вирусу другого типа (даже неродственному). В медицине появился новый термин – интерференция, позаимствованный из точных наук[13].
Если классическая реакция «антиген – антитело» отличается высокой избирательностью (при заражении корью антитела направлены только против вируса кори, но никак не против эпидемического паротита или ветряной оспы), то феномен интерференции, наоборот, предельно неспецифичен: инфицированная клетка начинает продуцировать низкомолекулярный белок, подавляющий репродукцию любых вирусов.
Однако идентифицировать этот белок удалось далеко не сразу, поэтому многие ученые настаивали на том, что загадочный феномен объясняется элементарной конкуренцией, когда один вирус отбирает у другого захваченную территорию.
Только в 1957 году английские ученые А. Айзекс и Д. Линденман, работавшие с вирусом гриппа, сумели наконец выделить «фактор икс» в чистом виде. Оказалось, что синтез интерферона (так назвали новый белок) напрямую связан с вирусной агрессией, поскольку в интактных (неинфицированных) клетках его обнаружить не удалось.
Синтез интерферона начинается сразу же после внедрения вируса в клетку и занимает всего лишь от двух до шести часов, так что вирусному потомству при всем желании за ним не угнаться. Кроме того, небольшие молекулы интерферона без труда проникают через клеточную оболочку. Таким образом, пока вирус еще только готовится приступить к делу, легкие молекулы успевают созреть, покинуть клетку, выйти в межклеточное пространство и просочиться в соседние клетки. Интерферон работает на опережение и напоминает группу быстрого реагирования или бдительную погранзаставу, которая первой принимает удар на себя и ведет бой, дожидаясь подхода основных сил.
Но что является непосредственным толчком к началу синтеза интерферона?
Когда вирус разоблачается, сбрасывая белковый чехол и освобождая свою нуклеиновую кислоту, клетка воспринимает эти действия как сигнал тревоги. Дело в том, что вирусная двунитевая РНК в клетке представляет собой чужеродный объект, поскольку собственные клеточные РНК, как мы помним, всегда построены из одной-единственной цепочки. Как только вирусная нуклеиновая кислота превращается в матрицу, готовую для снятия новых копий вирионов, клетка реагирует незамедлительно. Получив сигнал опасности, она включает так называемый ген-оператор, который запускает образование информационной (матричной) РНК, и на внутриклеточных полисомах – органеллах, отвечающих за синтез белка, – начинается сборка легких молекул интерферона. В дальнейшем события развиваются по описанному выше сценарию: синтез молекул интерферона значительно опережает темп репродукции вируса, и непрошеному гостю приходится несладко.
Молекулы интерферона
Теперь посмотрим, как интерферон расправляется с вирусом.
Антитела, как известно, просто находят и уничтожают пришельца, а вот механизм действия интерферона принципиально иной, что и было установлено в специальных исследованиях. Этот белок не вступает в прямой контакт с паразитом, он воздействует на синтетический аппарат клетки таким образом, что тот становится непригодным для репродукции вируса.
Полной ясности в этих вопросах пока нет. Вероятно, интерферон запускает группу «спящих» генов, отвечающих за синтез особых матричных РНК, с помощью которых клетка строит антивирусный белок. Когда этот белок присоединяется к рибосоме, ее конфигурация меняется таким образом, что становится непригодной для сборки новых поколений вирионов. При этом все синтетические процессы, необходимые для нормального функционирования самой клетки, полностью сохраняются. Одним словом, клетка превращается в своеобразную ловушку, куда вирус без особого труда проникает, но произвести на свет потомство оказывается не в состоянии.
Молекула антитела
Весьма примечательно, что молекулы интерферона напрочь лишены какого-либо побочного действия и подавляют размножение практически всех известных вирусов, чем выгодно отличаются от самых эффективных антибиотиков. Антибиотики широкого спектра действия оказывают влияние на очень многие возбудители бактериальной природы, но против вирусов они бессильны. В первые часы и дни после внедрения вирусных частиц за дело принимается именно интерферон, что весьма важно в тех случаях, когда организм встречается с каким-либо вирусом впервые и потому не имеет к нему готовых антител.
Нужно заметить, что активность натуральных противовирусных белков подвержена заметным возрастным колебаниям: интерферон плохо вырабатывается у маленьких детей до двух лет и у пожилых людей старше шестидесяти пяти. Кроме того, играют роль наследственность (примерно у третьей части населения продукция эндогенного – «внутреннего» – интерферона ощутимо снижена вследствие врожденных особенностей организма), температура воздуха, время года и некоторые другие факторы. Поэтому использование синтетических препаратов интерферона в качестве профилактического средства трудно переоценить.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Бактерии под микроскопом
Бактерии под микроскопом Бактерии — типичные представители мира микроорганизмов. Посмотрим, что может нам рассказать о них микроскоп. С его помощью мы обнаруживаем среди бактерий шаровидные, цилиндрические, нитевидные и различным образом закрученные клетки.Самые
Бактерии в истории человечества
Бактерии в истории человечества Древнеримский историк Квинт Курций Руф в своей «Истории Александра Македонского» так описал одну из его побед при покорении Малой Азии. При осаде города Тироса в 332 году до н. э. в армии Александра Македонского произошло неприятное
Свет убивает бактерии
Свет убивает бактерии Из рассказа о фотосинтезе мы уже знаем, что жизнь зеленых растений зависит от Солнца, дающего им энергию. Но большая часть бактерий иначе реагирует на солнечный свет. Прямые лучи солнца для них губительны.Очень показательный пример вредного влияния
Бактерии, открытые Виноградским
Бактерии, открытые Виноградским Сергей Николаевич Виноградский, выдающийся русский микробиолог, долгое время работавший в Пастеровском институте в Париже, внес огромный вклад в развитие микробиологии. Центральной темой его исследований было изучение автотрофных
Бактерии и наше меню
Бактерии и наше меню В предыдущей главе мы воздали должное дрожжам, обеспечивающим нас и вкусным хлебом на столе, и приятными напитками. Еще раньше мы говорили о других грибах — богатых источниках, витаминов. А что же бактерии? Неужели они не принимают никакого участия в
Бактерии, вырабатывающие аминокислоты
Бактерии, вырабатывающие аминокислоты Японские микробиологи в 50-е годы обратили внимание на другую важную роль бактерий. Они выделили микробы, продуцирующие аминокислоты, которые можно было бы использовать для повышения качества пищевых продуктов или как добавку к
1. Бактерии
1. Бактерии После беседы о гигантах растительного мира естественно сказать, хотя бы вкратце, о растениях-пигмеях. Далеко ходить за ними не приходится: они везде и вокруг нас, и на нас, и внутри нас; но видеть их не так-то легко: нужен хороший микроскоп и уменье им
2. Бактерии в почве
2. Бактерии в почве Вы, конечно, знаете, что не всякие бактерии зловредны. Существует много бактерий безвредных, много полезных, а много и таких, без которых едва ли была бы возможна жизнь человека, да и всей органической природы.Вот перед вами колхозное поле пшеницы.
1. Бактерии
1. Бактерии После беседы о гигантах растительного мира естественно сказать, хотя бы вкратце, о растениях-пигмеях. Далеко ходить за ними не приходится: они везде и вокруг нас, и на нас, и внутри нас; но видеть их не так-то легко: нужен хороший микроскоп и уменье им
2. Бактерии в почве
2. Бактерии в почве Вы, конечно, знаете, что не всякие бактерии зловредны. Существует много бактерий безвредных, много полезных, а много и таких, без которых едва ли была бы возможна жизнь человека, да и всей органической природы.Вот перед вами колхозное поле пшеницы. Урожай
50. Вирус полиомиелита, ЕСНО-вирусы, вирусы Коксаки
50. Вирус полиомиелита, ЕСНО-вирусы, вирусы Коксаки Вирус полиомиелита. Относится к семейству Picornaviridae, роду энтеровирусов.Это относительно небольшие вирусы с икосаэдральной симметрией. Геном образует несегментированная молекула +РНК.Каждая вирусная частица состоит из
Как бактерии превращаются в органеллы
Как бактерии превращаются в органеллы После приобретения митохондрий и пластид эукариоты вовсе не утратили способности к заглатыванию и «приручению» бактерий. Этот процесс продолжается и по сей день. Многие одноклеточные эукариоты (амебы, инфузории и другие) прямо-таки
2. ЕСНО-вирусы. Вирусы Коксаки
2. ЕСНО-вирусы. Вирусы Коксаки Относятся к семейству Picornaviridae, роду энтеровирусов.Строение вириона такое же, как у вируса полиомиелита.ЕСНО вирусы выделены в особую группу кишечных вирусов вследствие полного отсутствия патогенного действия на лабораторных животных.
Как бактерии становятся ксенофобами
Как бактерии становятся ксенофобами Способность отличать своих от чужих — фундаментальное свойство живых организмов. На этой способности основаны важнейшие биологические процессы: секс, формирование репродуктивной изоляции, защита от паразитов и конкурентов,
Бактерии
Бактерии Микробам — этим бесконечно малым живым существам — принадлежит бесконечно большая роль в природе. Луи Пастер Есть существа, которые не гибнут, если их кипятить 100 часов.Есть существа, которые выдерживают температуру, близкую к абсолютному нулю.Есть существа,