Гены и наследственные болезни
Гены и наследственные болезни

В этой главе речь пойдет о наследственных болезнях, имеющих генетическую подоплеку. Однако начать нам придется с механизмов развития злокачественных опухолей, ибо генетические поломки играют ведущую роль в этих процессах.
В самом общем виде любой опухолевый процесс характеризуется бесконтрольной пролиферацией (размножением) патологически измененных клеток, их способностью инфильтрировать ткани и значительной автономией этих процессов от защитных сил организма. При этом характер роста доброкачественных и злокачественных опухолей отличается принципиально. Доброкачественная опухоль образует капсулу и растет, раздвигая ткани, а злокачественная пронизывает (инфильтрирует) окружающую ткань, составляя с ней практически неразъемное целое.
Понятно, что хирургическое лечение рака имеет по этой причине свои сложности: иссекать опухоль приходится в пределах здоровых тканей, так как невозможно точно определить границу, разделяющую здоровые и пораженные ткани. Даже сам термин «рак» имеет патологоанатомическое происхождение – на препаратах отчетливо видны кляксоподобные образования, весьма напоминающие известное ракообразное, выбросившее вперед свои клешни. Кроме того, раковая опухоль способна к метастазированию: ее фрагменты (иногда в виде отдельных клеток) мигрируют по кровяному руслу и дают очаги вторичного роста.
Причины бесконтрольного роста опухолевой ткани окончательно неясны до сих пор. Существует огромное количество гипотез, связывающих пролиферацию раковых клеток с активизацией латентных онковирусов, то есть вирусов особого типа, находящихся до поры до времени в «дремлющем» состоянии (активизация такого вируса запускает механизм злокачественного перерождения клетки), или с нарастанием с возрастом числа мутаций в клеточном геноме. Все-таки злокачественные опухоли являются по преимуществу болезнью пожилых людей, поэтому гипотезы, связывающие их развитие с генетическими ошибками и иммунными «промахами», имеют полное право на существование. Бесспорно, играют роль и факторы среды – ионизирующее и ультрафиолетовое излучение, автомобильные выхлопы, промышленные загрязнители, лекарственные препараты, пищевые и ароматические добавки и так далее.
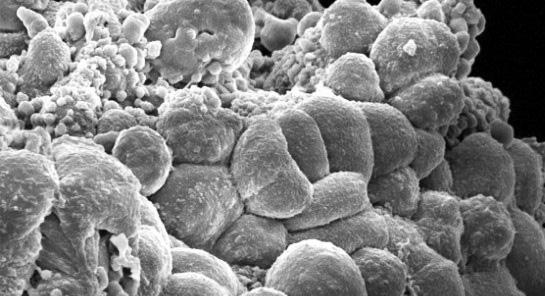
Раковая опухоль под микроскопом
Главной проблемой канцерогенеза – злокачественного перерождения тканей – остается неуязвимость опухолевых клеток. Дело в том, что любая клетка (микробный агент, проникший извне, или мутантная клетка нашего организма – роли не играет) несет на своей поверхности белки особого типа – своего рода опознавательные знаки, так называемые антигенные маркеры. Иммунная система, если не вдаваться в подробности, вообще устроена очень просто: принцип ее работы строится на распознавании «своего» и «чужого». И если какая-нибудь клетка идентифицируется как «не своя», то немедленно будет приведен в действие сложный механизм клеточных реакций по ее выявлению и уничтожению. Исправно функционирующая иммунная система всегда находится на страже гомеостаза внутренней среды организма.
Опухолевая клетка всегда несет в себе признаки генетической чужеродности. В эксперименте было не раз показано, что иммунная система не остается безучастной к бесконтрольной пролиферации злокачественных клеток: лимфоциты-киллеры получают сигнал о явном неблагополучии, направляются к месту событий, окружают растущую опухоль, но… Дальше возникают сплошные «но». То ли иммунный ответ не поспевает за стремительным ростом опухоли, то ли выпадают какие-то важные его звенья, то ли антигенная чужеродность мутантных клеток оказывается недостаточной, чтобы вызвать полноценную реакцию, но так или иначе опухолевые клетки разрушению не подвергаются, потому что иммунная система реагирует на них крайне вяло.
Все эти обстоятельства вызвали к жизни огромное количество теорий, стремящихся объяснить неполноценность иммунного ответа при раковой патологии. Некоторые исследователи вообще отказываются искать единые патогенетические механизмы рака, утверждая, что опухолевый процесс имеет в каждом конкретном случае свои собственные причины, связанные с локализацией опухоли, ее клеточным строением, состоянием макроорганизма и так далее. На этом фоне выделяется попытка генетика и биофизика Н. В. Лучника объяснить генез злокачественных новообразований с позиций теории «незаживающей раны». Но прежде чем изложить его версию (пусть небезупречную, но стройную и внутренне непротиворечивую), следует сделать небольшое отступление.
Все клетки нашего организма имеют свой срок жизни, по истечении которого они погибают. Гибель клеток может происходить двумя путями – посредством так называемого апоптоза (запланированная гибель клеток) и посредством некроза (незапланированная, внезапная гибель клеток). При апоптозе организм сам решает, какие структуры уже отработали свое и подлежат немедленному уничтожению. Это своего рода чистка, сохранение постоянства внутренней среды на должном уровне. С помощью ферментов клетки разбираются на составные части, и все образовавшиеся в ходе этой деконструкции структуры вновь пускаются в дело. Апоптоз – это заурядный процесс, направленный на поддержание гомеостаза. Например, эритроциты – клетки красной крови – живут всего лишь 100 дней и после этого погибают, а на смену им приходят новые клетки, прошедшие «инструктаж» в костном мозге.
Иное дело – некротическая гибель клеток. Она происходит случайно и незапланированно. Простейший пример: чистя картошку, вы порезали палец. Погибающие клетки буквально «кричат» о своем неблагополучии, посылая биохимические сигналы. В ответ на эти сигналы организм запускает каскад сложных реакций: происходит спазм поврежденных сосудов, начинается тромбообразование, к очагу поражения устремляются клетки воспаления и иммунные клетки, призванные нейтрализовать потенциальную инфекцию. В результате всех этих процессов начинается заживление и в конечном итоге формируется рубец из соединительной ткани.
По версии Н. В. Лучника, опухолевые клетки в силу их повышенной хрупкости гибнут некротически, непрерывно сигнализируя о своей беде. Погибают, разумеется, не все клетки опухоли, а только некоторая их часть. Каскад сигналов с периферии вызывает немедленную и парадоксальную реакцию: опухоль начинает активно снабжаться питательными веществами, прорастать кровеносной и нервной тканью, отнимая таким образом ресурсы у макроорганизма. Очаг злокачественного роста воспринимается организмом как травматический. А поскольку скорость размножения опухолевых клеток значительно превосходит аналогичные показатели нормальных клеток, масса опухолевой ткани стремительно увеличивается, отвлекая на себя все больше ресурсов. Вдобавок бурный опухолевый рост сопровождается нарастающей интоксикацией, что только усугубляет клиническую картину. Возникает что-то вроде самоподдерживающейся цепной реакции, исход которой заранее предрешен.
Остается выяснить только одно: в чем причина повышенной хрупкости опухолевых клеток, и почему они должны гибнуть по некротическому типу? Чтобы ответить на этот вопрос, надо вспомнить о том, что наши гены не остаются неизменными от рождения и до смерти. Они непрерывно подвергаются разнообразным внутренним и внешним воздействиям. Любое изменение структуры ДНК, нарушение ее целостности называется мутацией. Мутации являются заурядным явлением, и большая их часть своевременно распознается и устраняется при помощи специальных внутриклеточных репаративных механизмов. Генные (или точковые) мутации, затрагивающие отдельные гены и не отражающиеся на структуре хромосом, распознать очень сложно; хромосомные же мутации (инверсии, делеции, транслокации[45]), сопровождающиеся изменением формы и строения хромосом, хорошо видны под обычным световым микроскопом в период митоза (деления клетки). При митозе генетический материал удваивается (редупликация ДНК), хромосомы с помощью особых внутриклеточных структур растаскиваются к полюсам делящейся клетки, и в результате дочерние клетки получают избыток или недостачу хромосомного материала, если в материнской клетке часть хромосом была дефектной. Такие дочерние клетки, как правило, нежизнеспособны. Как раз из них и формируется вышеупомянутая популяция некротически погибающих опухолевых клонов, сигнализирующих с периферии о глубоком внутреннем неблагополучии.
Обычные (не опухолевые) клетки тоже мутируют, но возникающие в них изменения своевременно устраняются. При одноцепочечных разрывах дело обстоит сравнительно просто: дефектный участок вырезается специальными ферментами, а образовавшийся «пробел» восстанавливается по комплементарной неповрежденной цепочке, которая используется в качестве матрицы. Механизмы репарации двухцепочечных разрывов более сложны, но если даже такой дефект исправить не получается, в запасе всегда остается вторая (парная) хромосома с неповрежденным геном. Вероятность параллельного повреждения одного и того же локуса в обеих нитях молекулы ДНК исчезающе мала, поэтому нормальные клетки отличаются высокой стабильностью. Клетки же потенциально онкогенные, с точки зрения этой теории, несут в себе «первородный грех» в виде дефектной структуры одной из хромосом, поэтому даже сравнительно небольшое возмущение приводит к огромному числу нерепарируемых мутаций, что заставляет такие клетки погибать некротическим путем со всеми вытекающими последствиями. Развивается картина «незаживающей раны», и опухоль начинает неуклонно прогрессировать. Дело за малым – отыскать врожденный изъян опухолевых клеток.
Н. В. Лучник предложил свою гипотезу довольно давно, а наука, как известно, не стоит на месте. В последние годы выяснилось, что стволовые клетки, те самые стволовые клетки, обещавшие революцию в медицине, похоже, имеют непосредственное отношение к злокачественным опухолям. Более подробно об этих удивительных клетках мы поговорим в следующей главе, а пока коротко объясним читателю, что они собой представляют.
Как известно, зрелые кровяные клетки неспособны к размножению, а самые многочисленные из них – эритроциты – даже утрачивают ядро. Живут они не более 100 дней. Немедленно возникает вопрос: откуда они в таком случае берутся? В начале прошлого века отечественный гистолог[46] Александр Максимов обосновал изящную теорию, согласно которой в красном костном мозге обитают специальные клетки, занятые исключительно делением. Это их основная работа. После каждого деления одна дочерняя клетка претерпевает морфологические изменения и превращается в клетку крови, а другая, немного повзрослев, делится вновь. Затем история повторяется: одна клетка проходит обучение и становится обычной кровяной клеткой, а другая через некоторое время вступает в новый цикл размножения. Эта картина весьма напоминает ствол, пускающий молодые побеги, поэтому Максимов назвал такие клетки стволовыми (Stamzelle). Довольно скоро его теория получила блестящее экспериментальное подтверждение.
Впоследствии выяснилось, что своих предшественников имеют не только кровяные клетки. Эпителий кишечника, клетки кожи, мышц и сосудов, наконец костная ткань тоже все время обновляются. А чуть позже среди обычных кроветворных стволовых клеток была обнаружена популяция еще более пластичных, умеющих трансформироваться абсолютно в любую клетку человеческого организма (их у нас насчитывается около 290 типов). Короче говоря, такая плюрипотентная[47] стволовая клетка может дать начало любой ткани нашего тела. Медики возлагают на них большие надежды.
Сравнительно недавно стволовые клетки особого типа были найдены в раковых опухолях. Оказалось, что свыше 90 % опухолевой ткани приходится на обычные «старые» раковые клетки, неспособные к развитию, а ее бурный рост обусловлен размножением стволовых опухолевых клеток. Удельный вес этих клеток при разных формах рака сильно варьируется. Например, в случае лейкемии[48] на 100 тысяч злокачественных клеток приходится всего лишь одна стволовая, а при некоторых мозговых опухолях их число может достигать 20. Понятно, что агрессивность опухоли напрямую связана с числом стволовых клеток: чем их больше, тем быстрее опухолевый рост.
По мнению ученых, это самые обычные стволовые клетки, переродившиеся в результате мутации и ставшие смертельно опасными, ибо в полной мере унаследовали весьма эффективный механизм репарации ДНК. Поэтому традиционные методы лечения – радио-или химиотерапия – сплошь и рядом оказываются бессильны: проходит немного времени, и опухоль воскресает, как феникс из пепла.
А совсем недавно была высказана гипотеза, согласно которой причина рака кроется в пробуждении «спящих» генов клеточной кооперации. Эти гены появились около миллиарда лет назад одновременно с возникновением многоклеточных организмов.
Вероятно, читателю приходилось слышать об атавизмах – внезапном проявлении признаков, свойственных нашим далеким предкам. Объясняется это тем, что гены, за них отвечающие, продолжают сохраняться в геноме, но либо отключены, либо представляют собой некодирующие фрагменты ДНК. Эволюционно более молодые гены зорко приглядывают за дремлющими «старичками», а когда в силу тех или иных причин теряют бдительность, на свет божий появляются хвостатые и волосатые младенцы или детишки с перепонками между пальцами. Зубы у цыплят тоже воз никают в результате несвоевременного пробуждения древних генов. Одним словом, авторы новой гипотезы полагают, что рак – это своеобразный атавизм, активизация спящих генов, прекративших работу более 600 миллионов лет назад.
Переход от одноклеточных организмов к многоклеточным свершился не в одночасье, а растянулся на десятки миллионов лет. Дифференцировки органов и клеточной специализации тогда не существовало, так что первые организмы, ступившие на коварную тропу многоклеточности, представляли собой простонапросто рыхлые колонии эукариот, клеточное взаимодействие которых ограничивалось обменом химическими сигналами. Одним словом, эти бурно растущие конгломераты весьма напоминали раковую опухоль. А вот когда в кембрии[49] (или венде) появились сложные организмы, возникла необходимость координировать деятельность большого количества клеток разных типов. Однако природа – слепой конструктор, действующий методом проб и ошибок, – ничего не создает с нуля, она только лишь видоизменяет сделанное ранее. Поэтому новые многоклеточные унаследовали геном своих одноклеточных предков. Конечно, эволюция его основательно пошлифовала: одни гены были откорректированы, а другие вообще умолкли, но древние механизмы существуют в геноме до сих пор. И если в организме происходит сбой, доисторические гены могут активироваться и вызвать злокачественный рост. Так что опухоль – это древнее многоклеточное образование, которое может поселиться в каждом из нас.
Впрочем, у авторов красивой гипотезы впереди много работы. Для начала неплохо бы разобраться с некоторыми из ныне живущих, но очень древних организмов, которые умеют восстанавливаться из мельчайших фрагментов. Например, обыкновенную пресноводную гидру (примитивное животное из группы кишечнополостных) можно потереть на терке, и она легко вырастет вновь, чуть ли не из отдельной клетки. Точно так же обстоит дело и с губками. Кстати, расшифровка генома одной из губок выявила участки ДНК, отвечающие за рудиментарную клеточную кооперацию и за регуляцию роста. Неполадки в работе этих генов у высших организмов как раз и вызывают бесконтрольное размножение опухолевых клеток.
Одним словом, какая бы версия развития рака ни восторжествовала, бесспорно одно: наследственная предрасположенность играет здесь немалую роль.
И похоже, что окончательно победить этот недуг можно только путем генного модифицирования.
Некоторые психические болезни (шизофрения, в частности) тоже имеют наследственную природу – сегодня уже выявлены десятки генов, мутации в которых повышают риск развития тяжелого заболевания.
Однако не все так безнадежно и неопределенно. На сегодняшний день известно много болезней, тип наследования которых хорошо изучен. Вот, скажем, гемофилия – врожденный дефект свертывания крови, опасный недуг, которым страдал царевич Алексей, сын Николая II. В развитии этой болезни ключевую роль играют специфические белки – так называемые факторы свертываемости, и если в двух генах, их кодирующих, произошла мутация, нормальных белков в организме просто нет.
Оба гена располагаются в X-хромосоме, так что это наследование, сцепленное с полом. Поскольку у женщин две X-хромосомы, присутствие мутантной версии гена гемофилии в одной хромосоме компенсируется нормальным геном в другой. Поэтому женщины гемофилией практически не болеют, так как вероятность того, что в обеих хромосомах окажется «порченый» ген, исчезающе мала. А вот мужчинам скомпенсировать дефектный ген нечем – в Y-хромосоме его просто-напросто нет. Поэтому гемофилия – сугубо мужская болезнь. Кроме царевича Алексея этим недугом страдали испанские принцы и родные братья прусского принца Сигизмунда. От гемофилии умер брат английского короля Эдуарда VII. Одним словом, «королевская» болезнь в чистом виде – едва ли не все европейские дворы могли «похвастаться» собственными гемофиликами.
Причина между тем проста. Династические традиции (весьма и весьма жесткие) обязывали несчастных принцев жениться только на принцессах сопредельных дворов. А поскольку принцесс на свете не так много, то все царствующие фамилии Европы находились в кровном родстве. Судя по всему, носительницей гена гемофилии была английская королева Виктория, просидевшая на троне без малого 70 лет – с 1837 года по 1901-й. А так как никто из ее предков и родни по боковым линиям гемофилией не болел, резонно предположить, что генная мутация в X-хромосоме произошла у одного из ее родителей или у нее самой на ранней стадии эмбрионального развития.
У Виктории было девять детей. От гемофилии в возрасте 31 года умер один из ее сыновей – Леопольд, брат Эдуарда VII, о котором мы упомянули чуть выше. С принца Альберта – мужа королевы – подозрения снимаются, ибо он был здоров, а передача гена гемофилии от отца к сыну невозможна. Эта хворь наследуется от дяди к племяннику, что говорит о рецессивной мутации в X-хромосоме. От британской королевы-долгожительницы ген гемофилии унаследовали две ее дочери, поэтому многие их сыновья оказались больны. Алиса Гессенская, одна из дочерей Виктории, была носительницей опасного гена и матерью Александры Федоровны – жены последнего российского императора Николая II. Царевич Алексей унаследовал ген гемофилии именно от нее.
Между прочим, гемофилия – заболевание, известное с древнейших времен. Сообщения о ней в Талмуде относятся к VI веку до н. э. Уже тогда предписывалось воздерживаться от обрезания мальчиков, у старших братьев которых после этой процедуры наблюдалось сильное кровотечение. Сыновей сестры той женщины, чей сын терял много крови, тоже не обрезали. А вот если у того же отца были сыновья, рожденные от другой женщины, то на них запрет не распространялся. Совершенно очевидно, что тип наследования гемофилии был в общих чертах ясен задолго до рождества Христова. Так что поведение европейских королей (и российского царя, в частности) следует квалифицировать как преступную халатность или глупый аристократический гонор.
В своей книжке «Почему я похож на папу» Н. В. Лучник приводит еще более впечатляющий пример стойкости наследственных признаков в ряду поколений. Полководец английской армии Джон Тальбот, павший на поле брани в 1453 году, на излете Столетней войны, был с почестями похоронен в фамильном склепе Шрюберийского собора (король пожаловал ему незадолго до этого титул герцога Шрюберийского). А в 1914 году затеяли реставрацию собора, причем ремонтные работы возглавлял прямой потомок Тальбота, тринадцатый герцог Шрюберийский. У него была синфалангия – срастание первой и второй костной фаланги на пальцах руки, врожденный дефект, унаследованный от отца. Каково же было его удивление, когда он увидел на руке полуистлевших останков далекого предка в точности такой же изъян – сросшиеся фаланги пальцев. Родовой признак благополучно пережил 14 поколений.
Современная медицина насчитывает чуть более 5000 наследственных заболеваний. Лучше всего изучены хромосомные аномалии, когда меняется число хромосом или в них самих обнаруживаются нарушения – выпадение одного участка (делеция), его поворот на 180 градусов (инверсия) или его перемещение в другую хромосому (транслокация).
Например, трисомия по 21-й паре хромосом (то есть к 21-й паре присоединяется маленький «довесок» в виде дополнительной хромосомы) ведет к развитию синдрома Дауна. Такие дети сразу обращают на себя внимание малым ростом, короткопалостью, своеобразной «дальневосточной» раскосостью, монгольской складкой века (эпикантусом) и вообще монголоидной уплощенностью черт лица. Кроме того, у них отмечаются пониженный тонус мышц, недостаточность желез внутренней секреции и выраженная умственная отсталость.
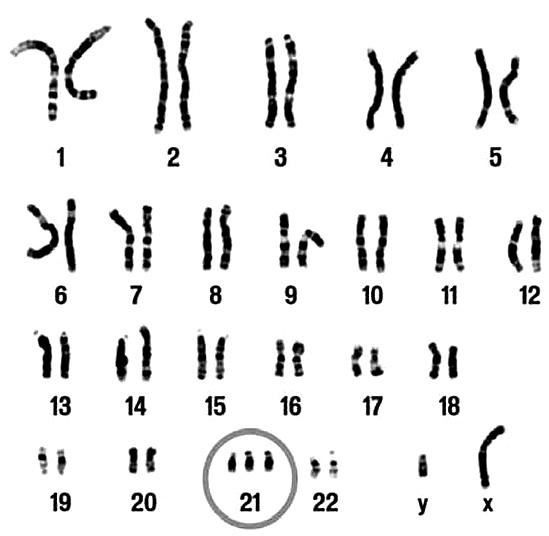
Трисомия по 21-й паре хромосом
А трисомия по 13-й паре приводит к рождению детей с резким недоразвитием головного мозга и тяжелейшими пороками сердца, которые умирают в младенческом возрасте. Лишняя половая хромосома вызывает синдром Клайнфельтера, проявляющийся задержкой полового развития, умственной отсталостью и затрудненной речью. Чаще всего у больных с этим синдромом обнаруживают классический набор – XXY, но экзотические наборы XXYY, XXXY и даже XXXXY дают ту же самую клиническую картину.
Если диагностика хромосомных аномалий особых трудностей сегодня не представляет, то с точковыми мутациями, затрагивающими отдельные гены, дело обстоит значительно хуже. Кроме того, многие болезни, имеющие наследственную природу, обусловлены «неправильной» работой нескольких десятков генов (некоторые психические болезни, например шизофрения). Тем не менее, уровень развития современных биотехнологий позволяет хотя бы в принципе нащупать терапевтические подходы к лечению врожденных недугов, а порой даже получить весьма неплохие результаты.
Генная терапия некоторых наследственных болезней – задача, вполне решаемая уже сегодня. Несколько лет назад появились сообщения об успешных генно-инженерных вмешательствах при муковисцидозе и тяжелых комбинированных иммунодефицитах (ТКИД). Муковисцидоз – неизлечимая наследственная болезнь, при которой происходит кистозное перерождение поджелудочной железы, желез кишечника и дыхательных путей в результате закупорки их выводных протоков вязким слизистым секретом. А ТКИД развивается из-за дефекта синтеза особого фермента, что приводит к накоплению токсических продуктов, убивающих T– и B-лимфоциты – центральное звено системы иммунитета. Для таких больных смертельно опасна любая, самая безобидная инфекция, и они вынуждены проводить всю свою жизнь в изолированной от внешнего мира стерильной камере. Но сначала несколько слов о методах генной инженерии.
Полезный ген вырезают из хромосомы одного организма и встраивают его в хромосому другого, в любую из его клеток. Казалось бы, нехитрая операция, но она проста только на первый взгляд. Сначала «донорский» ген нужно отыскать и вырезать его из молекулы ДНК с помощью специальных ферментов-рестриктаз. А для доставки гена по адресу – внутрь чужой клетки – используют так называемые векторы – «отредактированные» фаги, вирусы и плазмиды (кольцевые молекулы ДНК). С натуральными вирусами работать нельзя: они могут проявить свои агрессивные качества, и тогда все пойдет насмарку. Поэтому сначала их подвергают своеобразной хирургической операции, вырезая все лишнее и оставляя только те гены, которые доставят груз по назначению.
Итак, теперь в распоряжении биологов есть полезный ген и средство доставки. Остается вложить письмо в конверт. Для этого кольцевую молекулу ДНК (плазмиду) режут в нужном месте рестриктазами, внедряют в нее копию гена и запечатывают конверт – возвращают плазмиде исходную форму с помощью сшивающих ферментов – лигаз.
Когда полезный ген окажется в нужном месте чужой клетки, нужно убедиться, что он «прижился» и успешно работает (детали этой процедуры мы опустим). Если объектом был микроорганизм, то задача выполнена: создана популяция трансгенных клеток, готовых синтезировать несвойственный им продукт. Таким образом уже давно получают инсулин из бактерий и дрожжевых клеток, в геном которых вставлен соответствующий человеческий ген. Сложнее с растениями, потому что из культуры клеток их нужно сначала вырастить, и еще сложнее с животными, так как приходится работать с оплодотворенной яйцеклеткой, а потом еще вдобавок подыскивать для нее суррогатную мать.
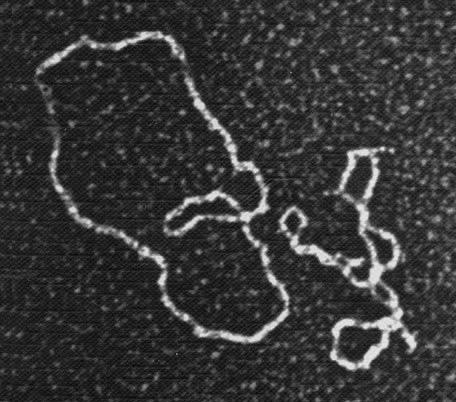
Плазмиды, визуализированные с помощью электронного микроскопа
В целях генной терапии муковисцидоза для корректировки дефектного гена использовали векторхимеру – тщательно обезвреженный вирус СПИДа (чтобы не развилась инфекция) и белковую оболочку вируса лихорадки Эбола (смертельно опасная тропическая инфекция), потому что вирус иммунодефицита не умеет самостоятельно размножаться в клетках легочного эпителия.
Биолог Александр Чубенко пишет:
Испытания на мышах и обезьянах показали высокую эффективность гибридного вируса: правильный ген удалось внедрить почти в четверть клеток легочного эпителия. Однако излечиться раз и навсегда таким способом невозможно. Вирус исправляет геном только в поверхностных клетках легочного эпителия, и лечение необходимо повторять несколько раз в год по мере отмирания клеток.
А вот при лечении ТКИД в качестве вектора использовался ретровирус, и у двоих из 12 детей развилась лейкемия. Но большинство специалистов всетаки решили, что в данном случае риск оправдан, так как без лечения смерть гарантирована, а лейкоз – меньшее зло. Для доставки генов в клетки-мишени применяются и другие модифицированные вирусы (вирус герпеса, аденовирусы), и хотя результаты, бесспорно, впечатляют, иногда пробежит холодок по спине: кто знает, какие побочные эффекты может вызвать этот вирус…
Правда, существуют и альтернативные, невирусные способы переноса генетического материала в клетку (например, с помощью липосом, умеющих просачиваться через клеточную мембрану, специфических антител и путем непосредственной бомбардировки клеток микрочастицами золота, к которым присоединены фрагменты ДНК), но все эти методы гораздо менее надежны. В клеточные ядра попадает ничтожная часть терапевтических генов, а в хромосомы они встраиваются с большим трудом.
В последнее время активно разрабатываются генные технологии по созданию искусственных хромосом с последующим их внедрением в клетки-мишени. Эксперименты на животных дают неплохие результаты, и ученые считают, что конструирование искусственных хромосом со встроенным лечебным геном для терапии наследственных болезней человека – дело ближайшего будущего. Вот что пишут специалисты:
Вводить хромосомы в ядро можно будет либо заключив их в контейнеры-липосомы, либо с помощью инъекций иглой атомно-силового микроскопа. Японские нанотехнологи в ноябрьском номере журнала Nano Letters за 2004 год опубликовали статью, в которой описан зонд длиной 8 микрометров и шириной 200 нанометров. В оболочке ядра клетки после прокола такой иглой образуется брешь диаметром 1 микрометр, которая исчезает после извлечения иглы. Таким способом можно проводить нанохирургические операции с генетическим материалом непосредственно в живых клетках без нарушения целостности их микроструктур.
Бум генной терапии пришелся на середину 1990-х годов, когда «отремонтированные» кроветворные клетки удалось пересадить детям с тяжелой формой врожденного иммунодефицита. На первых порах все шло хорошо (детей спасли от неминуемой смерти), но у двух больных развилась лейкемия. Откуда взялась эта напасть?
Американские биологи создали дрожжевую культуру, клетки которой содержат как обычные, так и синтетические хромосомы
Беда в том, что доставить нужный ген по адресу – всего лишь полдела. Нужно еще научить клетку читать вирусный белок. С другой стороны, вирус («отредактированный» вектор) тоже хочет быть прочитанным. Для этой цели у него есть промотор – особый фрагмент ДНК, который, взмахнув флажком, дает команду: поехали! Но вирусный промотор не подчиняется клеточным регуляторам, поэтому клетка читает не только полезный ген, но и соседние, оказавшиеся рядом. А среди них легко может оказаться латентный (скрытый) онкоген, запускающий злокачественное перерождение клетки. А поскольку каждому ребенку вводят около миллиона таких химер, вероятность того, что плохой ген вдруг неожиданно «выстрелит», резко увеличивается. Поэтому многообещающую программу без лишнего шума свернули.
Однако совсем недавно французские и американские ученые объявили, что разработана надежная генно-инженерная методика лечения талассемии[50] – врожденного заболевания крови. Тяжелые формы талассемии заканчиваются смертью больных в раннем детстве. Выбор у них невелик: или регулярные гемотрансфузии (переливания крови), или пересадка донорского костного мозга. В первом случае больной обречен на пожизненные процедуры, а во втором его подстерегает хронический иммунный конфликт. Но ученые сумели отыскать третий, неочевидный, путь. Они внедрили в клетки костного мозга больного неповрежденную версию гена, после чего модифицированные кроветворные клетки были возвращены на «родину» и занялись своим прямым делом – созреванием и размножением. Результат превзошел все ожидания:
Через год после лечения пациент смог отказаться от переливаний крови и вот уже 21 месяц успешно обходится без них, хотя прежде вынужден был делать их ежемесячно, начиная с трехлетнего возраста (больному на момент операции исполнилось 15 лет. – Л.Ш.). По сути дела, речь идет о радикальном и полном излечении от тяжелой генетической болезни.
Но бить в литавры пока рано. Авторы, к сожалению, не пишут о том, каким образом им удалось выявить и нейтрализовать латентные онкогены. Быть может, притаившаяся лейкемия еще покажет себя во всей красе. Или не покажет, так как выборка минимальна – один-единственный человек. А вот когда счет пойдет на десятки, тогда и поговорим.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Наследственные заболевания
Наследственные заболевания К биологическим видам неприменимо понятие неизменности. С каждым новым поколением особи наследуют новые гены — мутируют. Изредка мутация может улучшить шансы индивидуума на выживание, и тогда этот новый ген широко распространяется во всей
4. Наследственные и культурные детерминанты стереотипов поведения
4. Наследственные и культурные детерминанты стереотипов поведения После этих двух методологических отступлений рассмотрим собственно проблему соотношения стереотипов поведения, которые различаются по происхождению. Рассмотрим сначала генетический аспект этой
Доверчивость и благодарность — наследственные признаки
Доверчивость и благодарность — наследственные признаки Для понимания человеческой эволюции особое значение имеет изучение генетического базиса психологических признаков, связанных с кооперативным поведением, без которого существование устойчивых социальных
Наследственные изменения инстинкта у домашних животных.
Наследственные изменения инстинкта у домашних животных. Возможность или даже вероятность наследственных вариаций инстинкта в природе может быть подкреплена кратким обзором некоторых случаев у домашних животных. Благодаря этому мы получим возможность определить долю
Новые гены?
Новые гены? Активность генов может меняться в ходе эволюции не только путем изменений сайтов связывания ТФ, работы самих ТФ или регуляторных РНК, но и в результате дупликации генов. При прочих равных два одинаковых гена произведут больше продукта (то есть информационной
Наследственные нарушения транспорта аминокислот
Наследственные нарушения транспорта аминокислот Болезнь Хартнупа – нарушение всасывания триптофана в кишечнике и его реабсорбции в почечных канальцах. Так как триптофан служит исходным продуктом для синтеза витамина РР, то основные проявления болезни Хартнупа –
НАСЛЕДСТВЕННЫЕ ДЕФЕКТЫ
НАСЛЕДСТВЕННЫЕ ДЕФЕКТЫ В первый же день своей жизни щенок должен быть осмотрен на предмет врожденных дефектов. Проверьте все четыре конечности, ступни и пальцы; анус (щенки могут выжить значительное время с зарощенным анусом); проверьте расщелину неба и «заячью
14. НАСЛЕДСТВЕННЫЕ, ТРАВМАТИЧЕСКИЕ И АЛКОГОЛИЧЕСКИЕ ВЫКЛЮЧЕНИЯ ЗАДЕРЖИВАЮЩИХ ЦЕНТРОВ
14. НАСЛЕДСТВЕННЫЕ, ТРАВМАТИЧЕСКИЕ И АЛКОГОЛИЧЕСКИЕ ВЫКЛЮЧЕНИЯ ЗАДЕРЖИВАЮЩИХ ЦЕНТРОВ Гете утверждает, что не описал ни одного преступления, которого он не чувствовал себя в состоянии совершить. Но если такова тяга к преступлению, к убийству у этого величавого олимпийца,
Глава 13. Некоторые наследственные болезни собак
Глава 13. Некоторые наследственные болезни собак Благодаря упорному труду советских кинологов, служебные, охотничьи, декоративно-любительские породы собак широко распространены в нашей стране и в последнее десятилетие заметно усовершенствовались по целому ряду
Гены Моцарта
Гены Моцарта О детстве Моцарта не так много точных сведений, куда больше – предположений. Как все происходило у этого маленького гения? Сестра Наннерль, старше его на пять лет, захотела узнать побольше о своем младшем брате. Какой он был на самом деле в раннем детстве? В
ГЕНиальные гены
ГЕНиальные гены А теперь совсем другой вопрос: почему это так интересно? Что можно такого узнать, исследовав череп Моцарта? Ну, допустим, его взвесили и измерили. По результатам анализа костей можно выяснить, что ел владелец этого черепа. И это тоже уже сделали. Этот череп
Гены-преступники
Гены-преступники После того как в гангстерской саге Фрэнсиса Форда Копполы умирает крестный отец Дон Вито Корлеоне (Марлон Брандо) у мужчин клана появляется новый крестный отец – его сын Майкл Корлеоне (Аль Пачино). И почему сын должен быть таким же гениальным
Гены-свидетели
Гены-свидетели Криминология постоянно пытается выяснить, принадлежит ли найденный на месте преступления образец (волоса, крови, спермы…) подозреваемому или нет. Если бы у Питера Фалька, он же Коломбо, были генетические анализы, то у него определенно было бы намного
Гены
Гены Открытие Арендта подводит нас еще к одному вопросу. Одно дело, что у глаз разных животных есть общие части, но как получилось, что такие непохожие друг на друга глаза, как у червей, мух и мышей, родственны друг другу? Чтобы ответить на этот вопрос, обратимся к