Стволовые клетки, или Сделай сам
Стволовые клетки, или Сделай сам

«У господа бога впервые появился конкурент», – не так давно во всеуслышание заявил один из авторов журнала Nature. Он имел в виду успехи синтетической биологии последнего десятилетия. Однако прежде чем говорить о конструировании искусственных микроорганизмов, закончим разговор о стволовых клетках, начатый в предыдущей главе.
Помните о клоне наиболее пластичных стволовых клеток, умеющих превращаться в любую ткань? Их называют эмбриональными стволовыми клетками, потому что они образуются в процессе эмбрионального развития и откладываются в организме «про запас». Эти клетки получают в наши дни методом терапевтического клонирования. Суть его сводится к тому, что у человека в любом возрасте берут самую обычную клетку и пересаживают ее ядро в донорскую яйцеклетку, которая немедленно начинает дробиться – прямо в пробирке. Через пять дней она достигает стадии бластоцисты – полого шарика из нескольких сотен клеток, значительная часть которых приходится на универсальные стволовые. Такие клетки можно размножать и неограниченно долго поддерживать в виде клеточной культуры, а их полная генетическая идентичность тканям пациента исключает проблемы с иммунитетом.
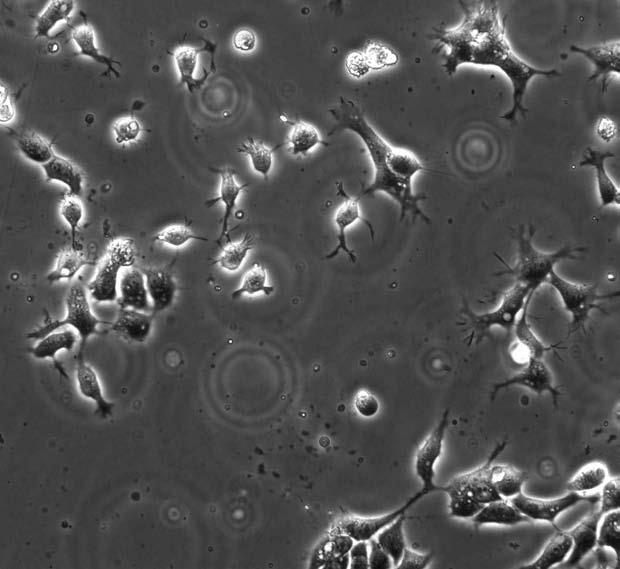
Эмбриональные стволовые клетки человека под микроскопом
Но в клинической медицине их используют крайне редко – только по жизненным показаниям, когда никакое другое лечение уже не помогает. Беда в том, что они способны превратиться во что угодно, очень плохо понимают химические команды взрослого организма и склонны к неограниченному делению. Если их ввести в организм, они легко могут спровоцировать злокачественный рост или вызвать образование тератом[51], что и было не раз показано в экспериментах на животных. Например, крысам, страдающим искусственно вызванной болезнью Паркинсона[52], пересадили эмбриональные стволовые клетки и добились массового их превращения в нейроны. Сначала все шло хорошо, и состояние крыс заметно улучшилось вплоть до полного исчезновения симптомов болезни. Однако на 10-й неделе эксперимента дифференцировку[53] сохранили всего 25 % нейронов, остальные же вновь превратились в неспециализированные клетки, которые начали активно размножаться, заселяя крысиный мозг. Руководитель опытов Стивен Голдман так прокомментировал наблюдаемую картину: «Не нужно быть нейроонкологом, чтобы понять, что этот процесс – начало образования опухоли».
Однако не все так безнадежно. Стволовые клетки находят применение в ортопедии: с помощью особого сигнального белка ученые стимулируют их трансформацию в остеобласты – клетки костной ткани. Биологи научились выращивать образцы различных тканей прямо в лабораторной посуде, если удается как следует «объяснить» универсальным стволовым клеткам, во что они должны превратиться. Больному пересаживают уже готовый продукт.
Биолог Борис Жуков пишет:
В лабораториях разных стран сегодня выращивают лоскуты живой кожи (для пересадок на обожженные места), хрящи в форме уха и даже участки кровеносных сосудов – настоящие, многослойные, с эпителием внутри и мышцами в толще стенки.
А совсем недавно пришло сообщение о том, что американские ученые сумели восстановить у цыплят ранее ампутированные крылья, «запустив» группу генов семейства Wnt. Эти гены управляют формированием конечностей в период эмбрионального развития, но у взрослых животных они «молчат». Американцам удалось заставить их работать, в результате чего произошла полная регенерация удаленного крыла. А поскольку удалось активизировать эти гены у цыплят, то, в принципе, их можно «разбудить» и у человека, так как в нашем геноме они тоже присутствуют. Быть может, пройдет не так уж много лет, и технология по отращиванию утраченных рук и ног станет реальностью.
А теперь вернемся к синтетической биологии. Под ней понимается не банальная генная инженерия наподобие внедрения в бактериальную клетку полезных генов (генно-инженерный инсулин применяется с 1982 года), а создание искусственных микроорганизмов, которые будут делать абсолютно все, что мы захотим. Сотруднику швейцарского политехнического института в Цюрихе Свену Панке это видится примерно так:
Мы примемся собирать бактерии из отдельных модулей, так что они станут соответствовать нашим представлениям <…> о производстве того или иного вида сырья, и вовсе не будут отвечать своему природному назначению.
Перспективы открываются воистину ошеломляющие. Ведь запасы нефти на нашей планете неуклонно тают, а с биотопливом из растительного сырья, о котором рассказывалось выше, дела обстоят не так хорошо, как хотелось бы. Например, энергоемкость спирта почти вдвое уступает бензину, поэтому и в бак его придется заливать в два раза больше, чтобы проехать то же самое расстояние. Выходом из положения мог бы стать бутиловый спирт, но его в процессе дрожжевого брожения образуется сравнительно немного. Если же заменить крахмал целлюлозой, то технология ощутимо усложнится, потому что целлюлозу нужно будет разлагать на отдельные компоненты.
А вот если «перепрограммировать» дрожжевые грибы таким образом, чтобы они питались целлюлозой вместо сахара и крахмала, хитрая проблема разрешится сама собой. По словам Джея Каслинга, сотрудника Калифорнийского университета, подобная технология станет реальностью уже к середине текущего десятилетия. Использование модифицированных дрожжей позволит получать биологическое топливо из древесины, соломы и других сельхозотходов. «На смену нефтяной индустрии должна прийти биология», – уверенно заявляет Крейг Вентер, бесспорный первопроходец в области микробного конструирования.

Крейг Вентер
Работы Вентера как раз и положили начало синтетической биологии. Первым делом он реконструировал бактериофаг phi X 174, кольцевая молекула ДНК которого содержит 11 генов и 5386 нуклеотидных пар. Это серьезное достижение, ибо фаги, паразитирующие на бактериях, устроены достаточно сложно.
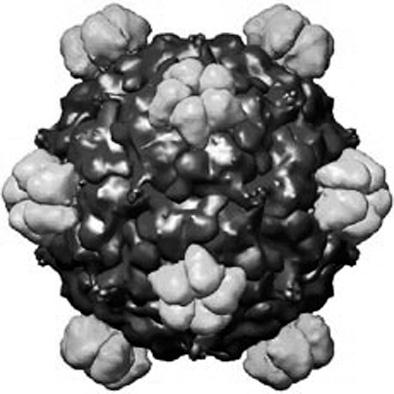
Бактериофаг phi X174 (его объемная модель). Относительная простота этого микроорганизма позволила американским ученым «собрать» его в лаборатории из отдельных «деталей»
А вот самая примитивная среди известных вирусоподобных частиц (вироидов) носит очень длинное название – «вироид кокосовой пальмы каданг-каданг» и состоит всего из 246 нуклеотидов. Однонитчатая РНК этого вироида замкнута в кольцо и не содержит даже истинных генов, кодирующих белки, поэтому у него отсутствует белковая оболочка, позволяющая ввести генетический материал через неповрежденную клеточную стенку.
Российский биолог Александр Чубенко пишет:
Геном наиболее простых вирусов содержит всего три гена, которые кодируют белки, необходимые для воспроизводства: белок, вызывающий разрыв клеточной стенки хозяина; фермент, обеспечивающий многократную репликацию своего генома; и белок капсида – оболочки, покрывающей вирусную ДНК или РНК. Пример такого вируса – бактериофаг Q?, инфицирующий кишечную палочку Escherichia coli. Его РНК состоит примерно из 3500 нуклеотидов. Самые большие вирусы содержат две-три сотни генов, закодированных в двухцепочечной нити ДНК длиной в несколько сотен тысяч пар нуклеотидов.
Усилия биологов по реконструкции вирусных частиц могут со временем пролить свет на проблему происхождения жизни на Земле (если, конечно, не считать, что она была занесена из космоса в ходе астероидной и кометной бомбардировки нашей планеты на заре ее образования). Современные вирусы, как мы помним, являются строгими внутриклеточными паразитами, поэтому выжить в «мертвой» они среде не могли. Но можно ли допустить, что некий доисторический протовирус умел размножаться самостоятельно, без помощи белков-ферментов, а впоследствии эту способность утратил?
Как известно, современным нуклеиновым кислотам такие подвиги не под силу: ДНК и РНК всех без исключения организмов, от простейших вирусов до высших животных и человека, нуждаются в услугах целой армии специфических белков, чтобы передавать закодированную информацию в ряду поколений. Сегодня ни одна из нуклеиновых кислот не может себя копировать без посторонней помощи. Выходит, что наш гипотетический вирус обречен: он должен появиться на свет только после того, как клеточные формы жизни с их сложным набором ферментов станут полноправными обитателями первобытного океана.
Но клетка (даже самая элементарная) – чересчур громоздкая структура, чтобы возникнуть скачком, в одночасье. И если мы хотим избавиться от «божественного» представления о зарождении жизни на Земле, нам требуется нарисовать закономерную и непротиворечивую картину возникновения естественным путем сложных макромолекул, способных к самосборке, что со временем приведет к рождению генетического кода, а затем и первых клеток. Жизнь – процесс антиэнтропийный (энтропия – мера беспорядка), для нее характерно самопроизвольное упорядочение и структурное усложнение, а суть этого упорядочения заключается в ограничении свободы. Порядок наводят тысячи белков-ферментов, благодаря которым химические реакции идут в нужном направлении, но беда в том, что белки не умеют сами себя воспроизводить. Способностью к воспроизведению обладают нуклеиновые кислоты, но они лишены каталитической активности и потому нуждаются в помощи ферментов. Таким образом, два важнейших свойства, необходимых для эволюции, – способность к упорядочению и способность к воспроизведению – оказались разделены между двумя классами органических структур. Как природа сумела их объединить?
В 1970-х годах были обнаружены совершенно необычные ферменты, включавшие в свой состав кроме белка еще и молекулу РНК. Когда белок полностью удалили, неожиданно выяснилось, что оставшаяся РНК способна катализировать свою специфическую реакцию. Это было сенсацией, поскольку всегда считалось, что к катализу способны только белки и уж никак не нуклеиновые кислоты. Способные к катализу молекулы РНК назвали рибозимами (по аналогии с энзимами – белковыми ферментами). Многие ученые сразу же заговорили о том, что «в начале была РНК». И действительно, вообразим себе молекулу, которая не только является носителем информации, но и вдобавок умеет катализировать химические реакции. Это же готовый кандидат на роль нашего искомого протовируса, давшего со временем начало всем остальным живым существам!
Но Вентер не остановился на полпути: ведь существуют еще и бактерии, которые тоже подлежат оптимизации. Крэйг Вентер решил, что для его целей больше всего подходят микоплазмы – очень мелкие бактерии, сопоставимые по размерам с крупными вирусами.
Если воздействовать на бактериальную клетку определенными веществами (например, лизоцимом), можно получить формы, лишенные клеточной стенки. Такие «рукотворные» микроорганизмы, получившие название L-форм, чрезвычайно уязвимы и весьма чувствительны к факторам среды. Они способны выживать только в особо благоприятных условиях, когда внешнее осмотическое давление находится в равновесии с внутриклеточным.
Однако микроорганизмы без клеточной стенки найдены и в природе. К их числу относятся микоплазмы – паразиты животных, растений и человека, наиболее примитивные бактериоподобные существа, имеющие клеточное строение. К тому же они самые мелкие из всех бактерий и по размерам приближаются к вирусам. Если, например, вирус гриппа чуть меньше одной десятой микрона, а размеры вируса коровьей оспы колеблются в пределах от 0,22 до 0,26 микрон, то диаметр микоплазмы, вызывающей повальное воспаление легких у рогатого скота, находится в пределах 0,1–0,2 мкм. При этом неприхотливые микоплазмы в отличие от вирусов могут расти и размножаться на синтетической питательной среде, то есть являются полноценными одноклеточными микроорганизмами.
Микоплазменная клетка построена из сравнительно небольшого числа молекул (около 1200), но имеет полный набор компонентов, необходимых для самостоятельного выживания (ДНК, РНК, белки), и содержит около трехсот ферментов. По некоторым признакам микоплазмы стоят ближе к животным, чем к растениям: их клетки заключены в гибкую цитоплазматическую мембрану, а их липидный состав близок к аналогичному показателю в животных клетках.
Крэйг Вентер работал с Mycoplasma genitalium – условно-патогенным обитателем мочеполовых путей, который состоит всего из 517 генов (из них 480 кодируют белки, а 37 – различные молекулы РНК), тогда как нуклеоид средней бактериальной клетки содержит от двух до четырех тысяч генов. Такая неслыханная простота делает микоплазмы идеальным объектом для генно-инженерных манипуляций.
Александр Чубенко отмечает:
Для выживания простейшей «версии» микроорганизма эти гены (имеется в виду полный набор из 517 генов. – Л.Ш.) не являются обязательными. Аккуратно, один за другим, вырезая эти гены из хромосомы M. genitalium, исследователи установили, что в ее лаконичном геноме только около 300 генов действительно необходимы для существования бактерии в питательном бульоне.
Проект «Минимальный геном» направлен на создание простейшего из простейших жизнеспособного одноклеточного организма. После этого можно будет проводить «апгрейдинг устройства с минимальной конфигурацией». В обычной бактериальной клетке избыточная продукция естественных метаболитов или синтез белка, закодированного в трансгене, конфликтует с основными программами, записанными в тысячах генов и обеспечивающими выживание клетки в природных условиях. В клетке с минимальным геномом все ресурсы, кроме необходимых для жизни и деления в тепличных условиях биореактора, будут направлены на синтез необходимых человеку белков.
Микоплазменный геном сотрудники института Крэйга Вентера собрали в 2008 году, а в 2010-м был предпринят решающий эксперимент, вобравший в себя все многолетние наработки. Синтетический геном бактерии Mycoplasma mycoides длиной более миллиона нуклеотидов внедрили в бактерию другого вида – Mycoplasma capricolum, ДНК которой была заранее удалена. Клетка, где поселился геном-агрессор, отныне выглядела как бактерия Mycoplasma mycoides, успешно размножалась и синтезировала именно те белки, которые ей и положено синтезировать.
Разумеется, никто не утверждает, что Крэйгу Вентеру действительно удалось создать искусственную жизнь. Не следует забывать, что Вентер работал исключительно с геномом, а цитоплазму и внутриклеточные органеллы использовал в готовом виде.
Австрийский биолог Маркус Шмидт пишет:
ДНК составляет примерно один процент сухого веса клетки. Если мы синтезировали всего один процент содержимого клетки, то у нас нет никакой причины утверждать, что мы создали живую клетку. Ведь нам не по силам пока синтезировать цитоплазму. Этого не делал никто.
Однако недооценивать и работы Вентера тоже не стоит, поскольку современные биотехнологии находят сегодня очень широкое применение. Так, совсем недавно ученые сумели «приручить» кишечную палочку – бактерию Escherichia coli, внедрив в нее гены полыни и дрожжей. Отныне она будет синтезировать артемизинин – лекарство, получаемое из однолетней полыни и незаменимое при лечении малярии, которой ежегодно заболевает около 250 миллионов человек. А уже знакомый нам Джей Каслинг собирается наладить массовый выпуск этого препарата и обещает снизить его цену с 2,2 доллара до 25 центов.
В обозримом будущем модифицированные бактерии помогут людям заселить землеподобные планеты – Марс или даже Венеру. А почему бы и нет? В полярных шапках Красной планеты хватает воды, а разреженная марсианская атмосфера, состоящая в основном из двуокиси углерода, может обеспечить неплохой парниковый эффект, если ее дополнительно насытить газами вроде метана. На Земле до сих пор существуют древние бактерии (археи), которые гораздо примитивнее обычных микроорганизмов и могут выживать в исключительно неблагоприятных условиях.
Например, некоторые археи имеют оптимальную температуру роста свыше 100 °C, за что получили название экстремальных термофилов. Прокариоты этой группы обитают на океанском дне, на глубинах порядка двух с половиной километров, где давление составляет 260 атмосфер, а температура воды в зонах выхода горячих термальных источников достигает 250–300 °C. Описаны археи, предпочитающие всему на свете кислую среду, и такие анаэробные формы, метаболизм которых связан с молекулярной серой. Надо сказать, что метаболизм этих необычных микроорганизмов в высшей степени уникален и никогда не встречается у типичных бактерий или эукариот. Например, только у архей обнаружены бесхлорофилльный фотосинтез и особый тип анаэробного (бескислородного) дыхания, в процессе которого происходит образование метана. Такие архебактерии получили название метанобразующих. Кстати, весьма любопытно, что среди прокариот этой группы отсутствуют патогенные и паразитические формы.
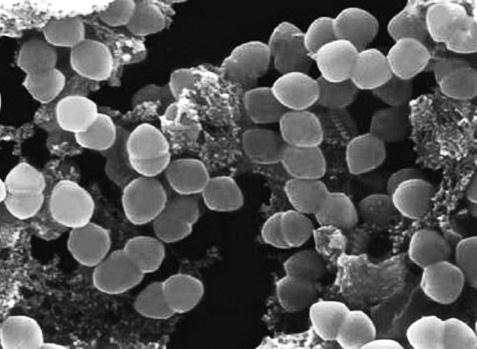
Древние бактерии (археи) под микроскопом
Вскоре после успеха Крэйга Вентера и его команды профессор Принстонского университета Майкл Хечт создал гены, кодирующие не существующие в природе белки. Белковая молекула построена всего из 20 аминокислот, однако этого более чем достаточно, поскольку в состав белковой молекулы входит несколько сотен аминокислот. Если их перетасовать, мы получим новый белок с принципиально иными свойствами. Число мыслимых комбинаций многократно превышает количество реальных белков, но это не означает, что любая комбинация даст на выходе работоспособный продукт. Одни белки окажутся нестабильными, другие – токсичными, ну а третьи – просто бесполезными. И все же среди бесчисленного множества виртуальных белков наверняка должны отыскаться аминокислотные последовательности, способные катализировать нужную организму реакцию. Именно такие белки и попытались создать принстонские ученые.
Биолог Борис Жуков пишет:
Для начала специальная компьютерная программа составила более миллиона аминокислотных последовательностей – термодинамически устойчивых и не похожих на известные белки. Из них ученые отобрали 27, трехмерная структура которых (рассчитанная опять-таки компьютером) позволяла предполагать, что они могут проявлять ферментативную активность[54]. Для каждого такого белка была написана последовательность нуклеотидов, которая могла бы его кодировать, – то есть ген. Каждый такой ген был искусственно синтезирован, а затем внедрен в ДНК бактерии, у которой перед этим был удален один из «естественных» генов. После этого «реконструированные» клетки были высажены на специальную среду, для жизни на которой необходим белок, кодируемый удаленным геном. На такой среде бактерия могла выжить лишь в том случае, если небывалый белок, считанный с искусственного гена, заменит утраченный фермент.
В четырех случаях из 27 именно это и произошло: клетки, лишенные жизненно важного гена, успешно росли и размножались. Белок, придуманный исследователями, не только успешно считывался в клетке, но и работал в ней.
Комментарии излишни: если эксперимент принстонских специалистов завершится созданием надежной технологии, можно будет не только синтезировать практически любые вещества, но и создавать организмы, не существующие в природе.
Хотя успехи молекулярной биологии последних десятилетий буквально ошеломляют, обольщаться сверх меры все же не стоит. Например, сравнительно недавно большой коллектив ученых во главе с профессором Киотского университета Акирой Иритани объявил о начале работ по воссозданию живого мамонта из палеолитических останков, похороненных в вечной мерзлоте. По мнению участников проекта, цель может быть достигнута уже через пять-шесть лет.

Источники генетического материала для клонирования – замороженные мамонтята
Большинство ученых весьма скептически относятся к таким заявлениям. Дело в том, что генетический материал мамонтов сохранился в виде мелких фрагментов, поскольку кристаллики льда при замерзании необратимо нарушают тончайшую клеточную структуру, в том числе ядерную мембрану. А цитоплазматические ферменты – нуклеазы, получив доступ к молекулам ДНК, за десятки тысячелетий успели поработать на совесть. Поэтому вместо строгой линейной последовательности генов мы имеем «кашу» из отдельных субъединиц, своего рода рассыпанный типографский набор.
Борис Жуков пишет:
Современные методы работы с нуклеиновыми кислотами позволяют сложить эти фрагменты в исходную последовательность – но, естественно, виртуально. Синтезировать по ней реальные молекулы ДНК длиной в сотню миллионов пар нуклеотидов (средний размер хромосомы мамонта) пока еще никто не пытался. К тому же сначала надо бы как-то узнать, какой фрагмент в какой хромосоме находится, – притом что обычные методы генетического картирования неприменимы к ископаемому материалу.
Но главная трудность даже не в этом. Ведь хромосома – это не просто молекула ДНК, а сложное нуклеопротеидное соединение, куда входят так называемые гистоновые белки. Мы пока еще слишком мало знаем о тонкой структуре хромосом, чтобы воссоздать ее в законченном виде. А как быть с клеточным ядром – ведь в ископаемых тканях целых ядер не сохранилось? Между тем ядра тоже придется собирать заново, потому что современные технологии клонирования предусматривают пересадку в донорскую яйцеклетку именно ядра, а не отдельных хромосом и уж во всяком случае не «голых» молекул ДНК. И совершенно непонятно, каким образом участники проекта намереваются обойти эти трудности.
Однако это еще далеко не все. Коротко напомним читателю, к чему сводится технология клонирования. Генетический материал (обязательно в виде клеточного ядра) помещают в донорскую яйцеклетку, из которой удалено ее собственное ядро, а затем подсаживают эту яйцеклетку в полость матки суррогатной матери. Именно так появилась на свет знаменитая овечка Долли.

Овечка Долли и ее «создатель» английский эмбриолог Ян Вилмут
На бумаге, конечно, все выглядит гладко, но следует иметь в виду, что клонирование – очень трудоемкая и капризная процедура. Большая часть пересаженных яйцеклеток отторгается, и даже сегодня в самых лучших современных лабораториях эффективность клонирования составляет всего лишь несколько процентов. И это при том, что технология хорошо обкатана, а все три особи (источник генетического материала, суррогатная мать и донор яйцеклетки) принадлежат к одному биологическому виду. Понятно, что при работе с генетическим материалом мамонта выход уменьшится как минимум на порядок, а это значит, что потребуются многие сотни слоних в качестве суррогатных матерей. Поэтому, похоже, мы еще очень нескоро сможем увидеть живого мамонта.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Глава XI Стволовые клетки
Глава XI Стволовые клетки Дифференцированные клетки взрослого организма отличаются одна от другой не только строением и функциями. Они отличаются и временем жизни. Некоторые из них, например нервные, обычно живут столько, сколько живет сам организм. Клетки крови или
2. Клетки крови
2. Клетки крови Система кроветворения сложнее других систем с постоянным обновлением дифференцированных клеток. В этом случае нет такого простого пространственного разделения стволовых клеток, дифференцирующихся клеток и клеток, достигших терминальной
Клетки-охранницы
Клетки-охранницы Говоря о той прогрессивной роли, которую сыграли первые наброски клеточной теории, нельзя не оговориться, что созданный ею образ «суверенных» клеток лишь в ограниченной степени приложим к организмам высших животных, хотя и здесь клетки подчас ведут
Клетки-коллективисты и клетки-одиночки
Клетки-коллективисты и клетки-одиночки В основе тесной кооперации клеток, входящих в состав многоклеточного организма, лежат по меньшей мере две важнейшие причины. Во-первых, каждая отдельно взятая клетка, будучи сама по себе на редкость умелым и исполнительным
1. Жизненный цикл клетки
1. Жизненный цикл клетки Непрерывность жизни на Земле обеспечивается размножением организмов — одним из важнейших проявлений жизни. Размножение обеспечивает передачу наследственной информации, преемственность поколений, увеличение численности организмов.
2. Хромосомный набор клетки
2. Хромосомный набор клетки Важная роль в клеточном цикле принадлежит хромосомам. Хромосомы — носители наследственной информации клетки и организма, содержащиеся в ядре. Они не только осуществляют регуляцию всех обменных процессов в клетке, но и обеспечивают передачу
3. Деление клетки
3. Деление клетки Способность к делению — это важнейшее свойство клетки. В результате деления из одной клетки возникают две новые. Одно из основных свойств жизни — самовоспроизведение — проявляется уже на клеточном уровне. Наиболее распространенным способом деления
Клетки, белки и гены
Клетки, белки и гены Жизнь есть способ существования белковых тел. Ф. Энгельс Наше тело является империей клеток, каждая из которых представляет собой миниатюрную фабрику для производства белков. Многие из этих важнейших макромолекул могут быть выделены из организма в
Бессмертные клетки
Бессмертные клетки Рождение и смерть часто воспринимаются нами как две стороны одной медали. Одно явление якобы неотделимо от другого. Появление на свет неизбежно влечет за собой старение и кончину. Между тем это не совсем так. Живая клетка, как своеобразная молекулярная
Анализ одной клетки
Анализ одной клетки Еще одним перспективным приемом анализа хромосом и даже отдельных генов будущего ребенка является так называемая преимплантационная диагностика при экстракорпоральном оплодотворении. Речь идет о случаях, когда врачи проводят оплодотворение
КЛЕТОЧНОЕ СТРОЕНИЕ ОРГАНИЗМОВ СТРОЕНИЕ КЛЕТКИ. ПРИБОРЫ ДЛЯ ИССЛЕДОВАНИЯ СТРОЕНИЯ КЛЕТКИ
КЛЕТОЧНОЕ СТРОЕНИЕ ОРГАНИЗМОВ СТРОЕНИЕ КЛЕТКИ. ПРИБОРЫ ДЛЯ ИССЛЕДОВАНИЯ СТРОЕНИЯ КЛЕТКИ 1. Выберите один наиболее правильный ответ.Клетка – это:A. Мельчайшая частица всего живогоБ. Мельчайшая частица живого растенияB. Часть растенияГ. Искусственно созданная единица для
3.7. Развитие грудной клетки
3.7. Развитие грудной клетки Грудную клетку составляют 12 пар ребер. Истинные ребра (первая – седьмая пары) с помощью хрящей соединяются с грудиной, из остальных пяти ложных ребер хрящевые концы восьмой, девятой и десятой пар соединяются с хрящом вышележащего ребра, а
3. Метаболизм бактериальной клетки
3. Метаболизм бактериальной клетки Особенности метаболизма у бактерий:1) многообразие используемых субстратов;2) интенсивность процессов метаболизма;3) направленность всех процессов метаболизма на обеспечение процессов размножения;4) преобладание процессов распада
18. Деление клетки. Митоз
18. Деление клетки. Митоз Вспомните!Как, согласно клеточной теории, происходит увеличение числа клеток?Как вы считаете, одинакова ли продолжительность жизни разных типов клеток в многоклеточном организме? Обоснуйте своё мнение.В момент рождения ребёнок весит в среднем