Избыточность и эволюционная пластичность
Избыточность и эволюционная пластичность
Как мы уже отмечали в главе 4, отбор на стабильность, т. е. фактически на постоянство и неизменность, парадоксальным образом повышает эволюционную пластичность (приспособляемость) организмов, т. е. склонность к изменениям. Механизм прост. Отбор поддерживает такие мутационные изменения генно-регуляторных сетей, которые повышают устойчивость развития. Устойчивость — это гарантия того, что у организма все ноги, глаза и прочие части тела будут на своих местах, невзирая на помехи, возникающие в ходе развития. Помехи бывают трех сортов: 1) изначальная стохастика в поведении клеток, о который говорилось выше; 2) мутации, нарушающие работу тех или иных внутриклеточных систем; 3) перемены внешних условий.
Самое важное, что любой регуляторный контур, защищающий от помех одного типа, как правило, будет защищать и от помех других типов. Например, если развился регуляторный контур, снижающий выработку вещества А, когда его концентрация превышает определенный порог, то этот контур будет защищать организм от перепроизводства вещества А независимо от того, по какой причине возникла угроза перепроизводства. Мутировал ли ген, отвечающий за синтез вещества А, или чисто случайно в ходе развития слишком много клеток начали его синтезировать, или его производство подскочило из-за перегрева — все равно стабилизирующий контур сработает и приведет уровень А к норме.
Развитие таких контуров, в свою очередь, способствует накоплению скрытой изменчивости. Мутации, эффекты которых были бы вредными в отсутствие этого контура, получают возможность свободно накапливаться.
Если стабилизирующий контур вдруг выйдет из строя из-за очень сильного внешнего воздействия или из-за мутации, вся эта накопленная скрытая изменчивость может стать явной. Если какое-то из проявившихся изменений окажется адаптивным в новых условиях, отбор начнет «собирать» новые стабилизирующие контуры уже вокруг этого измененного, нового фенотипа, постепенно делая его более стабильным.
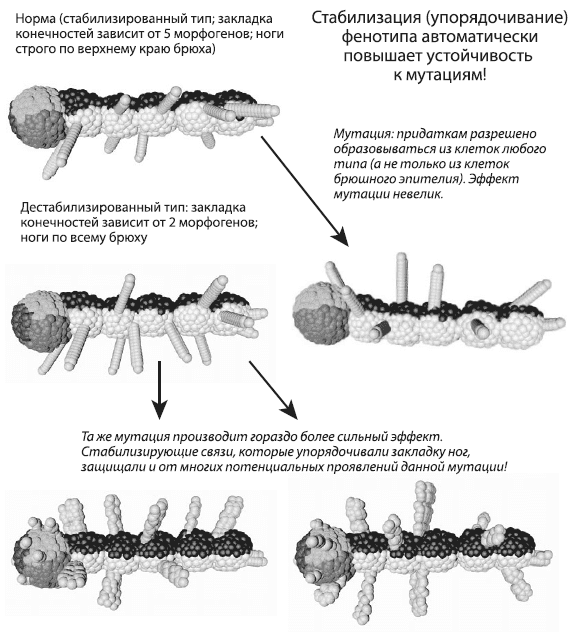
Взаимосвязь устойчивости к разным типам помех наглядно проявляется в программе EvoDevo. Например, чтобы добиться стабильного развития ног у сегментированного червячка, показанного на рисунке, нам пришлось поставить рост зачатков ног в зависимость от пяти морфогенов, образующих градиенты концентраций в сегментах тела. Без этой кажущейся «избыточности» ноги развивались сравнительно хаотично. Как бы мы ни старались, сегменты все равно получаются немного разными, поэтому в одних сегментах выручают одни, в других — другие регуляторы.
Внесем в этот стабилизированный генотип мутацию, меняющую алгоритм закладки конечностей. Исходно зачатки ног могли формироваться только из клеток брюшного эпителия (это клетки белого цвета). Мутация привела к тому, что они получили возможность формироваться из клеток любого типа (мы просто убрали условие «если ты клетка такого-то типа» из инструкции, руководящей превращением клеток в зачатки ног). Эффект мутации оказался на удивление невелик: ноги не выросли повсюду, как можно было бы ожидать. «Лишние» ноги появились только на спине, потому что во всех остальных частях организма не выполняются дополнительные условия, накладываемые регуляторными контурами. Так проявляется помехоустойчивость развития и универсальность стабилизирующих регуляторов. Мы ввели их в генотип, чтобы бороться с внутренней стохастикой онтогенеза, но они сгодились и для того, чтобы уменьшить чувствительность онтогенеза к мутациям.
Но возьмем менее стабилизированный генотип, в котором закладка конечностей зависит от концентрации только двух морфогенов, и внесем точно такую же мутацию — позволим конечностям развиваться из любых типов клеток. Хотя разница двух червячков с виду не так уж велика, но эффект мутации в этом случае оказался намного более серьезным. Расположение конечностей стало гораздо менее упорядоченным, ноги теперь выросли по всему телу, включая голову, и строение ног тоже изменилось — они стали толстые и кривые.
Мы даже не сразу поняли, почему ноги стали толстыми и кривыми. Как оказалось, дело в том, что теперь набор условий, необходимых для превращения клетки в зачаток ноги, стал время от времени выполняться и в самих растущих ногах, поэтому каждая такая толстая нога в действительности является несколькими сросшимися ногами.
Избыточные регуляторы — типичный пример адаптаций, которые поддерживаются отбором «для стабильности», но в конечном счете способствуют эволюционным изменениям.
Перейдем теперь от модели к реальности и познакомимся с недавно открытой группой таких «избыточных» регуляторов — теневыми энхансерами.
Майкл Левин и его коллеги из Калифорнийского университета в Беркли (США) много лет изучают работу генов — регуляторов раннего развития у дрозофил. Одним из таких генов является транскрипционный фактор Dorsal (DL), отвечающий за разделение брюшной и спинной стороны у ранних эмбрионов дрозофил. Исследования Левина с коллегами показали, что DL имеет сотни сайтов связывания, рассыпанных по всему геному, т. е. активирует экспрессию сотен генов. Сайты связывания DL входят в состав примерно 40 сложных энхансеров — комплексов из нескольких сайтов связывания ТФ (в широком смысле энхансером иногда называют и одиночный сайт связывания ТФ). Подтвердить функциональность энхансеров удалось с помощью трансгенных эмбрионов с удаленными участками ДНК. С помощью этих мутантов ученые выяснили, какие из нуклеотидных последовательностей действительно работают в качестве энхансеров, регулируемых белком DL.
Но оказалось, что у генов, подчиненных DL, может быть даже не по одному, а по два энхансера. Как правило, энхансеры находятся вблизи (в пределах нескольких тысяч пар нуклеотидов) начала белок-кодирующей части гена. Но в случае с DL-зависимыми генами их энхансеры могут располагаться и далеко, в десятках тысяч пар нуклеотидов от места начала транскрипции, и вблизи других, индифферентных к DL, генов или даже внутри них. Эти необычные энхансеры были названы теневыми. Соседние с теневыми энхансерами гены начинают экспрессироваться уже на более поздних стадиях развития, поэтому очевидно, что «ранний» транскрипционный фактор DL не имеет к ним отношения. Отключив основные энхансеры мутациями, ученые показали, что их скрытые двойники обеспечивают сходную картину экспрессии генов (т. е. теневые энхансеры дублируют функции основных).
Чтобы оценить изменчивость энхансеров, ученые построили эволюционные деревья по 12 близким видам дрозофил отдельно для теневых и основных регуляторных элементов. По длине ветвей получившихся деревьев оценили скорость мутирования у основных и теневых энхансеров. Оказалось, что теневые энхансеры мутировали в среднем в 1,6 раза чаще, чем основные.
Это значит, что теневые энхансеры более изменчивы и, таким образом, представляют больше материала для отбора. Они могут менять степень своего сродства к тем или иным ТФ, подстраивая системы организма к меняющимся условиям.
По-видимому, теневые энхансеры появляются в результате дупликаций некодирующих участков генома. Дублирование регуляторных участков ДНК позволяет «избыточным» участкам свободнее накапливать мутации — точно так же, как это происходит при дупликации целых генов. Бессмысленные мутации в дубликате не нарушат экспрессию подконтрольного гена, так как его нормальное функционирование поддерживается основными энхансерами. Полезные мутации при этом могут стать запасным вариантом или начать работать в нестабильных или новых условиях. По мнению Левина и его коллег, появление новой копии регуляторного участка может стать первым этапом формирования нового адаптивного признака или нового вида (Hong et al., 2008).
Поиск и выявление функций энхансеров требует применения самых «навороченных» молекулярных технологий и колоссальных усилий со стороны исследователей. Пока это очень сложный путь со множеством препятствий, но он помогает понять реальную роль регуляторных последовательностей в онтогенезе и эволюции.
Дальнейшие исследования подтвердили, что теневые энхансеры только кажутся избыточными. На самом деле (как читатели, конечно, уже догадались) они нужны для того, чтобы сделать развитие более помехоустойчивым.
Теневой энхансер обычно срабатывает (т. е. включает свой ген) в тех же клетках эмбриона и в то же время, что и основной энхансер. Такое дублирование генной регуляции, как мы уже знаем, способствует эволюционным преобразованиям. Впрочем, существование теневых энхансеров нельзя объяснить только тем, что они дают больше свободы для эволюционных изменений. Естественный отбор не умеет заглядывать в столь отдаленное будущее. Теневые энхансеры должны выполнять какую-то полезную функцию здесь и сейчас, иначе они бы разрушились под грузом мутаций и не встречались бы с таким постоянством около генов — регуляторов онтогенеза.
Выяснить эту функцию удалось американским и французским генетикам в ходе изучения гена svb (shavenbaby), который управляет формированием щетинок у личинки дрозофилы (Frankel et al., 2010). Название гена, означающее в переводе «бритый младенец», показывает, что происходит, если ген выходит из строя. Регуляторная область гена svb принимает «входные сигналы» от нескольких генно-регуляторных каскадов. В результате совместного действия нескольких ТФ, связывающихся с расположенными в этой области сайтами связывания, ген svb включается в тех клетках эмбрионального эпидермиса, которые должны дать начало щетинкам.
В некодирующей области длиной в 50 тыс. пар нуклеотидов перед геном svb расположены три энхансера: 7, E и A. Их работа была изучена ранее (о методах поиска энхансеров мы говорили в главе 5 в разделе «Загадка узорчатых крыльев»). Совместное действие энхансеров 7, E и A полностью объясняет распределение областей экспрессии svb в эпидермисе эмбриона: ген включается там, где срабатывает хотя бы один из трех энхансеров.
Казалось бы, ген svb не нуждается ни в каких дополнительных регуляторах, кроме энхансеров 7, E и A. Однако ученые обнаружили, что у него есть два теневых энхансера, расположенных на большем удалении от кодирующей части гена. Эти энхансеры получили название DG2 и Z. Функция новооткрытых энхансеров полностью перекрывается с функцией трех регуляторных элементов, известных ранее (см. рисунок).
Как показали генно-инженерные эксперименты, оба теневых энхансера эффективно работают (т. е. включают присоединенный к ним ген там, где должны образоваться щетинки) у тех видов дрозофил, у которых есть щетинки этого типа (D. melanogaster, D. simulans) и не работают (испорчены мутациями) у вида, который в ходе эволюции эти щетинки утратил (D. sechellia). Три «обычных» энхансера у последнего вида тоже не работают.
Зачем нужны «избыточные» энхансеры? Чтобы ответить на этот вопрос, исследователи удалили из генома мух участок, содержащий теневые энхансеры. Это почти не повлияло на развитие щетинок: изменились только мелкие детали их строения. На здоровье личинок это не отразилось вовсе. Тем самым, казалось бы, подтвердилось предположение об избыточности теневых энхансеров. Однако дальнейшие эксперименты показали, что эта «избыточность» имеет важное приспособительное значение: она повышает стабильность эмбрионального развития в неблагоприятных условиях.
Личинки с удаленными теневыми энхансерами развиваются нормально только при температуре, оптимальной для личинок дрозофил (25 °C). Если же понизить температуру до 17 °C или повысить до 32 °C, то щетинки у мутантных личинок развиваются хуже. Ген svb удобен для таких исследований, потому что число щетинок на том или ином участке эпидермиса в точности отражает уровень экспрессии этого гена. Нормальные личинки, из генома которых теневые энхансеры не были удалены, имеют одинаковое количество щетинок при любой температуре от 17 до 32 °C. Дополнительные эксперименты подтвердили, что теневые энхансеры стабилизируют онтогенез, обеспечивая высокий уровень экспрессии гена svb независимо от колебаний температуры.
Нормальный ход развития может быть нарушен не только внешними неблагоприятными воздействиями, но и внутренними — например, мутациями важных регуляторных генов. Могут ли теневые энхансеры защитить работающий ген и от таких помех? Чтобы проверить это, авторы использовали мух, гетерозиготных по мутации, выводящей из строя важнейший регуляторный ген wingless. Ген svb находится под контролем нескольких регуляторных генов, в том числе wingless.
Оказалось, что для мух, у которых одна из двух копий wingless не работает, наличие теневых энхансеров является необходимым условием формирования нормальных щетинок. Если теневые энхансеры удалены, щетинки развиваются значительно хуже. Таким образом, теневые энхансеры обеспечивают устойчивую работу гена svb не только при колебаниях температуры, но и при мутационном повреждении вышестоящего генно-регуляторного каскада.
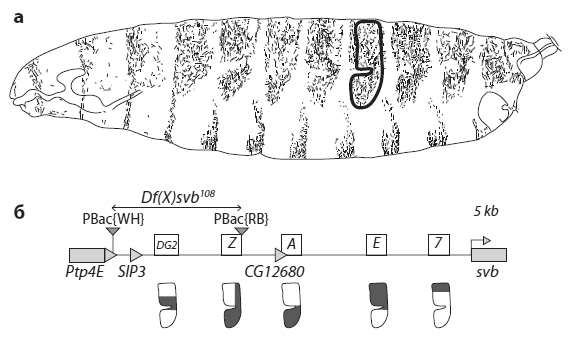
Регуляторный участок гена svb и области действия энхансеров. a — личинка дрозофилы, вид сбоку. Темным цветом показаны места, где развиваются щетинки. Ген svb управляет развитием одного из типов щетинок, которые занимают на каждом сегменте определенную область. На одном из брюшных сегментов эта область обведена черным контуром. б — расположение энхансеров в регуляторной области гена svb. Серый прямоугольник в правой части схемы — это начало (первый экзон) кодирующей части гена svb. Левее находятся три обычных энхансера (7, E, A), еще левее — два теневых энхансера (Z, DG2). Фигура, нарисованная под каждым энхансером, соответствует области формирования щетинок, которая обведена на верхнем рисунке. Для каждого энхансера показан район в пределах этой области, в котором он срабатывает. Из Frankel et al., 2010.
Теневые энхансеры с «избыточными» функциями обнаружены в окрестностях многих генов — регуляторов развития не только у дрозофил, но и у мышей. Очень может быть, что это общее свойство всех животных. Адаптивное значение помехоустойчивости онтогенеза очевидно. Поэтому отбор, как правило, должен способствовать закреплению мутаций, ведущих к росту независимости результатов развития от возмущающих воздействий. Появление дополнительных энхансеров (например, в результате дупликации регуляторных участков ДНК) является одним из самых простых (вероятных) путей достижения этой цели.
Разумеется, теневые энхансеры и другие «избыточные» регуляторы — не единственный механизм повышения помехоустойчивости онтогенеза. Этой же цели могут служить, например, контуры отрицательной обратной связи в геннорегуляторных сетях (Колчанов, Суслов, 2006), белки-шапероны и микро-РНК (Li et al., 2009).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
2.5. Эволюционная биология и систематика
2.5. Эволюционная биология и систематика Теоретические положения эволюционной биологии имеют основополагающее значение для принципов систематики. Вне систематики нет биологии. Без учета систематики не может рассматриваться ни одна биологическая проблема, в том числе и
11.5. Эволюционная психология
11.5. Эволюционная психология Эволюционная психология – это единственное направление в психологии, в котором адекватно отражены достижения генетики и эволюционной биологии. Сильной ее стороной является междисциплинарный подход. Анализ взаимодействия биологического и
Помехоустойчивость и избыточность
Помехоустойчивость и избыточность Если онтогенез по умолчанию нестабилен, возникает вопрос, почему же у реальных организмов мы видим, как правило, довольно точное соответствие между генотипом и фенотипом. Многим фенотипическим различиям между особями соответствуют
Эволюционная эстетика
Эволюционная эстетика Если эволюционная этика (область эволюционной психологии, занимающаяся происхождением морали и нравственности)[71] уже стала признанным научным направлением (28800 результатов поиска в Google по фразе evolutionary ethics), то об эволюционной эстетике широкой
Как определить оптимальность (недостаточность, избыточность) массы своего веса?
Как определить оптимальность (недостаточность, избыточность) массы своего веса? Для определения нормальной массы тела обычно пользуются формулой, предложенной еще в XIX веке известным французским антропологом Полем Брока (1824–1880): идеальный вес в килограммах равен росту
6. ПЛАСТИЧНОСТЬ РЕАЛИЗАЦИИ НАСЛЕДСТВЕННОЙ ИНФОРМАЦИИ И ПРОБЛЕМА «ИМПРЕССИНГА»
6. ПЛАСТИЧНОСТЬ РЕАЛИЗАЦИИ НАСЛЕДСТВЕННОЙ ИНФОРМАЦИИ И ПРОБЛЕМА «ИМПРЕССИНГА» Если перейти от содержания наследственной информации к ее реализации (даже если речь идет о самых элементарных, биохимических или морфологических особенностях), то в каждой данной ситуации, в
Пластичность поведения простейших
Пластичность поведения простейших Как мы видим, и в моторной и в сенсорной сфере поведение достигает у ряда видов простейших известной сложности. Достаточно указать на фобическую реакцию (реакцию испуга) туфельки в вышеописанном примере клинотаксиса: наткнувшись на
Пластичность поведения
Пластичность поведения Поведение кольчатых червей, как и других низших беспозвоночных, характеризуется малой пластичностью, консервативностью. Господствуют врожденные стереотипы («врожденные программы поведения»). Индивидуальный опыт, научение, играет в жизни этих
Ригидность и пластичность в поведении высших позвоночных
Ригидность и пластичность в поведении высших позвоночных Как уже указывалось, вопреки еще распространенному мнению инстинктивное поведение не теряет своей значимости в процессе эволюции, так как оно принципиально не может замещаться научением. Подчеркнем еще раз, что
Глава 16: Эволюционная этика
Глава 16: Эволюционная этика Другой вопрос — что желательно преподавать, — все согласны с общей утилитарностью. Старые и бесполезные заметки (недатировано) Значит, наше происхождение — источник наших злых страстей!! Дьявол в обличье бабуина — вот наш прадед. Записная
Склонность к имитации и пластичность поведения представителей поведенческого типа Б
Склонность к имитации и пластичность поведения представителей поведенческого типа Б Способность к социальному обучению различна у представителей разных психологических типов. Еще одним преимуществом особей психологического типа Б является высокая склонность
Пластичность женщин и ригидность мужчин
Пластичность женщин и ригидность мужчин Главные различия в психике и поведении представителей разных полов в том, что женщины пластичны, а мужчины ригидны.Ригидность – это свойство, противоположное пластичности. Мы не используем русскую кальку «твердость» из-за
Глава 1 ФАНТОМНЫЕ КОНЕЧНОСТИ И ПЛАСТИЧНОСТЬ МОЗГА
Глава 1 ФАНТОМНЫЕ КОНЕЧНОСТИ И ПЛАСТИЧНОСТЬ МОЗГА Обожаю дурацкие эксперименты. Я сам их всегда ставлю. Чарльз Дарвин Ещё будучи студентом-медиком, я осматривал пациентку по имени Михи во время моей практики в неврологическом отделении. Стандартное клиническое
Пластичность головного мозга: воздействие окружающей среды
Пластичность головного мозга: воздействие окружающей среды У новорожденного ребенка мозг примерно вчетверо меньше, чем у взрослого человека. Размеры нейронов мозга увеличиваются, а характер нервных связей и сетей усложняется по мере роста ребенка, его общения с людьми
2. Эволюционная теория Ж. Б. Ламарка
2. Эволюционная теория Ж. Б. Ламарка Вспомните!Что такое эволюция?Чем объясняется господство представлений о неизменности видов в эпоху К. Линнея?В конце XVIII в. большинство учёных было готово принять идею об изменяемости видов. Продолжалось активное накопление научных