Изменения белков[43]
Изменения белков[43]
Те участки генома, которые кодируют белки, изменились на удивление мало. Различия в аминокислотных последовательностях белков у человека и шимпанзе составляют значительно менее 1 %, да и из этих немногочисленных различий большая часть либо не имеет функционального значения, либо это значение остается неизвестным. Лишь в отдельных случаях удалось выдвинуть обоснованные гипотезы о возможной функциональной роли произошедших изменений.
Один из самых известных примеров связан с геном FOXP2, получившим (несколько преждевременно) броское прозвище «ген речи». У млекопитающих этот ген крайне консервативен. Например, у мыши белок, кодируемый геном FOXP2 (белок называется FOXP2 — прямым шрифтом, а не курсивом), отличается от обезьяньего аналога всего одной аминокислотной заменой. Столь высокий консерватизм означает, что возникающие в результате мутаций изменения аминокислотной последовательности этого белка почему-то почти всегда оказываются вредными дня млекопитающих и отсеиваются отбором. Однако человеческая версия FOXP2 отличается от шимпанзиного аналога целыми двумя аминокислотными заменами! Определенно, тут произошло что-то важное.
При этом известно, что мутации в гене FOXP2 приводят к серьезным нарушениям членораздельной речи. Чтобы нормально разговаривать, человеку необходима нормальная (не испорченная мутацией) версия этого гена. У других животных этот ген, возможно, выполняет сходные функции. Например, недавно было показано, что активность гена FOXP2 у певчих птиц резко снижается во время пения, причем именно в том отделе мозга, который отвечает за пение (Teramitsu, White, 2006). Напрашивается предположение, что замена двух аминокислот в человеческой эволюционной линии была связана с развитием способности к произнесению членораздельных звуков[44] (Vernes et al., 2006). Но какую именно функцию выполняет FOXP2 в мозге? Вплоть до недавнего времени о нем было известно лишь то, что он является транскрипционным фактором, то есть белком, регулирующим экспрессию (интенсивность работы, уровень активности) каких-то генов.
Если бы с высшими приматами можно было проводить генно-инженерные эксперименты, вопрос был бы решен быстро. Пересадили бы шимпанзе человеческий FOXP2 и посмотрели бы, не удастся ли научить генно-модифицированную обезьяну разговаривать (шимпанзе можно научить разговаривать на уровне двух- или даже трехлетнего ребенка, но не голосом, а жестами или специальными значками-символами, см.: Зорина, Смирнова, 2006). А еще пересадили бы человеку шимпанзиный FOXP2 и тоже посмотрели бы, что получится. Но с высшими приматами, слава гуманизму, такие опыты проводить нельзя.
Остаются мыши. Вольфганг Энард и его коллеги из Института Макса Планка (Лейпциг, Германия) вывели трансгенных мышей с человеческим геном FOXP2. Трансгенные мыши выросли вполне здоровыми, хотя некоторыми чертами отличались от нормальных мышей. В числе отличий авторы называют удлинение дендритов (входных, принимающих сигналы отростков нейронов) и увеличение синаптической пластичности[45] в полосатом теле, или стриатуме. Это как раз та часть мозга, работа которой меняется у людей с мутантным геном FOXP2. У мышей также снизилась исследовательская активность и общий уровень дофамина в мозге. Самое забавное, что у них к тому же изменились голосовые сигналы — характерные мышиные ультразвуковые вокализации (Enard et al., 2009). Эти результаты показывают, что изменения гена FOXP2, произошедшие в человеческой эволюционной линии, вероятно, оказали комплексное влияние на работу мозга.
В другом недавнем исследовании, выполненном американскими генетиками, многообразие функций FOXP2 было продемонстрировано с еще большей ясностью (Konopka et al., 2009). Работа была основана на множестве биохимических и генетических методов, которые в совокупности позволили выявить различия в составе генов и белков, связанных с экспрессией гена FOXP2 у человека и шимпанзе. Во-первых, трансгенным путем были выведены культуры предшественников нервных клеток человека, у которых вместо человеческого FOXP2 работал шимпанзиный аналог с соответствующими двумя аминокислотными заменами. Далее сравнили экспрессию всех остальных генов в нормальных и трансгенных клетках. Ясно, что разница в экспрессии генов в двух культурах в данном случае должна быть отнесена на счет различий в гене FOXP2 (естественно, исследователи имели в распоряжении несколько трансгенных и контрольных линий для статистики).
Выяснилось, что шимпанзиный FOXP2 производится активнее, то есть в клетках его больше, чем человеческого. Кроме того, в культурах с шимпанзиным и человеческим FOXP2 различается активность 116 генов: в человеческом варианте 61 ген демонстрирует повышенную экспрессию, а 55 генов — пониженную. Некоторые из этих генов являются прямыми генами-мишенями FOXP2, то есть FOXP2 связывается непосредственно с регуляторными участками этих генов, чтобы регулировать их активность. Для других FOXP2 является косвенным регулятором, действуя опосредованно через другие гены. Действительно, оказалось, что регуляторные участки некоторых генов из этого массива по-разному (с разной частотой или вероятностью) связывались с человеческим и шимпанзиным FOXP2.
В итоге ученым удалось получить схему генно-регуляторной сети, «завязанной» на FOXP2. В схему были включены гены, которые изменяют свою работу в зависимости от модификации FOXP2.
Раньше было показано, что гены DLX5 и SYT4 — а они являются важными узлами на этой схеме — регулируют развитие и нормальную работу мозга. Теперь понятно, что эти гены представляют часть сложной регуляторной сети. В ее составе оказались и некоторые гены, мутации в которых вызывают тяжелые наследственные заболевания. К ним относится, например, ген PPP2R2B, дефекты которого приводят к расстройству речи. Также в этой схеме присутствуют гены, для которых, как и для FOXP2, доказано действие положительного (движущего) отбора[46] в человеческой линии. К таким генам относится ген АМТ. Отличия нуклеотидных последовательностей этого гена от обезьяньих аналогов весьма значительны. Можно предположить, что имела место сопряженная ускоренная эволюция части регуляторного каскада, приведшая к важным «человеческим» изменениям в работе мозга.
Все эти результаты были получены на культурах зародышевых предшественников нервных клеток, но не сформированных клеток взрослых индивидуумов. Понятно, что во «взрослых» нервных клетках, которые, собственно, работают у человека говорящего, все может быть несколько иначе. Ученые, предвидя это возражение, провели дополнительное исследование. Они оценили экспрессию генов в тканях различных участков мозга у взрослых людей и шимпанзе и сравнили с результатами, полученными для соответствующих клеточных культур (клеточные культуры с геном шимпанзе сравнивали с мозгом взрослого шимпанзе, а культуры с человеческим геном — с человеческим мозгом). Выяснилось, что картина экспрессии генов в культурах клеток практически такая же, как и в тканях взрослого мозга. Сходство оказалось высоким и для человеческих клеток, и для клеток с геном шимпанзе.
Эта работа, как и целый ряд других, показала, что различия между человеком и нечеловеческими обезьянами нельзя объяснить только различиями в белок-кодирующих последовательностях. Огромную роль играют изменения в регуляторных участках генов, от которых зависит, какими белками будет регулироваться активность данного гена, в каких тканях и при каких условиях ген будет работать активнее или слабее. Самые важные человеческие признаки, в том числе связанные с работой мозга, формируются за счет изменения регуляции и количественных различий в экспрессии генов. Ген FOXP2 оказался важнейшим регуляторным фактором, влияющим на экспрессию целого комплекса генов, участвующих в развитии и работе мозга. Среди множества отдаленных (опосредованных) эффектов этого гена-регулятора находится и контроль работы мышц, участвующих в формировании речи. Но, несмотря на закрепившуюся репутацию руководителя речи, ген FOXP2 выполняет и другие важные функции в клетках мозга. В результате проведенных исследований сегодня мы можем уверенно утверждать, что человеческий вариант FOXP2 с его двумя значимыми нуклеотидными заменами — один из важных «генов человечности», изменения которого сыграли существенную роль в становлении человека. Крайне интересно, что у неандертальца ген FOXP2, как недавно выяснилось, был точно такой же, как у современного человека. Это можно рассматривать как серьезный аргумент в пользу того, что неандертальцы, а также общие предки неандертальцев и сапиенсов — гейдельбергские люди, носители позднеашельской культуры, — владели речью.
Помимо изучения отдельных генов и белков генетики часто используют более глобальный подход, анализируя сразу большие группы генов, объединенных каким-то общим свойством. Например, сравнивают человеческие и шимпанзиные варианты генов, так или иначе связанных с онкологией (это важно, чтобы понять, почему шимпанзе, в отличие от людей, почти не болеют раком). Аналогичным образом сравнивались и гены, связанные с развитием мозга. При этом удалось показать, что у приматов в целом эволюция этих генов идет заметно быстрее, чем, к примеру, у грызунов.
Подобные исследования разом выявляют десятки и сотни генетических различий между человеком и его ближайшими родственниками. Особенно «перспективными» считаются те гены, в которых удается обнаружить следы действия положительного (движущего) отбора. Такие следы свидетельствуют о том, что изменения, произошедшие в данном гене, были действительно важны для наших предков, повышали их репродуктивный успех и поддерживались отбором. Одним из надежных признаков действия положительного отбора является повышенная доля значимых нуклеотидных замен по отношению к незначимым, или синонимичным (напомню, что значимые нуклеотидные замены — те, что приводят к замене аминокислоты в кодируемом белке).
Еще один признак — пониженный нейтральный полиморфизм в окрестностях того участка ДНК, на который действовал положительный отбор. Это требует объяснений. Представьте для начала, что данный участок ДНК не подвергается действию положительного отбора. Допустим, на него действует отрицательный (очищающий) отбор — отбраковка всех возникающих значимых замен. Тогда в этом участке и рядом с ним будут свободно накапливаться нейтральные, то есть не влияющие на фенотип замены (синонимичные замены — это подмножество нейтральных). В результате в генофонде популяции будет накапливаться нейтральный полиморфизм (разнообразие). Генотипы разных особей будут отличаться друг от друга по нейтральным заменам в окрестностях интересующего нас участка. Теперь предположим, что у одной из особей в этом участке возникла полезная значимая замена. Раз мутация полезная, значит, ее будет поддерживать отбор. Эта особь и те из ее потомков, которые унаследуют эту мутацию, будут размножаться быстрее остальных. В результате полезная мутация начнет распространяться (повышать свою частоту) в генофонде популяции. Фокус тут в том, что вместе с полезной мутацией автоматически будут распространяться и те нейтральные замены, которые находились в ее окрестностях у той особи, у которой полезная мутация впервые возникла. Чем ближе находится нейтральная замена к полезной, поддерживаемой отбором, тем теснее она с ней «сцеплена», пользуясь языком генетиков. В результате одни нейтральные замены — те, которым повезло оказаться рядом с полезной — начнут вытеснять из генофонда все остальные нейтральные замены, встречающиеся в этом участке ДНК. Как следствие, в масштабе популяции нейтральный полиморфизм в этом участке снизится. Заметив в каком-то участке хромосомы пониженный уровень нейтрального полиморфизма, генетик имеет полное право заподозрить, что где-то в этом участке не очень давно возникла полезная мутация, распространившаяся под действием положительного отбора. «Не очень давно» — потому что после того, как положительный отбор прекратит свое действие (например, потому, что полезная мутация уже достигла 100 %-й частоты), в этом участке ДНК снова начнется свободное накопление нейтрального полиморфизма. Через какое-то время признаки действия положительного отбора могут быть полностью стерты.
Раскрытие биологического смысла обнаруженных генетических различий между человеком и шимпанзе и следов действия положительного отбора — отдельная, очень сложная задача, как видно из рассмотренного примера с FOXP2. Обычно ее решение откладывается на потом. Когда наступит это «потом», сказать трудно. К сожалению, науке еще далеко до четкого понимания связей между генотипом и фенотипом. Как правило, мы не знаем, как те или иные генетические различия сказываются на развитии и строении взрослого организма, а выяснять это долго, трудно и дорого. Поэтому сейчас многие генетики предпочитают заниматься масштабными «скринингами», во время которых генетические отличия человека от шимпанзе вылавливаются сотнями, но не осмысливаются, а только приблизительно сортируются по степени «перспективности».
К числу «особо перспективных» генов, выловленных таким способом, относятся ASPM и microcephalin. В них обнаружены явные следы действия отбора, а их связь с развитием мозга подтверждается тем, что мутации в них приводят к микроцефалии. Показано, что белок ASPM замедляет превращение эмбриональных стволовых нейроэпителиальных клеток в нейроны. Иными словами, клетки — предшественники нейронов в присутствии ASPM успевают поделиться большее число раз, прежде чем превратятся в нейроны, которые уже не могут делиться.
—————
Ген microcephalin указывает на древнюю гибридизацию сапиенсов с другими видами людей
Как мы помним, люди современного типа (Homo sapiens) появились в Африке не позднее 195 тыс. лет назад. Впоследствии часть их вышла из Африки (о датировке этого исхода мы поговорим в главе «Великое расселение сапиенсов»). Сапиенсы заселили сначала Южную Азию, затем Австралию, Европу и, наконец, Америку. Расселялись они не по безлюдным местам — в Евразии жили представители других человеческих популяций, потомков более древних волн расселения из африканской прародины.
Мы уже упоминали об острой дискуссии по поводу того, имела ли место гибридизация между сапиенсами, вышедшими из Африки, и древним евразийским населением. В течение почти 20 лет преобладала точка зрения об отсутствии гибридизации, однако начиная с середины 2000-х годов чаша весов начала склоняться в противоположную сторону. Один из весомых аргументов в пользу того, что наши предки все-таки скрещивались с представителями коренного населения Евразии, получил американский генетик Брюс Лан с коллегами из Чикагского университета. Исследователи в течение ряда лет изучали человеческий ген microcephalin, мутации которого приводят к микроцефалии. Этот ген привлек к себе пристальное внимание, поскольку выяснилось, что он быстро эволюционировал у человеческих предков после того, как они обособились от предков шимпанзе. Сочетание двух этих особенностей (связь с ростом мозга и быстрая эволюция в человеческой линии) сделало ген microcephalin одним из самых популярных объектов у генетиков, занимающихся поиском генетических основ человеческой уникальности.
В сентябре 2005 года Лан и его коллеги опубликовали в журнале Science первые результаты своих исследований (Evans et al., 2005). Они показали, что самая распространенная группа близкородственных вариантов (аллелей) гена microcephalin появилась в человеческой популяции всего 37 тыс. лет назад и очень быстро распространилась — очевидно, под действием положительного отбора. Ученые сделали вывод, что эта группа вариантов (которую они назвали группой D от слова derived, «производный») давала какое-то важное преимущество своим носителям, что и обусловило ее быстрое распространение.
Сначала ученые предполагали, что группа D появилась в результате мутаций одного из более древних вариантов гена, встречавшихся у сапиенсов. Это видно, в частности, по названию derived. Однако дальнейшие исследования показали, что происхождение D-аллелей было, вероятно, куда более драматическим (Evans et al., 2006).
Ученые определили последовательность нуклеотидов большого фрагмента гена microcephalin у 89 человек из разных регионов мира, получив таким образом 178 последовательностей (мы ведь помним, что большинство генов у каждого человека присутствует в виде двух копий, одна из которых получена от матери, другая — от отца). Оказалось, что в этой выборке имеется 86 различающихся аллелей. 124 из 178 последовательностей (70 %) относятся к группе D.
«Время схождения» всех вариантов, входящих в группу D, составляет около 37000 лет. Иными словами, все эти варианты происходят от одного предкового аллеля, который был частью генома какого-то нашего пращура, жившего 37 тыс. лет назад.
Попарное сравнение D-аллелей с другими (не-D-аллелями), а также не-D-аллелей между собой дало удивительные результаты. Между D- и не-D-аллелями обнаружились глубокие различия. Оказалось, что общий предок всех носителей не-D-аллелей жил около миллиона лет назад, а общий предок носителей D- и не-D-аллелей — примерно 1,7 млн лет назад (см. рисунок).
Получилась парадоксальная картина: с одной стороны, D-аллели появились и стали быстро распространяться в человеческой популяции лишь 37 тыс. лет назад, с другой, разделение эволюционных линий D- и не-D-аллелей произошло 1,7 млн лет назад. Если бы D-аллели появились в результате мутаций внутри популяции H. sapiens, следовало бы ожидать, что время разделения D- и не-D-аллелей окажется сопоставимым с временем начала дивергенции (расхождения) D-аллелей (около 37 тыс. лет).
При помощи статистических тестов и моделирования авторы показали, что наблюдаемая картина не может быть объяснена на основе гипотезы о единстве предковых популяций — носителей D- и не-D-аллелей. Эти популяции, несомненно, долгое время существовали изолированно друг от друга. По приблизительной оценке, изоляция скорее всего возникла около 1,1 млн лет назад, но не позднее, чем 530 тыс. лет назад. В одной из изолированных популяций закрепились D-аллели, в другой — не-D-аллели, а потом произошло смешение популяций.
Теоретически здесь возможны два альтернативных сценария: либо две популяции просто объединились и смешались, либо популяция Homo sapiens 37 тыс. лет назад получила от какой-то другой популяции, с которой ранее не было генетического обмена, полезный аллель D в результате эпизодического скрещивания, и этот аллель благодаря своей полезности быстро распространился. В первом случае в человеческом геноме должно быть множество генов с такой же генеалогией, как у гена microcephalin. Авторы проверили это предположение, проанализировав базы данных по полиморфизму человеческих генов, и пришли к выводу, что ничего подобного не наблюдается.
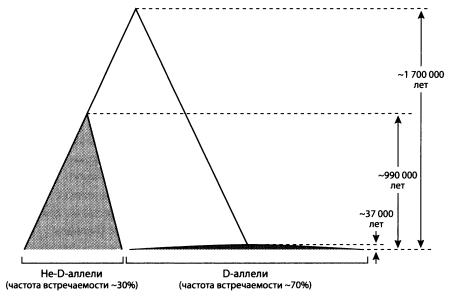
Реконструированная генеалогия аллелей гена microcephalin. По рисунку из Evans et al., 2006.
Таким образом, по мнению авторов, возможно только одно правдоподобное объяснение наблюдаемой картины. Популяция Homo sapiens 37 тыс. лет назад получила D-аллель гена microcephalin в результате скрещивания с представителем какой-то другой популяции гоминид, с которой до этого не было активного обмена генами в течение полумиллиона лет или более. Аллель оказался полезным и быстро распространился.
Кто были эти другие гоминиды? Возможно, неандертальцы, с которыми наши прямые предки в то время проживали на одной территории в Европе. Вычисленное авторами время возникновения изоляции между нашими предками и «носителями D-аллелей» (530 тыс. лет или более) примерно совпадает с предполагаемым временем расхождения сапиенсов и неандертальцев. Забегая вперед, скажу, что в прочтенном недавно неандертальском геноме D-аллель не обнаружен (но, может быть, он встречался не у всех, а только у некоторых неандертальцев — ведь и у современных людей он есть не у каждого).
Авторы отмечают, что вышедшие из Африки сапиенсы были чужаками в Евразии, заселенной древними представителями рода Homo. Эти последние наверняка были в чем-то лучше приспособлены к местным условиям. Да и по каким-то аспектам умственного развития они тоже могли опережать африканцев. И сапиенсы, скрещиваясь с аборигенами, вполне могли позаимствовать у них кое-какие полезные гены. Авторы предположили, что D-аллель микроцефалинового гена, скорее всего, не единственный случай такого рода. Должны найтись и другие гены, полученные нашими предками от других видов Homo. Это предположение блестяще подтвердилось в результате прочтения полных ядерных геномов неандертальцев и денисовцев, о чем будет сказано ниже.
Ходят слухи, что дальнейшее расследование детективной истории с микроцефалиновым геном сейчас приостановлено. Почему? Возможно, в связи с неполиткорректными выводами, которые начали намечаться. Частота встречаемости D-аллелей гена microcephalin у коренного населения разных регионов мира оказалась разной. Иначе и не могло быть, если эти аллели были получены в результате эпизодического скрещивания в период, когда сапиенсы уже активно расселялись по Старому Свету. Максимальная встречаемость отмечена у американских индейцев, минимальная — у некоторых африканских народов, таких как пигмеи (средняя частота по всему человечеству — около 70 %). Если журналисты раздули бы эту историю (вкупе с недоказанным пока предположением, что D-аллели положительно влияют на интеллект), пигмеи могли бы обидеться, а индейцы — возгордиться. Конечно, жаль, что подобные проблемы до сих пор могут притормаживать развитие некоторых научных направлений. Но, возможно, и вправду лучше кое-что отложить до тех пор, пока расизм и национализм не станут для нас такими же давно забытыми, допотопными «ужастиками», как гастрономический каннибализм наших далеких предков. Надеюсь, ждать придется не очень долго.
—————
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Глава 2. Молекулярная архитектура белков
Глава 2. Молекулярная архитектура белков Не будем скрывать: покончив с первой главой, авторы (а возможно, и читатель) испытали некоторое облегчение. В конце концов цель ее заключалась лишь в том, чтобы дать читателю сведения, необходимые для понимания последующих глав,
Генеалогическое древо (свидетельство белков)
Генеалогическое древо (свидетельство белков) Генеалогическое древо (свидетельство белков)Различия в белках двух видов отражают эволюционные изменения этих видов после их отделения от общего предка. Анализ показывает, что между альбуминами кровяных сывороток шимпанзе
Вселенная древних белков продолжает расширяться
Вселенная древних белков продолжает расширяться В 2010 году журнал Nature опубликовал интересную статью об эволюционном движении белков по ландшафтам приспособленности (Povolotskaya, Kondrashov, 2010). Авторы работы решили сравнить аминокислотные последовательности 572 древних белков,
Изменения активности генов
Изменения активности генов Эволюция животных в целом и приматов в частности протекает не столько за счет изменения структуры белок-кодирующих генов, сколько за счет изменения их активности. Небольшое изменение в верхних этажах иерархически организованных
Глава 2. Строение и функции белков
Глава 2. Строение и функции белков Белки – высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных в полипептидные цепи с помощью пептидных связей, и имеющие сложную структурную организацию.История изучения белковВ 1728 г.
Уровни структурной организации белков
Уровни структурной организации белков Первичная структура – строго определенная линейная последовательность аминокислот в полипептидной цепочке.Стратегические принципы изучения первичной структуры белка претерпевали значительные изменения по мере развития и
Функционирование белков
Функционирование белков Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от всех остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных
Посттрансляционные изменения белков
Посттрансляционные изменения белков Многие белки синтезируются в неактивном виде (предшественники) и после схождения с рибосом подвергаются постсинтетическим структурным модификациям. Эти конформационные и структурные изменения полипептидных цепей получили
Глава 23. Обмен аминокислот. Динамическое состояние белков организма
Глава 23. Обмен аминокислот. Динамическое состояние белков организма Значение аминокислот для организма в первую очередь заключается в том, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и
Переваривание белков в желудочно-кишечном тракте
Переваривание белков в желудочно-кишечном тракте Переваривание белков начинается в желудке под действием ферментов желудочного сока. За сутки его выделяется до 2,5 литров и он отличается от других пищеварительных соков сильно кислой реакцией, благодаря присутствию
Расщепление белков в тканях
Расщепление белков в тканях Осуществляется с помощью протеолитических лизосомальных ферментов катепсинов. По строению активного центра выделяют цистеиновые, сериновые, карбоксильные и металлопротеиновые катепсины. Роль катепсинов:1. создание биологически активных
Роль печени в обмене аминокислот и белков
Роль печени в обмене аминокислот и белков Печень играет центральную роль в обмене белков и других азотсодержащих соединений. Она выполняет следующие функции:1. синтез специфических белков плазмы: - в печени синтезируется: 100 % альбуминов, 75 – 90 % ?-глобулинов, 50 %
Характеристика белков сыворотки крови
Характеристика белков сыворотки крови Белки системы комплемента – к этой системе относятся 20 белков, циркулирующих в крови в форме неактивных предшественников. Их активация происходит под действием специфических веществ, обладающих протеолитической активностью.
9.4.1. Циклические изменения
9.4.1. Циклические изменения Циклические изменения сообществ отражают суточную, сезонную и многолетнюю периодичность внешних условий и проявления эндогенных ритмов организмов.Суточные преобразования в биоценозах обычно выражены тем сильнее, чем значительнее разница
8.2.1. Изменения климата
8.2.1. Изменения климата В настоящее время ни одну из рассмотренных версий происхождения Позднепермского и Позднетриасского кризисов (внутренние причины или удар астероида) нельзя считать доказанной окончательно. Однако осознание того, что и без вмешательства со стороны
Изменения в науке
Изменения в науке Суть научной деятельности не совсем такова, как она представляется нам. Мы привыкли считать, что развитие науки – это прямая дорога к постижению научных истин, путь, на котором постепенно накапливаются новые знания и расширяется круг рассматриваемых