Глава 2. Молекулярная архитектура белков
Глава 2. Молекулярная архитектура белков
Не будем скрывать: покончив с первой главой, авторы (а возможно, и читатель) испытали некоторое облегчение. В конце концов цель ее заключалась лишь в том, чтобы дать читателю сведения, необходимые для понимания последующих глав, хотя, откровенно говоря, мы не сомневались, что большая часть этих фактов и без того уже ему известна. В нашем изложении, однако, первая глава имеет и иное назначение: выделить круг проблем молекулярной биологии, которые связаны только с передачей и преобразованием наследственной информации, полностью отвлекаясь от физических механизмов ее передачи. Разумеется, такой описательный подход к делу (вообще говоря, типичный для биологической литературы) не может удовлетворить истинно любознательного читателя, которому может показаться, что авторы ущемляют его интеллектуальные права, замалчивая самое интересное — колесики и винтики этих самых физических механизмов.
Спешим, однако, заверить: это не так; наоборот, в первой главе мы изо всех сил старались дать понять, что такой порядок изложения в известной степени вынужденный: центральной фигурой любого биохимического механизма являются белки. Но согласитесь, для того чтобы поговорить о них подробнее, необходимо было хотя бы вкратце рассмотреть схему их возникновения. Что же касается охраны интеллектуальных прав, то на этот счет существуют, как известно, различные мнения: несколько лет назад известный молодежный поэт кокетливо заявил на страницах прессы, что незнание устройства, например, телефона, не мешает ему, поэту, ощущать себя глубоко интеллектуальным человеком, в полной мере приобщенным к сокровищнице мировой культурной мысли…
Как понимать слово «Структура»
Итак, мы предусмотрительно позаботились о том, чтобы читателю было известно, что молекула белка представляет собой длинную цепочку, образованную звеньями двадцати типов, причем последовательность их чередования для каждого белка строго определена генетически. В принципе для наглядного представления структуры белковой молекулы теперь недостает еще только одного пояснения, относящегося уже к области стереохимии. Предметом интереса этой науки является взаимное пространственное расположение атомов в молекулах различной валентной структуры, а в том, что он отнюдь не праздный, мы будем еще неоднократно иметь возможность убедиться.
Приводимые на страницах школьных учебников химии структурные формулы различных соединений, например,

являются «двумерными»: они передают способ размещения валентных связей между отдельными атомами, но ничего (по крайней мере, прямо) не говорят об их взаимном пространственном расположении. Вот, например, молекула метана CH4. По общему виду ее структурной формулы можно подумать, что это плоская молекула в форме квадрата, по вершинам которого расположены атомы водорода, а в центре — атом углерода. Однако на самом деле ее структура совершенно иная; ее лучше всего представить себе, вспомнив общеизвестные молочные пакеты. Такой пакет представляет собой пространственную фигуру, образованную четырьмя равносторонними треугольниками. Разместив на его вершинах атомы водорода и в центре — углерод, мы получим точную пространственную модель молекулы метана. А поскольку фигура, форму которой имеет молочный пакет, называется тетраэдром, говорят, что в молекуле метана заместители (атомы водорода) вокруг четырехвалентного углерода расположены тетраэдрически.

Размещение атомов в молекуле метана имеет одну весьма интересную особенность. Если построить пространственную модель метана из толстой проволоки, точно соблюдая равенство длин всех валентных связей C?H и всех валентных углов H?C?H (четыре связи и шесть углов), то получившаяся конструкция, какой бы стороной ее ни поставить на стол, всегда будет выглядеть одинаково: три «нижние» в данный момент связи опираются на плоскость стола, а четвертая торчит точно вверх.
Такого рода конструкции, между прочим, издавна находили применение в военном деле. Если каждый конец заострить и снабдить зубчиком (наподобие рыболовного крючка), получится так называемый «чеснок» — по-видимому, одно из старейших военно-инженерных средств. Русские воины рассыпали их на пути движения конницы Батыя (хотя наверняка «чеснок» был известен и много столетий раньше), а во время второй мировой войны партизаны и диверсионные группы во многих странах использовали все тот же, нисколько внешне не изменившийся «чеснок» уже против автомобильного транспорта.
Впрочем, мы опять отвлеклись; завершая разговор о геометрических особенностях рассматриваемой фигуры, которую мы отныне можем называть пространственной моделью молекулы метана, укажем, что все заместители — атомы водорода — удалены друг от друга на максимально возможное расстояние: увеличение расстояния между любой парой заместителей возможно лишь за счет сближения их с другими заместителями.
Мы уделяем так много внимания пространственной структуре молекулы метана неспроста: тетраэдрическое размещение заместителей характерно не только для молекулы метана; именно таким образом они располагаются вокруг каждого атома углерода, несущего любые четыре заместителя (правда, в этом случае равенство длин валентных связей и валентных углов может в точности не соблюдаться, но это несущественно). А поскольку органическая химия есть химия соединений углерода, тетраэдр стал, по существу, визитной карточкой этой науки: его изображения встречаются на эмблемах многочисленных химических съездов, конференций и симпозиумов, на значках участников этих собраний и, конечно же, на страницах научных журналов (кстати, один из наиболее авторитетных международных журналов по органической химии так и называется — «Тетраэдрон»).
Совершенно иначе обстоит дело с трижды замещенным атомом углерода (одна из связей — двойная). Здесь все четыре атома расположены в одной плоскости, так что углы между соседними валентными связями составляют около 120 градусов.
Аналогично заместители у атома кислорода располагаются всегда таким образом, что угол между парой валентных связей составляет около 100 градусов; то же самое относится к положению заместителей у атома серы и т. п. Эти закономерности справедливы для всех атомов данного типа, входящих в сколь угодно сложные структуры.
Иными словами, можно составить «стереохимический конструктор», содержащий набор всех атомов с присущими им типами расположения валентных связей, и с его помощью воспроизвести пространственную модель молекулы любого строения. Действительно, такие «конструкторы» есть, они называются молекулярными моделями, производятся во многих модификациях (часто в очень элегантном исполнении). С их помощью удается в принципе весьма наглядно представить пространственную структуру любой молекулы. Если при этом нас интересует общая форма молекулы, можно воспользоваться моделями, где все атомы представлены массивными шариками, радиус которых соответствует некоторой внешней границе «отталкивания» (об этом подробно — в следующей главе); если же мы хотим получить представление о характере пространственного расположения валентных связей, то пользуемся так называемыми «скелетными» моделями, на которых атомы обозначены символически.
Работа с такими моделями чрезвычайно проста; глядя на структурную формулу интересующего нас соединения и поочередно извлекая модели атомов из различных отделений ящика: «тетраэдрический углерод», «водород», «двузамещенный кислород», — их соединяют с помощью ножек — валентных связей. И вскоре, после несложного обучения, можно построить «трехмерную» модель белковой цепочки сколь угодно большой длины — хватило бы лишь деталей «стереохимического конструктора». Но, как бы мы ни старались, наша модель не будет похожа на «настоящую» белковую молекулу, если мы не обратим внимания на одно чрезвычайно важное и любопытное обстоятельство.
Нарисуем еще раз, несколько видоизменив, структурную формулу основного звена белковой цепи — типичной аминокислоты:
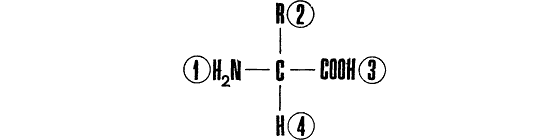
Для удобства последующих рассуждений мы пронумеровали заместители у центрального атома углерода. Если мы теперь попытаемся аналогичным образом пронумеровать вершины уже знакомого нам молочного тетраэдра, окажется, что это можно сделать двумя различными способами. Поставим пакет на стол так, чтобы вверх была направлена, скажем, вершина № 4. Глядя на него сверху, мы увидим, что прочие вершины могут образовать последовательность 1, 2, 3 (то есть N, R, С) либо в направлении вращения часовой стрелки, либо в обратном.
Легко убедиться, что тетраэдры, пронумерованные двумя способами, являются зеркальным отражением друг друга: всякая последовательность обхода окружности в зеркале представляется измененной на обратную.
Таким образом, оказывается, что молекулы со структурной формулой приведенного выше типа могут существовать в виде двух так называемых пространственных изомеров — соединений, различающихся пространственным расположением заместителей. Эти изомеры называют зеркальными, или, чаще, стереоизомерами, а атом углерода, о заместителях которого идет речь, — асимметричным. Название это, однако, относится лишь к такому тетраэдрическому углероду, все заместители которого различны.
Если же хоть одна пара заместителей одинакова, различных стереоизомеров одного и того же соединения не получится. Наиболее близким нам примером является аминокислота глицин, в которой боковой радикал R представляет собой водород, — для «глицинового» тетраэдра можно найти положение (вверх торчит группа COOH), при котором порядок обхода остальных заместителей (H, N, H) одинаков в обоих направлениях. Таким образом, глицин обладает лишь одним стереоизомером; все же остальные аминокислоты могут существовать в форме двух стереоизомеров, условно называемых «левыми» и «правыми» (или еще: аминокислотами L- и D-типа), причем никакими поворотами молекулярного тетраэдра нельзя перевести одну форму в другую, для этого придется разорвать валентные связи и поменять местами хотя бы одну пару заместителей углерода.
Наш стереоконструктор может с успехом быть использован как поточная линия по выпуску моделей аминокислот как L-, так и D-типа, но если мы захотим специализироваться на производстве лишь одной формы — скажем, L-аминокислот, нам придется резко повысить уровень квалификации и внимания стоящего у «поточной линии» персонала, иначе недолго и перепутать «ножки» асимметричного углерода и начать выпускать брак: смесь, состоящую наполовину из «левых», наполовину из «правых» стереоизомеров. Как раз такая смесь, называемая рацематом, и получается обычно при химических реакциях, приводящих к образованию веществ, содержащих асимметричный атом углерода. Тем более удивительно, что при синтезе молекулы белка в организме используются лишь L-аминокислоты, «правая» их разновидность не участвует в образовании белковой цепи. Ведь не стоит же, в самом деле, у «конвейера» синтеза белка разумное существо — контролер ОТК, — которое отбрасывает в сторону «правые» аминокислоты и подает на «конвейер» только «левые»!
(Кстати, природные аминокислоты не являются каким-то исключением среди веществ биологического происхождения, поскольку очень многие соединения, содержащие асимметричные атомы углерода — сахара, органические кислоты, стероиды, — синтезируются живыми организмами в форме только одного стереоизомера. Последнее обстоятельство используется, в частности, при попытках обнаружить в метеоритах остатки веществ биологического происхождения. Для этого существуют очень чувствительные оптические методы, и, обнаружив с их помощью преобладание одного из двух стереоизомеров — неважно, какого именно вещества, — можно было бы утверждать, что мы напали на след жизнедеятельности инопланетян. Пока, впрочем, этого сделать не удалось; точнее, несколько сообщений о положительных результатах такого анализа было, но все они впоследствии опровергались; как оказывалось, в образцы метеоритов попросту попадали заурядные земные микроорганизмы.)
До поры до времени авторы не намерены отвечать на вполне закономерный вопрос: как же все-таки происходит отбор стереоизомеров аминокислот при синтезе белков? Пока мы ограничимся лишь очередным намеком на то, что объяснение следует искать все там же: в удивительных свойствах ферментов, которые строжайшим образом контролируют любую химическую реакцию в организме, в том числе и синтез своих собственных молекул. И ключ к познанию этих свойств, информация, необходимая белку для выполнения его чрезвычайно важной биологической роли, заложена не в химическом составе молекулы белка (иначе не возникало бы проблемы неодинаковости L- и D-изомеров) и даже не в чередовании аминокислотных остатков, а в трехмерной, пространственной структуре белковой глобулы.
Переход от «обычной» структурной формулы к пространственной структуре молекулы белка — это не просто очередной этап биологического кодирования, передачи генетической информации. Это, помимо прочего, преобразование информации в принципиально иную форму — из «линейной» (чередование нуклеотидов в ДНК и РНК, аминокислотная последовательность белка) в «трехмерную».
Впрочем, пока мы совершенно не готовы к беседе на эту тему. Например, заметили ли читатели, что до сих пор мы избегали разговора о характере пространственного расположения заместителей у атома азота? Вообще говоря, в большинстве соединений трехвалентного азота заместители располагаются у основания пирамиды, в вершине которой расположен атом азота. Однако всякому человеку, мало-мальски знакомому с химией, известны коварство и непостоянство азота. То он, видите ли, двухвалентный, то пятивалентный, то почти полностью инертный, то агрессивный… В вопросах пространственной организации этот элемент также остается верен себе: иногда, как упоминалось, для него свойственно пирамидальное расположение заместителей, иногда — какое-то другое. А ведь атом азота входит в основную цепь белковой молекулы, и, чтобы иметь возможность что-то сказать о ее пространственном строении, просто необходимо точно знать, какую же форму расположения заместителей соизволил азот выбрать в этом случае…
Лайнус Полинг
Выше мы всюду говорили о способах расположения заместителей вокруг того или иного атома просто как об известном факте. Действительно, каждый из этих способов подтвержден экспериментальными методами, например, рентгеноструктурным анализом. Однако те же закономерности получаются и чисто расчетным путем на основе строгой квантовомеханической теории, то есть могут быть объяснены на основе самых общих физических законов.
Вот наконец проявилась (в первый, но далеко не в последний раз) проклятая особенность молекулярной биологии как «стыковой» научной дисциплины; для начала, как выясняется, необходим контакт с квантовой механикой. Случай, впрочем, не самый тяжелый, ибо на первый вопрос, поставленный молекулярной биологией, квантовая механика могла ответить с большой легкостью (просто потому, что ответ на него был ей во многом известен задолго до возникновения самой молекулярной биологии).
Конечно же, совершенно немыслимо пытаться излагать основы квантовомеханической теории строения молекул походя (а ведь на это толкает авторов неумолимая логика общего плана книги). Нам остается лишь скороговоркой повторить несколько самых общих ее положений.
Одна из наиболее заурядных особенностей квантовой механики состоит в том, что если на вопрос, где в атоме расположено его ядро, еще можно хотя бы приблизительно ответить: «В центре», то уж указать, в какой точке объема, занимаемого атомом, расположен некоторый электрон, невозможно никаким образом. Он, как известный дух из поэмы великого персидского поэта Фирдоуси, в каждый момент времени находится «здесь и не здесь».
Каждый атом состоит, таким образом, из положительно заряженного ядра и отрицательных электронных «облаков» вокруг него. Кстати, во многих научных дисциплинах, основанных на квантовой механике, термин «электронные облака» пишется без всяких кавычек.
Форма «облака» вокруг ядра не обязательно похожа на шар; напротив, в большинстве случаев протяженность «облака» в различных пространственных направлениях резко неодинакова. Именно с этим и связан факт различной пространственной ориентации валентных связей вокруг того или иного атома, входящего в состав молекулы. Дело в том, что образование валентных связей между атомами очень часто (хоть и не всегда) происходит так: электронные облака двух разных ядер сливаются в одно, охватывающее оба ядра.
Но вот наконец валентная связь оказывается сформированной: ядра атомов устанавливаются на некоем фиксированном расстоянии друг от друга. Расстояние это обычно очень невелико и в зависимости от типа валентной связи колеблется от 1 до 2 ангстремов — стомиллионных долей сантиметра. Длины связей между ядрами данного типа могут в принципе меняться от молекулы к молекуле, но, как правило, незначительно: не более чем на несколько сотых ангстрема.
Объяснить процесс образования валентной связи без квантовой механики совершенно невозможно: чего стоит одно лишь перекрывание электронных облаков, которые, будучи заряжены одноименно, как будто должны отталкиваться! Но, с другой стороны, любая химическая реакция, в сущности, есть не что иное, как разрыв одних валентных связей и образование новых.
Стало быть, все грандиозное здание химии, построенное трудом десятков поколений ученых, начиная от длинноволосых и бородатых алхимиков в черных, усеянных звездами колпаках и кончая длинноволосыми и бородатыми аспирантами середины 70-х годов нашего века, стояло бы без квантовой механики на курьих теоретических ножках? И нынешнее основание этого здания — квантовая химия — сохранило слово «химия» в названии только как дань традиции? Может быть, и нет вовсе никакой теоретической химии, даже квантовой, а есть квантовомеханическая (читай — физическая) теория образования и распада молекул?
Много подобных провокационных вопросов может задать проницательный читатель, особенно если он связан с химией по роду своей деятельности… Мы уклоняемся от более детального разговора на эту тему, но если у читателя появится все же желание самостоятельно разобраться в основах квантовомеханической теории строения молекул, почти наверняка ему придется начать свое образование с проработки классического труда «Природа химической связи», первое издание которого появилось еще в 1940 году. Его автором является американский ученый Л. Полинг — один из творцов современной квантовой химии.

Можно считать, что научному направлению, которое впоследствии стало называться молекулярной биологией, сильно повезло: самый ранний этап исследования пространственной структуры белковых молекул возглавил именно Л. Полинг. В самом деле, кому же, как не ему, автору целого ряда сложных и изощренных теорий, было взяться за объяснение валентного строения «нетипического» атома азота из остова белковой цепи и весьма вскоре получить это объяснение. Л. Полинг показал, что азот, входящий в состав пептидной группы — а это, как мы помним, элементарный фрагмент остова белковой цепи, — образует с атомом углерода соседнего остатка очень странную валентную связь: не одинарную, не двойную, но как бы промежуточную. А отсюда — очень важное следствие: плоскостное расположение заместителей у атома азота пептидной группы — повторяющегося элемента белковой цепи. Тем самым все атомы пептидной группы лежат в одной плоскости, причем Л. Полинг показал также, что атомы O и H находятся по разные стороны от связи C?N. Наконец он сам подтвердил такое строение пептидной связи экспериментально, с помощью рентгеноструктурного анализа, и указал точные размеры длин отдельных связей и значения валентных углов.
Тем самым был сделан первый шаг в исследовании пространственного строения белковой молекулы. Конечно, далеко не семимильный, но совершенно необходимый. А кроме того, сделан он был человеком, вовсе не намеревавшимся ограничиваться одним шагом.
Л. Полинг, будучи большим знатоком физики полимеров, понимал, что, по крайней мере, часть общей длины белковой цепи по аналогии с остальными полимерами должна стремиться приобрести периодическую, спиральную структуру. И следующей своей задачей он поставил выяснение вопроса о том, какова же должна быть эта структура.
Деятельность Л. Полинга на этом поприще положила начало довольно длительному периоду спиралемании в молекулярно-биологических исследованиях. Л. Полинг совместно со своими сотрудниками предложил для начала более десятка спиральных структур, правдоподобных с точки зрения самых общих стереохимических критериев. Бывало, что 80 процентов объема одного номера «Докладов» Американской академии наук (редактор Л. Полинг) занимали его статьи о новых типах спиралей. «Охота за спиралями» перекинулась на другие исследовательские центры, и одним из побочных эффектов этого явления оказалось, как знают читатели книги «Двойная спираль», замечательное открытие Дж. Уотсона и Ф. Крика.
Тем временем Л. Полинг принялся критически пересматривать предложенные им структуры с учетом новейших рентгенограмм — до того, впрочем, неоднозначных, что получить на их основе какую-либо полезную информацию было почти невозможно. Почти, но ведь за дело взялся сам Л. Полинг!
Окончательный его вывод был таков: полипептидные цепи могут образовывать два вида периодических структур. Первая, названная ?-спиралью, представляет собой как бы цилиндрическое образование, основу которого составляет главная валентная цепь полипептида, а боковые радикалы торчат наружу; это одноцепочная структура, которая стабилизируется за счет возникновения между остатками, удаленными друг от друга на три звена, водородных связей (мы вынуждены несколько преждевременно упомянуть этот вид межатомных взаимодействий; более подробно они рассматриваются в следующей главе).
Совсем иное строение имеет вторая периодическая форма — так называемая ?- или слоисто-складчатая структура. Здесь стабилизация происходит за счет образования водородных связей между двумя цепями противоположного направления, причем возможно в принципе сколь угодно расширить такой слой, «подстраивая» в ряд дополнительные цепочки. Для построения ?-структуры из одноцепочечной молекулы необходимо образование шпильковидного изгиба цепи.
Одновременно Л. Полинг подчеркивал, что регулярную пространственную структуру имеет лишь часть полипептидной цепи, образующей белковую молекулу, причем во многих случаях — лишь незначительная ее часть. Можно сказать, таким образом, что им была установлена структура одного универсального типового элемента — пептидной группы — и двух факультативных: ?-спирали и ?-структуры. Впоследствии это было отмечено Нобелевской премией. Вторую Нобелевскую премию — премию мира — выдающийся американский ученый получил в 1962 году за свою общественную деятельность. По сей день Л. Полинг является активным участником всемирного движения в защиту мира; в знак признания заслуг в 1974 году ему была присуждена международная Ленинская премия мира. Возвращаясь к научной деятельности Л. Полинга, нельзя не упомянуть его пионерские работы по исследованию молекулярной природы генетических заболеваний (об этом тоже попозже), решение ряда фундаментальных вопросов теории химического строения, причем различные специалисты наверняка указали бы нам еще добрый десяток не менее важных результатов. И остается только удивляться обилию столь значительных вех на творческом пути одного-единственного человека — Л. Полинга.
По-прежнему кодируем
Будем считать, что нам теперь известны самые общие принципы пространственного строения элементарных молекулярных фрагментов белковой цепи. И тем не менее мы все еще находимся в самом начале пути перехода от представления о белковой молекуле как о формальной последовательности символов — аминокислот (привитом читателю еще в первой главе) — к представлению о ней как о реальном физическом объекте, обладающем пространственной структурой.
Ну что ж, воспользуемся еще раз уже знакомым нам «стереоконструктором» и соберем из него «трехмерную» модель какой-нибудь молекулы — для начала необязательно белковой. Выберем из ящика с «деталями» нужные нам атомы, соединим их стерженьками — «валентными связями» и… обнаружим, что установить пространственную структуру молекулы было бы очень просто, если бы в дело не вмешивалось одно обстоятельство: вокруг любой одинарной связи возможно вращение. Одна часть молекулы может поворачиваться относительно другой.
Для очень многих молекул это означает, по существу, отсутствие фиксированной молекулярной структуры. Такие молекулы представляют собой более или менее сложный шарнир, допускающий сближение или удаление отдельных пар атомов в зависимости от углов поворота вокруг некоторых одинарных связей. Эти углы принято называть углами внутреннего вращения, а структуры, соответствующие различным наборам углов внутреннего вращения, — различными КОНФОРМАЦИЯМИ молекулы. Мы выделили это слово по двум причинам. Во-первых, оно символизирует собой целую эпоху многих современных отраслей знаний: физики полимеров, химии и, конечно же, молекулярной биологии; во-вторых, впредь мы будем использовать его так часто, что нам захотелось как-то отметить первое появление этого слова на страницах книги.
Растягивая или сжимая резинку, мы изменяем конформации молекул каучука и чувствуем при этом их противодействие. Гибкость, пластичность других бытовых полимеров, хотя бы полиэтилена, — это также следствие способности их молекул легко изменять конформацию, приспосабливаясь практически к любой форме. Прозрачный яичный белок на горячей сковородке становится белым — изменилась конформация… Нет, нет, позвольте, ведь мы как раз и хотим повести разговор о конформациях белковых молекул, так что с этим примером пока следует подождать. Давайте лучше излагать все по порядку.
Итак, зная пространственное устройство каждого из 20 типов элементарных звеньев белковой цепи, мы можем попытаться построить с помощью «стереоконструктора» модель целой молекулы белка, представляющую собой чрезвычайно длинную шарнирную систему, в сотнях или даже тысячах мест допускающую вращение одной части молекулы относительно другой. Очевидно, подобно молекулам всех полимеров, такая молекула должна обладать гибкостью и способностью принимать самые разнообразные пространственные структуры (не откажем себе в удовольствии повторить еще раз — КОНФОРМАЦИИ!) от полностью вытянутой до скатанной в клубок. Причем, помимо внутренних вращений в главной валентной цепи — остове, возможны еще вращения боковых радикалов.
Несомненно, что белковая молекула даже в чисто механической трактовке — объект очень сложный, и, глядя на ее модель (правильнее было бы сказать карикатуру), невозможно просто умозрительно предсказать какие-нибудь особенности пространственной подвижности молекулы. С другой стороны, все подробности геометрического строения элементарного звена, характерные для цепочки белка, принципиально не выделяют ее в ряду прочих полимеров. В смысле гибкости и пространственной подвижности цепочки других полимеров тоже заметно ничем от нее не отличаются, и все же ни один из них не обладает теми замечательными свойствами, которые присущи белкам.

Объяснить это можно только одним способом. Цепи синтетических полимеров состоят либо из звеньев одного типа
А А А А…
Б Б Б Б…
и т. д., либо из регулярных комбинаций разных звеньев
А Б А Б А Б А Б…,
либо, наконец, из случайно чередующихся звеньев различных типов
А Б Б А А А Б Б А Б…
В каждой молекуле белка определенного сорта, как мы знаем, чередование различных звеньев-аминокислот строго упорядоченное. Однако никакой регулярности, периодичности в чередовании различных остатков, если угодно, «правильности» их расположения, в белках не наблюдается.
Поиски такого рода закономерностей проводились хитроумнейшими методами математической статистики и не дали никаких результатов.
Кстати, совершенно аналогичное разочарование постигло в сравнительно недавнее время литературоведов (вот и еще один стык наук!): все те же хитроумные математические методы потерпели полное фиаско в попытках установить сколько-нибудь существенные закономерности расстановки отдельных букв в произведениях великих писателей.
Чтобы окончательно покончить с проблемой регулярности белковых последовательностей, оговоримся, что все сказанное не относится к белкам, выполняющим в организме чисто механические функции, например, тем, которые составляют основу сухожилий (коллаген) или волос (кератин). В этих белках существует четко выраженная регулярность аминокислотной последовательности, что имеет большое значение в связи с их механическими свойствами.
В особой упорядоченности аминокислотных остатков белковой цепи скрыт ключ к пониманию свойств белка. Подтверждением тому могут служить синтетические полипептиды — соединения, имеющие тот же тип мономерных звеньев, что и белковые молекулы, но с монотонным или случайным их чередованием. По всем своим свойствам они являются самыми заурядными полимерами. Поскольку каждый белок, обладающий каким-то экстраординарным свойством (а других белков просто не бывает), выполняет в организме определенную функцию, его присутствие в организме должно быть «предусмотрено» тем, что в последовательности нуклеотидов зашифрована (и мы теперь знаем, как именно) его аминокислотная последовательность. Точнее говоря, в последовательности нуклеотидов ДНК закодирована последовательность РНК, в последовательности РНК — аминокислотная последовательность белка, в последовательности белка… (невольно вспоминается философская фраза Дерсу Узала, охотившегося на медведя, занятого рыбной ловлей: «Чего-чего рыба кушай, медведь рыба кушай, мы хотим медведь кушай…»). В самом деле, что же (в свою очередь) кодирует аминокислотная последовательность?
Вкратце ответить на вопрос о том, что закодировано в аминокислотной последовательности белковой молекулы, мы уже попытались: пространственная структура, способ пространственного «сворачивания» полипептидной цепи. Однако это, вообще говоря, справедливо для любого полимера. Но вот еще об одном — и самом важном — отличии белков от прочих полимеров речи пока не было: каждая молекула белка данного типа имеет одну и ту же, строго определенную пространственную структуру. Структура эта очень сложной и «неправильной» формы, то есть речь здесь идет вовсе не об одной из рассмотренных выше периодических структур, которые характерны лишь для некоторых фрагментов белковой цепи.
Кстати говоря, теперь следует обратить внимание на то, что выражение «структура белковой молекулы» звучит достаточно неопределенно. В самом деле, имеем ли мы в виду ее аминокислотную последовательность или пространственное строение? Поэтому в специальной литературе для краткости принята следующая терминология. Если мы имеем в виду порядок чередования аминокислотных остатков в белковой молекуле, мы говорим о первичной ее структуре. Под вторичной структурой подразумеваются ?-спираль и ?-структура — типы периодических структур; поэтому понятие «вторичная структура» может относиться лишь к регулярным фрагментам молекулы белка, но не к молекуле в целом. Наконец, третичная структура молекулы — это ее пространственное строение.
Необходимо при этом еще раз подчеркнуть, что свойство существования в виде единственной, причем непериодической структуры присуще не полипептидам вообще, а только белкам. Вот, оказывается, в чем смысл неслучайности, строгой заданности чередования боковых привесков у регулярного полимерного остова. Вот схема очередного этапа биологического кодирования, о котором один из виднейших его исследователей, американский биохимик К. Анфинсен, выразился следующим образом: «Язык боковых цепей, на котором написана пространственная структура белковой молекулы».
«О господи, еще одна табличка! — вздохнет в этом месте читатель. — Ну, давайте — аланин — „поворот цепи влево“, тирозин — „поворот вправо“, или как там у вас?»
Ошибка, дорогой читатель, ошибка. Не будет таблички, да и быть не может. Просто потому, что способ такого кодирования на сегодняшний день никому не известен. Нет ни одного человека, который сумел бы, глядя на аминокислотную последовательность белка, нарисовать его пространственную структуру.
Впрочем, не может быть таблички и по другим причинам. Сколь ни мало нам известно о способе кодирования пространственной структуры белковой молекулы ее аминокислотной последовательностью, тем не менее одно можно утверждать вполне определенно: примитивным словарем «слов», состоящих из немногих знаков, здесь не обойтись. Если рациональный словарь такого рода и существует, его «слова» должны содержать до десятка знаков, а при двадцатибуквенном алфавите это порождает огромное разнообразие комбинаций, массу возможных оттенков тех еще не вполне понятных элементов, которыми мы намерены описывать сложную и неправильную пространственную структуру белковой молекулы.
Вспоминается известный случай, имевший место во время первой мировой войны. Для исключения возможности подслушивания телефонных разговоров в американской армии использовались в качестве телефонистов индейцы одного очень малочисленного племени, причем все переговоры они вели на своем родном языке. И уж, конечно, не зная этого языка (а за пределами США он был практически неизвестен), расшифровать такие сообщения было намного труднее, чем, скажем, криптограммы, написанные самым сложным цифровым кодом, но на известном языке. А если вернуться к проблеме выяснения способа кодирования третичной структуры белков, то не подлежит сомнению, что в этом случае гораздо более близкой аналогией будет расшифровка сообщения, переданного на незнакомом языке…
Для нас с вами это означает окончание победного марша по глади хорошо изученного и окончательно установленного и вступление в сумрачную чащу гипотетического и ненадежного. Именно к этому, сказать по правде, и стремились лукавые авторы, а вся предыдущая часть книги — это своего рода введение в существо задач, на которых, образно говоря, пробуксовывает ныне могучий сверхвездеход современной молекулярной биологии.
«Теперь вся сила в гемоглобине»
Возможно, мы несколько сгустили краски: нельзя, конечно, сказать, что о способе предопределения пространственной структуры белковой молекулы ее аминокислотной последовательностью не известно вовсе уж ничего.
Прежде всего пространственное строение молекул более двух десятков белков установлено чисто экспериментальными средствами — методами рентгеноструктурного анализа. С помощью этих методов удается установить точное пространственное расположение всех атомов молекулы в кристаллической структуре. Слово «удается» очень точно передает ситуацию, если речь идет о рентгеноструктурном анализе белков. Около трех десятков лет лучшие специалисты-рентгеноструктурщики всего мира бились над этой проблемой. Первые попытки рентгенографического анализа строения белка были предприняты при активном участии знаменитого английского кристаллографа Дж. Бернала; как мы уже знаем, именно рентгеноструктурными методами было подтверждено строение полинговских ?-спирали и ?-структуры. Однако еще долгое время (хотя как знать? Восемь или девять лет — так ли уж это долго?) полная расшифровка третичной структуры белковой молекулы средствами рентгенографии была невозможной. И лишь в 1959–1960 годах это впервые удалось англичанам М. Перутцу и Дж. Кендрью. Первенцем оказалась молекула миоглобина — белка, запасающего кислород в тканях мышц. И сразу же вслед за ней М. Перутц и Дж. Кендрью установили структуру молекулы гемоглобина, известного красного вещества крови.
Вот и еще один большой триумф молекулярной биологии. Шутка ли: стало известно строение важнейших в физиологическом плане веществ организма, а главное — стало возможным установление пространственного строения белков вообще!
На пятом Международном биохимическом конгрессе, состоявшемся в Москве в 1961 году, одновременно проходили заседания многих тематических симпозиумов; каждому из них был отведен отдельный — и вовсе не маленький — зал. И надо было видеть отчаяние организаторов конгресса, когда почти все делегаты, покинув заседания «своих» симпозиумов, ринулись на доклад М. Перутца!
Почтенные профессора и энергичные ассистенты толпились в проходах, тянулись на цыпочках в дверях, усаживались прямо на полу возле кафедры. А на столе красовалась модель молекулы миоглобина, изображению которой впоследствии было суждено обойти все книги по молекулярной биологии. Однако главный интерес вызывал не миоглобин (расшифровка его структуры к тому времени уже перестала быть последней сенсацией), а модель молекулы гемоглобина. К тому было много причин. Однако, коль уж скоро речь заходит о гемоглобине, невозможно обойтись без краткого отступления.
Если говорить о роли гемоглобина в истории исследования принципов структурной организации белков вообще, само собой напрашивается сравнение с плодовой мушкой-дрозофилой, главным героем генетических исследований на протяжении многих десятилетий, вплоть до сегодняшнего дня. Именно гемоглобин стал тем полигоном, на котором отрабатывались основные теоретические представления и экспериментальные приемы структурных исследований. Именно на гемоглобине Л. Полингом (опять Полинг!) была впервые показана молекулярная природа наследственных болезней. Наконец, число исследованных первичных структур гемоглобинов различных биологических видов ныне перевалило за полторы сотни: в этом отношении гемоглобин является бесспорным лидером среди прочих белков.

И в наши дни научный работник, интересующийся проблемами структуры белка, с большим сочувствием читает пророческие строки И. Ильфа и Е. Петрова: «„Пьер и Константин“ (городской парикмахер. — Примеч. авт.), давно уже порывавшийся сделать сообщение на медицинскую тему, заговорил, опасливо оглянувшись:
— Теперь вся сила в гемоглобине.
Сказав это, „Пьер и Константин“ умолк. Замолчали и горожане, каждый по-своему размышляя о таинственных силах гемоглобина».
Более подробное знакомство с гемоглобином начнем с введения понятия о следующем (и пока, кажется, последнем) уровне структурной организации белков — четвертичной структуре. Молекулы многих белков при ближайшем рассмотрении оказались не цельными молекулами, а молекулярными комплексами, образованными несколькими отдельными молекулами (их еще называют субъединицами) одного или нескольких типов. Между частями такого комплекса не существует валентных связей, и он удерживается за счет более слабых сил.
Оказалось, что гемоглобин представляет собой именно такой комплекс, состоящий из четырех валентно не связанных белковых субъединиц двух разных типов — ? и ?, причем каждая из них обладает различной аминокислотной последовательностью. Молекула (строго говоря, это слово следовало бы, по крайней мере, взять в кавычки) гемоглобина содержит по две субъединицы каждого типа, образуя как бы неправильный тетраэдр. Каждая из субъединиц, помимо белковой части, содержит также важную небелковую химическую группу — гем. Именно гем (точнее, содержащийся в нем атом железа) обладает свойством обратимого связывания кислорода, что, как известно, и является основной физиологической функцией гемоглобина.
Кстати говоря, точно такую группу содержит и молекула близкого по своей функции миоглобина; ведь вся разница физиологической роли этих двух белков в том, что первый из них является как бы подвижным контейнером, разносящим кислород с кровотоком из легких по всем органам, а второй — контейнером неподвижным, запасающим в мышцах кислород впрок. Миоглобин, исследованный М. Перутцем и Дж. Кендрью, был получен из мышц кита. И понятно почему, ведь образ жизни кита, связанный с длительными погружениями, требует резко повышенного содержания этого белка в мышцах.
Далее, большая близость характера функций, выполняемых в организме обоими белками, позволяла надеяться, что и их пространственное строение окажется сходным. И в самом деле, М. Перутц и Дж. Кендрью установили, что третичные структуры молекулы миоглобина и каждой из субъединиц гемоглобина почти совпадают… Как и следовало ожидать, сказали бы мы в этом месте, развивая начатую мысль, если бы не одно поистине ошеломляющее обстоятельство. Вспомним, что основной принцип рассматриваемого нами этапа передачи генетической информации гласит: «Первичная структура определяет третичную». И с этой точки зрения, казалось бы (опять же только казалось бы!), близкие по третичной структуре белки должны иметь также и сходные первичные структуры. Но при сравнении аминокислотных последовательностей миоглобина и любой из субъединиц — ?- или ?-гемоглобина оказывается, что их «тексты» совпадают менее чем на 30 процентов!
Это сравнение производит очень сильное впечатление, однако лишь на самый первый взгляд. Поразмыслив, нетрудно прийти к выводу, что ничего здесь особенного нет. Просто мы оказались перед лицом факта: одна и та же третичная структура может кодироваться различными аминокислотными последовательностями. Но ведь то же самое мы наблюдаем и в отношении генетического кода: одна и та же аминокислота может кодироваться двумя, тремя, а то и шестью различными кодонами. Важно, таким образом, знать способ кодирования, но его-то как раз мы и не знаем. В конце концов, если нам неизвестны принципы предопределения третичной структуры аминокислотной последовательностью, — как знать, может быть, последовательности миоглобина и субъединиц гемоглобина — своего рода «синонимы», подобно двум разным выражениям одного и того же предложения руководителя учреждения: «Подавайте заявление по собственному желанию» и «Не смею более вас удерживать».
И опять перед нами возникает проклятая проблема кода, используемого природой на этапе «первичная структура — третичная структура». Уместно отметить одну особенность этого кода: если предыдущие этапы передачи генетической информации ДНК?РНК, РНК?белок требовали очень сложных и очень специальных «обслуживающих систем» (мы о них старались говорить по возможности меньше именно из-за их сложности), то третичная структура молекулы белка с определенной аминокислотной последовательностью приобретается молекулой самопроизвольно, достаточно предоставить ее самой себе.
Это ее внутренняя способность, и для реализации этапа «первичная структура — третичная структура» никакие обслуживающие механизмы не нужны. Молекула, вынесенная из клетки, сохраняет не только свою третичную структуру, но и способность ее самопроизвольно восстанавливать. Молекула как молекула, валентная структура ее нам известна — значит, и ее поведение должно определяться известными нам физическими законами. Иными словами, наконец-то оказалось возможным вполне подробно рассмотреть элементарный биологический объект в физических терминах, или, еще короче,
Наконец-то физика!
Раз белковой молекуле ничто внешнее не помогает принять определенную, единственную пространственную укладку, значит, это происходит за счет сил, действующих внутри самой молекулы. Более того, если бы эти силы прочно не удерживали молекулу в конформации соответствующей этой структуре, никакие первоначальные упорядочения за счет внешних причин не помогли бы: под действием теплового движения молекула очень быстро утратила бы эту конформацию, приняв постоянно меняющуюся форму случайного клубка, как это происходит с «обычными» полимерами.
Благодаря тому, что боковые радикалы аминокислотных остатков весьма разнообразны по своей структуре, химической природе, электрическим свойствам, оказываются различными гибкость отдельных участков белковой молекулы, их взаимное сродство, способность к образованию периодических структур и т. п.
И существуют такие способы чередования аминокислотных остатков в белковой молекуле, что, предоставленная самой себе, она самопроизвольно свернется во вполне определенную структуру. Значит, проблема предсказания третичной структуры, записанной на языке аминокислотной последовательности, сводится к подробному описанию внутримолекулярных взаимодействий в белке, которое позволило бы точно воссоздать основные силы, изгибающие или выпрямляющие отдельные участки цепи, сближающие или отталкивающие различные ее части, а это, несомненно, физическая задача.
Не теряя времени, мы тут же, прямо-таки через полторы-две страницы примемся за ее постановку в традиционном «физическом» виде. Но перед этим — несколько слов на более общие темы.

Нет смысла скрывать далее от читателя, что необычная пространственная структура белковых молекул и есть причина их необычных свойств (будем опять-таки для простоты говорить только о свойствах ускорения химических реакций). И общая схема организации жизненного процесса, вскрытая молекулярной биологией, выглядит таким образом: на основе записанной в ДНК аминокислотной последовательности всех белков данного организма при участии или под действием части этих белков осуществляется синтез новых белковых молекул.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
ДНК — МОЛЕКУЛЯРНАЯ ОСНОВА ГЕНОМА
ДНК — МОЛЕКУЛЯРНАЯ ОСНОВА ГЕНОМА Сколько истин, признаваемых нами в настоящее время бесспорными, в момент провозглашения их казались лишь парадоксами или даже ересями! Екатерина II Что мыслимо — то возможно, что возможно — то мыслимо. Г. Лейбниц Тонкое устройство
ДНК — МОЛЕКУЛЯРНАЯ ОСНОВА ГЕНОМА
ДНК — МОЛЕКУЛЯРНАЯ ОСНОВА ГЕНОМА Сколько истин, признаваемых нами в настоящее время бесспорными, в момент провозглашения их казались лишь парадоксами или даже ересями! Екатерина II Что мыслимо — то возможно, что возможно — то мыслимо. Г. Лейбниц Тонкое устройство
Глава 13 Молекулярная биология. протеин
Глава 13 Молекулярная биология. протеин Энзимы и коэнзимЫXX в. открывал все новые и новые детали метаболизма клетки. Каждая метаболическая реакция, как выяснилось, катализируется каким-то определенным энзимом. Для того чтобы понять природу метаболизма, нужно исследовать
Глава 14 Молекулярная биология. нуклеиновые кислоты
Глава 14 Молекулярная биология. нуклеиновые кислоты Вирусы и геныКак только молекулы протеина вошли под контроль науки, неожиданно обнаружилось, что на роль первородных кирпичиков жизни претендуют совсем иные, нежели предполагали ученые, структуры. Эти структуры вышли
Изменения белков[43]
Изменения белков[43] Те участки генома, которые кодируют белки, изменились на удивление мало. Различия в аминокислотных последовательностях белков у человека и шимпанзе составляют значительно менее 1 %, да и из этих немногочисленных различий большая часть либо не имеет
Глава 6. Молекулярная генетика
Глава 6. Молекулярная генетика Поиски причин – занятие, не имеющее конца. У каждой причины есть своя причина, и нам приходится изучать все более и более отдаленные моменты в прошлом. Н. Тинберген (1907–1988), выдающийся голландский биолог, один из основателей этологии, лауреат
Глава 2. Строение и функции белков
Глава 2. Строение и функции белков Белки – высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных в полипептидные цепи с помощью пептидных связей, и имеющие сложную структурную организацию.История изучения белковВ 1728 г.
Функционирование белков
Функционирование белков Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от всех остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных
Глава 23. Обмен аминокислот. Динамическое состояние белков организма
Глава 23. Обмен аминокислот. Динамическое состояние белков организма Значение аминокислот для организма в первую очередь заключается в том, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и
Расщепление белков в тканях
Расщепление белков в тканях Осуществляется с помощью протеолитических лизосомальных ферментов катепсинов. По строению активного центра выделяют цистеиновые, сериновые, карбоксильные и металлопротеиновые катепсины. Роль катепсинов:1. создание биологически активных
Глава 3 Морфологическая и молекулярная эволюция
Глава 3 Морфологическая и молекулярная эволюция Я думаю, что отец наш небесный выдумал человека, потому что разочаровался в обезьяне. Марк
Тема 6. Молекулярная генетика
Тема 6. Молекулярная генетика Кто ясно мыслит, тот ясно излагает. А. Шопенгауэр (1788–1860), немецкий философ Молекулярная генетика изучает молекулярные основы наследственности и изменчивости. Основное положение молекулярной генетики связано с признанием ведущей роли
Глава 5. Нуклеиновые кислоты и молекулярная репликация
Глава 5. Нуклеиновые кислоты и молекулярная репликация Теперь, когда мы в несколько абстрактных выражениях описали требования к живой системе, мы должны подробнее рассмотреть, как осуществляются различные процессы в тех организмах, которые мы видим повсюду. Как мы уже
МОЛЕКУЛЯРНАЯ ЭКОЛОГИЯ
МОЛЕКУЛЯРНАЯ ЭКОЛОГИЯ В прессе часто появляются заметки о том, что торговцы дикими животными пытаются продавать запрещенные виды или продукты, изготовленные из вымирающих видов животных, прикрываясь торговлей вполне легальным товаром.Один из способов разрешения
Как молекулярная биология высадилась на Луну
Как молекулярная биология высадилась на Луну Передавая свой геном по наследству, человек тем самым вручает потомству сохраненные в ДНК тексты, которые определяют большую часть структуры и свойств его жизни. Это обстоятельство объясняет, почему в июне 2000 года генетики
3. Архитектура мозга. Как мозг строит ум
3. Архитектура мозга. Как мозг строит ум Каждый раз, когда силы души вступают во взаимодействие с тварным миром, они получают тварные образы и подобия от творения и впитывают их. Так в душе возникает знание о творении. Тварные вещи не могут стать к душе ближе, чем так, как