Глава 5. Похвала ферментам
Глава 5. Похвала ферментам
Высокое и несколько уже позабытое в наш рациональный век искусство многозначительных умолчаний, таинственных намеков и прочего кокетства не должно, казалось бы, иметь никакого отношения к рабочему стилю литературного произведения, трактующего в конце концов, что ни говорите, о суровых научных истинах. И все же наши многократные упоминания о том, что способность белковых молекул принимать вполне определенную структуру сообщает им такие необычные и очень важные свойства, что и рассказывать-то пока об этих свойствах нельзя, при некоторой доле читательского недоброжелательства может быть принята за разновидность литературного кокетства. Не знаем, удастся ли нам с помощью подобного (несомненно, предосудительного) приема завлечь в свои сети хоть одного читателя и зажечь в его сердце пламя бескорыстного интереса к молекулам ферментов. Однако более скромной цели мы, как нам кажется, все же достигли: читатель предупрежден, что цепочка биологического кодирования не обрывается на звене «третичная структура», а продолжается этапом «структура белка — функция белка».
Подробный рассказ о функциях белков в живом организме мы будем вести на примере, пожалуй, самой ответственной из них — ферментативного катализа.
На существование этого свойства белков мы в полном соответствии с избранным нами литературным стилем уже намекали ранее и даже, сколько помнится, попутно посудачили, что с помощью ферментов только и удается упорядочить химические превращения веществ, образующих живой организм. Теперь же, зная кое-что о принципах образования пространственной структуры молекул белков, мы можем поговорить на эту же тему гораздо подробнее.
Раздел, которого могло бы и не быть
Персонаж одной из миниатюр А. Райкина дал следующее определение: «Художник — это человек, который берет нужную краску и наносит ее в нужное место». Оставив претензии на оригинальность, напишем и мы вслед за А. Райкиным: «Фермент — это белок, берущий нужную молекулу и осуществляющий химическую модификацию нужной ее части».
Определение райкинского персонажа рассчитано на взрыв хохота в зрительном зале; наше определение, увы, может вызвать у знатоков обратную реакцию — удивление и возмущение, ибо оно, конечно же, не лишено множества недостатков. Взять хотя бы использованное в нем слово «нужный». («Нужный кому?» — сурово спросит иной бдительный материалист и, к сожалению, будет совершенно прав.) И еще: в нашем злополучном определении фермента ничего не говорится (по крайней мере, явно) о чудовищной быстроте, с которой ферменты выполняют свою работу. И еще о том, что в состав молекулы фермента могут входить, помимо белковой части, также и небелковые компоненты. И еще…
При желании этот список можно продолжить за счет упреков не столь существенных, но тем более неприятных. Что уж поделать, такова судьба всех лаконичных и категорических определений. Рассказывают, что некий литератор, занятый составлением толкового словаря, поинтересовался мнением знаменитого зоолога Ж. Кювье по поводу следующего определения слова «краб»: «Маленькая красная рыбка, которая плавает задом наперед». Ж. Кювье нашел это определение превосходным, однако отметил ряд мелких недочетов: краб не рыбка, не красный, не обязательно маленький и задом наперед не плавает.
Так что отречемся, пожалуй, от погони за чеканным и всеобъемлющим определением понятия «фермент». В конце концов, первые научные описания различных проявлений обескураживающих свойств ферментов неплохо обходились и без него. Ведь представление о ферментах как о белковых молекулах, обладающих особой валентной и пространственной структурой, внедрилось в биохимию лишь в последние десятилетия; до этого вопрос о химической природе ферментов оставался дискуссионным. Это не мешало, однако, интенсивному исследованию их каталитических свойств.
Большинство ранних исследований действия ферментов связано с процессами брожения — превращения сахара в спирт клетками дрожжей. Отсюда и происходят основные термины: «ферментум» по-латыни — закваска, брожение. Слово «фермент» прижилось в русском языке вполне основательно; для большинства же европейских языков характерен термин «энзим» («эн зимон» означает опять же «в закваске», но уже по-гречески). Изредка называют ферменты энзимами и в русской литературе, а уж слово «энзимология» для обозначения науки о ферментах приобрело совершенно монопольные права.
Итак, долгое время биохимики не имели вообще никакого понятия о том, что же за вещества представляют собой ферменты. Скорости, с которыми ферменты осуществляют контролируемые ими реакции, настолько велики, что для нормального течения обмена веществ в организме достаточны очень малые количества ферментов. Естественно, что их химическое выделение оказалось делом чрезвычайно сложным.
Первоначально полагали даже, что сбраживание сахара могут производить только целые, неповрежденные клетки дрожжей, а выделить из них некий «катализатор брожения» невозможно. Ярым приверженцем этой точки зрения оказался — увы! — один из величайших естествоиспытателей XIX века, Л. Пастер. К началу XX века стало ясно, что на этот раз Л. Пастер ошибается; удалось выделить сок дрожжевых клеток, который сбраживал сахар точно так же, как и целые клетки, удалось обнаружить в различных бесклеточных препаратах и другие проявления активности тогда еще загадочных ферментов. Однако в течение первой четверти нашего века вопрос о природе ферментов так и не нашел окончательного решения. И это несмотря на то, что средства химического анализа уже не были столь архаичными, а библиография исследований в области энзимологии насчитывала тысячи статей и сотни монографий.
Вот что можно было прочесть даже в лучших из них. В книге И. Смородинцева «Ферменты растительного и животного царства» (1922 год, 2-е издание) глава «Химическая природа ферментов» начинается словами: «Наши сведения о химической природе ферментов очень смутны и сбивчивы». И действительно, второй параграф этой главы озаглавлен «Доводы в пользу белковой природы ферментов», а третий — «Возражения против белковой природы ферментов». Другая книга: В. Бейлис. «Природа действия энзимов», перевод с английского. 1927 год. Здесь мы находим заголовок параграфа, который звучит еще более категорично: «Энзимы не представляют собой протеинов» (то есть белков). Мало того, в обеих книгах обсуждаются даже (правда, со значительной долей скепсиса) гипотезы, согласно которым ферменты как материальные химические соединения и не существуют вовсе, а ферментативная активность есть свойство, способное передаваться от одного тела другому, подобно, например, теплоте. Авторы этих гипотез утверждали, что ферменты способны действовать на расстоянии, через воздух или различного рода перегородки.
Странно, что все это вполне серьезно обсуждалось всего-то каких-нибудь пятьдесят лет назад. Может быть, такая серьезность диктовалась традиционным академическим стилем обеих монографий, требующим беспристрастного рассмотрения как «материальной», так и «силовой» теории действия ферментов. Симпатии авторов, несомненно, на стороне первой из них, и тем не менее И. Смородинцев завершает обсуждение вопроса примирительной фразой: «Надо сознаться, что все это шаткие доводы в пользу материальности ферментов, и потому некоторые исследователи придерживаются теории физического влияния ферментов».
Однако пусть не думает читатель, что мы пошли на беспрецедентное до сих пор отступление от своих литературных принципов (никакой «истории вопроса»!) ради высокомерного похлопывания по плечу «заблуждающихся» ученых прошлых десятилетий. Нет, этот раздел (которого, как справедливо отмечено в заголовке, могло бы и не быть) понадобился нам, чтобы показать, насколько трудно дается постижение даже сравнительно простых молекулярно-биологических истин, например, установление белковой природы ферментов. Ну и, конечно, для демонстрации динамизма развития неустанно прославляемой нами биологический науки: переход от полусхоластических рассуждений о тайнах активности ферментов к установлению первичной аминокислотной последовательности молекул сотен ферментов потребовал всего около сорока лет.
Сто тысяч операций в секунду
Всепроникающее влияние научно-технической революции распространяется в наши дни на самые неожиданные области человеческой деятельности. Возьмем, к примеру, цирк — веселое и жизнерадостное искусство, ничего, казалось бы, не имеющее общего с сухими и унылыми законами науки: в цирке все построено на смелости, ловкости, виртуозном умении владеть своим телом и (чего греха таить) на пресловутой ловкости рук.
Однако никакая ловкость рук не поможет фокуснику продемонстрировать такой, например, аттракцион: снятый с плеч пиджак небрежно швыряется под самый потолок, к люстре и… повисает в воздухе, в метре от люстры, презрев земное притяжение. Чем-то там гремит ударник циркового оркестра, прожекторы эффектно высвечивают замерший в высоте пиджак, а бешено аплодирующие зрители (по крайней мере, часть из них), пытаясь разгадать загадку, приходят к выводу, что они стали невольными участниками сеанса массового гипноза. А между тем никто не гипнотизировал и не пытался их «обмануть». Фокус (с точки зрения физики) исключительно прост: в пиджак запрятана металлическая пластинка, а в люстру — мощный электромагнит переменного тока. Как видите, никакой ловкости рук.
Подобных «научных» фокусов существует немало, но все они, как это ни обидно авторам-биологам, носят либо «физический», либо «химический» (вроде известного самовозгорания свечей) характер. Поэтому мы берем на себя смелость рекомендовать широким массам фокусников — как любителей, так и профессионалов — идею «биохимического» фокуса: в стакан, до половины заполненный прозрачной жидкостью, после соответствующих пассов и заклинаний, незаметно добавляют каплю некоего раствора. Жидкость немедленно «вскипает», да так бурно, что все содержимое стакана выплескивается наружу; это должно выглядеть очень эффектно, так что за аплодисменты зрителей можно не беспокоиться.
Секрет нашего фокуса, как ясно каждому, скрыт в свойствах загадочного «раствора» и «прозрачной жидкости». В «жидкости» ничего биохимического нет: это обычная перекись водорода (Н2О2), которую можно приобрести в любой аптеке, поскольку она широко используется в быту (средство для прижигания порезов и царапин, для чистки одежды, для… впрочем, во избежание гнева читательниц-блондинок, здесь лучше поставить точку). Перекись водорода, как известно, способна самопроизвольно распадаться на воду и кислород: 2Н2О2 ? 2Н2О + О2. Именно поэтому купленная в аптеке перекись через несколько месяцев становится непригодной к употреблению.
Таинственный же «раствор», наоборот, как раз и придает фокусу «биохимический» характер: это раствор фермента под названием каталаза, функция которого в организме заключается в ускорении распада перекиси водорода. (На языке биохимии то же самое говорится иными словами: молекула перекиси водорода является субстратом фермента каталазы.) Дело в том, что она образуется в организме при различного рода биохимических превращениях, а поскольку перекись водорода является сильным окислителем, то и дело норовящим вмешаться в течение других реакций, возникает необходимость оперативно ее обезвреживать, разлагая на вполне безопасные продукты. Эта-то задача и «возложена» организмом на каталазу.
Именно колоссальная «производительность труда» каталазы и служит причиной успеха нашего фокуса: «взрыва» перекиси водорода в стакане. Судите сами: измеренное хитроумными способами быстродействие некоторых типов каталазы (например, каталазы, содержащейся в печени лошади) поистине впечатляет — одна молекула фермента в течение секунды способна расщепить 100 тысяч молекул перекиси водорода! Теперь понятно, что может натворить одна капля каталазы в ста граммах перекиси: процесс распада на воду и бурно выделяющийся кислород будет длиться не несколько месяцев, как в обычных условиях, а несколько секунд. Здесь уместно заметить, что лучший небиологический катализатор реакции разложения перекиси водорода — платина — уступает каталазе по эффективности действия примерно в тысячу раз.
Кстати, по скорости действия каталаза вовсе не чемпион среди ферментов; так, фермент холинэстераза из электрического органа ската превосходит ее в несколько раз. Так что эпитеты «огромная», «удивительная» и даже «чудовищная», которые авторы позволяли себе использовать в предыдущих главах, говоря о скорости ферментативных реакций, никоим образом не являются преувеличением — мы только что убедились в этом с фактами в руках.
Ну что же, 100 тысяч так 100 тысяч, подумает читатель, уже привыкший к всевозможным астрономическим (или все же молекулярно-биологическим?) числам на страницах этой книги. И тем не менее давайте попытаемся хоть с чем-нибудь сравнить «производительность» в 100 тысяч «обработанных» молекул субстрата в секунду. С конвейера Волжского автозавода сходит 0,026 автомобиля в секунду, поточная линия по вырубке «лепестков» для пайки радиодеталей за секунду выпускает около десятка изделий, производительность швейной машины — 20 стежков в секунду… Нет, пожалуй, механические устройства нам не подойдут — характеристики типа «100 тысяч операций в секунду», «300 тысяч операций в секунду» мыслимы лишь в связи с быстродействующими современными ЭВМ (да и то быстродействие самой распространенной ныне ЭВМ «Минск-32» всего около 20 тысяч операций в секунду).
Впрочем, все эти сравнения выглядят несколько суховато; оставив их в стороне, попросим читателя еще раз задуматься над фактом: одна молекула каталазы разлагает в течение секунды 100 тысяч молекул перекиси водорода.
Молекулы-автоматы
Вообще говоря, цифра «100 тысяч операций в секунду» уже должна, по расчетам авторов, поразить воображение читателя и заставить его задуматься над загадкой быстродействия ферментов. С другой стороны, искушенный в чтении научно-популярных сочинений человек понимает, что загадка эта будет далее объясняться с помощью особых свойств молекул фермента и субстрата и их взаимодействия (именно описание свойств биологических молекул и составляет главную тему нашей книги). Но вот тут-то (по крайней мере, вначале) читателя ждет жестокое разочарование: первое же самое отдаленное знакомство с молекулярным механизмом отдельного акта ферментативного катализа показывает, что цифру «100 тысяч операций в секунду» следует, по крайней мере, удвоить!
Дело в том, что «технологический цикл» ферментативного катализа состоит из двух операций: поиск и связывание молекулой фермента молекулы субстрата и собственно акт катализа — химическая модификация молекулы субстрата. Условие выполнения первой части этого цикла выглядит так: каждая молекула субстрата, участвующая в реакции, должна на некоторое время связаться с молекулой фермента, образуя так называемый фермент-субстратный комплекс. Подобное связывание может осуществляться за счет рассмотренных ранее невалентных сил, водородных связей, электростатических сил, гидрофобных взаимодействий, однако в ряде случаев между молекулами фермента и субстрата на короткое время образуются валентные связи. Иными словами, молекула фермента как бы захватывает молекулу субстрата, производит с ней некоторую операцию и затем отделяет от себя уже модифицированную молекулу (или молекулы), называемую продуктом.
Весь этот процесс не так уж сложен, как кажется с первого взгляда: во всяком случае, любой допризывник, изучающий устройство автомата, уже сможет довольно наглядно представить себе акт ферментативного катализа. Ведь процесс стрельбы из автомата организован похожим образом: вначале патрон из магазина подается в приемную коробку (с образованием, могли бы мы сказать, комплекса «автомат — патрон»), а затем срабатывает затвор, и «продукты реакции» — пуля и стреляная гильза — отделяются от автомата, после чего автомат готов для приема следующего патрона.
Прямое доказательство именно такого пути ферментативной реакции — через образование фермент-субстратного комплекса — было экспериментально получено сравнительно недавно. Вначале это удалось сделать с помощью спектральных методов (спектр смеси субстрат-фермент отличался от суммы спектров фермента и субстрата в отдельности), а в самое последнее время методы рентгеноструктурного анализа позволили установить и молекулярное строение некоторых фермент-субстратных комплексов.
Однако интереснее всего то, что само представление о существовании фермент-субстратного комплекса вовсе не является заслугой современной молекулярной биологии. Предположение об образовании фермент-субстратного комплекса высказывалось на основании различных косвенных данных еще в конце прошлого и в самом начале нынешнего века петербургским профессором Г. Тамманом и французским химиком В. Анри (в отечественной биохимической литературе фамилия последнего почему-то упорно пишется на английский лад — Генри). Окончательно же гипотезу фермент-субстратного комплекса утвердили в 1913 году немецкие ученые Л. Михаэлис и М. Ментен. Как мы помним, в это время ни один исследователь еще не имел представления не то что о молекулярной структуре ферментов, но и о химической их природе вообще. Каким же образом все-таки удалось установить факт образования фермент-субстратного комплекса?
История утверждения в биохимии понятия «фермент-субстратный комплекс» представляет собой блестящий пример успеха теоретической мысли при истолковании экспериментальных данных: характера зависимости скорости ферментативной реакции от концентрации субстрата, и поэтому заслуживает более подробного изложения (таким образом, авторы еще раз нарушают свой собственный принцип «антиисторизма»; что ж, по крайней мере, теперь никто не сможет назвать их догматиками).
Вновь повторим, что рабочий процесс молекулы фермента может быть расчленен на две операции: поиск молекулы субстрата, заканчивающийся ее связыванием, и каталитический акт, по окончании которого молекула фермента освобождается для следующего цикла. Очевидно, что в растворе, содержащем определенное количество молекул фермента, столкновения свободных молекул фермента с молекулами субстрата при их случайном движении происходят тем чаще, чем выше концентрация субстрата: число таких столкновений в единицу времени оказывается тем самым пропорциональным концентрации субстрата. Значит, с увеличением концентрации субстрата в растворе ферментативная реакция пойдет быстрее, поскольку быстрее будет выполняться первая операция — связывание субстрата.
Ясно, однако, что достигаемое таким образом ускорение процесса не безгранично: ведь при этом сокращается лишь время, «расходуемое» молекулой фермента на первую операцию. Пусть даже при очень больших концентрациях субстрата связывание освободившейся молекулой фермента новой молекулы субстрата будет происходить практически мгновенно. Легко понять, что скорость реакции будет в этом случае целиком определяться временем, расходуемым на вторую операцию, — собственно каталитический акт. И сколько бы мы ни продолжали увеличивать концентрацию субстрата, на скорости реакции это уже не скажется. (Здесь опять может пригодиться аналогия «автомат-патрон»: увеличивать скорость подачи патронов в приемную коробку не имеет смысла — затвор просто не будет успевать срабатывать.) Иными словами, существует предельная скорость реакции, определенная только «чистой» скоростью второй операции, которая по большей части не зависит от величины концентрации субстрата.

Ох уж это «по большей части», которое нам приходится сплошь и рядом вставлять в довольно простые вообще-то объяснения! Вот, казалось бы, и здесь — к чему оно? Ответим вопросом на вопрос: а к чему на новом, добротном и безусловно надежном теплоходе на каждом шагу развешаны спасательные круги? В нормальной ситуации, ясное дело, — ни к чему, а попадись на пути корабля айсберг, риф или торпеда — глядишь, и пригодятся.
Точно так же в большей части тиража этой книги можно было бы совершенно безболезненно опустить все эти «по большей части», «почти всегда», «в большинстве интересующих нас случаев» и т. д. Но в каждый экземпляр из того (мы надеемся, минимального) их количества, который попадет в руки, скажем, студента-биохимика, все эти оговорки непременно должны быть включены. Ибо, прочитав последнюю фразу предыдущего абзаца, в варианте, не содержащем спасительного «по большей части», такой студент — если, конечно, он не совсем уж круглый двоечник — придет в законное негодование: «Позвольте, а полисубстратные ферменты, а аллостеризм, а…» Много еще мудреных слов может высказать оскорбленный в лучших своих чувствах биохимик по этому поводу и будет, безусловно, прав. Но, как это уже не раз случалось и ранее, в создаваемой нами идеализированной и упрощенной картине основных жизненных процессов, увы, нет места второстепенным деталям, в том числе и аллостеризму и всему остальному. Тем паче следует предупредить возможные упреки людей сведущих в чрезмерной категоричности. Так что истинная причина возникновения перечисленных словесных вкраплений — самая обычная перестраховка.
Однако к делу: итак, если в процессе ферментативной реакции действительно образуется фермент-субстратный комплекс, зависимость скорости реакции от концентрации субстрата окажется значительной при малых его концентрациях и практически исчезнет при больших. Л. Михаэлис и М. Ментен представили эту зависимость математически в виде уравнения, носящего с тех пор их имена. И именно благодаря тому, что с помощью этого уравнения прекрасно удалось описать измеренные на опыте кривые зависимостей скоростей ферментативных реакций от концентрации субстрата, умозрительная гипотеза образования в процессе реакции фермент-субстратного комплекса превратилась в почти полную уверенность, хотя ни о каком прямом наблюдении такого комплекса не могло быть и речи в те времена. Подобные наблюдения стали возможны лишь гораздо позже, и они-то во многом и создали молекулярной биологии репутацию наиболее современной отрасли науки.
О ключах, замках и огурцах
Новый раздел начнем со ставшего уже традиционным горестного сетования на свою авторскую судьбину. На этот раз — вот по какому поводу: количество страниц, остающихся до конца книги, быстро тает, и становится непонятным, как же нам удастся успеть объяснить все те вопросы, которые мы оставляли без ответа в предыдущих главах и разделах, небрежно обещая вплотную заняться ими в главах последующих. Правда, мы успели подробно обсудить одну из чрезвычайно интересных особенностей молекул ферментов — их быстродействие (но не объяснить его) и получили возможность перейти к высокой избирательности действия, их специфичности, поскольку указание на возможную природу этого свойства содержится уже в самом факте существования фермент-субстратного комплекса.
Необычность специфичности действия ферментов легко понять на таком простом примере: фермент, расщепляющий определенный тип сахара, скажем, глюкозу, — безошибочно будет выбирать молекулы глюкозы, и только глюкозы из смеси, содержащей хотя бы и сотню сахаров иного типа. Иногда специфичность фермента менее узка, и он действует не на единственное соединение, а на более или менее ограниченный круг соединений, объединяемых некими общими структурными признаками.
Чрезвычайно важно здесь упоминание именно о структурных признаках молекулы субстрата — в данном случае слово «структура» следует понимать как «пространственная структура». А если вспомнить при этом, что всякий фермент — белок, и как таковой обладает уникальной, строго определенной трехмерной структурой молекулы, то сама собой напрашивается мысль: на поверхности молекулы фермента должна быть какая-то выемка или иной пространственный шаблон, точно соответствующий форме молекулы того субстрата, в отношении которого специфичен данный фермент. Тогда случайное попадание молекулы субстрата в выемку на поверхности фермента может вызвать его связывание и, следовательно, образование фермент-субстратного комплекса. И значит, фермент-субстратный комплекс возникает за счет пригнанности друг к другу пространственных структур фермента и субстрата, причем подгонка должна быть весьма точной, такой, как… как, например, подгонка ключа к замку.

Воздержимся здесь от обсуждения вопроса о том, насколько сама собой и всякому ли действительно напрашивается вышеупомянутая мысль; впервые, по-видимому, она пришла в голову знаменитому немецкому исследователю Э. Фишеру, основоположнику современной химии белка. (Отметим лишь в скобках, что таково, надо полагать, всеобщее свойство «очевидных» научных идей: они, как правило, посещают лишь наиболее выдающихся и знаменитых ученых — правда, обычно до того, как те становятся знаменитостями.)
Итак, аналогия «субстрат — фермент» — «ключ — замок» принадлежит, как ни жаль, вовсе не авторам настоящей книги: выражение «гипотеза ключа и замка» вот уже более шестидесяти лет кочует по страницам учебников биохимии именно с легкой руки Э. Фишера.
В наше время гипотеза ключа и замка (с незначительными модификациями) получила надежное экспериментальное подтверждение. Проиллюстрируем это примером лизоцима — фермента, призванного ограждать организм от ряда бактерий.
Оболочка многих бактерий состоит главным образом из полисахаридов — так же как и у большинства прочих растительных клеток (напомним, что бактерии относятся к растительному царству). У высших растений основную массу клеточной оболочки составляет целлюлоза — вещество, всем хорошо знакомое: эта книга, например, процентов на семьдесят состоит из целлюлозы. («А на оставшиеся тридцать — из неимоверно скучного текста», — заметит про себя язвительный читатель.) Молекула целлюлозы — полимер, элементарным звеном которого является остаток глюкозы: молекулы интересующего нас класса полисахаридов, входящих в состав клеточной стенки бактерий, образованы остатками так называемых аминосахаров. Защитная роль лизоцима заключается в разрушении бактериальных оболочек; действуя на цепочку полисахарида клеточной стенки, он расщепляет его молекулу на аминосахара, и лишенная оболочки бактерия погибает.
Модель молекулы лизоцима очень легко и даже приятно изготовить самому: возьмите не слишком длинный огурец (лизоцим — короткий белок, в его аминокислотной последовательности всего 129 остатков) и откусите на середине его длины умеренных размеров кусок, следя за тем, чтобы выемка чуть не доходила до центра. Откушенную часть можно съесть, а оставшаяся — если только направление выкушенного желоба не вполне перпендикулярно продольной оси огурца — и будет вполне подходящей моделью молекулы лизоцима.
В том, что наша модель правильна, убеждают многолетние исследования группы английских кристаллографов под руководством Д. Филлипса. Третичная структура лизоцима, по их данным, представляет собой два сравнительно массивных элемента, соединенных более узкой перемычкой, то есть в точности соответствует нашей огуречной модели. Желоб, проходящий поперек глобулы, вполне четко оформлен, и, как оказалось, неспроста: именно в этот желоб «укладывается» молекула полисахарида, расщеплением которой и занят лизоцим. Правильнее, видимо, было бы даже сказать, что молекула лизоцима усаживается верхом на цепочку полисахарида, — поскольку молекула фермента подвижнее и меньше.
Даже очень грубое представление о форме глобулы фермента позволяет кое-что сказать о том, почему он специфичен по отношению к данному субстрату. В нашем случае огурца-лизоцима приблизительным критерием возможности образования комплекса с субстратом — молекулой полимера может служить просто-напросто ширина оставленного на поверхности огурца желоба. Ясно ведь, что молекулы полимера, имеющие большую ширину, в таком желобе не поместятся, меньшую — не удержатся: как мы помним, плотно упакованные структуры гораздо стабильнее рыхлых. Однако взаимное соответствие связывающего центра фермента (то есть того же желоба) и субстрата касается не только «поперечных» размеров полимера, но и особенностей его формы: «ширина молекулярной цепочки» — понятие условное и может использоваться разве что в сочетании с нашим огурцом. Цепочка определенного диаметра может быть набрана из цилиндрических, сферических, чечевицевидных и вообще какой угодно формы бусинок, и, несмотря на одинаковый диаметр, след каждой такой цепочки, оттиснутый, например, в пластилине, будет различным.
Так что на самом деле подборка «ключа» к «замку» производится гораздо точнее (недаром в нашем изложении появились оттиски в пластилине — заветная, если верить авторам детективных романов, мечта профессионального взломщика). Упоминаемые выше работы кристаллографов показали, что участок молекулы полисахарида, состоящий из шести звеньев, оказывается идеально «пригнанным» по размерам и форме к имеющемуся на поверхности глобулы лизоцима желобу; аналогично и в принимающем молекулу субстрата углублении учтены особенности пространственной формы ее мономерного звена. Поэтому для всех прочих молекул, кроме полисахаридов весьма узкого класса, образование фермент-субстратного комплекса с лизоцимом практически исключено.
Вот так или — проявим еще раз склонность к перестраховке и осмотрительности — примерно так и организовано образование фермент-субстратного комплекса и в случаях иных субстратов и ферментов. Случаев этих многие тысячи: ведь практически каждая химическая реакция в живом организме катализируется ферментами. И для каждой реакции необходим, как правило, «свой» фермент — белок, пространственная структура которого уникальным образом «настроена» на образование фермент-субстратного комплекса именно с этой, участвующей в данной реакции молекулой субстрата.
Узкая «специализация», избирательность ферментов создает на первый взгляд излишнюю громоздкость и запутанность: цепочка последовательных химических реакций в организме с участием «обслуживающих» ее ферментов несколько напоминает торжественную процедуру одевания французских королей в XVII–XVIII веках — один придворный несет чулки короля, другой — камзол, третий — башмаки… «Специфичность» придворных по отношению к деталям королевского туалета налицо: привилегия нести именно чулки, а не камзол, завоевывалась беспорочной службой десятка поколений, и малейшее посягательство на нее становилось причиной дуэлей, интриг, отравлений… Однако тема нашего рассказа, к сожалению, далека от захватывающих историй в духе А. Дюма — в четком и налаженном «конвейере» ферментов нет места претензиям на «чужую компетенцию». И понятно почему: соперничество между, скажем, графом де Рокфором, наследственным Подавателем Левого Башмака Его Величества, и виконтом дю Камамбером, Подавателем Правого, может, в худшем случае, привести к тому, что Его Величество останется необутым. А вот если тот же лизоцим начнет расщеплять вместо узкого класса полиаминосахаров другие полимеры, например белки, — нет, страшно представить себе размеры катастрофы, которая постигнет организм вследствие превышения лизоцимом своих полномочий. Уж лучше примириться с мнимым «излишеством» — за счет специфичности — количества ферментов: по крайней мере, можно быть уверенным в надежности последовательности ферментативных реакций в организме.
Все эти проблемы, однако, выходят за рамки нашего и без того уж затянувшегося раздела. Мы надеемся, что в дальнейшем удастся еще вернуться к ним (как видите, авторы так и не удержались еще от одного легкомысленного обещания), а пока попытаемся дать разумное объяснение другому свойству ферментов — стереоспецифичности. Так называется избирательность ферментов по отношению к одному из зеркальных изомеров молекул с асимметричным атомом углерода. (Помните — проблема асимметрии биологических молекул?) Теперь, познакомившись с основными принципами образования фермент-субстратных комплексов, можно в общих чертах представить себе, как «удается» ферменту выбирать из смеси стереоизомеров лишь один тип молекул — например, только L-аминокислоты.
Дело в том, что участок молекулы фермента, непосредственно взаимодействующий с молекулой субстрата при образовании фермент-субстратного комплекса (такой участок называют активным центром фермента), характеризуется не только размерами и формой своей «выемки», но и вполне определенным расположением специфических групп: гидроксилов, карбоксилов, алифатических и ароматических боковых радикалов и т. д. Каждая из этих групп способна по-своему содействовать более тесному связыванию молекул фермента и субстрата: например, положительно заряженные функциональные группы фермента могут взаимодействовать с отрицательно заряженными группами субстрата, между группами другого типа могут возникать водородные связи — словом, возможностей для специфических взаимодействий вполне достаточно.
Если рассмотреть теперь, как мы делали ранее, молекулу субстрата (например, аланина), содержащую асимметричный атом углерода:
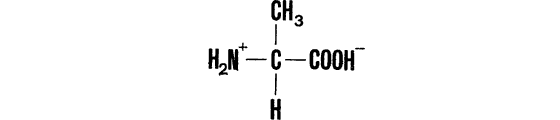
с тетраэдрическим расположением заместителей, и предположить, что в активном центре фермента, вовлекающего аланин в некоторую реакцию, происходит связывание субстрата за счет трех групп ?NH2+, ?СООН? (электростатические взаимодействия с группами активного центра) и ?СН3 (гидрофобные взаимодействия), то очевидно, что группы, ответственные за поддержание этих взаимодействий, должны образовать в активном центре треугольник. Причем, и это самое главное, такой треугольник будет соответствовать лишь одной из возможных последовательностей обхода вершин по часовой стрелке: либо ?NH2+ ?СН3, ?СООН? (левая аминокислота), либо ?NH2+, ?СООН?, СН3 (правая аминокислота). И уж если расположение специфических групп в активном центре фермента способствует связыванию L-аминокислот, то на их зеркальные изомеры, D-аминокислоты, фермент не будет обращать никакого внимания.
Иными словами, явлению стереоспецифичности ферментов тоже можно найти вполне сносное истолкование, исходя из двух «китов» молекулярной биологии: существования строго определенной пространственной структуры белковых молекул и представления об образовании в процессе ферментативной реакции фермент-субстратного комплекса. В заключение нам остается лишь (с привычной уже читателю осторожностью) воспользоваться стандартной формулировкой, которую авторы детективных романов помещают на первой же странице: все конкретные детали описанного механизма действия стерео-специфичного фермента нами вымышлены, а всякое их совпадение с реальными фактами следует считать чисто случайными.
Бухгалтерия в биохимии
Ну что ж, основные детали первого этапа ферментативной реакции — образование фермент-субстратного комплекса — как будто прояснились. А что дальше? Что происходит с молекулой субстрата, встроенной в фермент-субстратный комплекс? Пока ясно только одно: такая молекула должна претерпеть некие химические превращения — иначе говоря, принять участие в какой-то химической реакции. Причем скорость такой реакции, или, что то же самое, вероятность ее осуществления, должна быть намного выше, чем в отсутствие фермента.
Мы попытаемся объяснить, почему же все так и происходит на самом деле; для этого, однако, придется вернуться к кое-каким из понятий, которые авторы пытались привить читателю в третьей главе (возможно, легкомысленно им пропущенной) — к элементам физической химии, термодинамики, статистической физики, словом, чего угодно, только не биологии.
Впрочем, выражаясь подобным образом, мы нечаянно льем воду на мельницу тех, в чьем представлении образ биолога ассоциируется с чуточку карикатурными олеографиями конца прошлого века: «ботаник», «зоолог», «энтомолог», «натуралист» вообще — прежде всего чудак (и чудак почему-то неизменно тощий и с хилой бороденкой). Авторы рассматривают такие олеографии в старых журналах без обиды и даже с удовольствием; но вот ведь что удивительно — масса людей, никогда и в глаза-то не видевших эти картинки, представляет себе биолога точь-в-точь таким, как персонажи старых олеографий. Конечно, и сейчас встречаются среди биологов бородачи (хоть вовсе не обязательно тощие) или индивидуумы плохо упитанные (хоть даже и без бороды), да не в том корень нашей обиды.
Хуже всего то, что очень, очень многие по сей день представляют себе биологию как науку чисто описательную, не требующую особых мыслительных усилий. Вот идет себе этакий жюль-верновский кузен Бенедикт по джунглям, глядь — ему на шляпу садится бабочка. Присмотрелся — батюшки, это же неизвестный науке вид. Или, например: смотрит иссохший бородач в микроскоп день, другой, месяц, год и вдруг видит: плывет холерный вибрион. Вот тебе сразу и открытие!
Можно было бы, полемизируя с подобными взглядами, пуститься в пылкие объяснения по поводу того сколько нужно знать, а самое главное — как много приходится размышлять таким вот кузенам Бенедиктам о том, где именно и каким способом следует искать эту самую бабочку или вибрион.
(Заметим вскользь, что поиск, скажем, элементарных частиц «неизвестного науке вида» ничем принципиально не отличается от задачи энтомолога: в обоих случаях речь идет прежде всего о пополнении и уточнении существующей классификации — будь то бабочки с острова Маврикий или всевозможные сорта мезонов. И тем не менее в глазах широкой общественности, научной в том числе, физики-ядерщики окружены куда как большим почтением — может быть, из-за гигантских и дорогостоящих установок: циклотронов, реакторов, пузырьковых камер? В самом деле, разве можно даже в шутку сравнить синхрофазотрон и марлевый сачок энтомолога!)
И все же мы воздержимся от рассуждений по этому поводу и не только по соображениям дисциплины изложения. Дело в том, что и среди значительной части самих биологов по сей день бытует представление об истинно идеальном облике своего коллеги, как две капли воды сходное с теми, прабабушкиными олеографиями. Какой же вы биолог, справедливо полагают коллеги, если все свое рабочее время вы проводите за спектрофотометром, счетчиком Гейгера — Мюллера или, упаси боже, вычислительной машиной! И если, к примеру, редколлегия сборника «Проблемы зоологии северных морей» получит две статьи, из коих одна будет называться «Исследование веса печени годовалых тюленей в районе острова Врангеля», а другая — «Энтропия плавления ДНК различных ракообразных Карского моря», — можете совершенно не сомневаться, что вторая статья будет отвергнута, а первая — принята. Между тем в обеих речь идет об измерении физических характеристик составных частей обитателей Ледовитого океана. (На всякий случай поспешим заверить редколлегию сборника с таким названием — если он существует, — что приведенный пример никоим образом не связан с реальными сборниками и вообще совершенно не типичен для зоологии северных морей.)
Молекулярная биология вовсе не выделяется в ряду прочих биологических дисциплин тем, что использует понятия и методы точных наук. Термины «вес», «температура», «скорость», «доля сухого вещества», «содержание кальция» совершенно неизбежны на страницах любого вполне традиционного учебника биологии, являясь в то же время бесспорным заимствованием из области физики и химии. Но все они интуитивно понятны каждому, и использование их представляется чем-то естественным в любом контексте. Любые же молекулярные процессы по необходимости должны описываться в терминах менее «обычных». Отсюда и упреки в почти искусственном привлечении понятий физики или химии для обсуждения молекулярно-биологических проблем.
Вот и сейчас нам необходимо рассмотреть несколько специальный вопрос об энергетике химических реакций; без этого трудно продолжать разговор о том, как действуют ферменты. А для того чтобы понять течение ферментативной реакции, надо же знать хоть кое-что о химических реакциях вообще.
Примером нам послужит одно из простейших органических соединений — метиловый спирт СН3ОН. Оно легко окисляется до так называемого муравьиного альдегида с выделением воды:
2СН3ОН + О2 ? 2СН2О + 2Н2О.
Напомним структурные формулы соединений, участвующих в этой реакции:
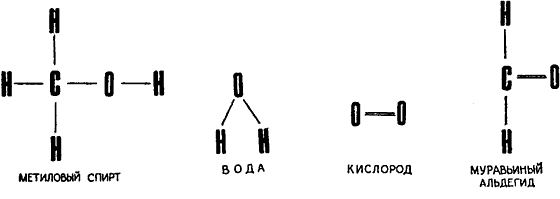
Перестройку атомов, соответствующую такой реакции, можно без труда осуществить, пользуясь необходимыми элементами описанного ранее «молекулярного конструктора»: восемью атомами водорода, четырьмя атомами кислорода и двумя — углерода. Но вот задача: почему, собственно, молекула метилового спирта, разлагаясь, дает «на выходе» именно такие молекулы? Ведь при помощи «молекулярного конструктора» можно воспроизвести и другие реакции, например: 2СН3ОН ? 2CH4 + O2.
Тем не менее самопроизвольного разложения метилового спирта на метан и кислород почему-то не происходит…
К сожалению, наш «молекулярный конструктор», прекрасно подходящий для моделирования пространственной структуры молекулы и ее конформационной подвижности, абсолютно непригоден в другом отношении: он никак не отражает чрезвычайно важную для химической реакции характеристику валентных связей — их сравнительную прочность, стабильность или, говоря языком физики, энергию их разрыва. Ведь при сборке или разборке молекулярных моделей любой тип валентных связей разрывается или формируется с одинаковой легкостью, а это, увы, совершенно не соответствует действительности.
На самом деле энергия разрыва валентной связи — по-видимому, нет нужды объяснять, что по величине она совпадает с энергией ее образования, — довольно сильно различается в зависимости от типа связи (одинарная, двойная, «полуторная» и т. д.) и от того, какая пара атомов образует такую связь. В нашем случае «молекулярный конструктор» позволяет в принципе формировать разные типы валентных связей, — как одинарных (C?O, О?H, C?H), так и двойных (С = О, О = О, С = С и т. д.). Однако «цена», которую система должна «заплатить» за их образование — энергия, — далеко не одинакова. Описывать, как можно теоретически рассчитать такую «цену», мы не будем (иначе над нашим изложением вновь нависнет зловещая тень квантовой механики), а сразу приведем примерный «прейскурант»:
О?H 120 ккал/моль
C?H 100 ккал/моль
С?O 90 ккал/моль
С = O 165 ккал/моль
O = O 120 ккал/моль
(Величины энергии валентных связей здесь приведены в килокалориях на один моль — единицах, имеющих наиболее распространенное (хоть и не исключительное) хождение в физико-химической практике. Вообще же в различных физических, химических, технических и т. п. расчетах используются самые разнообразные единицы энергии. Не будем, однако, придавать этому обстоятельству никакого значения, поскольку для взаимного пересчета различного рода энергетических «валют» существует определенный курс, в отличие от обычных валютных курсов, установленный раз навсегда и не подверженный влиянию какой бы то ни было конъюнктуры. Страшно даже подумать, что бы случилось, если бы в очередном номере «Журнала экспериментальной и теоретической физики» было помещено объявление о снижении с 15 июля курса джоуля по отношению к килокалории на 17 процентов!)
Итак, попытаемся с помощью нашего «прейскуранта» проанализировать реакцию окисления метилового спирта:
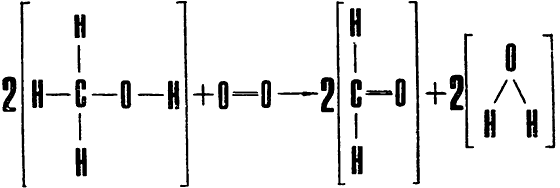
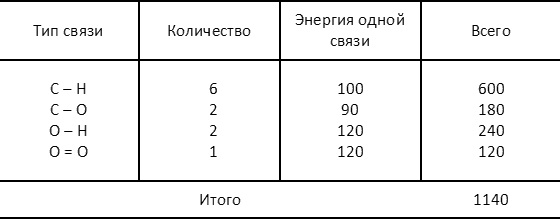
Расчет суммарной энергии связей компонентов, находящихся в левой части уравнения реакции, осуществляется очевидным способом:
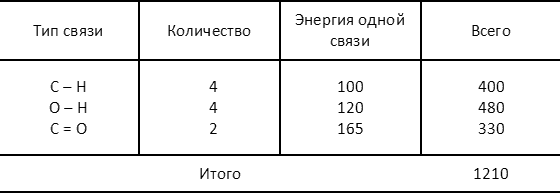
Совершенно аналогично для правой части:
Если среди читателей нашей книги попадутся счетно-финансовые работники, они, вне всякого сомнения, воспримут эту страницу как нечто до боли знакомое. Да и не надо вовсе быть счетоводом или бухгалтером, чтобы установить полнейшее сходство приведенных табличек со счетами, выписываемыми, скажем, в сапожной мастерской или ресторане. Есть люди, считающие проверку ресторанных счетов признаком дурного тона; надеемся, что они не станут проверять также и наши расчеты, и мы не обманем их доверия. Ту же часть читателей, которые решат все же наши выкладки проверить, ожидает разочарование: у нас все правильно.
Результаты этих расчетов надо понимать следующим образом. Если нашу систему молекул «разобрать» на отдельные атомы, а затем сформировать из них совокупность веществ, соответствующую либо левой, либо правой части уравнения рассматриваемой реакции, то в первом случае выделилось бы 1140 ккал/моль, во втором — 1210. Во втором случае, таким образом, система должна «потерять» больше энергии — иначе говоря, комбинация 2Н2СО + 2Н2О является состоянием с более низким значением энергии, чем комбинация 2СН3ОН + О2. А это, в свою очередь, означает, что направленность рассматриваемой реакции определена уже хорошо знакомой нам тенденцией самопроизвольного перехода системы в состояние с более низким значением энергии. Освобождающаяся при этом энергия, равная 70 ккал/моль, то есть разности энергий двух состояний, выделяется в виде тепла.
Теперь понятно также, почему не идет самопроизвольно упомянутая реакция разложения метилового спирта на метан и кислород:
2CH3OH ? 2CH4 + O2.
Если повторить наши нехитрые расчеты для этой реакции, то окажется, что для перестройки системы в требуемом направлении нужна затрата энергии — 90 ккал/моль. Иными словами, такая реакция предполагает переход из состояния с низким уровнем энергии в состояние с более высоким уровнем, что, как мы знаем, невероятно.
Правда, если уж быть совершенно точными, то придется признаться, что использованный нами метод расчета энергии, высвобождающейся в результате реакции, — несомненно, самый простой, — к сожалению, не является универсальным. В его основу положено предположение, что связь данного типа имеет одну и ту же энергию в любом соединении, а это справедливо лишь для очень ограниченного круга соединений. Для большинства реакций подобного рода расчет выглядит намного сложнее (напомним еще раз: квантовая механика!), но всегда его конечный результат — разница в энергии исходных и конечных продуктов — определяет направление химической реакции. Разумеется, мы говорим только о правильно выполненных расчетах…
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава 7. Похвала биологии
Глава 7. Похвала биологии Каждый из нас, к сожалению, хорошо знаком с неприятным явлением, которое все еще бытует кое-где, несмотря на строгие приказы министерств торговли, культуры и Госкомиздата СССР. Речь идет о так называемой «продаже с нагрузкой». Согласитесь, крайне
ГЛАВА XI.
ГЛАВА XI. Атмосферное орошение (ирригация).В 1876 г. в нашей литературе появилась книга, заслуживающая самого серьезного внимания. Но так как книга осмелилась быть оригинальной, а мы привыкли верить, что только книги, написанные на основании трудов заграничных "авторитетов",
ГЛАВА XII.
ГЛАВА XII. Очистка почвы от сорных трав.Целью очистки почвы от сорных трав является такое ее состояние, при котором после посева не могло бы расти никакое другое растение, кроме посеянного. Если мы позволим сорным травам расти на ниве, то они будут отнимать у почвы
Глава I
Глава I Восемь лет назад я написал небольшую книгу «Аксиомы биологии»[1], в конце которой высказал предположение, что возможно создание общей теории эволюции последовательно реплицирующихся систем. Завершил я книгу словами: «Под эту категорию попадают не только объекты
Глава 3
Глава 3 Описание метода лечебной кинологии и результатов исследования В предыдущих главах описывались теоретические аспекты метода лечебной кинологии. Постараемся схематически описать практический аспект методологии. Как уже отмечалось, данный метод находится на
Глава 3
Глава 3 Описание метода лечебной кинологии и результатов исследования В предыдущих главах описывались теоретические аспекты метода лечебной кинологии. Постараемся схематически описать практический аспект методологии. Как уже отмечалось, данный метод находится на
Глава 2. ДНК
Глава 2. ДНК На стене паба “Орел” в Кембридже висит синяя мемориальная доска, установленная в 2003 году в честь пятидесятилетия одного случая, когда разговоры в этом пабе приняли не совсем обычный оборот. Во время обеда 28 февраля 1953 года два завсегдатая “Орла”, Джеймс
ГЛАВА 5
ГЛАВА 5 С помощью Пам Смарт мне удалось разработать более простую и эффективную методику работы с людьми, испытывающими фантомные ощущения в отсутствующих конечностях, чем та, которая была описана в пятой главе.Мы провели серию опытов с людьми, у которых были
Глава III. Мир РНК-ДНК
Глава III. Мир РНК-ДНК 3.1. Миры до РНК и мир РНК Многие исследователи полагают, что первым клеточным миром был мир РНК (Ferris, 1999; Hoenigsberg, 2003). Однако по причинам, рассмотренным выше, более правдоподобна версия, согласно которой в ранних клетках функционировали информационные
Глава 1. Вид
Глава 1. Вид ТЕМЫ• История эволюционных идей• Современное эволюционное учение• Происхождение жизни на Земле• Происхождение человекаВ настоящее время на нашей планете обитает несколько миллионов видов живых организмов, каждый из которых по своему уникален. Каким
Глава 10. Уши{10}
Глава 10. Уши{10} Того, кто заглянет поглубже в ухо, чтобы увидеть, как устроен наш орган слуха, ждет разочарование. Самые интересные структуры этого аппарата скрыты глубоко внутри черепа, за костяной стенкой. Добраться до этих структур можно только вскрыв череп, удалив мозг,