4. БҰЛШЫҚ ЕТТЕР ФИЗИОЛОГИЯСЫ
Ет к?птеген ?зын клеткалардан немесе ет талшы?тарынан т?рады. Еттерді? е? басты ?асиеті – жиырылу ж?не боса?су.
– Ет ?анмен жа?сы ?амтамасыз етілген.
– Ет жеке-жеке нерв талшы?тары ар?ылы реттеледі.
Гистологиялы? т?р?ыдан ?арастырса? ?ш типтен т?рады:
а) ?а??а еттері;
б) біры??ай салалы еттер;
в) ж?рек еті.
Ет талшы?ы к?птеген миофибрилден т?рады. Осыны? н?тижесінде к?лдене? жола?ты болып к?рінеді.
?рбір миофибрилл екі т?рлі белокты? жіпшелерден т?рады: актин ж?не мизин. Миофибрилдерді? арасында к?птеген митохондриялар орналас?ан. Ет талшы?ыны? цитоплазмасын саркоплазма деп атайды, оны? ішін к?птеген мембраналы? торлар немесе саркоплазмалы? торлар алып жатады. Ет талшы?тарыны? к?лдене? ж?не миофибрил-дерді? арасында т?тікше ж?йесі немесе Т – ж?йесі ?теді. Олар сарколеммамен байланыс?ан.
Кейбір жерлерде (?сіресе, саркомерада) Т – ж?йесі 2 саркоплазма торында цистернасыны? арасында орналасады. Сонды?тан да осы бір Т – т?тікшеден ж?не екі цистернадан т?ратын кешенді триада немесе ?штік деп атаймыз. Т?тікшемен цистерналар бір-бірімен к?лдене? орналас?ан к?піршелер ар?ылы байланысады. Цистерналар Са++ ионын жинап ж?не шы?арып отырады. Соны? н?тижесінде осы иондарды? концентрациясы саркоплазмада кейде т?мендеп, кейде жо?арылап отырады, с?йтіп А?Фазаны? белсенділігін жо?арылату ар?ылы ет талшы?ыны? жиырылуына ?сер етеді.
?ара?ош?ыл ж?не ашы? т?сті жола?тарды? ауысып отыруы І ж?не А айма?тарыны? орналасуына байланысты (1-сурет).
І айма?ы Z деп белгіленіп, сол?ын сызы? ар?ылы екіге б?лінген. Екі Z сызы?ыны? аралы? б?лігін (миофибрилл) саркомера деп атайды. Осы екі Z сызы?ыны? екі жа?ына ?арай актин жіпшесі таралады. Ал саркомераны? ортасында миозин жіпшесі орналас?ан. Саркомераны? белгілі бір участогында актин ж?не миозин жіпшелері бірін-бірі жауып т?рады. Осындай ?зара бірін-бірі жауып орналасуыны? н?тижесінде саркомерада бірнеше жола?ты? болуына ?келеді. Актин жіпшесі миозин жіпшесін жауып т?р?ан жерінде А дискісін немесе жола?ын ??райды, ал сол кезде І дискі немесе жола?ы бар айма?та тек актин жіпшесі ?ана болады. А дискіні? ортасы ашы? т?сті оны Н айма?ы деп атайды, ?з кезегінде М сызы?ы ар?ылы миозинді екіге б?ліп тастайды.
Миозин – жуан талшы?тар. Миозин молекуласы екі б?ліктен т?рады: ?зын тая?ша т?різді б?лігі “??йры?ы” ж?не біркелкі екі “басы”. Миозин жіпшесіндегі миозин молекуласыны? орналасуына келсек, “басы” оны? ?зына бойына орналас?ан, тек орта шетінде ?ана жо?. Миозин басыны? б?рінде де А?Фазалы? активтілік ?асиеті бар.
Актин – жі?ішке талшы?тар. ?рбір актин талшы?ы екі спиральдан т?ратын актинні? молекуласынан т?зілген, оны? (G – актин) біреуіні? бетіне екіншісі оралып орналасады. Актин молекуласыны? б?кіл комплексін F – актин деп (фибриллярлы актин) атайды. F ак-тинні? ?рбір молекуласы мен А?Ф байланыста болады. Біра? актинны? еш?андай да т?ріні? А?Фазалы? белсенділік ?асиеті болмайды. Сонымен актин F – актиннен ж?не екі к?мекші белок – тропомиозин ж?не тропониннен т?рады.
Тропомиозин – тая?ша т?різді фибриллярлы белок. Ол жіпшелерді ?осып, ажыратып т?ратын механизм. Тропонин – глобулярлы белок ?ш суббірліктен т?рады – І,С,Т. Мысалы, Тропонин Т – тропонинді тропомиозинмен байланысты. Тропонин С – Са++ ионына ?те сезімтал, оны? ?осылысы т?седі. Ал тропонин І – актин мен миозин арасында?ы ?зара ?серлегішті т?мендетіп отырады.
Актинні? осы екі к?мекші б?лігі миозинмен ?рекетке Са++ ионы болма?ан жа?дайда да т?се береді.
Жіпшелерді? жылжу теориясы
(Дж. Хэнсон, А. Хаксли 1954 ж.)
Тынышты? к?йде саркомерада белгілі бір де?гейде Mg++ ионы ж?не А?Ф бар, біра? Са++ ионыны? концентрациясы т?мен. Осы жа?дайда актин жіпшесі “ж?мыссыз к?йде” болады, себебі тропомиозин актинді ?стап т?рады, миозинні? “басы” жіпшені? ?зына бойында болады.
Ет талшы?ына нерв импульсі келгенде сарколеммада деполяризация тол?ыны пайда болады да, ол Т – ж?йе ар?ылы саркомераны? ішіне кіреді. Импульс триада?а дейін жетіп, Са++ ионыны? босанып шы?уына ?сер етеді, с?йтіп саркоплазмада оны? концентрациясы жо?арылайды. Одан кейін Са++ ионы С-тропонинмен байланысып, ?з кезегінде І тропонинмен ?зара байланыс?а т?сіп, актин мен миозин арасында?ы “к?пір” ар?ылы байланыс тудыру?а кедергі жасаушы тропонин эффект ж?йесіне жаяды. С?йтіп, Са++ ионы миозинні? А?Фазалы? белсенділігін жо?арылатады, одан ?рі актинні? ?серінен к?шейіп миозин “басы” актинмен байланыс?а т?сіп, к?лдене? актин-миозин “к?пірін” т?зейді. Осы “к?пірді” жасау?а кеткен энергия А?Ф-ты? гидролиздеу реакциясынан пайда болады, осы энергияны? ?серінен к?лдене? к?пірлерді? б?рышы ?згеріп, актин жіпшесі саркомераны? ішіне ?арай жылжиды.
Барлы? миофиламинеттерді? белсенділігіні? жо?арылауыны?, саркомераны тітіркендіруді? н?тижесінде к?ш пайда болып, оны? ?ыс?аруына ?сер етеді.
?озу саркомерада азая баста?аннан кейін Са++ ионын ?айтадан А?Фазаны? к?мегімен кальций сор?ышы ар?ылы цистерна?а кіреді.
Тропомиозин–тропонин кешені кезінде А?Фазаны? активтілігі басылып, к?лдене? к?пірлер ажырап, актин немесе миозин активтілігі жойылып, саркомера б?рын?ы тынышты? к?йіндегі де?гейіне келеді.
К?дімгі жа?дайда етті? жиырылуы ?шін ?ажет энергия гликогенді кейде май ?ыш?ылдарын пайдаланады. Осы заттарды? ыдырауыны? н?тижесінде А?Ф т?зіліп, энергия бірден жиырылады да, етке А?Ф?АЕФ+Фн+энергия т?зіледі. Тынышты? к?йде етте А?Ф-ты? саны онша к?п емес, ол сегізге жа?ын жеке жиырылу?а кетеді. А?Ф-ты? осындай де?гейі аэробты зат алмасу кезінде болады. Ал ж?мыс ат?ару кезінде А?Ф тез ж?мсалып, оны? тез арада ?алпына келуі ?амтамасыз етілуі керек, ол ?шін бас?а процестер іске ?осылады. А?Ф ?алпына келтіруге етті? ??рамында?ы креатинфосфат (КрФ) ?атысады. Креатинфосфат ар-?ылы еттегі т?зілген АЕФ ? А?Ф-ке ауысады. АЕА + КрФ ? А?Ф+ Креатин.
Осы процесс А?Ф ?орын ?здіксіз толы?тырып, етті? жиырылуына м?мкіндік жасайды.
Ал креатинфосфатты? де?гейі де т?мендейді, біра? оны? де?гейін толы?тыру гликогенні? немесе май ?ыш?ылдарыны? тоты?уыны? н?тижесіне байланысты. Н?тижесінде пайда бол?ан А?Ф креатиннен креатинфосфатты ресинтездеуге пайдаланады.
Кр + А?Ф ?КрФ + АЕФ
Б?лшы? ет ?те жо?ар?ы ?ар?ынмен ж?мыс істегенде о?ан келіп отыратын О2 оны? ?ызметін керекті де?гейде ?стап т?ру?а жеткіліксіз. Сонды?тан да осы жа?дайда гликолизді? е? а?ыр?ы ?німі ж?зім ?ыш?ылы Н+ ионыны? ?атысуымен с?т ?ыш?ылына айналады.
СН3 СОСООН + Н2 ? СН3 – СНОН – СООН
Осы Н+ ионын байланыстырушы оттегі м?лшеріні? жетіспеушілігінен болады. Оттегі етке “?арыз” болады.
Б?л кездегі энергия аз б?лінеді, барлы?ы 7 %. Сонымен бірге с?т ?ыш?ылы ?те улы, а?задан сырт?а шы?ып отыруы керек. Сонды?тан да шаршау болады. Ал ет ж?мысын то?тат?анда немесе азайт?анда ?ана, оттегі с?т ?ыш?ылын тоты?сыздандырып, жартысын гликогенге айналдырады. Осы процесс бауырда ж?реді. Осы жерде 1/5 с?т ?ыш?ылы толы? к?мір ?ыш?ылына ж?не су?а дейін тоты?ады. Осы реакция кезіндегі б?лінген энергия с?т ?ыш?ылыны? ?ал?ан б?лігін глюкоза?а айналдыру?а ж?мсалады. Глюкозаны? бір б?лігі етке ?айтып келеді, сол жерде е? со?ында гликогенге ауысады, ?ал?аны бауырда гликоген т?рінде ?орланады.
Б?лшы? ет талшы?тарыны? жиырылу ?рдісінде мынадай ?згерістер ?алыптасып, алты кезе?нен т?ратынды?ын д?лелдеген.
А. Электрохимиялы? ?згеріс б?л ?ш кезе?нен т?рады:
1. ?рекет потенциалыны? генерациясы;
2. ?П-ны? Т – ж?йесі ар?ылы таралуы;
3. Т – ж?йеде, саркоплазмалы? торда электр то?ыны? артуы, ферменттерді? активтілігіні? артуы, инозитол ?шфосфатты? ?алыптасуы, клетканы? ішінде Са++ ионыны? концентрациясыны? жо?арылауы.
Б. Хемомеханикалы? ?згеріс (б?л да ?ш кезе?нен т?рады).
1. Са++ ионыны? тропонинмен байланыс?а т?суі, актин жіпшесінде акцивті орталы?тарды? ?алыптасуы;
2. Миозин басыны? актинмен байланыс?а т?суі, миозин басыны? айналыс?а т?сіп серпімділігіні? дамуы;
3. Актин ж?не миозин талшы?тары бір-біріне ?арсы сыр?анау ар?ылы жылжуыны? н?тижесінде саркомераны? арасы тарылып, ет талшы?ы ?ыс?аруыны? н?тижесінде ?уаты жо?арылайды. Ал енді осы кезе?дерде болатын ??былыстар?а толы?ыра? то?талайы?.
Етті? ?оз?алу митонейроны ар?ылы ж?не ацетилхолин (АХ) медиаторы ар?ылы етте ?озу процесі пайда болады. Ацетилхолинні? ет пластинкасыны? ?шында?ы холинрецепторы мен ?зара ?серінен АХ-ге сезімтал каналдарда белсенділік пайда болып, пластинкада ?рекет потенциалы 60-мВ-?а дейін к?теріледі. Пайда бол?ан ?П ет талшы?ы мен клетка мембранасына жа?ын шеткі пластинка?а ?арай екі жа??а тарайды, жылдамды?ы 3-5 м/сек., t 360. Осында ?П жо?арылап, етті? жиырылуыны? бірінші кезе?і болып табылады.
Екінші кезе?де ?П кезіндегі ?озу денеде орналас?ан т?тікше ж?йелері ар?ылы етті? ішкі жа?ына ?арай таралады, с?йтіп мем-брананы? беткейімен етті? жиырыл?ыш аппараттарымен байланыс?а т?седі. Т–ж?йе саркоплазмалы? торды? цистернарларымен бірге к?рші екі саркомерамен байланысады. Электроимпульсті байланыс бол?ан жерде ферментті активтендіріп, инозитол?шфосфорды ?алыптастырады. Ал б?л фермент ?з кезегінде цистерна терминалында?ы кальций каналдарын белсендендіріп, Са++ иондарыны? цистернадан сырт?а шы?уына ?серін тигізеді,соны? н?тижесінде клетка ішінде оны? концентрациясы 10-7-ден 10-3 М-?а к?теріледі. Осы барлы? процестерді? жиынты?ы ?шінші кезе?де болады. Сонымен бірінші кезе?інде электросигналды? ?П-ны? тууынан химиялы? ?згеріске немесе Са++ ионы концентрациялы? жо?арылауыш?а, былайша айт?анда электрохимиялы? ?згеріске ?шырауына ?сер етеді.
Клетка ішіндегі Са++ ионыны? концентрациясыны? жо?арылауы тропомиозинді актин жіпшелеріні? арасында?ы тесіктерге ы?ыстырып, актин жіпшелеріні? участоктарында?ы к?лдене? к?пірше-лерді? пайда болып, о?ан миозин жіпшелеріні? байланыс?а т?суіне м?мкіндік береді. Ал б?л жерде айта кетерлік бір ж?йт, тропомиозинні? ішке ?арай ы?ысуына басты себеп – бол?ан жа?дай Са++ ионымен байланыс кезінде тропонинні? белокты? молекуласыны? конформациясыны? ?згеруіне байланысты. С?йтіп, кальций ионыны? ?атысуымен актин мен миозинні? ?зара байланысуы тропонин ж?не тропомиозин ар?ылы іске асырылады деп т?жырымдау керек.
Сонымен, т?ртінші кезе?де электромеханикалы? ?згерісіні? тууы Са++ионы мен тропонин арасында ?зара байланыс?а байланысты деп ?арау?а болады.
Бесінші кезе?де миозинні? басты актин жіпшелеріндегі к?лдене? к?пірлерге байланысуы. Б?л кезде миозин басы ?з ?сінен айналады, себебі актин жіпшесінде бірнеше активті участоктар бар, олар белгілі бір ретпен ?ана байланыс?а т?седі. Миозин ?з ?сінен айналуы талшы?тарда серпімділік ж?не ?ысым тудыру ар?ылы талшы?тарды? жиырылуын ту?ызады. Осы 4 ж?не 5-кезе?де хемомеханикалы? ?згеріс болады. Сонымен, миозин басыны? белгілі бір ретпен актин жіпшесі к?лдене? к?пірлерге байланысып, боса?сып отыруыны? салдарынан жуан ж?не жі?ішке жіпшелерді? бір-біріне ?арсы жылжып, саркомераны? арасы азайып, ет талшы?ыны? ?ыс?аруын алтыншы кезе? деп атаймыз.
Етті? жиырылу режимдері
?а??а еттеріне т?н ?асиет оларды? екі т?рлі режимде жиырылу ?абілеттілігі: изометриялы? ж?не изотониялы?. Изометриялы? режим мынадай жа?дайда бай?алады. Етті? активтілігі жо?арыла?ан сайын к?ші арт?анмен де талшы?тары ?ыс?армайды (мысалы, ет ?лкен ж?кті к?терген кезде), себебі талшы?тарыны? екі басыда ?атты бекітілген.
Изотониялы? режимде, ет ал?аш?ы кезде к?шін дамытып, ж?кті к?теруге ?абілеттілік к?рсетеді, содан кейін ет жиырылады, былайша айт?анда талшы?ыны? ?зынды?ы ?згереді, біра? сол ж?кті к?теру салма?ына те? к?ш ?атаяды.
Біры??ай салалы еттерді? жиырылу режимі изотониялы? ж?не изометриялы? режимді б?ліп ашумен ?атар кейде аралы? ауксотониялы? режим болатынды?ын да айта кету керек. Мысалы, іші ?уыс м?шелерді? ?абыр?асында?ы еттер жиырыла баста?анда ол м?шеде с?йы? бар десек, ал сырт?а шы?атын жерде сфинктер жабы? к?йде, сол жа?дайда изометриялы? жиырылу режимі пайда болады. М?шені? ?уысында ?ысым жо?арылап, ал біры??ай салалы еттерді? клеткасы ?згермейді (с?йы? ?осылмайды). Егер ?ысым артатын болса ж?не сфинктерді ашу?а м?жб?рлік туып Б.С.Е. клеткалары изотониялы? режимге ауысып с?йы?ты сырт?а шы?ару?а байланысты Б.С.Е. клеткаларыны? м?лшері азайып, к?ші т?ра?ты к?йде, с?йы?ты айдап шы?у?а жеткілікті к?йде болады.
?а??а еттері жеке дара жиырылу?а ж?не жина?талып немесе тетанус (гр. оцепенение – ?атып ?алу, дірілдеу) т?рінде жиырылады.
Дара жиырылу – берілген бір стимул?а бір рет жауап беру немесе стимулды? дара жиырылу?а жеткілікті ?сері.
Тетанус дегеніміз – ет талшы?ыны? ?за? уа?ыт бойы тітіркендіргенде ?за? жиырылуы. Тетанус кезінде ?рекет потенциалы бірнеше рет дамып отырып, С – тордан Са++ ионыны? ?за? уа?ыт бойы б?лініп шы?уынан кальцийді? де?гейі жо?арылап, тропонинмен байланыс?а т?седі. Тітіркендіргішті то?тат?анша жиырылу к?йінде ?алады.
Суммация – м?ндай жиырылу мынадай жа?дайда пайда болады: егер етке екі немесе одан да к?п стимул ?сер еткенде, та?ы да ?рбір келесі стимул одан б?рын?ыдан со? екінші жиырылу фазасы кезінде (боса?сып немесе ?зару кезінде) немесе 1-фазасында (?ыс?ару немесе к?шею), онда ?а??а етінде стимулдан жиырылу к?штері бірігіп, ?осылып тісті тіркеу бай?алады.
Суммацияны? екі т?рі болады: уа?ытша немесе жеке суммация, егер екінші тітіркендіргіш талшы?ты? боса?сы?ан кезіне с?йкес келсе (?заруы), онда толы? жиырылып ?лгермейді, біра? жа?а жиырылу процесі басталады. Бір интервалмен тітіркендіргішті жиілетсе, тісті суммация пайда болады (секундта 8 стимул). Егер тітіркену интервалын азайтып, тітіркендіргенде келесі тітіркендіргіш ?ыс?ару фазасына с?йкес келсе, тегіс тетанус пайда болады.
?а??а еттеріне т?н та?ы да бір жиырылу т?рі бар – контрактура. М?ндай жиырылуды эксперимент жасау ар?ылы о?ай бай?ау?а болады. Мысалы, етке жо?ары калийлі ерітіндімен ?сер ету. Осы кезде деполяризация процесі ?за??а созылып, етті? активтілігі ?за? уа?ыт бойы са?талады. Кофеинде осындай ??былыс береді, сонды?тан да гипер калийлік, кофеинді контрактура деп те атайды. Кофеинді контрактураны? себебі – саркоплазмалы? тордан Са++ ионыны? б?лінуі. Паталогиялы? жа?дайда да пайда болады, біра? ол кезде адамны? еркіне ба?ынбайды.
Б?лшы? ет ( musculus – б?лшы? ет) – б?лшы? ет ?лпасынан т?ратын дене б?ліктері, ж?йке ?лпасыны? ?сер етуімен ?ыс?ару ?абілетіне ие.
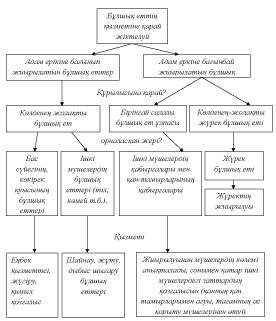
Б?ЛШЫ? ЕТТЕРДІ? ЕРЕКШЕЛІКТЕРІ
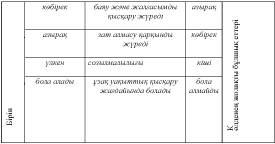
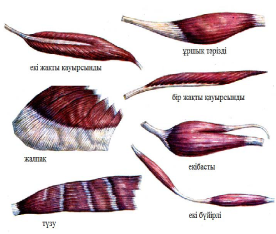
Б?ЛШЫ? ЕТТЕРДІ? ПІШІНІ МЕН К?ЛЕМІ
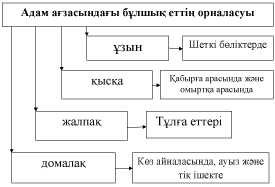
Б?ЛШЫ? ЕТТІ? ?ЫЗМЕТІ
Ж?мыс – б?лшы? етті? болуыны? негізгі шарты. Б?лшы? еттер тіпті тынышты? к?йіндеде тонусын са?тайды.
Тонус – б?лшы? ет талшы?тарыны? ?уатты аз шы?ындай отырып, т?ра?ты ширы?у жа?дайында, кернеулі к?йде болуын айтады.
Атрофия – б?лшы? етті? ?за? уа?ыт ?ызметсіз т?ру н?тижесінен ж?мыс ?абілетінен айырылуы.
?ажу – б?лшы? еттерді? физиологиялы? к?йі. Б?лшы? етті? ?ызметі н?тижесінде туындайтын, ж?мыс ?абілетіні? уа?ытша т?мендеуі.

Б?ЛШЫ? ЕТТІ? Ж?МЫСЫН ?АЛАЙ ЕСЕПТЕП ШЫ?АРУ?А БОЛАДЫ?
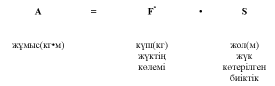
Ж?мысты? к?лемі б?лшы? ет к?ші мен ?зынды?ына т?уелді.
К?ш барлы? б?лшы? ет талшы?тарыны? ж?мысына тура пропорционал.
Б?лшы? ет к?шіні? пайда болуы мына факторлар?а да т?уелді: анатомиялы?, механикалы?, физиологиялы?, ж?не психологиялы? (б?лшы? етті? 1см2 к?лдене? ?имасы 10 кг ж?кті к?теруге ?абілетті).
Б?ЛШЫ? ЕТТЕРДІ? ?ЙЛЕСІМДІЛІГІ

Б?ЛШЫ? ЕТТІК ?ЙЛЕСІМДІЛІК
Синергистер – бір ?ана ?оз?алысты ж?зеге асыратын б?лшы? еттер.
Антогонистер – ?арама-?арсы ?оз?алыстарды ж?зеге асыратын б?лшы? еттер.
Б?лшы? еттік ?йлесімділік – б?лшы? еттерді? келісілген ж?мысы (бицепсті?(екі басты) ?ыс?аруынан – трицепсті?(?ш басты) жазылуыы, жиырушыны? боса?суынан, буші б?лшы? етті? жазылуы)
?А??А Б?ЛШЫ? ЕТТЕРІНІ? ??РЫЛЫСЫ МЕН ?ЫЗМЕТІ
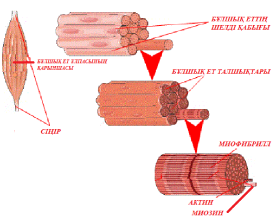
?ЫС?АР?АН ?А??А Б?ЛШЫ? ЕТТЕРІ
Миофибрилдерді? ??рылысы
Миофибриллдер – белоктардан(актин ж?не миозин) ??рал?ан протофибриллдерден т?рады.
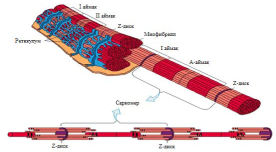
Саркомер – б?лшы? ет талшы?ыны? бірліктік ??рылымы.
Б?лшы? етті? жиырылуы
Данный текст является ознакомительным фрагментом.