Глава 9 Ламарковский, дарвиновский и райтовский режимы эволюции, эволюция эволюционируемости, надежность биологических систем и созидательная роль шума в эволюции
Глава 9
Ламарковский, дарвиновский и райтовский режимы эволюции, эволюция эволюционируемости, надежность биологических систем и созидательная роль шума в эволюции
Пер. Д. Тулинова
Драма ламаркизма
Как уже отмечалось в предисловии к данной книге, одной из ключевых заслуг Дарвина явилось то, что ему удалось выявить основополагающее сочетание случая и неизбежности, сопровождающее эволюцию жизни. Согласно Дарвину, большинство наследственных вариаций случайны, а направленность эволюции всецело задается естественным отбором, обусловливающим закрепление либо отсев случайных мутаций (Darwin, 1859). Как мы неоднократно подчеркивали, на стадии фиксации случайность также вносит свой существенный вклад посредством дрейфа и генетической тяги, которые критически зависят от популяционной динамики (см. гл. 8). Между тем Дарвин отводил значимую, хотя и второстепенную роль фундаментально иному типу вариации, так называемому ламарковскому наследованию.
К ламарковскому наследованию относят не случайно приобретенные фенотипические изменения, в особенности те, что непосредственно возникают в связи с использованием тех или иных органов и, соответственно, предположительно имеют адаптивный характер (полезны для организма). Вызывающий множество споров французский натуралист Жан-Батист Ламарк предполагал, что приобретенные изменения наследуются и представляют тем самым основу для эволюции. Ламарк был автором первой логически последовательной теории эволюции, которую представил в своей «Философии зоологии»: «наследование приобретенных (адаптивных) признаков» играло ключевую роль в этой теории (Lamarck, 1809).
Как неоднократно здесь подчеркивалось, в противоположность Ламарку Дарвин поставил во главу угла случайные, ненаправленные изменения, которые, согласно его теории, обеспечивают основной материал для естественного отбора. Правда, в более поздних изданиях «Происхождения видов…» Дарвин придавал гораздо больший вес ламарковскому механизму эволюции, по-видимому из-за опасений, что случайных вариаций и естественного отбора может оказаться недостаточно для обеспечения эволюционного процесса во всей его полноте.
«Наследование приобретенных (адаптивных) признаков» остается фундаментальной проблемой, значимость которой простирается далеко за рамки драматичной и увлекательной истории биологии XIX и XX веков. Взаимодействие между случайными и направленными изменениями генома (если последние вообще существуют) — главная тема данной книги. Здесь мы подходим к самой сути парадокса случая и необходимости, обращаясь к той части биологически важной неслучайности, которая, вероятно, присутствует уже на начальной стадии эволюционного процесса, в момент возникновения вариации. Говоря более конкретно, ключевой вопрос, касающийся ламарковского механизма наследования и эволюции, звучит следующим образом: могут ли факторы среды вызывать адаптивную эволюцию генома напрямую, без обращения к обходному пути естественного отбора?
По общему мнению, ламарковское наследование было всерьез скомпрометировано знаменитыми опытами Вейсмана, в которых он обрубал хвосты крысам[86]. Дискредитация этого типа наследования была усугублена причудливым и трагическим эпизодом предположительно мошеннических экспериментов Пола Каммерера с окраской жаб-повитух, что в итоге привело ученого к самоубийству[87]. В XX столетии «ламаркизм» приобрел исключительно дурную репутацию, когда в Советском Союзе стал составной частью лысенковщины[88]. Однако в последнее время несколько направлений исследований, похоже, сходятся в своих выводах, указывающих на то, что механизмы, которые в разной степени отвечают критериям наследственности по Ламарку, могут вносить важный вклад в процесс эволюции (Koonin and Wolf, 2009b).
Классическая ламарковская схема подразумевает наследование конкретных адаптивных характеристик фенотипа, которые индивид приобрел в течение жизни. В этом узком смысле ламарковский сценарий действительно выглядит несостоятельным по причине явного отсутствия механизмов прямого кодирования приобретенных признаков в геномный текст. Вместе с тем эта необратимость потока генетической информации, которую сформулировал Фрэнсис Крик и которая затем стала известна как центральная догма молекулярной биологии (Crick, 1970), строго применима лишь к передаче информации между нуклеиновыми кислотами и белками. Необратимость появляется на этапе узнавания аминокислот специфичными тРНК, что определяет сборку аминокислот в синтезируемые белки на основе последовательности триплетов в соответствующих мРНК. Не существует обратного пути в геном от любых изменений, могущих возникнуть в белковой последовательности[89]. Однако ситуация с нуклеиновыми кислотами, в частности РНК, иная: в биогенезе РНК нет необратимой стадии, которая делала бы невозможной передачу информации обратно в геном. Данное различие важно иметь в виду, когда мы обращаемся к разным классам генетических изменений, некоторые из которых могут быть инициированы факторами окружающей среды.
В этой главе я обсуждаю возможные ламарковские и квазиламарковские эволюционные механизмы наряду с другими важными феноменами, такими как эволюция эволюционирования (evolvability), точность передачи биологической информации и роль шума в эволюции. Все это имеет отношение к одному принципиальному вопросу: существует ли определенная эволюционная логика в мутационных процессах, порождающих геномные вариации, или эти процессы определяются одной лишь случайностью?
Ламарковский, дарвиновский и райтовский режимы эволюции и критерии для обнаружения ламарковского наследования
Прежде чем обратиться к широкому кругу явлений, в которых можно усмотреть все или некоторые признаки эволюционного механизма, ассоциирующегося с именем Ламарка, необходимо сформулировать суть ламарковского подхода и критерии, которым эволюционный процесс должен удовлетворять, чтобы считаться ламарковским. Я не рассматриваю подробно различия между оригинальными взглядами Ламарка и многочисленными их последующими интерпретациями; напротив, я хочу сосредоточиться на вычленении сущности того, что обычно известно как наследование приобретенных признаков и эволюция по Ламарку. Концепция наследственности Ламарка, будучи одним из двух краеугольных камней его эволюционной теории (Gould, 2002), зиждется на двух принципах, которым Ламарк в своей «Философии зоологии» и других работах придавал статус фундаментальных законов:
1. Использование или неиспользование органов.
2. Наследование приобретенных признаков.
Ламарк напрямую связывал «использование или неиспользование» с воздействием среды на «повадки» организма и, через эти повадки, на «форму и свойства» частей тела. При этом он, конечно, полагал, что такие адаптивные, вызванные воздействием среды, изменения наследуются. Ламарк писал: «Природа дает нам несчетные… примеры воздействия среды на поведение, а поведения на формы, организацию и пропорции частей тела животных». Таким образом, его идея наследственности была основана на трехкомпонентной причинно-следственной цепочке: среда — поведение — форма. Ламарк настаивал на важности изменений поведения в качестве промежуточного звена, связывающего окружающую среду с (наследуемым) изменением формы организма:
«Каково бы ни было влияние природных условий, они не вырабатывают непосредственных модификаций формы и организации животных. Однако серьезные перемены в окружающей обстановке влекут за собой изменение стимулов, а смена стимулов с неизбежностью приводит к перестройке поведения. И тогда, если новые потребности становятся постоянными, у животных вырабатываются новые повадки, которые сохраняются столько времени, пока действуют стимулы, породившие их» (Lamarck, 1809).
Ламарк ни в коем случае не был единственным, кто верил в наследование приобретенных признаков: по-видимому, таково было всеобщее убеждение того времени. Однако он был более конкретен, чем другие, в разъяснении цепи причин наследственности и, что более важно, сделал эту схему основой своей незаурядной концепции эволюции. Другим основанием эволюционной теории Ламарка была его убежденность в присущем эволюционирующим организмам стремлении к усложнению организации — или, попросту, прогрессу — которое, в глазах Ламарка, определяет процесс биологической эволюции вместе с наследственностью, как он ее понимал.
Хотя для обозначения этой фундаментальной тенденции Ламарк часто использовал словосочетание «жизненная сила» (pouvoir de la vie), его идея была абсолютно материалистической, можно даже сказать механистической, поскольку причину стремления к прогрессу он видел в движении жидкостей в теле животных. По его мысли, эти жидкости проделывали каналы и полости в мягких тканях, что постепенно вело к эволюции в сторону усложнения организации. Для объяснения присутствия просто устроенных форм жизни, несмотря на предположительно прогрессивный характер эволюции, Ламарк постулировал, что постоянным источником примитивных организмов служит самозарождение. Идеи самозарождения и врожденной склонности к усложнению в настоящее время безнадежно устарели.
Однако по-прежнему широко распространено убеждение, будто эволюция ведет к усложнению организации в результате многочисленных последовательных адаптаций (разумеется, в наши дни ученые, продолжающие выступать за реальность такой тенденции, не назовут ее «врожденной»). Как уже обсуждалось в главе 8, оно явно не соответствует действительности: на самом деле никакой глобальной тенденции к усложнению живых форм в ходе эволюции не прослеживается, даже если максимум наблюдаемой сложности растет в силу стохастических причин. В данной главе мы обратимся к более значимой и интересной проблеме из наследия Ламарка, а именно рассмотрим наследование приобретенных признаков и его вклад в эволюционный процесс.
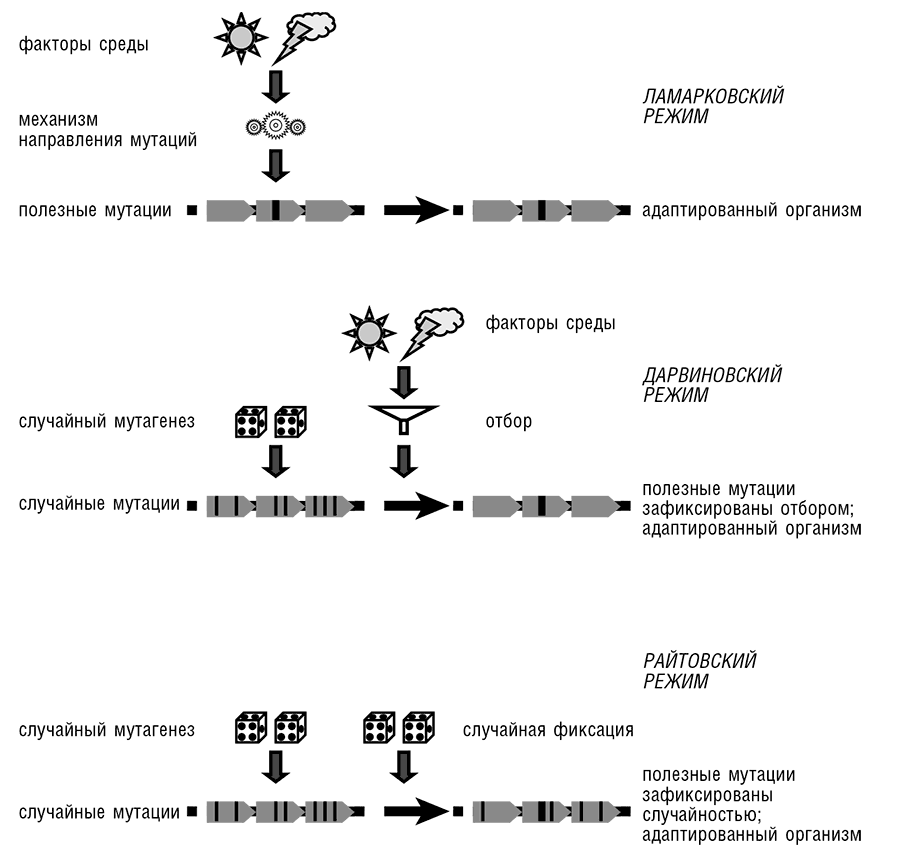
Рис. 9-1. Ламарковский, дарвиновский и райтовский режимы эволюции. Заимствовано из Koonin and Wolf, 2009b.
Схема Ламарка, представленная в терминах, совместимых с современной генетикой (см. рис. 9-1), утверждает следующее:
1. Факторы окружающей среды вызывают (наследуемые) изменения генома.
2. Индуцированные изменения (мутации) затрагивают конкретный ген или группу генов.
3. Индуцированные изменения обеспечивают адаптацию к первоначальному причинному фактору.
Очевидно, что адаптивная реакция на конкретный фактор окружающей среды должна быть опосредована молекулярным механизмом, который бы вызывал изменение в соответствующем гене (или генах). В этом состоит явное отличие от хода дарвиновской эволюции: в ней окружающая среда не является фактором, вызывающим адаптивные изменения, скорее она служит источником внешнего селективного давления, которое способствует фиксации тех случайных изменений, что адаптивны при данных условиях (см. рис. 9-1). Дарвиновская схема проще и менее взыскательна по сравнению со схемой Ламарка, поскольку Дарвину не требовались специальные механизмы, направляющие мутации в соответствующие локусы генома и ограничивающие изменения конкретными мутациями, которые обеспечивают необходимую адаптацию.
С другой стороны, режим эволюции Ламарка был бы более эффективным и быстрым по сравнению с дарвиновским. В самом деле, за предпочтение дарвиновского механизма приходится платить втридорога: многочисленные мутации, что возникают в геномах, по-настоящему вредны, так что их носители погибают, другие почти нейтральны и иногда закрепляются с помощью дрейфа, однако при этом не вносят непосредственного вклада в адаптивную эволюцию. Поэтому ламарковская схема оказалась бы очень полезной для эволюционирующих организмов, будь она практически осуществимой. Трудность обнаружения или даже гипотетического представления механизмов направленного адаптивного изменения в геноме отправила сценарий эволюции Ламарка на долгие десятилетия в мусорную кучу истории науки.
Несмотря на существенные различия в механизмах и невзирая на кажущуюся «расточительность» дарвиновской модальности, которая контрастирует с потенциальной эффективностью эволюции по Ламарку (см., однако, дискуссию ниже в этой главе), схемы Дарвина и Ламарка похожи: у обеих конечные результаты преимущественно адаптивны, и в этом отношении, они радикально отличаются от случайного дрейфа. Последний процесс может быть обозначен как «райтовская модальность эволюции», в честь Сьюэлла Райта, одного из отцов-основателей популяционной генетики и создателя концепции случайного генетического дрейфа (см. рис. 9-1 и гл. 2). В последующих разделах я расскажу о недавних исследованиях некоторых феноменов, которые, на мой взгляд, заставляют нас возвратиться к одной из версий ламарковского сценария в качестве важного вклада в эволюцию на уровне геномов и организмов.
Ламарковские и квазиламарковские явления в эволюции
Системы антивирусного иммунитета CRISPR-Cas у прокариот: демонстрация аутентичног омеханизма по Ламарку
Система антивирусной защиты и адаптивного иммунитета у архей и бактерий, которая в последнее время была изучена благодаря целой серии открытий, часто случайных, по всей видимости, работает непосредственно через предложенный Ламарком механизм. Такая система известна как CRISPR-Cas (или просто CRISPR, для краткости). Аббревиатура CRISPR означает «короткие палиндромные повторы, регулярно расположенные группами», а Cas — «белки, ассоциирующиеся с CRISPR» (Deveau et al., 2010; Karginov and Hannon, 2010; Koonin and Makarova, 2009; van der Oost et al., 2009). CRISPR-повторы содержат короткие уникальные участки-спейсеры, встроенные внутри палиндромных повторяющихся блоков. Геномы архей и бактерий содержат кассеты (группы тандемно организованных, тесно сцепленных, функционально связанных локусов) с многочисленными CRISPR-блоками — во многих случаях более одной кассеты на геном. Хотя CRISPR-повторы были открыты еще в 1980-х, за годы до первых расшифровок полных бактериальных геномов, только гораздо позже стало понятно, что CRISPR-кассеты в геномах практически всегда примыкают к группе cas-генов. Cas-гены кодируют различные ферменты, участвующие в метаболизме нуклеиновых кислот, включая нуклеазы, геликазы и, возможно, полимеразы[90].
После того как было показано, что некоторые из уникальных спейсеров в CRISPR-кассетах идентичны фрагментам генов бактериофагов и плазмид, была высказана гипотеза о том, что CRISPR-система использует полученные от фагов последовательности в качестве молекул-шаблонов для разрушения мРНК-фагов аналогично эукариотической РНК-интерференции (РНКи) (Makarova et al., 2006). Хотя большую часть деталей механизма еще предстоит выяснить, главные предсказания этой гипотезы к настоящему времени подтверждены: наличие спейсера, последовательность которого в точности комплементарна мишени, то есть соответствующей последовательности в фаговом геноме, необходимо для резистентности[91]; РНК-шаблоны, содержащие CRISPR-спейсеры, образуют комплексы с несколькими Cas-белками и используются для борьбы с инфекцией; могут приобретаться новые спейсеры, которые делают бактерию или архею устойчивой к соответствующим фагам. Примечательно, что, судя по всему, некоторые CRISPR-системы нацелены на вирусные мРНК, как и постулирует изначальная гипотеза, тогда как другие уничтожают вирусную ДНК непосредственно (Barrangou et al., 2007; Brouns et al., 2008; Hale et al., 2009; Marraffini and Sontheimer, 2008).
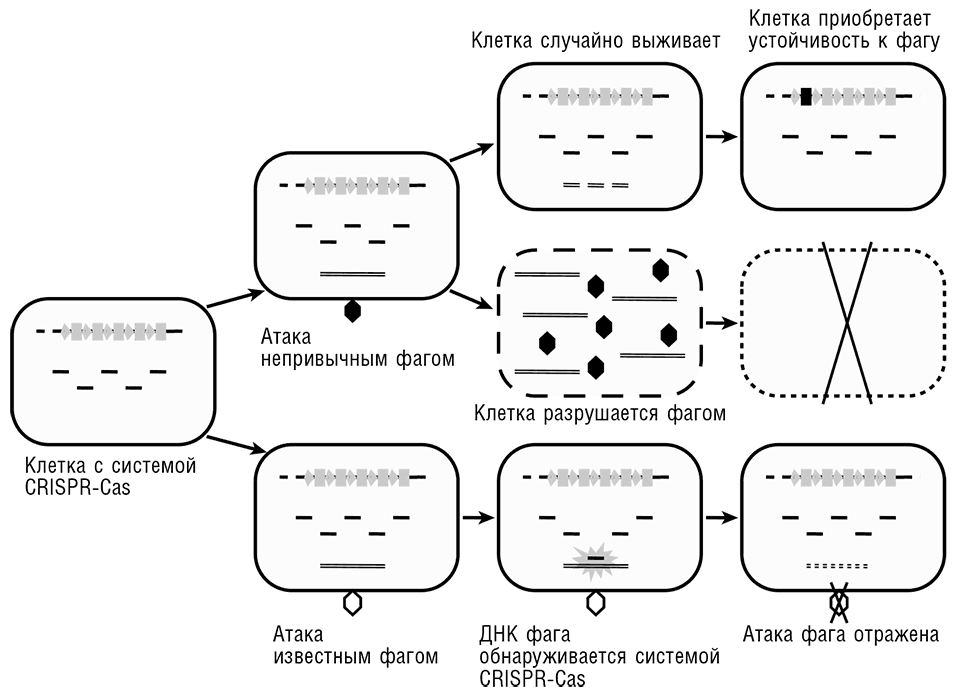
Рис. 9-2. Система CRISPR-Cas и механизм ее действия как пример ламарковской эволюции. Заимствовано из Koonin and Wolf, 2009b.
Механизм наследственности и эволюции генома, реализованный в CRISPR-Cas системе, представляется в полной мере ламарковским (см. рис. 9-2).
• Стимул из внешней среды (эгоистичный генетический элемент, такой как вирус) используется для непосредственного изменения генома.
• Возникающая модификация (уникальный элемент-специфичный спейсер) напрямую влияет на фактор, вызвавший изменение.
• Модификация явно адаптивна и наследуется потомками клетки, столкнувшейся с эгоистичным элементом.
CRISPR-опосредованная наследственность, по-видимому, не очень устойчива: даже близкородственные геномы архей и бактерий не содержат одинаковых вставок. Подразумевается, что, как только бактерии или археи перестают сталкиваться с конкретным агентом (вирусом), соответствующие спейсеры быстро вырождаются. В самом деле, вставки вряд ли могут быть эволюционно стабильными в отсутствие сильного селективного давления, поскольку единственная мутация сразу делает их бесполезными. Кроме того, во многом подобно адаптивной иммунной системе у животных, CRISPR-системы в редких случаях демонстрируют свойство аутоиммунности: спейсеры, идентичные фрагментам обычных генов клетки-хозяина, вставляются в CRISPR-кассеты и, предположительно, нарушают экспрессию соответствующих генов (Stern et al., 2010). Несмотря на некоторую эфемерность наследственности CRISPR, ее ламарковский характер неоспорим: адаптивная эволюция организмов происходит непосредственно в ответ на внешний фактор среды и результатом является конкретная адаптация (резистентность) к данному специфическому фактору[92].
Другие (квази)ламарковские системы, функционирующие по принципу CRISPR
Интересно и поучительно сравнить особенности наследственности и эволюции в случае CRISPR-системы с соответствующими характеристиками эукариотической РНК-интерференции (RNAi) и, в частности, малых интерферирующих (si) РНК и PIWI-взаимодействующих (pi) РНК, то есть с защитными системами эукариот, в общих чертах функционально аналогичными CRISPR. Для начала вспомним примечательный и довольно загадочный факт: белковый аппарат эукариотической РНК-интерференции не гомологичен Cas-белкам; белковые компоненты этой сложной эукариотической системы были собраны из прокариотических доменов, которые первоначально были вовлечены в исполнение других функций (см. гл. 7; Shabalina and Koonin, 2008). Очевидное отсутствие ортологов для любого из Cas-белков в клетках эукариот позволяет предположить, что эта система каким-то образом исключена из эукариотического мира отбором, хотя лежащее в основе селективное давление представляется смутно. Единственным намеком может служить общая причина утраты оперонов у эукариот, которую мы обсуждали в главе 7: опероны исчезают под действием рекомбинационного храповика, и гены, которые требуют особенно тесной координации экспрессии или же вредны вне контекста действия оперона, устраняются путем очищающего отбора[93].
В отличие от CRISPR-Cas, системы РНК-интерференции не используют механизм Ламарка напрямую. Тем не менее они явно демонстрируют характерные «ламарковские» черты. Система siРНК (отдельный вид РНКи) «обучается» внешним агентом (вирусом) путем генерации малых интерферирующих РНК, комплементарных вирусным генам (Kim et al., 2009). Этот процесс, безусловно, имеет сходство с CRISPR-механизмом, но, кроме того, напоминает, по крайней мере метафорически, «изменение повадок» по Ламарку. Более того, система имеет некоторый уровень памяти, поскольку во многих организмах миРНК амплифицируются, и устойчивость к соответствующему вирусу может сохраняться в течение нескольких поколений (Ding, 2010). Подобная стабильность миРНК служит одним из проявлений получающего все более широкое признание РНК-опосредованного наследования, которое иногда называют парамутацией (Hollick, 2010). Ключевое отличие от CRISPR состоит в том, что (насколько известно в настоящее время) миРНК не записываются в геном, так что здесь имеет место лишь эпигенетическая наследственность ламарковского типа, но не полноценная генетическая наследственность.
Однако даже это различие размывается в случае piРНК, которые являются производными транспозонов. Это наиболее распространенные малые РНК в животном мире, образующие быстро растущие геномные кластеры, обеспечивающие защиту от мобильных элементов в зародышевой плазме (Bourc’his and Voinnet, 2010). В случае этих малых РНК, как и в ситуации с CRISPR, фрагменты генома мобильного элемента интегрируются в геном хозяина, где они быстро размножаются, видимо, под давлением отбора на эффективную защиту (Assis and Kondrashov, 2009). Такая система, похоже, отвечает всем критериям наследования приобретенных признаков и ламарковского режима эволюции. Здесь особенно примечательно, что изолированная зародышевая плазма, будучи важнейшим изобретением многоклеточных эукариот, которые, по-видимому, блокируют некоторые формы (квази)ламарковского наследования, такие как горизонтальный перенос генов (см. обсуждение далее в этой главе), сама выработала в процессе эволюции особую версию механизма ламарковского типа.
Целый ряд примечательных данных по растениям и животным, полученных совсем недавно, указывает на то, что эукариоты используют обратную транскрипцию для интеграции ДНК-копий генома РНК вирусов в хромосомы и могут затем использовать эти встроенные последовательности для производства миРНК или белков, обеспечивающих устойчивость к соответствующим вирусам (Feschotte, 2010; Horie et al., 2010; Koonin, 2010c). Эти механизмы еще предстоит исследовать более тщательно, но по идее они должны быть аналогичны CRISPR и, следовательно, являются ламарковскими.
Горизонтальный перенос генов: важная ламарковская составляющая
Одним из главных открытий сравнительной геномики является демонстрация широкого распространения и высокой частоты горизонтального переноса генов среди прокариот, а также значительного уровня горизонтального переноса у одноклеточных эукариот (см. гл. 5 и 7). Прокариоты с легкостью усваивают ДНК из окружающей среды с помощью фагов и плазмид, служащих векторами, или же без векторов, через механизм трансформации, при участии мембранных насосов, специализирующихся на захвате ДНК.
Поглощенная ДНК часто интегрируется в хромосомы прокариот и может быть зафиксирована в популяции, даже если перенесенный генетический материал дает получателю совсем небольшое селективное преимущество или будучи вовсе нейтральным. Явление горизонтального переноса обладает очевидными ламарковскими признаками: ДНК черпаются из окружающей среды, и, естественно, вероятность приобретения генов, которые находятся в изобилии в данной среде, гораздо выше, чем вероятность захвата редкого гена. Второй компонент схемы Ламарка, повышение приспособленности за счет приобретенного признака, не реализуется во всех случаях фиксации горизонтального переноса, однако является значимым и достаточно обычным явлением.
Пожалуй, самый простой и привычный пример — эволюция резистентности к антибиотикам (Martinez, 2008; Wright, 2007). Когда чувствительная бактерия попадает в среду, где присутствуют антибиотики, единственный шанс для пришельца выжить заключен в приобретении гена устойчивости путем горизонтального переноса, как правило через плазмиды. Этот распространенный (и исключительно важный в практическом плане) феномен представляет собой ярко выраженный пример наследования по Ламарку. В самом деле, признак — в этом случае активность перенесенного гена, способствующего резистентности к антибиотикам, — приобретается под непосредственным влиянием окружающей среды и очевидным образом оказывается выгодным — часто необходимым в данных конкретных условиях.
Похожая картина наблюдается для генов фотосинтеза в океане: гены бактериородопсина, главного белка светозависимой биоэнергетики (протон-движущей силы) в галофильных археях, а также в многочисленных бактериях, как и гены фотосистем первого и второго типа, участвующие в хлорофиллзависимом фотосинтезе, судя по всему, распространяются горизонтальным переносом с высокой скоростью, часто посредством бактериофагов, выступающих в качестве переносчиков (Alperovitch-Lavy et al., 2011; Falkowski et al., 2008; Sullivan et al., 2006). Эти гены наделяют организм обладателя серьезным селективным преимуществом, так что они фиксируются с высокой частотой.
В целом любой случай горизонтального переноса, при котором приобретенный ген дает реципиенту преимущество с точки зрения воспроизводства в данной среде (которая благоприятствует передаче такого гена), по-видимому, удовлетворяет ламарковским критериям. Исследования по сравнительной геномике показывают, что горизонтальный перенос служит основным способом адаптации бактерий к окружающей среде путем расширения метаболических и сигнальных сетей, куда интегрируются новые горизонтально приобретенные гены и, таким образом, добавляют новые свойства в уже существующие схемы (Maslov et al., 2009). Количественно горизонтальный перенос, с его ламарковской компонентой, оказывается у прокариот гораздо более важным средством адаптации, нежели дупликация генов (Pal et al., 2005).
Интересным указанием на то, что горизонтальный перенос может быть адаптивным феноменом, служит уже упоминавшееся открытие агентов переноса генов (АПГ). Как отмечалось в главе 5, АПГ являются производными дефектных бактериофагов, которые заключают в себе, по-видимому, случайные фрагменты генома хозяина и переносят их внутри бактериальных и архейных популяций. Интереснейшие наблюдения переноса генов в морских бактериальных сообществах показывают, что АПГ довольно неразборчивы по отношению к бактериям, которых они инфицируют, и обеспечивают очень высокую интенсивность ГПГ (McDaniel et al., 2010). Свойства АПГ еще предстоит детально исследовать, но существует реальная возможность, что эти агенты представляют собой специально предназначенные для горизонтального переноса средства доставки, которые эволюционировали под селективным давлением, направленным на усиление обмена генами. Если это так, напрашивается вывод, что сам ГПГ выступает частично как адаптивный процесс (см. также обсуждение гипотезы оптимизации переноса в гл. 5). Подводя итог сказанному, мы, видимо, не можем избежать вывода, что некоторые из наиболее важных путей эволюции генома — по меньшей мере у прокариот — являются (квази)ламарковскими.
Стресс-индуцированный мутагенез и активизация мобильных элементов: квазиламарковский феномен
Дарвин подчеркивал эволюционную важность случайных, ненаправленных вариаций, в то время как ламарковская эволюция основана на направленной изменчивости, специфически вызываемой экологическими факторами. Реальная эволюция отвергает это противопоставление. Самой яркой иллюстрацией может служить комплекс разнообразных явлений, которые в совокупности известны как стресс-индуцированный мутагенез, одним из важных аспектов которого является активизация мобильных элементов. Явление такого типа впервые было описано Барбарой Макклинток, продемонстрировавшей (в серии классических экспериментов, которые в конечном итоге принесли ей Нобелевскую премию) активизацию «перескакивания генов» в растениях в условиях стресса, а также важность этой стресс-индуцированной мобильности отдельных «управляющих элементов» для возникновения резистентных фенотипов (McClintock, 1984).
Позднее столь же известный и спорный эксперимент Джона Кэрнса (John Cairns) с сотрудниками по восстановлению мутаций в Lac-опероне, индуцированному лактозой, впечатляющим образом вывел ламарковский механизм эволюции на видное место (Brisson, 2003; Cairns et al., 1988; Rosenberg, 2001). Кэрнс и его коллеги обнаружили заметное усиление реверсии мутаций рамки считывания в Lac-опероне в присутствии лактозы и смело предположили, что за наблюдаемым эффектом стоит классический ламарковский механизм эволюции — иначе говоря, лактоза непосредственно и направленно вызвала мутации в Lac-опероне.
Последующие, более тщательные исследования, включая работы Патрисии Фостер и самого Кэрнса, показали, что это не так: стресс, в частности выращивание культуры при недостатке питания, действительно вызывает мутации, но не в специфических локусах (Foster, 2000). Было показано, что все мутации, лежащие в основе реверсии Lac-фенотипа и других подобных фенотипов, дуцированы стрессом (Lac-клетки, высеянные на питательную среду с лактозой в качестве единственного источника углерода, испытывают голодный стресс), а не берутся из предсуществующего запаса редких, спонтанных мутаций.
Стресс-индуцированный мутагенез — в частности, механизм мутагенного восстановления в кишечной палочке, известный как SOS-репарация, — был открыт задолго до опытов Кэрнса. Более того, Мирослав Радман (Radman, 1975) и Харрисон Эколс (Echols, 1981) независимо друг от друга пришли к плодотворной мысли, что эта мутагенная форма репарации может быть адаптивным механизмом антистрессовой реакции, а не просто сбоем в работе восстановительных систем. Два десятилетия дальнейших исследований подтвердили эту замечательную идею, сомневаться в истинности которой уже нет разумных оснований. Несколько групп убедительных исследований подтверждают адаптивный характер неточной репарации ДНК (Foster, 2007; Galhardo et al., 2007; Rosenberg, 2001).
Активность SOS-каскада и других мутагенных механизмов репарации в бактериях тщательно регулируется, в частности, переключением с точного воспроизведения к подверженному ошибкам восстановлению разрывов двойной спирали под воздействием сигма-фактора РНК-полимеразы, RpoS, с тем чтобы, по-видимому, достичь оптимальной скорости мутаций. Важнее всего, что стресс-индуцированные мутации, возникающие вследствие склонных к ошибкам процессов репарации, хотя и не нацелены на конкретные гены, в то же время не разбросаны по геному беспорядочно. Напротив, эти мутации концентрируются вокруг двухцепочечных разрывов ДНК, которые вызваны различными стресс-факторами и привлекают к себе аппарат мутагенной репарации.
Мутагенная репарация могла возникнуть как специфический адаптивный механизм, который делает возможной координированную эволюцию групп функционально связанных генов (ключевая особенность геномной архитектуры у прокариот) в тех редких клетках, где происходят полезные мутации, одновременно ограничивая ущерб для других частей генома. Стресс-индуцированный мутагенез, в особенности активация ретротранспозонов, был продемонстрирован также у дрожжей и животных, и это дает основание предполагать, что такой путь адаптивной эволюции универсален для клеточных форм жизни.
По крайней мере среди бактерий стресс-индуцированный мутагенез — не редкий или экзотический, а крайне распространенный процесс. Среди сотен изученных природных штаммов E. Coli индуцированный мутагенез характерен для более 80 процентов стареющих колоний, и превышение числа мутаций, запускаемых стрессом, над конститутивными мутациями варьирует на несколько порядков (Bjedov et al., 2003).
Примечательно, что стресс-индуцированная и, по всей видимости, адаптивная нестабильность генома лежит также в основе рака. Хорошо известно, что опухоли развиваются (эволюционируют) в условиях постоянного кислородного стресса, который вызывает обширные перестройки генома и мутации. Главным образом благодаря этим стресс-индуцированным изменениям выживают мутанты, способные к неконтролируемому росту в условиях стресса. Несмотря на различия в конкретных механизмах мутагенной репарации и ее регулирования, злокачественные опухоли животных (включая человека) в принципе не так уж отличаются от бактериальной популяции, эволюционирующей в стрессовых условиях.
Адаптивная эволюция, происходящая в результате стресс-индуцированного мутагенеза, не является строго ламарковской, потому что стресс не вызывает мутации непосредственно и исключительно в генах, отвечающих за устойчивость к данному стрессу. Вместо этого в организмах развились механизмы, которые в ответ на стресс вызывают неспецифический мутагенез. Однако этот процесс, как оказывается, тонко настроен таким образом, чтобы минимизировать ущерб от вредных мутаций в тех редких геномах, которые содержат полезную мутацию. Механизмы этого типа лучше всего определить как квазиламарковские. Действительно, в случае стресс-индуцированного мутагенеза необходимо учитывать следующее:
1. Условия окружающей среды приводят к появлению мутаций.
2. В результате индуцированных мутаций возникает адаптация к факторам стресса, запустившим мутагенез.
3. Мутагенная репарация управляется сложными механизмами регуляции, что не оставляет никаких сомнений относительно адаптивного характера этого процесса.
Существует прямая связь между ламарковским аспектом стрессиндуцированного мутагенеза и горизонтальным переносом, проявляющаяся в явлении переноса детерминант резистентности, индуцируемого антибиотиками. Многие антибиотики вызывают SOS-ответ, что, в свою очередь, приводит к мобилизации интегративных конъюгационных элементов, которые служат переносчиками генов устойчивости к антибиотикам (Barriss et al., 2009). Аналогия с АПГ очевидна и абсолютно уместна. Здесь мы наблюдаем конвергенцию различных механизмов изменения генома в ламарковской модальности эволюции.
Континуум дарвиновских и ламарковских механизмов эволюции
В предыдущих разделах мы обсудили значительное разнообразие явлений. Некоторые из них, по-видимому, строго соответствуют критериям Ламарка, тогда как другие можно квалифицировать как квазиламарковские (см. табл. 9-1). Принципиальное различие между дарвиновским и ламарковским механизмами эволюции состоит в том, что первый опирается на случайную, ненаправленную изменчивость, второй же основан на вариациях, непосредственно обусловленных внешними стимулами и влекущих за собой специфический ответ на этот стимул (см. рис. 9-1). Ни Ламарк, ни Дарвин не знали ничего о механизмах возникновения и закрепления наследственных изменений, так что им было относительно легко допустить мысль, что фенотипические модификации напрямую транслируются в наследственные (или, как сказали бы в наше время, генетические или геномные) изменения. Тем не менее жесткий ламарковский сценарий крайне требователен, поскольку подразумевает, что должен существовать молекулярный механизм для точного перевода фенотипического изменения в соответствующую модификацию генома (мутацию). По всей видимости, фундаментального механизма для такой обратной геномной инженерии не существует, и не лишено смысла предположение, что подобные механизмы находятся под жестким контролем отбора, направленного против дестабилизации генома. Более того, передача информации от белков к нуклеиновым кислотам была бы крайне затруднительна физико-химически — эта трудность, по всей видимости, отражает разграничение между матричными и каталитическими биомолекулами, возникшее на ранних этапах эволюции жизни (см. гл. 12). Центральная догма молекулярной биологии (Crick, 1970), согласно которой поток информации от белков к нуклеиновым кислотам отсутствует, является частичным воплощением этого разделения. Однако в принципе обратный поток некоторых типов информации от фенотипа — или от окружающей среды, рассматриваемой как расширенный фенотип, — в геном не является невозможным, учитывая широкое распространение обратной транскрипции и ДНК-транспозиции. Для работы истинно ламарковского сценария требуются чрезвычайно изощренные механизмы; в двух примечательных случаях, систем CRISPR-Cas и piРНК (описанных ранее в этой главе), такие механизмы были обнаружены.
Существование других полноценных ламарковских систем вполне представимо и даже вероятно, что предполагает, в частности, открытие вирус-специфических последовательностей, которые потенциально несут устойчивость к генетически родственным вирусам в растительных и животных геномах (см. гл. 10). Тем не менее эти механизмы вряд ли представляют собой доминирующую тенденцию в геномной эволюции, возможно, в силу вышеупомянутой селекции против чрезмерной нестабильности генома. Механизмы, обозначенные в предыдущих разделах как квазиламарковские, напротив, повсеместны. По существу, они оказываются не менее поразительными — и не менее сложными, — чем оригинальный ламарковский сценарий: квазиламарковские процессы переводят случайные мутации в конкретные адаптивные реакции в ответ на стимулы внешней среды.
Тема мощных, часто неблагоприятных воздействий окружающей среды на организмы представляется общим мотивом для различных аспектов (квази)ламарковского режима эволюции, описанных в данной главе: для системы CRISPR-Cas, стресс-индуцированного мутагенеза и других явлений (см. табл. 9-1). Эта связь, скорее всего, не иллюзорна: кажется вполне логичным, что сильные (чрезвычайные) сигналы из окружающей среды инициируют (квази)ламарковские процессы, в то время как относительно слабые («обычное дело») сигналы транслируются в дарвиновскую модальность эволюции (см. рис. 9-3).
Обсуждая эволюционное значение горизонтального переноса генов, Энтони Пул предположил, что ламарковская составляющая горизонтального переноса становится иллюзорной, если посмотреть на эволюцию с «точки зрения гена» (Poole, 2009). Действительно, ламарковская модальность связана в первую очередь с организменным уровнем сложности и не распространяется на самый фундаментальный уровень эволюции, включающий гены, независимо эволюционирующие части гена (те, что кодируют различные белковые домены), а также мобильные элементы (см. гл. 6). Таким образом, ламарковская эволюция выступает в качестве «эмергентного феномена». Это, пожалуй, неудивительно, учитывая сложность механизмов, необходимых для интеграции нового генетического материала в геном при реализации ламарковской схемы.
Таблица 9-1
Ламарковские и квазиламарковские явления
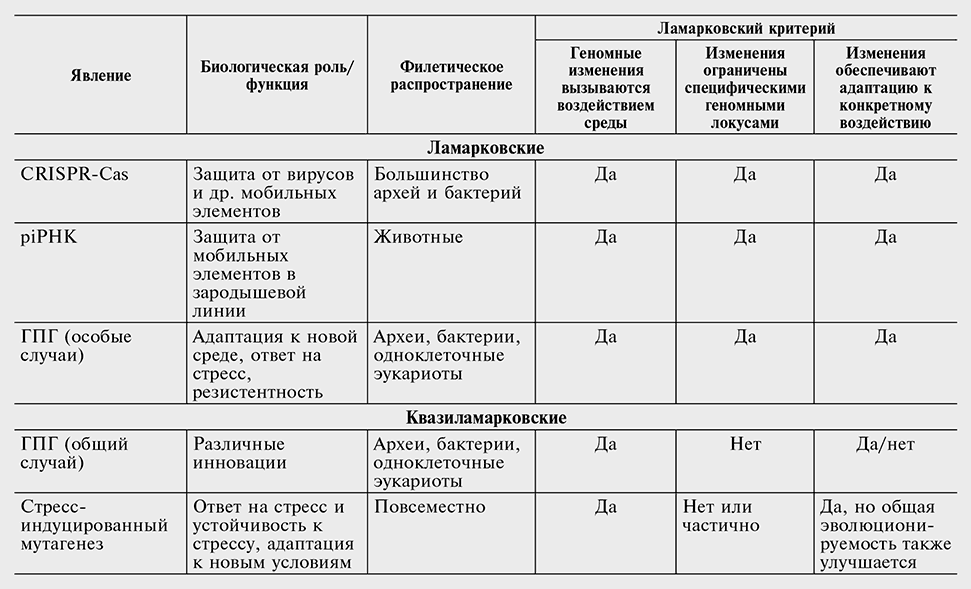
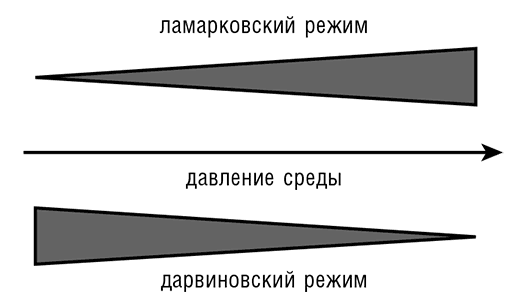
Рис. 9-3. Давление среды и переход от дарвиновского к ламарковскому режиму. Заимствовано из Koonin and Wolf, 2009b.
В целом сравнение между дарвиновским и ламарковским сценариями предполагает, что эволюция представляет собой континуум процессов, от совершенно случайных до истинно адаптивных, которые тонко регулируются для обеспечения определенного ответа на конкретный стимул. Принципиальный вывод, напрашивающийся по итогам многих новейших исследований, упомянутых в этой главе, состоит в том, что изменчивость генома предстает гораздо более сложным явлением, чем это казалось ранее, и регулируется сразу на нескольких уровнях, для того чтобы обеспечить адаптивную реакцию на изменения в окружающей среде. Устранение конфликта между ламарковским и дарвиновским эволюционными сценариями, обладая далеко не только историческим значением, влияет на наши фундаментальные взгляды на роль и место случайности в эволюции. Это представляется подлинной, хоть и недооцениваемой, сменой парадигмы в современной биологии.
Точность передачи информации в биологических системах и ее (не)адаптивная эволюция
Эволюция жизни целиком основана на процессах передачи дискретной информации — между поколениями путем репликации генома и от генома к эффекторным молекулам (РНК и белкам) — как описано в главе 2. Не существует канала передачи информации, свободного от ошибок, как впервые математически сформулировал Клод Шеннон, создавший теорию информации, связав процесс передачи информации с законами термодинамики. Как отмечалось в главе 2, точность репликации генома не должна быть ниже определенного минимума; соответственно, частота мутаций не должна превышать определенный порог, чтобы избежать мутационного вырождения популяции. Очевидно, что частота мутаций не может быть и слишком низкой, дабы оставить возможность хотя бы для минимальной эволюционируемости (потенциала для эволюции — см. обсуждение в следующем разделе). Менее ясно, важен ли этот нижний предел практически в реальных биологических системах. Таким образом, фундаментальный вопрос сводится к следующему: каким образом отбор контролирует частоту мутаций (если он это действительно делает)? Точнее, удерживает ли очищающий отбор частоту мутаций просто ниже порога вырождения, или же происходит по крайней мере, для некоторых организмов и, возможно, в особых ситуациях, отбор на достаточно высокую частоту мутаций, чтобы обеспечить сырье для эволюции?
Отбор на приемлемую точность репликации (и, более глобально, всех процессов передачи информации) является одним из центральных аспектов эволюции. Это непосредственно видно из того огромного разнообразия, сложности и многоуровневой организации репарационных систем, которые обнаруживаются во всех клеточных формах жизни (Aravind et al., 1999; Friedberg et al., 2005). У прокариот до 10 процентов кодирующей емкости генома могут быть заняты компонентами систем репарации, которые действуют на всех этапах репликации ДНК, а также устраняют различные мутационные повреждения, происходящие за пределами процесса репликации. С другой стороны, существует класс репликаторов, у которых (практически) отсутствуют механизмы исправления повреждений; это РНК-содержащие вирусы. Действительно, эти вирусы демонстрируют чрезвычайно высокий уровень ошибок включения нуклеотидов и общий уровень мутаций, явление, хорошо известное в связи с важностью для медицины быстрой эволюции вирусов гриппа и ВИЧ (Holmes, 2009). Эти вирусы, по-видимому, эволюционируют не слишком далеко от порога мутационного вырождения (Drake and Holland, 1999). Все РНК-вирусы обладают небольшими геномами (менее 30 Кб), что отчасти является следствием физической хрупкости длинных молекул РНК, но также связано с отсутствием репарационных механизмов. (Можно было бы утверждать, что сложные системы репарации в таких вирусах не могли развиться, потому что они не были бы выгодны, учитывая фундаментальную нестабильность генома.) На самом деле РНК-содержащие вирусы с самыми большими геномами (вирусы отряда Nidovirales), по всей видимости, обладают различными, хотя и простыми, системами репарации (Eckerle et al., 2007). Кроме того, открытие РНК-деметилаз в геномах различных растительных РНК-содержащих вирусов означает, что даже в этих простейших геномах репарация может эволюционировать, когда вирус распространяется в условиях повышенного давления окружающей среды (Aravind and Koonin, 2001; van den Born et al., 2008).
В рамках концепции мутационного вырождения возникает естественная мысль, что частота мутаций на нуклеотид должна быть обратно пропорциональна размеру генома организма, так чтобы число мутаций на геном на поколение оставалось примерно постоянным. Ян Дрейк первым выразил эту идею явным образом, и потому ее часто называют гипотезой Дрейка (Drake, 1991). Гипотеза Дрейка довольно хорошо работает для вирусов и прокариот. Однако изучение новейших данных, проведенное Майклом Линчем, неожиданно (по крайней мере, на первый взгляд) выявило противоположную зависимость у эукариот: скорость мутирования в расчете на нуклеотид положительно коррелирует с размером генома (Lynch, 2010). Следуя в русле неадаптивной теории эволюции сложности, Линч показал, что небольшое повышение частоты мутаций не будет «замечено» очищающим отбором в небольших популяциях, которые типичны для многоклеточных эукариот, и, соответственно, не может элиминироваться в ходе эволюции этих организмов. Отсюда появляется «полуадаптивная» гипотеза эволюции мутационного фона: существует селективное давление на понижение частоты мутаций ниже порога вырождения и чуть дальше, поскольку за счет этого популяция становится более устойчивой, однако не на окончательную минимизацию частоты мутаций. В соответствии с этой гипотезой отбора, который бы препятствовал падению частоты мутаций ниже любого минимального значения, не существует; частота мутаций остается относительно высокой по чисто стохастическим причинам (см. также следующие разделы в этой главе).
Однако ситуация не столь проста, как видно из результатов долгосрочных экспериментов с эволюционирующими популяциями кишечной палочки, проведенных Ричардом Ленски и его коллегами. Эти эксперименты показывают, что интенсивный отбор на адаптацию бактериальных популяций к новой среде часто ведет к появлению аллелей-мутаторов (иными словами, бактерий с повышенной частотой мутаций в связи с повреждением одного из ферментов репарации), которые вытесняют предыдущие поколения с низкими показателями мутаций (Sniegowski et al., 1997). Если быть более точным, представляется, что аллели-мутаторы достигают значительного распространения в популяции и даже фиксируются за счет тесного сцепления с адаптивными мутациями, вызываемыми этими мутаторами. Однако, когда внешнее селективное давление убрано, мутаторы становятся невыгодными и вымываются отбором (Denamur and Matic, 2006). Эти результаты приводят к важному обобщению: в зависимости от целого ряда факторов, таких как экологический стресс и эффективный размер популяции, отбор на низкую или высокую частоту мутаций может происходить и происходит в действительности.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Приложение (1991). Компьютерные программы и эволюция самой эволюции
Приложение (1991). Компьютерные программы и эволюция самой эволюции Компьютерная программа «Биоморф», описанная в третьей главе сейчас доступна для «Эппл Макинтош», «Нимбус» и IBM-совместимых компьютеров. Все три программы поддерживают девять основных «генов», необходимых
Глава 1 Основы эволюции: Дарвин и синтетическая теория эволюции
Глава 1 Основы эволюции: Дарвин и синтетическая теория эволюции Пер. А. НадирянВ этой и следующей главах дается краткое описание современного состояния эволюционной биологии, какой она была до 1995 года, когда возникло новое направление науки — сравнительная геномика.
Глава 2 От синтетической теории эволюции к эволюционной геномике: различные механизмы и пути эволюции
Глава 2 От синтетической теории эволюции к эволюционной геномике: различные механизмы и пути эволюции Пер. А. НестеровойВ этой главе мы продолжим обсуждение эволюционной биологии в период до появления геномики. Многие из обсуждаемых направлений развития не являлись
Глава 4 Геномика, системная биология и универсалии эволюции: эволюция генома как феномен статистической физики
Глава 4 Геномика, системная биология и универсалии эволюции: эволюция генома как феномен статистической физики Пер. К. МуратовойВ предыдущей главе была подчеркнута относительная стабильность отдельных генов, составляющая яркий контраст динамизму геномной эволюции.
ГЛАВА 1 РОЛЬ ПОЛОВОГО РАЗМНОЖЕНИЯ В ЭВОЛЮЦИИ
ГЛАВА 1 РОЛЬ ПОЛОВОГО РАЗМНОЖЕНИЯ В ЭВОЛЮЦИИ Способы размножения Размножение — важнейший биологический процесс, обеспечивающий поддержание и увеличение численности вида, возможность его расселения и, в конечном итоге, успех борьбы за существование. В животном мире
5.1. «Эволюция эволюции»
5.1. «Эволюция эволюции» История эволюционизма, или, как иногда говорят, «эволюция эволюции», является темой огромного числа публикаций (Завадский К. М., Колчинский Э. И., 1977; Waddington С., 1975). Рассмотрим основные вехи этой истории.Эволюционизм возник как альтернатива учению о
Глава 8. Эволюция биологических форм
Глава 8. Эволюция биологических форм 8.1. Неодарвинистская теория эволюции Фактически очень мало известно, если вообще когда-нибудь может быть известно, о деталях эволюции в прошлом. Также эволюцию нелегко наблюдать в настоящем. Даже на шкале времени в миллионы лет начало
2.3. Атмосфера ранней Земли и ее роль в доклеточной эволюции
2.3. Атмосфера ранней Земли и ее роль в доклеточной эволюции Самым распространенным элементом во Вселенной является водород. В газово-пылевой туманности, из которой сформировалась Солнечная система, также преобладал водород. Поэтому естественной была гипотеза Опарина и
Глава 6 Особенности продуцирования биологических систем
Глава 6 Особенности продуцирования биологических систем 6.1. Общие понятия, термины, определения В экологии принято количество живого вещества всех групп растительных и животных организмов называть биомассой. Она является результирующей величиной всех процессов
Глава 7 Созидательная эволюция
Глава 7 Созидательная эволюция Иногда люди думают, что естественный отбор — сила исключительно отрицательная, способная только устранять уродцев и неудачников, но никак не создавать сложность, красоту и эффективность конструкции. Разве он не удаляет просто-напросто