Биохимические и биофизические изменения, связанные с усилением пролиферативной активности
Биохимические и биофизические изменения, связанные с усилением пролиферативной активности
Имеется большое количество книг и обзоров, рассматривающих биохимические процессы в тканях и популяциях клеток со стимулированной пролиферацией. Существуют общие закономерности, свидетельствующие об одинаковой направленности большинства биохимических изменений в эмбриональных, регенерирующих и опухолевых тканях по сравнению с нормальной тканью, хотя встречаются и отдельные исключения.
Пролиферирующие активно делящиеся клетки обычно отличаются усиленным расходованием липидов, ускоренным гликолизом, нуклеосинтезом и протеосинтезом, повышением активности пентозофосфатного шунта. В таких клетках, как правило, соотношение циклаз смещается в сторону гуанилатциклаз, соотношение циклонуклеотидов — в сторону цГМФ над цАМФ. Соответственно увеличивается активность цГМФ-зависимых протеинкиназ и уменьшается активность цАМФ-зависимых протеинкиназ. В митохондриях увеличивается активность АТФаз и снижается активность АТФ-синтетаз, накапливаются ионы Ga2+ и уменьшается содержание ионов Mg2+. Активность НАДФ-зависимых дегидрогеназ повышается, а НАД-зависимых — падает. В цитоплазме уменьшается соотношение белковых SH- и S—S-групп, а в ядре и ядрышке — увеличивается. В отношении небелковых SH- и S—S-групп картина обратная.
При длительном усилении пролиферативной активности ткани и снижении степени дифференцировки составляющих ее клеток однозначно увеличивается активность систем, определяющих основные биологические характеристики делящихся клеток и являющихся более древними в эволюционном плане. Одновременно или несколько позже в таких случаях снижается активность эволюционно более молодых систем, связанных с ведущими признаками дифференцированного состояния клетки.
Эта закономерность общая для всех ускоренно размножающихся клеток, включая и клетки злокачественных опухолей. Не обнаружено никаких специфических опухолевых ферментов или каких-либо белков, липидов, гликолипидов или других химических соединений, которые не были бы свойственны нормальным клеткам на различных этапах их жизненного пути.
При длительном состоянии ускоренной пролиферации любых клеток происходит определенная редукция клеточного метаболизма. Так, Уоррен и Бак отметили, что злокачественные, активно пролиферирующие клетки содержат больше гликолипидов с короткими углеводными цепями, чем нормальные (из-за сниженного содержания сиаловой кислоты), но меньше гликолипидов с длинными цепями. Такие клетки в силу укорочения митотического цикла не успевают завершать синтез углеводных компонентов своих гликолипидов. Уменьшено среди белков и гликопротеидов поверхности клеток количество фибронектина и коллагена, неспецифических и адгезивных гликопротеидов как при стимуляции пролиферации в норме, так и при опухолевом росте. Подобные аномалии могут нести к снижению чувствительности клеток к контактному угнетению митотической активности и к изменению иммунной специфичности гликопротеинов клеточной поверхности.
При длительном состоянии ускоренной пролиферации в существующих в норме последовательностях реакции, преимущественно имеющих специализированное значение, возможно также выпадение промежуточных звеньев. Оно начинается со снижения активности и содержания фермента, а затем приводит к исчезновению последнего. Соответственно происходит упрощение состава метаболитов и укорочение метаболического пути.
Клетка в связи с ускоренным размножением как бы освобождается от уже ненужных метаболических реакций. Некоторые специализированные ферменты, принимающие участие в функции нормальных тканей (аргипаза, каталаза, цитохромоксидаза, цитохром с, эстераза и др.), в опухолях отсутствуют, или их активность очень низка. Иными словами, нарушается или утрачивается специфический ферментный профиль. Например, в митохондриях с увеличением скорости роста гепатом Морриса появляется дефицит моноаминооксидазы на внешней мембране, аденилатциклазы в межмембранном пространстве и глутаматдегидрогеназы в матриксе. Аналогичные данные получены и для нормальной печени, регенерирующей после частичной гепатэктомии. Некоторые опухоли имеют митохондрии с недостатком одного или двух компонентов дыхательной цепи с дефицитом ферментов клеток крови.
При редукции метаболизма в ускоренно размножающихся клетках в реакциях катаболизма (распада) происходит снижение эффективности работы метаболической цепи в целом. В реакциях анаболических (синтеза) в условиях энергетического дефицита может происходить неполное завершение последовательности реакций и(или) переход к «крупноблочному строительству», т. е. утилизации высокомолекулярных недорасщепленных субстратов. Сокращение этапов синтетических процессов наиболее вероятно в условиях обостренной конкуренции за макроэргические соединения, выработка которых может затрудняться падением общей продуктивности митохондриального окислительного фосфорилирования при редукции митохондриального аппарата либо при внутритканевой гипоксии в далеко зашедших пролиферативных состояниях.
Так, есть некоторые экспериментальные доказательства возможности использования активно делящейся клеткой крупных блоков для синтеза ДНК. Например, в опухолевых клетках по сравнению с нормальными в десятки раз более активны ферментные системы, направляющие биосинтез нуклеотидов на энергетически выгодные пути утилизации готовых пуриновых и пиримидиновых оснований без предварительного их синтеза. Такой механизм может обеспечить клетке повышенную скорость обновления нуклеиновых кислот независимо от наличия простых предшественников энергоемкого синтеза азотистых оснований (из глицина, аспартата, глутамина, формиата, рибозы).
В то же время «крупноблочное строительство» может уменьшить эффективность репарации ДНК и увеличить накопление в ней ошибок. В быстро пролиферирующих тканях и опухолях низка активность не только деполимераз нуклеиновых кислот, но и ряда катаболических ферментов пиримидинового, пуринового и аминокислотного обмена. Создаются условия для снижения субстратной специфичности ферментов. Известны случаи замещения аминокислот в полипептидных цепях в процессе их синтеза, вероятность которых с усилением пролиферации нормальных клеток, как мы предполагаем, может повышаться.
Такие же замены аминокислот часто делают ферменты более чувствительными к тепловой денатурации. При этом доля термолабильной фракции белков возрастает. С другой стороны, термолабильная фракция ферментов обладает сниженной субстратной специфичностью и реагирует с аналогами субстратов с большей эффективностью, чем нормальные ферменты катализа.
Немногочисленные биофизические данные также свидетельствуют о существенной роли нарушений содержания элементов кальция, хлора, меди, йода, железа, магния, марганца, фосфора, калия, натрия, цинка и соотношений их концентраций в процессах пролиферации в дифференцировки и опухолевой трансформации.
По мнению ряда ученых, ключевая роль в этом процессе принадлежит ионам Mg2+. Удаление Mg2+ из среды инкубации сказывалось в торможении синтеза ДНК, а снижение концентрации Са2+ действовало на синтез только при одновременном четырехкратном уменьшении содержания Mg2+. Предполагается, что роль кальция в регуляции деления клеток опосредована магнием.
В настоящее время наибольшее признание имеет точка зрения, согласно которой модификация ферментов, участвующих в обмене циклических мононуклеотидов, и внутриклеточная концентрация последних являются одними из ранних реакций, связанных со стимулированием пролиферации или дифференцировки.
В различных нормальных и опухолевых клеточных популяциях и тканях отмечается общая направленность изменения циклазных систем при увеличении содержания пролиферирующих и дисдифференцированных клеток. Это увеличение отношений цГМФ/цАМФ, гуанилатциклаза/аденилатциклаза, цГМФ-зависимые протеинкиназы/цАМФ-зависимые протеинкиназы.
В нормальных дифференцированных тканях взрослых животных активность аденилатциклазной системы, как правило, существенно превышает активность гуанилатциклазной. С увеличением пролиферативной и особенно дисдифференцированной компонент клеток эти соотношения начинают возрастать в сторону гуанилатциклазной системы.
В связи с этим широко распространено мнение, что цАМФ участвует в фосфорилировании белков, отвечающих за специализированную функцию дифференцированной клетки, а цГМФ — за фосфорилирование белков, участвующих в пролиферации.
Для гепатом Морриса отмечена корреляция перечисленных изменений циклазных систем со скоростью роста. Интересны также данные о том, что гуанилатциклаза печени может стимулироваться некоторыми химическими канцерогенами.
Так называемые связанные сульфгидрильные (SH-) и дисульфидные (S—S-) группы находятся в белках благодаря наличию в них серосодержащих взаимопревращающихся аминокислот цистеина (SH-) и цистина (S—S-), а свободные группы (если не учитывать SH-группы свободных аминокислот) принадлежат в основном глутатиону.
Отмечено, что общеклеточный сдвиг равновесия групп SH?SS влево стимулирует деление клеток, а смещение вправо — задерживает. В целом в клетках животных, растений и микроорганизмов для прохождения митоза необходима относительно высокая концентрация SH-групп.
Таким образом, в ряде случаев прослеживается положительная корреляция между общим содержанием SH-групп в клетках и интенсивностью их пролиферации. Существенный вклад в это увеличение, по-видимому, вносит и синтез de novo глутатиона.
Есть ряд данных, указывающих, что внутритканевое содержание убихинонов, токоферолов, некоторых стероидных гормонов, фосфолипидов и SH-содержащих белков при усиленной пролиферативной активности возрастает в нормальных и злокачественных клетках.
Концентрация водородных ионов (pH) внутри и вне клетки является фактором, регулирующим направленность и интенсивность множества внутриклеточных процессов.
Как в нормальных, так и в малигнизированных тканях в состоянии активной пролиферации нередко регистрируется снижение pH. Это особенно характерно для тех случаев, когда ускоренная пролиферация сопровождалась гипоксией и дисфункцией митохондриального аппарата, что способствует внутриклеточной аккумуляции метаболических кислот, например молочной кислоты. Измерения pH в раковых тканях показали, что они в среднем на 0.5 единиц pH имеют более кислую реакцию, чем нормальные ткани, хотя в отдельных случаях pH снижается на 1—2 единицы. Если нормальные клетки имеют внутриклеточный pH около 7,4, а раковые в обычных условиях ~7,0, то с усилением потребления последними глюкозы pH может достигать 5,8—6,0.
С интенсификацией клеточного деления и соответственно снижением степени дифференцировки клеток, как правило, уменьшаются электропроводность, теплопроводность, мембранный потенциал покоя, ионселективность плазматической мембраны, степень кальцификации, механическая прочность мембран, степень адгезии (прилипания) в системах «клетка+клетка», «клетка+подложка», контактное торможение деления, антиокислительная активность липидов, вязкость цитозоля и повышаются перекисное окисление липидов, способность белков и ДНК к денатурации, неспецифическая проницаемость мембран, подвижность органических молекул в мембране, электрофоретическая подвижность, диффузия веществ внутри клетки, гидрофильность мембран (степень гидратации), степень текучести, «разжижения» мембран.
Среди перечисленных характеристик нет ни одной, которую можно было бы строго доказательно отнести к специфическим признакам опухолевого роста. Все эти изменения обусловлены повышенной интенсивностью клеточной пролиферации. В условиях нормальной пролиферации они обратимы. Изменения не являются ведущими в опухолевой трансформации и в малигнизации, а служат функциональным отражением или сопутствующим фоном реакций исполнительного аппарата клетки в ответ на регулирующие пролиферацию сигналы и изменения окружающей ее среды.
То же самое можно сказать и в отношении морфологических изменений. Изменения, выявляемые различными методами световой и электронной микроскопии, обычно тем глубже, чем выше уровень пролиферативной активности и степень нарушения дифференцировки. При длительной интенсивной пролиферации повышается количество аномалий клеточного деления как в нормальных, так и в опухолевых тканях. Электронная плотность клеток и части их органелл (митохондрии, ядерного матрикса, цитозоля) обычно снижается в состоянии активной пролиферации. Объем ядра, ядрышек и ядерно-цитоплазматическое отношение часто значительно увеличиваются. Возрастает количество пор в ядерной мембране. Понижена степень конденсации хроматина. Расширяются эндоплазматические цистерны. Соответственно уменьшается число связанных рибосом и увеличивается количество свободных рибосом. Размеры полисом сокращаются. Пониженное содержание гранулярной сети в эмбриональных, регенерирующих и других тканях с интенсивным делением клеток отражает тот закономерный факт, что их клетки заняты собственным воспроизводством в большей степени, чем выполнением специализированных функций для удовлетворения внеклеточного функционального запроса в данный момент.
Это же обстоятельство объясняет снижение количества и размеров секреторных пузырьков и гранул, а также иногда наблюдаемую частичную редукцию секреторных структур аппарата Гольджи. Запасы резервных полимеров, капель липидов и особенно гранул гликогена в животных клетках резко истощаются. Эти морфологические наблюдения совпадают с биохимическими данными о существенной стимуляции гликолиза и липолиза при недостаточности соответствующих анаболических процессов.
В среднем может быть увеличено количество и размеры некоторых цитоплазматических включений: липофусциновых гранул, миэлиновых фигур, Бизаровых телец и т. д. Предполагается, в частности, что липофусциновые гранулы (каротиноксисомы) могут способствовать активации реликтовых путей поддержания энергетического и окислительного обмена в условиях ограничения функции митохондрий и развивающейся в связи с этим клеточной гипоксии. Известно появление так называемой токсической зернистости нейтрофилов при состояниях, сопровождающихся при токсических отравлениях лейкопенией с последующей стимуляцией лейкопоэза. Увеличение числа дегенеративных клеток характерно для абортивного подъема числа лейкоцитов при лучевой болезни, когда наблюдается первый пик регенерации лейкопоэза и предполагается укороченным митотический цикл бластных клеток. Тельца Бизара появляются в предлейкозный период, когда обычна гиперплазия эритроидного ростка костного мозга.
Претерпевают изменения и митохондрии: матрикс светлеет, часто объем их возрастает, количество крист уменьшается, содержание осмиофильных гранул повышается. Последнее обстоятельство имеет биохимическое подтверждение в увеличении количества внутримитохондриального кальция, что характерно как для регенерирующих, так и для опухолевых тканей. Относительно быстро истощается компенсаторный резерв окислительного фосфорилирования и становится невозможным его эффективное функционирование в связи с низким напряжением кислорода и по другим причинам. Митохондрии клеток быстро пролиферирующих тканей по сравнению с неделящимися более чувствительны к повреждению в различных неблагоприятных для клетки условиях.
Уменьшается степень связи клеток в ткани, о чем свидетельствует увеличение размеров межклеточных пространств, снижение числа и размеров щелевых мостиков и других структур межклеточных контактов. Сокращение межклеточных контактов совпадает с изложенными биофизическими данными. В далеко зашедших случаях хронической ускоренной пролиферации может происходить потеря контактного торможения деления клеток.
Важно обратить внимание на то, что в клетках, длительное время ускоренно размножающихся, уменьшается число специализированных выростов и выпячиваний плазматической мембраны, содержащих различные рецепторные комплексы на гормоны белковой природы, антигены, гормональные регуляторы и др. Этот признак является морфологическим отражением утраты клеткой многих поверхностных глюко- и протеоконъюгатов, падения чувствительности делящейся клетки к внешним регуляторным влияниям. Происходит относительная «регуляторная глухота», снижение чувствительности ко многим гормонам белковой природы, действующим на уровне внешней стороны плазматической мембраны.
Средняя картина морфологической перестройки клетки в связи с длительной интенсификацией деления характеризуется сокращением количества и объема мембранных структур, выполняющих специализированные функции в интересах целого организма, и одновременно усилением структур, непосредственно связанных с функцией деления. Клетка морфологически упрощается и становится более похожей на независимо существующий одноклеточный организм (рис. 5).
Все изложенное приближает изначально дифференцированную зрелую клетку к ее эволюционно более древним предкам. Сокращение общей площади мембран клетки сочетается с биохимическими и биофизическими данными о нарушении интегральных функций мембран и связанных с ними структур и первичных регуляторных процессов.
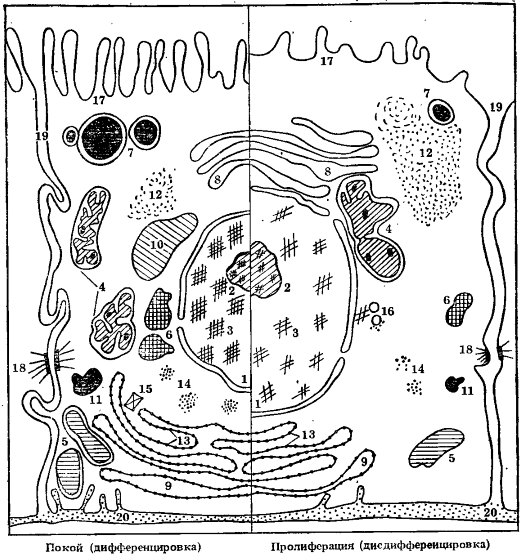
Рис. 5. Цитологическая перестройка «идеальной» животной клетки при переходе от состояния «покоя» (специфической функции в дифференцированном состоянии) к пролиферации (снижению специфической функции и дисдифференцировке)
1 — ядро; 2 — ядрышко; 3 — хроматин; 4 — митохондрии; 5 — лизосомы; 6 — микротельца; 7 — секреторные пузырьки; 8 — агранулярный эндоплазматический ретикулум; 9 — гранулярный эндоплазматический ретикулум; 10 — гранулы гликогена; 11 — капли липидов; 12 — свободные рибосомы; 13 — связанные рибосомы; 14 — полисомы; 15 — гранулы неорганических веществ; 16 — центриоль; 17 — микроворсинки; 18 — межклеточные контакты; 19 — межклеточные пространства; 20 — базальная мембрана
Способность к пролиферации — древнейшее свойство клеточного уровня организации биологических систем. Специфические функции клетки, возникшие в ходе дифференцировки у многоклеточных организмов, относятся к более поздним эволюционным приобретениям. Эти функции связаны с разделением обязанностей и специализацией отдельных клеток в интересах целого организма.
Переход клетки и ткани от выполнения специализированной функции в системе целостного организма, т. е. от дифференцированного состояния, к снижению дифференцировки и усилению пролиферации означает переход на эволюционно более древние и более устойчивые пути метаболизма. Обнаружение в активно или длительно пролиферирующих тканях каких-либо эмбриональных свойств (ферментов, антител и т. п.) следует рассматривать как проявление эволюционно-древних признаков.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
3. СИСТЕМНАЯ ДЕТЕРМИНАЦИЯ АКТИВНОСТИ НЕЙРОНА
3. СИСТЕМНАЯ ДЕТЕРМИНАЦИЯ АКТИВНОСТИ НЕЙРОНА 3.1. Парадигма реактивности: нейрон, как и индивид, отвечает на стимул Как мы уже отмечали, с позиций парадигмы реактивности поведение индивида представляет собой реакцию на стимул. В основе реакции лежит проведение
Глава 16 СВЯЗАННЫЕ С СОБЫТИЯМИ ПОТЕНЦИАЛЫ МОЗГА (ССП) В ПСИХОФИЗИОЛОГИЧЕСКОМ ИССЛЕДОВАНИИ
Глава 16 СВЯЗАННЫЕ С СОБЫТИЯМИ ПОТЕНЦИАЛЫ МОЗГА (ССП) В ПСИХОФИЗИОЛОГИЧЕСКОМ ИССЛЕДОВАНИИ 1. ОПРЕДЕЛЕНИЕ, ОСНОВНЫЕ ПРОБЛЕМЫ И КРАТКАЯ ИСТОРИЯ МЕТОДА ССП 1.1. Связанные с событиями потенциалы мозга ССП представляют собой широкий класс электрофизиологических феноменов,
1.1. Связанные с событиями потенциалы мозга
1.1. Связанные с событиями потенциалы мозга ССП представляют собой широкий класс электрофизиологических феноменов, которые специальными методами выделяются из «фоновой», или «сырой», электроэнцефалограммы (ЭЭГ). Термин ССП – калька введённого Г. Воном термина Event-Related
3.4. Потенциалы, связанные с выполнением движений
3.4. Потенциалы, связанные с выполнением движений Потенциалы, связанные с выполнением движений (ПСВД, movement-related potentials – MRP, movement-related brain potentials – MRBP; в русскоязычной литературе используют неточный термин «моторные вызванные потенциалы – МВП»). К этой группе феноменов,
Изменения активности генов
Изменения активности генов Эволюция животных в целом и приматов в частности протекает не столько за счет изменения структуры белок-кодирующих генов, сколько за счет изменения их активности. Небольшое изменение в верхних этажах иерархически организованных
Биохимические основы лечения атеросклероза.
Биохимические основы лечения атеросклероза. Важным лечебным фактором, снижающим риск развития гиперхолестеролемии и атеросклероза, является гипокалорийная и гипохолестериновая диета, Поступление ХС с пищей не должно превышать 300 мг/сут. К лечебным и профилактическим
Познавательная функция игровой активности животных
Познавательная функция игровой активности животных Игра и исследовательское поведение В ходе игры молодое животное приобретает разнообразную информацию о свойствах и качествах предметов в окружающей его среде. Это позволяет конкретизировать, уточнять и дополнять
Общая характеристика психической активности
Общая характеристика психической активности Как мы могли убедиться, на низшем уровне элементарной сенсорной психики поведение животных выступает в достаточно разнообразных формах, но все же мы имеем здесь дело лишь с примитивными проявлениями психической активности.
Измерение активности мозга
Измерение активности мозга Решению проблемы помогла не структурная томография. Прогресс в этой области обеспечили функциональные томографы, разработанные через несколько лет после структурных. Эти аппараты позволяют регистрировать потребление энергии тканями мозга.
Прямые замеры активности мозговых структур
Прямые замеры активности мозговых структур В недавнем прошлом, когда активность тех или иных мозговых структур можно было измерить, лишь вживляя электроды в мозг, данный метод применялся крайне ограниченно — только на животных или тяжело больных людях, перенесших
Формы смещенной активности
Формы смещенной активности Смещенная активность имеет одну из трех следующих форм:Мозаичная активность. Мозаичным называется поведение, состоящее из фрагментов различных ФКД. Герой рассказа А. П. Чехова «Папаша»[104], застигнутый женой наедине с горничной, «скинул сюртук
Глава I. КАК ЭТО ДЕЛАЕТ ОН, А КАК ОНА? О сексуальной активности поляков
Глава I. КАК ЭТО ДЕЛАЕТ ОН, А КАК ОНА? О сексуальной активности поляков ЯЛВ: Я хочу, чтобы ты, как социолог и сексолог, сказал мне, а может, даже поставил диагноз: что, собственно, происходит в спальнях у поляков? И даже не обязательно в спальнях, ведь есть и такие, кто не прочь
Глава 14. Основные витамины и болезненные состояния у собак, связанные с их недостатком или избытком
Глава 14. Основные витамины и болезненные состояния у собак, связанные с их недостатком или избытком О витаминах, гиповитаминозах и авитаминозах Витамины (от лат. «vita» — жизнь) — эти разнообразные органические соединения не случайно названы так: их роль в