Порочные круги во внутриклеточных системах как основа клеточной патологии
Порочные круги во внутриклеточных системах как основа клеточной патологии
Вводные замечания можно распространить и на порочные потенциально патогенетические круги во внутриклеточных системах. Следует сказать, что в клетке труднее, чем в физиологических системах, выделить те существующие связи между различными системами, которые могли бы в соответствующих условиях формировать порочные круги. Здесь труднее отделить одни процессы от других ввиду тесных взаимосвязей различных внутриклеточных систем, опосредованных прежде всего непосредственно биохимическими регуляциями.
Тем не менее ниже сделана попытка выделить основные взаимосвязи, возникновение которых, по нашим представлениям, ведет к формированию порочных потенциально патогенетических кругов под влиянием непрерывной стимуляции клеток к ускоренной пролиферации, к ускоренному размножению.
В отличие от порочных кругов в физиологических системах здесь ведущие связи оказались более сложными. Их трудно описать простым кругом. Приходится прибегать к разветвленным и параллельно существующим связям. Тем не менее и их оказалось возможным замкнуть в конечном итоге в порочный круг, препятствующий возвращению клеток к состоянию, в котором они находились до воздействующего сигнала к ускоренной пролиферации.
Первый порочный круг. Ведущие процессы: ускоренный ритм деления клеток и редуцированный метаболизм. Как следует из ранее изложенных материалов, конечным результатом функционирования порочных потенциально патогенетических кругов в физиологических системах может быть длительное время продолжающаяся стимуляция пролиферативной активности отдельных тканей или части клеток этой ткани. Такая стимуляция вызывает не только вовлечение в делящийся пул новых, ранее покоящихся клеток, но и ускорение самого ритма прохождения клетками митотического цикла. Сокращение митотического цикла, происходящее за счет укорочения периодов интерфазы и продолжающееся во многих поколениях клеток, влечет за собой целый комплекс изменений, характеризующих недодифференцированное — дисдифференцированное состояние с определенной редукцией метаболизма.
Для нормального завершения структурообразующих дифференцировочных реакций необходимо определенное время. При укорочении интерфазы митотического цикла сокращается и время для указанных реакций. Уже одно это может в определенной мере препятствовать осуществлению дифференцировки клеток. В настоящее время считается доказанной даже для морфологически неразличаемых костно-мозговых стволовых клеток зависимость степени дифференцировки (уход в коммитированное состояние или в пролиферацию) от продолжительности периода G1 интерфазы. Укорочение или удлинение периода G1 сопровождалось соответственно пролиферацией или дифференцировкой стволовых клеток. Сокращение периодов интерфазы митотического цикла сокращает и время для осуществления процессов репарации и восстановления спонтанных и индуцированных внешними для клетки влияниями повреждений, ошибок обмена и синтеза. Известно, что биологические системы в ответ на возросший объем повреждений (если он не превышает критического уровня) обычно отвечают повышением эффективности восстановительных процессов за счет ускорения их и увеличения времени на их осуществление.
При этом большее значение имеет фактор времени, чем ускорение восстановительных процессов. На уровне клеточных популяций эта закономерность проявляется в увеличении продолжительности периодов интерфазы митотического цикла за счет блоковых задержек и в определенном соотношении их степени повреждения клеток.
В случае сохранения сокращенных периодов интерфазы митотического цикла в последующих поколениях клеток недорепарируемые и недовосстановленные повреждения, ошибки обмена и синтеза, не приводящие к гибели клеток в первом митозе, будут накапливаться с каждым поколением клеток и в конце концов начнут мешать течению нормальных метаболических процессов и в крайнем случае вызывать гибель клеток. В этом мы видим причину гибели части поврежденных клеток не в первом митозе, а в последующих, а также причину срыва так называемого абортивного подъема числа лейкоцитов после их снижения при воздействии ионизирующих излучений. С этим, видимо, связаны и другие наблюдения.
Так, при длительной стимуляции пролиферативной активности ткани в клетках могут появляться различные морфологические аномалии и включения. Например, в период, предшествующий появлению клиники типичного лейкоза, наиболее характерны гиперпластические состояния костного мозга, в основном по красному ростку. Такие состояния сопровождаются ускоренным эритропоэзом с сокращением митотического цикла клеток делящегося пула. Именно для предлейкозного синдрома характерно появление телец Бизара. Они могут встречаться у 79% лиц, находящихся в предлейкозном состоянии.
Другой пример связан с упоминавшимся абортивным подъемом числа лейкоцитов в крови в пострадиационном периоде. В развитии лейкопении имеются два максимума снижения числа лейкоцитов в периферической крови: у человека на 8—12-е и 27—32-е сутки и у собаки на 4—8-е и 19—20-е сутки после воздействия радиации. Между этими периодами снижения числа лейкоцитов отмечается временный подъем их числа с последующим абортивным снижением уровня лейкоцитов. В этот период бурного, но неудавшегося восстановления лейкопоэза выявляют значительное повышение митотического индекса и сокращение цикла, а также появление клеток со структурными аномалиями, пикнотическими ядрами и дегенеративными изменениями цитоплазмы. В том числе отмечают изменения, связанные с характером конденсации ядерного хроматина, и изменения типа и степени сегментации ядра гранулоцитов.
Подробно проблема биохимических, биофизических и цитологических изменений, связанных с усилением пролиферативной активности ткани, рассмотрена выше. Здесь мы хотели только напомнить, что имеются общие биохимические, биофизические и цитологические особенности для совершенно разных клеточных популяций: 1) в эмбриональной ткани по сравнению с происходящей от нее более дифференцированной тканью; 2) в ткани в период репаративной регенерации по сравнению с этой же тканью в период нормальной физиологической регенерации; 3) в активно растущей злокачественной ткани по сравнению с предшествующей ей нормальной тканью. Общими особенностями для них являются состояние активной пролиферации, сопровождаемое преобладанием анаэробного гликолиза над дыханием, накопление лактата, падение окислительно-восстановительного потенциала (при достатке углеводного питания), закономерные изменения изоэнзимного и антигенного спектра белков, цитологическое упрощение морфологии клеток.
На первых порах после создания прекрасной модели — гепатом Морриса с различной степенью злокачественности (начиная с состояния, близкого к норме) стали искать закономерности изложенных изменений в зависимости от степени дифференцировки ткани. Была обнаружена корреляция между степенью дифференцировки и скоростью роста ткани, выраженностью указанных биохимических особенностей и изменением изоэнзимного состава ферментов. Такая расстановка последовательности событий не давала возможности подойти к изучению причинно-следственных отношений.
Поэтому позднее стали искать зависимость указанных изменений от скорости роста, т. е. от степени пролиферативной активности ткани. Следовательно, изложенные изменения стали связывать и с сокращением интерфазы митотического цикла, в частности периода G1 со всеми вытекающими последствиями, рассмотренными выше.
Возрастание ошибок синтеза описано и на примере ошибочного включения аминокислот в пептидную цепь белка при усилении пролиферативной активности ткани, сокращений стадии G1 митотического цикла и ускорении рибосомального цикла. На возможность такой взаимосвязи процессов мы указывали еще в 1974 г.
Вопрос большой принципиальной важности: могут ли сохраняться те многообразные изменения в клетках, которые возникают при длительной стимуляции пролиферативной активности, в случае снятия такой стимуляции? Морфологическое упрощение и редукция метаболических путей, навязанные клеткам длительно сохраняющейся стимуляцией к ускоренному делению клеток, становятся ли настолько привычными, что клеткам уже невыгодно в энергетическом и в других отношениях возвращаться к исходному состоянию? Материалы, обобщенные выше, говорят в пользу возможности сохранения указанных изменении и при последующем снятии стимуляционного сигнала.
Мы обращаем внимание при этом на следующие обстоятельства. Во-первых, при длительно сохраняющейся стимуляции пролиферативной активности происходит одновременно в силу указанных уже выше причин сокращение периодов интерфазы митотического цикла и накопление проходящих через митоз спонтанных и индуцированных внешними для клеток факторами повреждений, ошибок обмена и синтеза. В этих условиях, затрудняющих осуществление полноценной дифференцировки клеток, ее потенциальные возможности к нормальной дифференцировке не реализуются во многих поколениях клеток. Соответствующие локусы генома не дерепрессируются и не реализуют свою информацию. Многократное повторение такой ситуации во многих поколениях клеток при возрастающей нестабильности генома в конце концов, как считают, может закрепить постоянную репрессию их на уровне регуляторных генов. Это будет препятствовать возвращению клеток в нормальное дифференцированное состояние и после снятия стимуляционного сигнала. Клетки будут продолжать находиться в состоянии сокращенного митотического цикла и ускоренного деления.
Во-вторых, при длительно сохраняющемся ускоренном делении клеток могут быть затруднения в энергетическом обмене. Превалирование анаэробного обмена над дыханием существенно уменьшает синтез макроэнергетических соединений. Недостаток времени и энергетических и пластических веществ (имеются серьезные ограничения в увеличении скорости их транспорта) упрощает и редуцирует клеточный метаболизм. Начинают играть все большую роль короткие, упрощенные и менее энергоемкие метаболические пути. Все большее значение приобретает «крупноблочный» синтез ряда макромолекул.
Известно, что синтез органических соединений из неорганического сырья обходится организму энергетически дорого. Так, при синтезе одной молекулы глутаматной кислоты (с преобразования которой идет последующий синтез ряда других аминокислот) расходуется 28,5 молекулы АТФ. Для синтеза одной молекулы пиримидинового нуклеотида уридинмонофосфата из аспарагиновой кислоты затрачивается 53,5 молекулы АТФ. В норме у высших млекопитающих нуклеиновые кислоты распадаются до мононуклеотидов, пуриновых и пиримидиновых оснований и далее часть их — до мочевины и аммиака. В условиях ускоренного деления клеток, смещения pH в «кислую» сторону и недостатка макроэргов распад нуклеиновых кислот происходит лишь до моно- или даже олигонуклеотидов, а синтез их — из блоков готовых нуклеотидов без предварительного синтеза их оснований. Синтез белка в основном идет из готовых аминокислот. Такие изменения метаболизма становятся энергетически более выгодными, и клетки по этой причине также сохраняют эти изменения и после снятия стимула к ускоренному делению клеток. Сохраняется и недодифференцированное состояние.
Основные связи между указанными процессами представлены на рис. 14 в максимально упрощенном виде. Они сформировали первый внутриклеточный порочный круг, препятствующий возвращению клеток к состоянию нормальной дифференцировки и спокойной пролиферации.
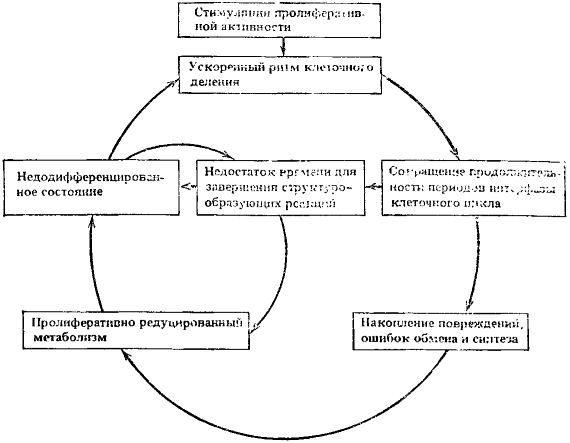
Рис. 14. Первый круг
Ведущие процессы: ускоренный ритм деления клеток и пролиферативно-редуцированный метаболизм
Второй порочный круг. Ведущие процессы: избыточный синтез низкомолекулярных тиолов и уменьшение специфичности структуры поверхности клетки. Навязанный клеткам ускоренный ритм деления, помимо рассмотренных событий, упомянутых при изложении первого порочного круга, вызывет одновременно и много других биофизических и биохимических изменений. Рассмотрим связи, в которых ведущее значение имеют синтез низкомолекулярных тиолов и изменение специфичности клеточной поверхности и которые формируют второй порочный круг (рис. 15).
На возможности изменения соотношений анаэробного и аэробного метаболизма, прежде всего глюкозы, и на связанном с этим снижении окислительно-восстановительного потенциала мы уже останавливались. Наблюдаются также изменения обмена низкомолекулярных тиолов. По мнению Е. Е. Селькова, перестройка всего клеточного метаболизма может происходить со сменой стационарных состояний обмена низкомолекулярных тиолов, сопровождаемой большим количеством изменений в различных звеньях метаболизма. Активность анаэробного гликолиза и пентозофосфатного шунта увеличивается.
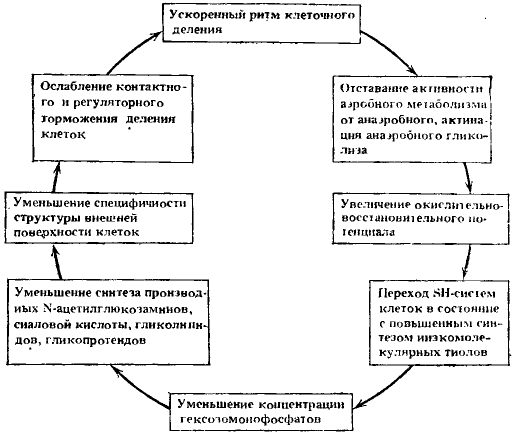
Рис. 15. Второй круг
Ведущие процессы: повышенный синтез низкомолекулярных тиолов и уменьшение специфичности структуры поверхности клеток
Увеличение транспорта кислорода и активности окислительного фосфорилирования в то же время имеет свои ограничения. Скорость глюконеогенеза и транспорта глюкозы в клетку отстает от скорости ее потребления. Концентрация гексозомонофосфатов уменьшается. Уменьшается активность ряда ферментов синтеза гликолипидов и гликопротеидов. Активность липолиза и синтеза фосфолипидов и белков в то же время увеличивается.
Однако уменьшен синтез разнообразных производных N-ацотилглюкозамина, сиаловой кислоты и глюкоконъюгатов клеточной поверхности. Это существенно отражается на молекулярной структуре внешней поверхности плазматической мембраны клеток. Уменьшаются ее специфичность и адгезивность (способность к прилипанию).
Указанные глубокие изменения метаболизма, по мнению Е. Е. Селькова, происходят в связи с переключением SH-систем клетки из одного стационарного состояния, характеризующегося низким уровнем тиолов, в альтернативно другое стационарное состояние с повышенным уровнем тиолов. Выполненный им анализ кинетики поведения биохимических систем показал, что следствием нового стационарного состояния метаболизма низкомолекулярных тиолов должен быть ускоренный ритм клеточного деления.
Упомянутые изменения клеточной поверхности приводят к ослаблению контактного торможения деления клеток и к изменению иммунной специфичности гликопротеидов плазматической мембраны и ее акцепторных свойств по отношению к медиаторам межклеточных связей.
Изложенные взаимосвязи изменений в различных процессах формируют второй внутриклеточный порочный круг, сохраняющий, так же как и первый круг, ускоренное клеточное деление и в случае снятия внешнего для клетки сигнала стимуляции пролиферативной активности.
Третий порочный круг. Ведущие процессы: усиление перекисного окисления липидов мембран и частичная декомпартментализация низкомолекулярных веществ. Длительное повторяющееся во многих поколениях клеток ускоренное их деление существенно отражается и на состоянии липидного обмена. На рис. 16 выделены некоторые из них, приводящие к формированию третьего порочного круга. Основное внимание уделено тем процессам в липидном обмене, которые изменяют неспецифическую мембранную проницаемость и которые выше уже рассматривались. Здесь только мы пытаемся составить логическую последовательность их изменений.
Длительная стимуляция пролиферативной активности и ускоренное деление клеток приводят к уменьшению образования новых липидных соединений и, наоборот, увеличивают использование ранее синтезированных липидов. Липонеогенез в значительной мере заменяется липолизом.
Количество ненасыщенных жирных кислот увеличивается, а насыщенных — уменьшается.
Происходят существенные изменения и в системе оксидантов, т. е. природных соединений, участвующих в окислительных процессах. Содержание прооксидантов увеличивается при уменьшении антиоксидантов. Активируются процессы окисления.
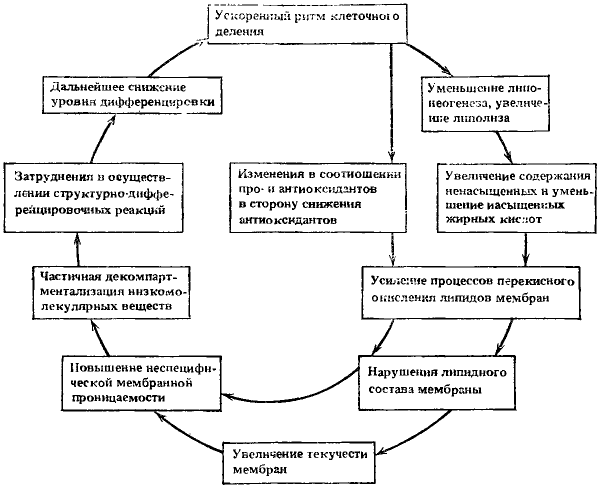
Рис. 16. Третий круг
Ведущие процессы: усиление перекисного окисления липидов мембран и частичная декомпартментализация низкомолекулярных веществ
Все изложенное приводит к усилению процессов перекисного окисления липидов, изменению состава липидов мембран и повышению «текучести» мембран; их вязкость снижается. Проницаемость мембран для многих веществ повышается. Происходит нарушение нормального распределения и разграничения различных веществ в цитоплазме, т. е. происходит определенная декомпартментализация их, особенно низкомолекулярных веществ.
Указанная частичная декомпартментализация усложняет осуществление структурно-дифференцировочных реакций в клетке, создает новые затруднения в дифференцировке клеток. Это наряду с другими причинами, изложенными выше, приводит к дальнейшему снижению уровня дифференцировки клеток, что по причинам, ранее изложенным, смещает пролиферативно-дифференцировочное отношение в сторону активации пролиферации, т. е. ускоренного размножения клеток. Снятие первоначального внешнего для клетки сигнала к пролиферации в этих условиях не снимает ускоренного деления клеток. Появились новые внутриклеточные условия, которым более соответствует ускоренный ритм деления. Порочный круг вновь замкнулся.
В этом разделе рассмотрены процессы, наиболее характерные для цитоплазмы клеток. Рассмотрение близких процессов для ядра клеток представлено следующим порочным кругом.
Четвертый порочный круг. Ведущие процессы: нарушение проницаемости ядерной мембраны и фиксирование на уровне генетической регуляции изменений метаболизма и дедифференцированного состояния. Описанные выше навязанные ускоренной пролиферацией изменения метаболизма, снижение окислительно-восстановительного потенциала, усиленное перекисное окисление липидов влияют и на состояние ядерной мембраны клеток. Вязкость ядерной мембраны падает, а неспецифическая проницаемость ее повышается. Физиологический барьер между содержимым цитоплазмы и ядра ослабевает. В ядро из цитоплазмы начинают проникать чуждые для него вещества. Среди них могут быть и вещества, способные активно вмешиваться в работу генетического аппарата. Известно, например, что нарушение проницаемости ядерной мембраны может приводить к проникновению в ядро из цитоплазмы некоторых эндогенных мутагенов фенольной природы.
Такие вещества могут взаимодействовать с комплексом ДНК—белок и затруднять нормальные процессы репрессии — дерепрессии генетической информации.
Длительно поддерживаемый внешней для клетки стимуляцией ускоренный ритм клеточного деления одновременно приводит также к накоплению повреждений, ошибок обмена и синтеза. Могут, по-видимому, накапливаться и спонтанные и индуцированные повреждения комплекса ДНК—белок, в первую очередь той его части, которая связана с функциями регуляторных генов, зависимых от целого ряда других процессов в клетке, в частности от состояния ближайшего окружения ДНК-белкового комплекса.
Часть повреждений и изменений фиксируется в трудно репарируемые, и некоторые из них могут трансформироваться в изменения суперструктуры ДНК или в изменения структуры хроматина. Это уменьшает репарируемость возникших изменений в ДНК и хроматине. Недорепарированные по тем или иным причинам изменения и повреждения ДНК могут накапливаться.
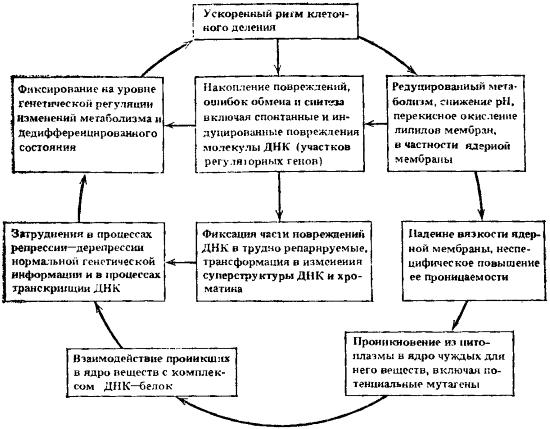
Рис. 17. Четвертый круг
Ведущие процессы: нарушение проницаемости ядерной мембраны и фиксирование на уровне генетической регуляции изменений метаболизма и степени дифференцировки
Все это может вызывать затруднения в процессах репрессии — дерепрессии нормальной генетической информации и в процессах транскрипции ДНК.
В случае многократного повторения указанных изменений в регуляторных функциях ДНК во многих поколениях клеток при нарастании затруднений в процессах выбора и транскрипции локусов генома, по-видимому, может происходить фиксирование на уровне генетической регуляции происшедших изменений метаболизма и дедифференцированного состояния, хорошо соответствующего ускоренному ритму деления клеток. Поэтому снятие внешнего стимула к усилению пролиферации в этих условиях не снимает ускоренный ритм деления. Начал функционировать четвертый внутриклеточный порочный круг (рис. 17), также препятствующий возвращению клеток к нормальному уровню дифференцировки и к спокойной пролиферации.
Рассмотренные порочные круги не исчерпывают всех возможных взаимосвязей, возникающих при длительной стимуляции пролиферативной активности, которые затрудняют возвращение клеток в исходное дифференцированное состояние. Можно найти и другие взаимосвязанные процессы в разных внутриклеточных структурах, создающие аналогичные порочные круги. Задача заключалась не в этом, а в поиске более общих закономерностей. Стало ясно, что длительная по времени стимуляция клеточного деления смещает пролиферативно-дифференцировочное отношение в сторону недостаточной дифференцировки. Повышается активность эволюционно старых метаболических процессов, направленных на обеспечение подготовки и деления клеток. В конечном итоге это приводит к уменьшению компенсаторного резерва внутриклеточных систем, к гипотрофии и гипоплазии структур, ответственных за дифференцировку. Это вновь открывает пути к ускоренной пролиферации. Ускоренный ритм деления хорошо соответствует недостаточной дифференцировке клеток, и потому он сохраняется и в случае снятия внешнего для клетки сигнала к ускоренной пролиферации.
В последние несколько лет появились принципиально новые данные по взаимосвязанным внутриклеточным процессам, в которых участвуют циклические нуклеотиды, протеинкиназы, фосфоинозитолы, диацилглицерины и фосфолипазы и которые в порядке положительной обратной связи могут создавать эффект длительного присутствия внешнего стимулирующего пролиферацию фактора.
Главной особенностью рассмотренных порочных кругов во внутриклеточных системах является их тесная, неразрывная связь друг с другом. Одни и те же процессы могут присутствовать в различных кругах. Разделение кругов весьма условно.
Вторая их особенность заключается в том, что все они функционируют одновременно. Здесь нет той последовательности вовлечения одного порочного круга за другим по мере развития событий в первом. Некоторая последовательность событий в каждом порочном круге имеется, и в этом их специфика. Однако начало функционирования кругов происходит одновременно и вызывается одной и той же причиной. События одного порочного круга усугубляют события других порочных кругов. Каждый из порочных кругов можно рассматривать как отражение разных углов зрения для принципиально одних и тех же процессов.
Третья особенность внутриклеточных порочных кругов связана с тем, что основная причина их возникновения общая: длительное время сохраняющееся ускоренное деление клеток в связи с непрерывной, хронической внешней для клеток стимуляцией пролиферативной активности. Это причина всех возникающих последующих событий.
Следующая особенность внутриклеточных порочных кругов заключается в общем возможном следствии их функционирования: создание в клетке внутренних условий, поддерживающих ускоренный ритм деления клеток и в случае снятия сигнала к стимуляции пролиферативной активности. Тогда уже ускоренный ритм клеточного деления начинает сам поддерживать все изложенные биохимические, биофизические и цитологические изменения, а последние, в свою очередь,— поддерживать ускоренный ритм деления клеток. Поэтому появляется определенная автономность самоуправления скоростью пролиферации, которая в силу рассмотренных причин может закрепиться в генетической регуляции, т. е. вызвать стойкие изменения в регуляторных генах, а это, по-видимому, и есть первый шаг в сторону малигнизации клеток.
Подчеркиваем, что для малигнизации клеток с этой точки зрения чрезвычайно важно, чтобы указанные изменения продолжались в течение очень длительного времени. Здесь фактор времени, вероятно, является определяющим. Необходимо постепенное накопление проходящих через митоз многих поколений клеток неспецифических изменений, закрепляемых в силу этого в регуляторных генах. Известно, что для абсолютного большинства видов лейкоза и других злокачественных заболеваний необходим очень длительный период накопления изменений, многократно превышающий продолжительность жизни клеток пролиферирующих тканей. С такими же, но сравнительно кратковременными изменениями в условиях гомойтермного организма млекопитающих клетки, как правило, успешно справляются, и малигнизации не происходит.
Однако в случае малигнизации вследствие большой нестабильности генома появляются злокачественные клетки с широким набором важнейших цитологических характеристик. Часть из них находится длительное время в периоде G0 и редко вступает в деление.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
2. Строение клеточной стенки и цитоплазматической мембраны
2. Строение клеточной стенки и цитоплазматической мембраны Клеточная стенка – упругое ригидное образование толщиной 150–200 ангстрем. Выполняет следующие функции:1) защитную, осуществление фагоцитоза;2) регуляцию осмотического давления;3) рецепторную;4) принимает
НА КРУГИ СВОЯ
НА КРУГИ СВОЯ Продолжим нашу беседу об отношениях между насекомыми и растениями. Сначала скажем несколько добрых слов о растениях вообще, потому что они — травы, кустарники и деревья, — изобретя хлорофилл, взяли на себя величайшую ответственность за судьбу всех
7. РОЛЬ БЕССОЗНАТЕЛЬНОГО ПРИ НЕКОТОРЫХ ФОРМАХ ПАТОЛОГИИ
7. РОЛЬ БЕССОЗНАТЕЛЬНОГО ПРИ НЕКОТОРЫХ ФОРМАХ ПАТОЛОГИИ Формированием условного рефлекса на неосознаваемые внешние стимулы объясняется нервный механизм пространственной ориентации слепых людей [Бериташвили, 1969]. Существенная роль звуковых раздражений для ощущения
8.4. Изменение проекции индивидуального опыта в условиях патологии
8.4. Изменение проекции индивидуального опыта в условиях патологии Проекция опыта на структуры мозга может изменяться не только при нормальном ходе индивидуального развития. Повреждающие воздействия, такие, например, как перерезка нервов или ампутация пальцев,
8.6. Значение материала патологии для изучения системной организации поведения
8.6. Значение материала патологии для изучения системной организации поведения Таким образом, проекция индивидуального опыта на структуры мозга изменяется в филогенезе, определяется историей обучения в процессе индивидуального развития и модифицируется при
Порочные потенциально патогенетические круги в физиологических и внутриклеточных системах
Порочные потенциально патогенетические круги в физиологических и внутриклеточных системах Биофизический анализ совокупности экспериментальных и клинических материалов о некоторых пострадиационных, возрастных и предлейкозных изменениях позволил обнаружить и
Порочные круги в физиологических системах как основа клинической предпатологии
Порочные круги в физиологических системах как основа клинической предпатологии Первый порочный круг. Ведущие процессы: уменьшение эффективности действия гормонов и недостаток гормонов. Имеются данные о возрастном повышении порога чувствительности гипоталамуса и
Метаболиты в норме и при патологии
Метаболиты в норме и при патологии В живой клетке ежесекундно образуются сотни метаболитов. Однако их концентрации поддерживаются на определенном уровне, который является специфической биохимической константой или референтной величиной. При болезнях происходит
Патологии системы свертывания крови.
Патологии системы свертывания крови. ГемофилииГемофилин – наследственные заболевания, обусловленные отсутствием определенных факторов свертывания крови. Гемофилия А связана с дефицитом фактора VIII, гемофилия В (болезнь Кристмаса) – фактора IX, гемофилия С – фактора XI.
Патологии органов мужской половой системы
Патологии органов мужской половой системы Аномалии строения полового членаВ ряде случаев у кобелей встречаются аномалии в виде укорочения, искривления, сужения крайней плоти (фимоз), недоразвития дистального отдела мочеиспускательного канала, при котором его наружное
4.5. Морфогенетические зародыши в биологических системах
4.5. Морфогенетические зародыши в биологических системах На клеточном уровне зародыши морфогенетических трансформаций могут быть морфическими единицами низшего уровня в клетках, которые присутствуют как в начале, так и в конце процесса клеточной дифференциации.
2.1. Вопрос нормы и патологии. Определение нормальной психики
2.1. Вопрос нормы и патологии. Определение нормальной психики В работе с животными, проявляющими аномальное поведение, одним из базовых понятий, на которое должны опираться в своей деятельности специалисты в области поведенческой медицины, это различение нормы и
Патологии беременности и послеродового периода
Патологии беременности и послеродового периода Выпадение влагалища наблюдается во второй половине беременности при погрешностях кормления и отсутствии моциона. Оно обусловливается повышением внутрибрюшного давления в сочетании с расслаблением сфинктера преддверия
5.5. О значении элементов случайности на разных этапах клеточной эволюции
5.5. О значении элементов случайности на разных этапах клеточной эволюции Мы рассмотрели основные этапы химической, предклеточной и клеточной эволюции вплоть до формирования эукариотических клеток, основавших царства животных и растений. Это сделано, в частности, для
4.2. Возникновение клеточной организации
4.2. Возникновение клеточной организации Учеными было доказано, что после испарения воды из реакционного объема в амфифильных липидоподобных и липидных молекулах формируются жидкокристаллические агрегаты, в которых молекулы расположены периодическими слоями, как в