11.1 Трудно быть богом?
А теперь предлагаю немного потренироваться, попробовав себя в роли создателя живых организмов. Представьте, что Вам дали задание – создать животное размером примерно с тигра. Понятно, что популяции таких животных в дикой природе не смогут составлять многие миллиарды особей. Иначе никакой еды на них не напасешься. И так же понятно, что достигать половозрелости всего за несколько часов такие животные тоже не смогут. Животные подобного размера должны будут долго расти, чтобы достигнуть размеров, близких к размеру тигра. То есть, созданное Вами животное подобного размера просто обязано будет иметь низкую численность популяций, и низкую скорость смены поколений.
Но ведь в окружающей среде, в которую Вы должны будете выпустить это животное, наверняка происходят какие-то колебания. И если Вы хотите, чтобы созданное Вами животное, выпущенное в дикую природу, не вымерло сразу же после выпуска, Вы обязаны предусмотреть для этого животного какие-то специальные механизмы, которые позволят ему быстро и эффективно реагировать на неизбежно появляющиеся новые вызовы среды (в том числе, и непредсказуемые). Понятно, что тупой естественный отбор случайных мутаций, с попыткой поиска именно того мутантного «тигра», который сумеет выжить в новой ситуации, здесь не подойдет. Этот механизм в данном случае недопустимо медленный и расточительный.
Здесь можно провести хорошую аналогию с хакерскими атаками. Допустим, имеется задача взломать какую-нибудь систему безопасности, подобрав к ней ключ доступа. Профессиональным хакерам хорошо знаком термин «brute force search», то есть, взлом пароля методом «грубой силы». Это когда необходимый пароль подбирается наиболее тупым способом – путем полного перебора всех возможных вариантов (вплоть до того момента, пока нужная комбинация не совпадёт с одним из вариантов перебора).
Понятно, что если пароль – длинный, то для его взлома методом «грубой силы» требуется большое число попыток. И этих попыток тем больше, чем длиннее пароль. Вплоть до астрономического числа попыток. Чтобы проиллюстрировать, насколько сильно повышается необходимое число попыток при увеличении длины пароля, и сколько времени на этот взлом потребуется компьютеру, приведу соответствующую таблицу:[181]
Таблица 4. Оценочное время полного перебора паролей в зависимости от их длины
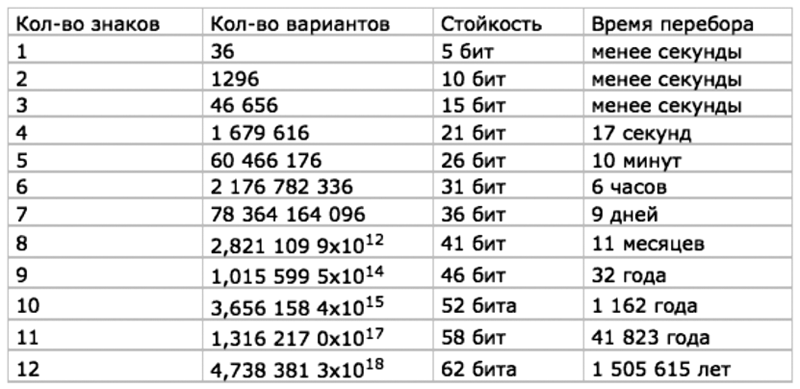
Из таблицы видно – чтобы найти нужный пароль длиной 6 символов, компьютеру Pentium 100 потребуется, в среднем, 6 часов. А вот для того, чтобы найти нужный пароль длиной 12 символов, этому же компьютеру потребуется уже 1.5 млн. лет времени.
Теперь перейдем ближе к нашим «тиграм». Допустим, наши «тигры» в природе столкнулись с новым штаммом вируса, который для них крайне опасен и приводит к 90 % гибели в случае заражения. Спасти наших «тигров» может всего одна конкретная точечная мутация (мутация конкретного нуклеотида) в одном из генов, отвечающих за синтез антител к этому вирусу. То есть, вирус немного изменился, став страшно опасным, но спастись от этого вируса вполне можно, если только соответствующее (уже имеющееся) антитело к старому варианту этого вируса тоже немного изменится, подстроившись под новый вариант вируса.
Допустим, частота случайных точечных мутаций у нашего «тигра» составляет примерно 1 к 1 млрд. (на нужный нуклеотид). В этом случае нам потребуется примерно миллиард наших бедных «тигров», чтобы, наконец, «взломать» этот новый вирус с помощью соответствующего (нового) мутантного «тигра». Понятно, что если у нас по всей дальневосточной тайге бегает не более 500 тигров, то тратить миллиард таких тигров для защиты от одной несчастной инфекции – это недопустимая расточительность. То есть, если мы решим, что наши тигры должны адаптироваться к новым инфекциям именно по методике полного перебора, то это гарантированно приведет к вымиранию наших «тигров», над созданием которых мы столь упорно (теоретически) трудились.
Поэтому нам следует позаботиться о том, чтобы снабдить созданных нами «тигров» специальными механизмами, которые будут гораздо более эффективны, чем метод «грубой силы». Хорошим решением здесь будет, например, создание специальной системы гипер-мутирования внутри каждого тигра. То есть, подвергать методу полного перебора следует не самих тигров, а лишь определенные гены в соответствующих клетках, находящихся внутри самих этих тигров. А именно, в таких клетках, которые специально предназначены для борьбы с разнообразными инфекциями (клетки иммунной системы). Таким образом, при появлении новой инфекции, внутри каждого тигра будет происходить быстрый «brute force search». И вполне вероятно, что «тигры» с таким специально встроенным «решателем проблем» успешно преодолеют новую для них напасть. Причем число выживших особей окажется вполне достаточным для будущего устойчивого существования созданного нами вида.
Всё это мы и наблюдаем в реальной природе – сложные и большие организмы с низкими численностями популяций и низкой скоростью смены поколений имеют специальные (встроенные) «решатели проблем» для преодоления огромного числа «сиюминутных» возмущений среды. Начиная от крайне эффективной иммунной системы (в которую как раз встроен тот самый метод «грубой силы») и кончая никак не менее эффективным реагированием на повседневные вызовы среды с помощью механизмов нервной системы у высокоразвитых животных и т. п.
А теперь давайте представим себе, что мы создаем не «тигра», а наоборот – крайне маленькое и очень просто устроенное живое существо. По нашей задумке, таких существ в природе должно быть очень много. И размножаться они должны так быстро, чтобы ими могла питаться вся следующая ступень громадной пищевой пирамиды живых существ, но при этом бы эти мелкие существа не заканчивались.
И вот мы, допустим, создали таких живых существ. И получились эти существа точь в точь похожими на известных нам бактерий.
Понятно, что и перед этими существами тоже будет стоять задача эффективного реагирования на многочисленные мелкие изменения среды (в том числе, и на непредсказуемые). Стоит ли снабжать этих живых существ специальными механизмами решения возникающих проблем? Например, мы можем каким-то образом попытаться «всунуть» в эти существа нервную систему. Но насколько в этом случае замедлится рост и размножение этих микроскопических созданий? Ведь тогда каждой «бактерии» придётся строить и содержать весьма дорогостоящую структуру (нервную систему). А нам была нужна от этих существ максимальная численность и максимальная продуктивность (создание биомассы в единицу времени).
И после небольших раздумий на эту тему мы понимаем, что никаких особо сложных механизмов выживания в такие существа «встраивать» не надо. Вполне достаточно минимума процедур, необходимых для выживания.
Но что же делать со средствами быстрого реагирования на вызовы окружающей среды? Ведь нашим «бактериям» всё-таки нужно как-то бороться с постоянными колебаниями природных условий. И опять после небольших раздумий мы понимаем, что никаких особенных средств в этом случае – тоже не нужно. Поскольку наши микроскопические создания имеют колоссальную численность (в колониях), и не менее колоссальную скорость смены поколений (по сравнению с озвученными выше «тиграми»), то для эффективного реагирования на непредсказуемые изменения среды этим созданиям вполне достаточно того самого метода полного перебора, о котором мы говорили чуть выше. Действительно, если частота точечных мутаций у наших «бактерий» будет такой же, как и у созданных нами «тигров», то есть, 1 к 1 млрд. (на конкретный нуклеотид), тогда поставленная выше задача по «подбору необходимого ключа» к новому смертельно опасному вирусу – может быть успешно решена даже внутри одной единственной колонии бактерий (в первом же поколении). Потому что единственная колония бактерий может насчитывать многие миллиарды особей. Что уж тогда говорить о сотнях и тысячах подобных колоний (которые могут находиться всего на одном метре площади) и о сотнях сменившихся поколений в этих колониях (которые могут смениться в течение одного месяца).
Получается, что механизм случайные мутации+естественный отбор является вполне достаточным для поддержания способности приспосабливаться к мелким изменениям окружающей среды конкретно у бактерий. И способен обеспечить надежное выживание в природе этих микроскопических созданий.
То есть, получается, что Дарвин, когда-то опубликовавший принцип случайные изменения+естественный отбор в качестве механизма глобальной эволюции, на самом деле, может быть, действительно кое-что открыл. Он открыл конкретный адаптивный механизм, с помощью которого бактерии подстраиваются под мелкие изменения окружающей среды. Ну что же, и этот результат – тоже результат.
Итак, давайте подведем предварительные итоги. Ясно, что бактерии и эукариоты – это настолько разные формы жизни, что возникает большой вопрос, насколько вообще корректно сравнивать механизмы эволюции этих двух форм жизни, даже если бы такие механизмы (эволюции) действительно существовали.
Допустим (еще раз) на минуту, что бактерии на самом деле способны эволюционировать, причем именно по механизму случайные мутации+естественный отбор. Ну и какие же результаты этой эволюции? Результаты весьма скромные – отсутствие каких-либо видимых морфологических изменений на протяжении миллиардов лет (см. выше). Этот факт косвенно демонстрирует нам, насколько маломощной эволюционной силой является озвученный механизм эволюции. А вот конкретно слоны (точнее, отряд хоботные), в отличие от бактерий, морфологически изменялись весьма интенсивно (в ходе предполагаемой эволюции). И это несмотря на очень малую численность популяций (в сравнении с бактериями) и несмотря на очень низкую скорость смены поколений (в сравнении с этими же бактериями). Так на каком основании мы должны считать механизмы изменения бактерий и механизмы изменения слонов – одинаковыми?!
Можно, конечно, предположить, что бактерии – это просто такой биологический таксон, для которого именно морфологическая эволюция – крайне затруднена по тем или иным причинам (например, в силу воображаемой исходной «жесткости» организации бактериальных клеток). А вот во всех остальных отношениях бактерии вполне способны эволюционировать. Но это лишь теоретические спекуляции. А по факту у нас получается, что за 3 млрд. лет собственного существования бактерии продемонстрировали очень скромные способности к эволюции форм. И если бы слоны в этом отношении были подобны бактериям, то они бы вообще никуда не сэволюционировали.
Итак, даже если бы сегодняшние бактерии действительно демонстрировали нам совершенно ясную «эволюцию в пробирке», то такие примеры всё равно вряд ли могли бы считаться корректными для объяснения эволюции слонов.
Но мы уже выяснили, что бактерии, скорее всего, демонстрируют нам не «эволюцию в пробирке», а просто «адаптацию в пробирке» (к мелким изменениям окружающей среды), которая конкретно у этих живых существ осуществляется методом «грубой силы» (то есть, собственно, естественным отбором всех возможных случайных мутаций). И никуда дальше этого «эволюция» бактерий не заходит.
Интересно, что для достижения адаптации к локальным изменениям среды, бактерии могут использовать не только метод «грубой силы», но и другие, специальные генетические механизмамы, гораздо более эффективные, чем обычный «полный перебор». Во всяком случае, результаты некоторых исследований в этой области явно свидетельствуют в пользу наличия таких специальных механизмов у бактерий.
Например, весьма впечатляют результаты знаменитых опытов Холла (Hall, 1991). В этих исследованиях Холл получил двойных мутантов, у которых с помощью мутаций было сломано сразу два гена, необходимых для синтеза аминокислоты триптофан. Причем каждая из этих двух мутаций в отдельности – уже лишала бактерию способности синтезировать триптофан. Поэтому мутантные бактерии не могли самостоятельно синтезировать триптофан, а усваивали его только в готовом виде. Далее Холл сажал этих бактерий в среду, в которой отсутствовал готовый триптофан. Триптофан необходим для нормальной жизнедеятельности бактерий, но получить сразу нужного двойного мутанта, то есть, такого мутанта, у которого нужные нуклеотиды восстановлены обратно (необходимой двойной мутацией), вряд ли стоило ожидать, поскольку вероятность такой (двойной) мутации слишком низка. Поэтому будущее этих несчастных бактерий в среде без готового триптофана представлялось совершенно печальным. Однако к удивлению Холла (и всей остальной научной общественности), эти бактерии по-быстрому умудрились отремонтировать себе нужные гены обратно, и снова стали синтезировать триптофан, как ни в чем не бывало. То есть, бактерии продемонстрировали (по факту), что они способны получать жизненно необходимые им двойные мутации примерно в 100.000.000 раз чаще (!), чем это ожидалось при чисто случайном распределении мутаций. Такой результат опытов Холла выглядел чуть ли не мистически. Создавалось ощущение, что бактерии просто знают, что и как им надо отремонтировать у себя в ДНК, чтобы выжить.
Позже были обнаружены такие факты, в свете которых мистичность результатов, полученных Холлом, немного поуменьшилась. Оказалось, что бактерии, помимо обычного метода «полного перебора», всё-таки имеют еще один, специально встроенный «решатель проблем». Видимо, для таких ситуаций, которые совсем уже «из ряда вон».
Бактерии (и не только бактерии) имеют особый генетический комплекс – SOS-систему, которая в нормальных условиях почти бездействует. SOS-система начинает активно работать в случае возникновения множественных повреждений молекул ДНК. Эти повреждения могут быть вызваны самыми разными причинами – начиная от ультрафиолетового излучения и кончая воздействием ряда антибиотиков. В таких случаях SOS-система производит экстренный ремонт молекул ДНК.
И вот (как выяснилось) SOS-система бактерий устроена таким образом, что в совсем уже экстремальных случаях (когда повреждения ДНК становятся особенно массированными), SOS-система начинает ремонтировать ДНК специфическим образом – она начинает специально допускать гораздо больше генетических ошибок, чем в своем обычном режиме работы. По сути, SOS-система бактерий переключается с режима ремонта ДНК в режим гипер-мутагенеза этой ДНК. Переход SOS-системы из режима репарации в режим гипермутагенеза обеспечивается включением целого ряда специальных генов, которые в свою очередь, достаточно «умны», чтобы включаться только в самых экстренных случаях (так устроена эта генетическая система).
В результате включения режима гипер-мутагенеза, частота возникновения мутаций в ДНК может повыситься сразу на несколько порядков. Понятно, что в таких условиях быстро находить необходимые варианты одинарных или даже двойных мутаций методом «полного перебора» становится намного легче (учитывая огромную численность бактериальных колоний). Таким форсированным способом можно быстро получить, например, устойчивость к тому или иному антибиотику (или к другому разрушительному фактору среды).
Однако решать проблемы подобным способом – это уже так называемый «вариант атас». Потому что значительная часть бактерий станет получать мутации, либо вредные, либо вообще несовместимые с жизнью. В результате, бактериальная колония в целом станет либо хуже расти, либо вообще сокращаться. Но видимо, иногда проблемы бывают настолько серьезными, что всё-таки требуют включения механизма гипер-мутирования. Пусть большая часть бактерий при этом погибнет от вредных мутаций, но зато какие-то отдельные счастливчики могут стать обладателями именно такого генетического изменения, которое успешно решит возникшую проблему выживания. И в результате, данная линия бактерий сможет продолжить своё существование.
Таким образом, получается, что бактерии для приспособления к среде могут использовать не только обычный вариант «полного перебора», но и его форсированный вариант (во всяком случае, в некоторых ситуациях). Такую способность можно рассматривать, как еще один (дополнительный) механизм, которым кто-то заботливо снабдил (?) бактерий, для того чтобы повысить надежность их выживания при самых экстремальных возмущениях среды. Действительно, трудно представить, каким образом подобный генетический механизм мог бы появиться у бактерий естественным образом. Ведь переход SOS-системы в режим гипер-мутагенеза полезен только иногда, в самых экстремальных условиях (для получения необходимой редкой мутации). В обычных же условиях, такой режим работы будет приводить к снижению конкурентоспособности тех бактериальных линий, в которых SOS-система вздумает начать работать именно в таком режиме. Потому что в этом случае образуется слишком много бактериальных клеток с вредными мутациями. Следовательно, для того чтобы приносить пользу (а не вред!), такой режим работы SOS-системы должен был появиться сразу в готовом виде, то есть, уже уметь надежно «засыпать» в нормальных условиях и просыпаться только в самых экстремальных. Но такая особенность работы SOS-системы обеспечивается несколькими специальными генами. Поэтому представить, как это могло образоваться методом постепенных «случайных тыков» – не очень получается.
Впрочем, проблема естественного возникновения подобного генетического комплекса ничуть не тяжелее проблемы естественного возникновения какой-нибудь системы свертываемости крови, или механизма мейоза, или биохимического пути гликолиза.
А теперь давайте вернемся обратно к результатам опытов Холла (Hall, 1991). Можно предположить, что бактерии, которые в экспериментах Холла поразительно быстро восстанавливали способность синтезировать триптофан – делали это не в силу обладания мистическими способностями, а просто в результате резкого повышения общего мутационного фона (вызванного, допустим, работой озвученной SOS-системы в режиме мутагенеза). Вследствие чего необходимая двойная мутация находилась гораздо быстрее (в 100 млн. раз быстрее), чем это ожидалось в обычном «режиме» жизнедеятельности бактерий.
Однако при ближайшем рассмотрении такое предположение перестаёт выглядеть привлекательным.
Во-первых, потому что той частоты мутагенеза, которую могут обеспечить гены-мутаторы SOS-системы, всё равно не хватает для объяснения результатов опытов Холла. Например, в работе (Maisnier-Patin et al., 2005) исследователи использовали один из генов-мутаторов бактериальной SOS-системы, но даже самая активная работа этого гена обеспечила повышение частоты разных[182] мутаций не более чем на 2 порядка (то есть, всего в 100 раз или немного больше). Однако Холл оценил скорость восстановления «триптофановых способностей» у своих бактерий – в 100 миллионов раз выше, чем это ожидалось бы при случайном распределении мутаций (происходящих в обычном темпе мутагенеза). Получается, что наблюдаемая скорость восстановления бактерий в эксперименте Холла всё равно была в миллион раз выше, чем это ожидалось бы методом «полного перебора», даже после его форсирования в 100 раз.
Во-вторых, в работе (Maisnier-Patin et al., 2005) было показано, что работа гена-мутатора приводит к более-менее равномерному распределению мутаций по всему геному бактерии, при общем повышении частоты разных мутаций в 100 раз. В связи с этим возникает вопрос – а способны ли вообще бактериальные колонии выдержать повышение мощности мутагенеза не в 100 раз, а в 100.000.000? Не получится ли при такой частоте мутаций полного вымирания бактериальных колоний, вследствие мгновенного накопления вредных мутаций практически в каждой бактериальной клетке?
В общем, маловероятно, что быстрое восстановление бактерий (из состояния двойного мутанта) в экспериментах Холла происходило за счет общего повышения уровня мутагенеза. Поэтому не исключено, что «недра» бактериальной клетки скрывают внутри себя еще какой-то (пока не очень понятный) специальный механизм, который в ответ на вызовы среды способен подбирать необходимые генетические изменения гораздо эффективнее, чем обычный мутагенез, и даже эффективней, чем гипер-мутагенез бактериальной SOS-системы.
То есть, бактерии, оказывается, не так просты, чтобы адаптироваться к изменениям окружающей среды только с помощью естественного отбора случайных мутаций в обычном режиме мутирования. Помимо обычных случайных мутаций они могут: 1) обмениваться между собой нужными генами в ходе горизонтального переноса, 2) использовать форсированный вариант «полного перебора» (гипермутагенез), 3) возможно, обладают еще какими-то (более «умными») механизмами адаптаций.
Ну а каковы же возможности самого примитивного генетического механизма адаптации бактерий – метода «полного перебора» в обычном режиме? По этому поводу имеется некоторый разнобой фактов.
С одной стороны, имеются данные, что такой способ весьма неплох. Например, в работе (Weinreich et al., 2006) исследователи на практике показали, что «brute force search» в исполнении бактерий, в принципе, способен на многое. В этой работе исследователи продемонстрировали, что у бактерий, с которыми они работали, может выработаться устойчивость к новому антибиотику цефотаксиму. Для этого в ДНК исходных бактерий должны произойти 5 конкретных точечных изменений (мутаций). В этом случае, устойчивость бактерий к новому антибиотику возрастает в 100000 раз. Понятно, что сразу все 5 нужных изменений появиться у бактерий не могут. Для подобной мутации не хватит вообще всех существующих бактерий на планете Земля. Действительно, если частота точечной мутации (с заменой нужного нуклеотида) будет одна к миллиарду, то вероятность того, что сразу 5 нужных нуклеотидов мутируют именно нужным образом внутри какой-нибудь одной бактерии, составит 1 к 1045. Понятно, что такое событие не случится вообще никогда.[183]
Более того, авторы исследования благоразумно рассудили, что даже нужную двойную мутацию (где сразу два конкретных нуклеотида мутируют внутри одной бактерии) тоже вряд ли можно сразу получить методом полного перебора. Потому что такая двойная мутация (вероятность 10-18) потребует количества бактерий (1018 особей), которое вряд ли можно насобирать в пределах воздействия нового антибиотика.
Поэтому авторы работы (Weinreich et al., 2006) решили посмотреть, можно ли получить из исходного немутантного гена, мутантный ген, несущий все 5 нужных мутаций – с помощью цепочки из пяти последовательных одинарных (нужных) мутаций.
То есть, они рассматривали вариант, когда одновременно происходит только одна единственная мутация (из пяти необходимых). И далее исследовали, смогли бы бактерии (в принципе) приобрести конечную устойчивость к новому антибиотику путем «пошагового» (постепенного) приобретения всех пяти мутаций, с величиной шага в одну единственную мутацию. Или не смогли бы. Действительно, это весьма интригующий вопрос. Ведь для того, чтобы естественный отбор последовательно поддержал все пять мутаций, каждая новая мутация, взаимодействуя с предыдущими мутациями, должна повышать, а не понижать устойчивость к новому антибиотику.
Например, одна из пяти мутаций, исследовавшихся в этой работе, не увеличивает, а наоборот, снижает устойчивость к антибиотику, поскольку соответствующий фермент, получив эту мутацию, начинает разрушать данный антибиотик медленнее, чем без этой мутации. Зато эта мутация заметно повышает стабильность («время жизни») этого фермента в цитоплазме самой бактерии. Другая мутация приводит к тому, что соответствующий фермент начинает разрушать антибиотик быстрее. Но зато из-за этой мутации фермент становится менее стабильным (сам быстрее разрушается). А вот двойной мутант по только что озвученным мутациям – уже имеет резко повышенную устойчивость к антибиотику. Потому что соответствующий фермент (с этими двумя мутациями), с одной стороны, быстрее разрушает антибиотик, а с другой стороны, сам «живет» внутри бактериальной клетки дольше. Получается, что например, первая мутация вообще не сможет закрепиться в колонии бактерий до тех пор, пока бактерия не получит вторую мутацию.
То есть, каждая из пяти мутаций определенным образом изменяет конформацию соответствующего белка (фермента, расщепляющего антибиотик). И теоретически, каждое такое изменение может либо «разрешить», либо, наоборот, «запретить» закрепление следующей мутации (вследствие отрицательного отбора).
Поэтому авторы исследования экспериментально проверили все возможные варианты, в каком порядке могли бы появляться 5 нужных одиночных мутаций. Число этих вариантов 120 (факториал из 5). И действительно, обнаружили несколько путей (из возможных 120), с помощью которых каждая из 5 конкретных мутаций, возникая, повышала в той или иной степени устойчивость к антибиотику, пока, наконец, все 5 нужных мутаций не давали бактерии практически полную защиту от антибиотика (повышали устойчивость бактерии к цефотаксиму в 100 тысяч раз).
Таким образом, авторы работы (Weinreich et al., 2006) показали на практике, что метод «полного перебора» даже при величине «шага» всего в одну мутацию – может приводить к весьма впечатляющим результатам, надежно защищая бактерий от непредсказуемых условий среды.
Правда, остался невыясненным вопрос, а что будет, если для достижения результата (возникновения полезного признака или свойства) нужно не 5 одновременных мутаций, а например, 20? Найдется ли в этом случае непрерывная «дорожка» из отдельных «шажков», каждый из которых будет повышать приспособленность? Или уже не найдется?
Впрочем, этот вопрос уже из области знаменитой «проблемы неуменьшаемой сложности» (Behe, 1996). То есть, из серии – а можно ли собрать паровоз путем постепенного присоединения к нему отдельных деталей таким образом, чтобы каждая деталь хотя бы немного повышала функциональность этого паровоза? Задаваться такими теоретическими вопросами мы здесь не будем. А лучше посмотрим, какие результаты и возможности демонстрируют нам сами бактерии, вооруженные методом «прямого перебора».
К сожалению, в целом эти результаты всё-таки не впечатляют. «Дорожка» из 5 мутаций, повышающих в итоге приспособленность в 100000 раз – это конечно круто. Но в большинстве реальных случаев, когда бактериям срочно необходимо к чему-нибудь приспособиться, дело обычно оканчивается всего одной (максимум, двумя) мутациями. И на этом этапе всё и останавливается. Причем в итоге получаются отнюдь не идеальные варианты, а как правило, уже известные нам «полезные поломки». То есть, когда бактериям срочно нужно к чему-нибудь приспособиться, то подхватывается любая мутация, которая может помочь в этой ситуации. Но эта же мутация одновременно серьезно ухудшает что-нибудь другое. И в результате, такие бактерии, содержащие «полезную поломку», проигрывают в борьбе за выживание обычным («не поломанным») бактериям, как только условия среды возвращаются в нормальное русло. То есть, подобные «полезные поломки», полученные методом «грубой силы», можно рассматривать лишь как временные реакции бактерий на какие-то экстремальные возмущения среды. А потом «всё возвращается на круги своя» (и окружающая среда, и живущие в ней бактерии).
Например (допустим) какая-то бактерия использует специальный белок для активного транспорта внутрь собственной клетки какого-нибудь полезного для неё вещества. И тут Вы создаёте антибиотик, молекула которого похожа на это полезное вещество. В результате, бактерии начинают закачивать внутрь себя этот новый яд, и погибают. Однако у какой-то бактерии случилась «полезная поломка» – тот белок, который транспортировал полезное вещество через мембрану – мутировал. И в результате стал плохо выполнять свои функции. В обычных условиях такая бактерия – является калекой. Она будет расти и размножаться хуже своих соседок. Однако в условиях отравления антибиотиком, эта бактерия получает преимущество. Потому что все нормальные бактерии в этих условиях исправно накачивают себя ядом. А больная бактерия этого делать не может.
Вот такие «калеки» обычно и получаются в результате знаменитого «приспособления бактерий к антибиотикам», о котором прожужжали все уши верующие дарвинисты, выдавая такие приспособления за «доказательства эволюции». То есть, те самые «супер-бактерии» из наших больниц, которыми нас так пугают свидетели Дарвина (будто бы эти бактерии настолько «эволюционировали», что стали устойчивы чуть ли не ко всем антибиотикам сразу)… на самом деле, в большинстве своем являются весьма серьезными калеками и инвалидами. И по этой причине в естественной среде не могут быть конкурентами обычным здоровым колониям исходных бактерий.
Наверное, так бывает не всегда. Ведь теоретически, методом «грубой силы» можно получить не только «полезные поломки», но и какие-нибудь более полезные вещи. Но по факту, о появлении у бактерий чего-нибудь полезного и при этом невредного – слышно очень редко. А уж о возникновении методом «грубой силы» каких-нибудь принципиально новых (полезных) генов, и уж тем более, новых биохимических путей – вообще не слышно.
В тех же случаях, когда для борьбы с теми или иными антибиотиками у бактерий обнаруживаются какие-то особые гены (т. е. гены, специально предназначенные для борьбы с тем или иным антибиотиком)… неожиданно оказывается, что ископаемые бактерии возрастом в десятки тысяч или даже в миллионы лет – уже обладали этими генами. Но об этом чуть ниже.
А сейчас давайте разберем один конкретный пример такой «полезной поломки» у бактерий, который, благодаря совместным усилиям всех верующих дарвинистов мира, стал, наверное, самым известным примером «доказательства эволюции» у бактерий. Чуть ли не «притчей во языцех».
Речь идет о «бактериях, научившихся есть цитрат», в экспериментальных исследованиях коллектива Ленски (Blount et al., 2008). Это наиболее модный пример, известный сегодня в области «наблюдаемой эволюции бактерий». Действительно, если рассматривать этот пример «с высоты птичьего полёта», то результат выглядит впечатляюще – бактерии сначала не умели есть цитрат, а потом (в результате случайной мутации) научились его «кушать». То есть, освоили новый вид «корма» в ходе естественной эволюции.
Но дело в том, что если не «пролетать над гнездом кукушки» (С), а рассмотреть этот пример внимательно, то первое, что мы выясним – на самом деле, бактерии кишечной палочки всегда умели кушать цитрат. Просто в природе они делают это только в выгодных для себя (особых) условиях.
В эксперименте, поставленном коллективом Ленски, бактерии искусственно пересаживались в колбы с питательной средой, где они питались глюкозой. Кроме того, в питательной среде содержался еще и цитрат (лимонная кислота).
Цитрат не усваивается бактериями кишечной палочки в присутствии кислорода. В кислородных условиях кишечная палочка использует гораздо более эффективные пути добычи энергии (более эффективные в десятки раз), чем те, которые даёт потребление конкретно цитрата. Поэтому кишечная палочка начинает использовать цитрат только в условиях отсутствия кислорода. Такая способность реализуется за счет того, что ген, который кодирует белок-переносчик цитрата (необходимый для того, чтобы бактерия стала потреблять цитрат), связан с управляющим участком ДНК (промотором), который подавляет работу гена, синтезирующего белок-переносчик цитрата, если в среде присутствует кислород.
И вот, в результате, бедные колонии бактерий на протяжении 30.000 поколений в этом эксперименте практически «сидели» на цитрате, но не могли его использовать. И только примерно на 31.000 поколении произошла соответствующая мутация – описанный выше генный комплекс (оперон), наконец, сломался. А именно, ген, кодирующий только синтез белка-переносчика цитрата, дополнительно скопировался еще и в другую область ДНК, тем самым вырвавшись из того оперона, который блокировал его работу в присутствии кислорода, и попал в оперон, не чувствительный к фактору присутствия кислорода. Поэтому этот ген стал работать всё время, то есть, соответствующий белок-переносчик цитрата начал синтезироваться бактериальной клеткой всё время. В результате, мутантные кишечные палочки начали усваивать цитрат тоже всё время – как в условиях отсутствия кислорода, так и в его присутствии.
Говоря простыми словами, произошло примерно следующее. Раньше у Вас на кухне был работающий кран. Поэтому вода из него текла только тогда, когда Вам это было нужно (когда Вы открывали этот кран). Но в какой-то момент этот кран – сломался. И теперь вода из него течет всё время. Однако в каких-то особых условиях это «новое свойство» Вашего крана может оказаться полезным. Например, теперь Вы точно не умрете от жажды, даже если у Вас связаны руки.
Вот так же и поломка генного комплекса, регулирующего потребление цитрата, оказалась полезной в специфических условиях, заданных экспериментаторами.
Таким образом, в этом эксперименте:
1). Бактерии «научились» есть цитрат не за счет возникновения каких-то новых генов, а за счет поломки уже имевшегося генного комплекса.
2). На то, чтобы сломать соответствующий генный комплекс, у бактерий ушло более 31.000 поколений! Здесь надо вспомнить, что колонии бактерий (в одной пробирке) насчитывают миллиарды особей. Тем не менее, потребовалось ждать 31.000 поколений до нужной поломки.
Что уж тогда говорить об эволюции каких-нибудь тигров или горилл, популяции которых насчитывают всего сотни особей? При этом (еще раз) речь здесь идет не о возникновении какого-нибудь нового гена, а лишь о поломке уже имеющихся генов, конкретно, о разрыве связи между геном, синтезирующим нужный белок, с его исходным опероном. В свете таких интересных подробностей, возможные перспективы воображаемой эволюции бактерии в человека по такому же (!) механизму – начинают выглядеть весьма удручающими. Наверное, можно даже сказать, что эксперимент Ленски наглядно показал невозможность такой эволюции (по механизму случайные мутации + естественный отбор). Ведь для эволюции бактерии в человека, во-первых, требуется возникновение многих тысяч принципиально новых генов. А не поломка уже имеющихся генных комплексов. А во-вторых, воображаемые предки людей были высшими животными, поэтому не могли иметь популяции размером многие миллиарды особей. Что обесценивает возможности механизма «полного перебора» просто критически.
Тем не менее, эксперимент коллектива Ленски на этом не был остановлен. Биологи продолжали наблюдать за теми бактериями, которые в результате озвученной «полезной поломки» приобрели способность потреблять цитрат. Пока они делали это еще слабо, поэтому скорость их размножения еще очень мало отличалась от бактерий, не имевших подобной мутации (Blount et al., 2008; Blount et al., 2012).
Но в следующих поколениях бактерий, мутантный ген (оторвавшийся от своего кислород-регулирующего промотора и «примкнувший» к промотору, безразличному к наличию кислорода), скопировался в ДНК бактерий, возможно, еще несколько раз подряд. В результате, синтез белка-переносчика цитрата тоже резко усилился. И как следствие, серьезно усилилась транспортировка цитрата через бактериальную мембрану и его усвоение кишечной палочкой. Таким образом, в течение еще нескольких тысяч поколений исходная кишечная палочка научилась кушать цитрат, как говорится, «на полную катушку». То есть, здесь имела место не просто (одна) полезная поломка, а этот результат был еще усилен дополнительными мутациями – созданием дополнительных копий нужного гена. Явление, тоже не редкое у бактерий – когда они наращивают в ДНК копии тех генов, которые дают им сиюминутное преимущество в какой-то конкретной среде (например, дополнительные копии тех генов, которые ответственны за синтез белков, разрушающих тот или иной антибиотик).
Интересно, что в эксперименте Ленски мутантные бактерии, научившиеся эффективно усваивать цитрат в любых условиях, так и не смогли до конца вытеснить исходные бактерии (усваивающие цитрат только в отсутствии кислорода). Оно и понятно. Если вокруг есть глюкоза, то ставить на постоянный «поток» синтез белка-переносчика цитрата, является не экономичным занятием. В это время лучше сосредоточиться на синтезе белков, расщепляющих глюкозу. То есть, мы опять наблюдаем, что «бактерию, научившуюся есть цитрат», в принципе, можно считать своеобразным «инвалидом», который в естественных условиях неизбежно проиграет исходным бактериям. Видимо поэтому кишечные палочки и оставили себе «лазейку» (для возвращения к своему нормальному состоянию) в виде некоторого числа исходных (не мутантных) особей?
В этот момент верующий дарвинист может, конечно, начать иронизировать, говоря о том, что таким же образом в качестве «инвалида» можно представить вообще любое живое существо, приспособленное к конкретной среде обитания. Например, гималайского медведя можно представить в качестве «инвалида», проигрывающего белому медведю в условиях Арктики. Однако факт остаётся фактом – ни окончательного разделения ниш, ни окончательного вытеснения в эксперименте Ленски пока не получилось. Как не получается аналогичных разделений и вытеснений и в естественных, «диких» колониях кишечной палочки. Никто пока, вроде бы, не зафиксировал в реальной природе возникновения новых видов кишечной палочки. Да что там кишечные палочки. Озвученные выше цианобактерии не потрудились измениться и за 2 млрд. лет собственной «эволюции». Хотя цианобактерии, наверное, способны к генетическим перестройкам собственной ДНК никак не меньше кишечных палочек. Тем не менее, никакой (видимой) эволюции за 2 млрд. лет.
Более того, имеются и такие факты, которые превращают ситуацию с «эволюцией бактерий» уже в полный анекдот. Дело в том, что периодически ученые находят и «размораживают» бактерий очень древнего возраста. Поскольку «эволюция бактерий» часто доказывается именно указанием на их способность приспосабливаться к воздействию антибиотиков, то в ряде исследований биологи проверили древних бактерий именно на устойчивость к этим самым антибиотикам. И оказалось, что древние бактерии… столь же устойчивы к современным антибиотикам, как и сегодняшние бактерии. Причем устойчивость к антибиотикам древним бактериям обеспечивают… те же самые гены, которые сегодня ответственны за то же самое в ДНК современных бактерий.
Конкретно, устойчивость к современным антибиотикам продемонстрировали «размороженные бактерии» возрастом 30000 лет (D'Costa et al., 2011).
Такую же устойчивость к современным антибиотикам показали бактерии возрастом 4000000 лет (Bhullar et al., 2012).[184]
Некоторые штаммы этих бактерий оказались устойчивыми сразу к 14 различным коммерчески доступным антибиотикам. В том числе, к сравнительно новому даптомицину, полусинтетическим макролидным антибиотикам и т. п.
Наконец, еще одно исследование, проведенное совсем недавно, установило, что у индейцев изолированного племени яномами (Южная Америка), которые никогда не сталкивались с антибиотиками – бактерии их кишечной флоры, тем не менее, обладают целым набором специальных генов устойчивости к разным современным антибиотикам. В том числе, и к современным синтетическим антибиотикам (Clemente et al., 2015).
Спрашивается, ну и какие же изменения в «жизни бактерий» мы наблюдаем? Бактерии, оказывается, испокон веков обладают способностью сопротивляться воздействию антибиотиков. Вот тебе и «эволюция бактерий».
Причем благодаря широко распространенному у бактерий горизонтальному переносу генов (за счет захвата ДНК других бактерий), эти маленькие создания, в принципе, способны к распространению уже имеющихся (испокон веков?) генов устойчивости к разным антибиотикам чуть ли не по всему бактериальному царству. В этом отношении, бактерий, наверное, можно рассматривать, как некий сверх-организм, эдакий «океан-Солярис», с громадным совокупным генофондом, включающим в себя гены «на все случаи жизни». Может быть, бактерии так и выживают, испокон веков отбивая атаки антибиотиков с помощью существующей (тоже испокон веков) «общей базы данных» генов устойчивости к этим антибиотикам?
Но тогда при чем здесь вообще «эволюция»?
В общем, в деле «эволюции бактерий» всё обстоит примерно так же, как и в деле «эволюции» всех остальных живых организмов (эукариот). За «доказательства эволюции» эукариот верующие дарвинисты пытаются выдать, как правило, наблюдаемые факты внутривидовой изменчивости (за исключением нескольких интересных примеров изменений, произошедших явно не по дарвиновским механизмам). А за «эволюцию бактерий» они выдают наблюдаемые факты адаптации этих бактерий к локальным особенностям и мелким колебаниям условий среды обитания.
И потом предлагают Вам поверить, что вот точно по такому же механизму постепенно появился и человек из бактерии.
Несмотря на то, что никаких фактических оснований для столь смелых обобщений – даже близко не существует.
Действительно, давайте решим простую задачку:
Исходные условия:
Известно, что за 30.000 поколений бактерии могут сломать уже имеющийся генный комплекс (см. выше).
Вопрос:
За какое число поколений может возникнуть биохимический цикл гликолиза, который включает в себя десять разных белков-ферментов (соответственно, 10 разных генов, кодирующих эти белки), где каждый из ферментов работает только на одной стадии, передавая «эстафету» на следующую стадию следующему ферменту (то есть, эти ферменты бессмысленны друг без друга). Причем первые этапы гликолиза происходят с затратами энергии. Поэтому первые стадии были бы не только бесполезны, но даже вредны, если бы не было заключительных стадий гликолиза, где происходит уже накопление энергии, с итоговым положительным балансом.
Итак, за какое время возникнет подобный комплекс, состоящий из тысяч необходимых нуклеотидов, если бактерии могут сломать один (уже имеющийся) ген за 30.000 поколений?
Правильный ответ:
Результаты экспериментов Ленски вообще не позволяют судить о возможности (или невозможности) возникновения гликолиза методом «полного перебора». Поскольку, как говорится, «ломать не строить». Но и так понятно, что методом «полного перебора» мы будем получать работающий гликолиз дольше, чем всё время существования Нашей Вселенной.
Вот на этой «оптимистической» ноте я и предлагаю закончить эту книгу.
Здесь я попробовал критически рассмотреть (и в ряде случаев переосмыслить) те фактические свидетельства, которые насобирал в свою пользу дарвинизм со времени первого опубликования этой теории Дарвиным в 1859 году. И как оказалось, этих (фактических) свидетельств, во-первых, крайний дефицит, а во-вторых, практически все они либо недостаточно строги (надежны), либо недостаточно впечатляющи (можно объяснить другими способами), либо вообще не имеют никакого отношения к дарвиновским механизмам. Мне кажется, это печальное обстоятельство верующим дарвинистам просто необходимо учитывать в проповедях своего любимого и «единственно верного» учения.
Ну а следующую книгу я посвящу, во-первых, фактам, которые опровергают дарвинизм. Некоторые из таких фактов я уже озвучил в этой книге. Но мне кажется, необходим более подробный перечень таких фактов. А во-вторых, я посвящу следующую книгу фактам, которые, на мой взгляд, очень серьезно свидетельствуют в пользу разумного дизайна живых организмов, как основной причины наблюдаемого нами разнообразия живых существ.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК