Глава пятая Атомы Редукция вещества
Глава пятая
Атомы
Редукция вещества
Я покажу те атомы, из которых природа творит все вещи…
Лукреций
Великая идея: вещество состоит из атомов
Мы видели внешние проявления изменений в образовании биосферы и внутренние механизмы этих изменений в молекулярных основаниях генетики. Мы видели то, что не изменяется, энергию, и видели, в терминах энтропии, почему изменяются вещи. Теперь мы исследуем материальную основу изменений еще более детально, совершив, таким образом, переход от мастодонтов к элементам.
Что сообщает наука о природе вещества, материала, из которого сделано все, доступное ощущениям? Мы изучим этот чрезвычайно важный вопрос в два этапа. На первом этапе, составляющем предмет настоящей главы, мы исследуем вопрос, который окажется лежащим на поверхностном уровне, хотя и не выглядит таким, и опишем появление концепции атома, этой валюты всех рассуждений в химии. Мы увидим, почему различные атомы имеют различные индивидуальности, которые мы называем их химическими свойствами. Пусть не оттолкнет вас мысль о том, что эта глава посвящена химии. Химия является мостом между постигаемым миром веществ и воображаемым миром атомов, и несмотря на зачастую ужасные воспоминания о столкновениях с этим предметом в школе, он способен глубоко очаровывать и просвещать, даже если его скорее вертят в руках (как здесь), чем разжевывают. Моя цель — ввести сюда немного химии, чтобы ваши глаза увидели мир вокруг вас, и ваше восхищение им стало глубже. Затем, в следующей главе, мы оставим поверхностный взгляд на атомы и погрузимся в самые глубины того понятия, которое мы именуем материей. Тогда мы приблизимся к пониманию того, чем материя является на самом деле, и сделаем это таким способом, который мог бы удовлетворить даже древних греков.
Греки много думали о материи и предложили так много различных гипотез о ее природе, что по крайней мере одна из них, вполне вероятно, могла оказаться правильной. Некоторые из их предположений были совершенно ложны, но демонстрировали достойный одобрения дух исследования. Так, Фалес из Милета (около 500 до н.э.), считающийся в народном воображении отцом философии, найдя высоко в горах ископаемые морские раковины, незадолго до своей кончины внезапно пришел к заключению, что все сделано из воды. Тысячу лет спустя этот взгляд нашел свое место в Коране:
Мы… сделали из воды всякую вещь живую. Неужели они не уверуют?[20]
Величие этого источника в глазах некоторых придает такому взгляду авторитетность даже сегодня. Однако греки продвигались в своих поисках понимания, считая, что одной сущности недостаточно для объяснения многообразия сущностей мира. Так, Гераклит из Эфеса (приблизительно 540-475 до н.э.), развивая идею Фалеса, заключил, что необходим агент изменений, и добавил в котел бытия огонь. Вскоре Эмпедокл из Сицилии (приблизительно 492-432 до н.э.), считая, что твердость трудно образовать только из воды, воздуха и огня, усовершенствовал эту первосмесь еще больше, добавив к ней землю, и предположив, а возможно и веря, что все может быть построено из воздуха, земли, огня и воды (рис. 5.1). Аристотель (384-322 до н.э.) был почти полностью согласен с эмпедокловой редукцией мира к четырем элементам, возражая только, что подлунный мир Земли, это театр перемен и распада, совершенно отличен от вечной небесной сферы, и что эмпедокловы элементы приложимы к первому, но недостаточны для понимания последней. Для вневременной, совершенной небесной сферы Аристотель считал обязательным пятый основной элемент, квинтэссенцию.
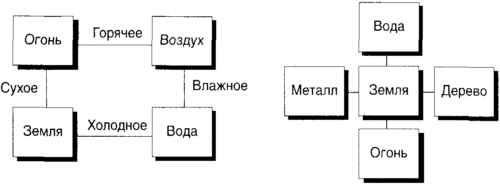
Рис. 5.1. Две самых ранних периодических таблицы элементов. Диаграмма слева показывает четыре элемента, положенные древними греками в основу материи, и свойства, сообщаемые этими элементами тем веществам, которые они образуют. Диаграмма справа дает китайскую версию, восходящую к даосскому взгляду на бытие, основанному Лао-цзы (около 600 до н.э.), в котором пять элементов возникают из взаимодействия ян (мужское, положительное, теплое, светлое) и инь (женское, отрицательное, холодное и темное).
Все это было, конечно, совершенно неверно, так как ни одна из этих сущностей не является элементарной, за исключением, возможно, гипотетической, экспериментально ненаблюдаемой и, как мы знаем, не существующей квинтэссенции на небесах. Но формулирование и разработка концепции о том, что сложное возникает из простого, были фундаментально важным понятийным шагом, и этот подход до сих пор лежит в сердцевине современной науки.
Предположение о существовании элементов, пусть даже и неправильных элементов, подняло вопрос, который находится в центре внимания настоящей главы: является ли вещество непрерывным или дискретным. Другими словами, можно ли делить элементы ad infinitum на все более малые кусочки, или они дискретны, и в этом случае деление приведет нас к далее неделимому, к атомам? У греков спекуляции процветали и обладали той свободой, которую дает лишь отсутствие экспериментальных данных, поэтому обе идеи нашли своих сторонников. То, что одна из этих идей, атомистическая точка зрения, оказалась верной, не заставляет нас непременно восхищаться ее приверженцами, поскольку они поддерживали эту версию, исходя из прихотливого умозрения и философских пристрастий, которые в наши дни не считаются особо надежными составляющими научного метода при поиске истины.
Мы можем проследить линию удачных спекуляций до Левкиппа из Милета (не ранее 450-420 до н.э.), который представлял себе материю гранулированной, состоящей из атомов, которые ставят предел делимости. Только если существует конец возможности деления, утверждал Левкипп, материя может быть вечной, ибо в противном случае все давным-давно распылилось бы в ничто. Однако его точка зрения на атомы была далека от той, которую мы теперь считаем ортодоксальной. Так, он представлял себе, что атомы имеют большой диапазон форм и размеров и что почти все различные вещества сделаны из различных атомов. Эти взгляды развил и назвал умозрительные неделимые сущности атомами ученик Левкиппа, «смеющийся философ» Демокрит из Абдеры (приблизительно 350-322 до н. э.). Демокрит придерживался точки зрения, что существуют атомы молока и атомы угля, атомы костей и атомы воды. Его воображение текло, не стесненное экспериментом, и он считал существующими атомы дыхания, звука и души. Атомы души он считал особенно красивыми, как и приличествует душе; среди атомов цвета атомы белого были гладкими и округлыми, как бы интерпретирующими сам этот цвет.
Эти мысли были частью системы верований эпикурейцев, последователей Эпикура (341-270 до н.э.), который использовал их для атак на суеверия, утверждая, что, поскольку все, включая богов, сделано из атомов, то даже боги — для Эпикура боги были обаятельно безучастными, они были существами, жившими в свое удовольствие, образцами удовлетворенности и высокомерия, не утруждавшими себя вмешательством в ничтожные человеческие дела — были субъектами законов природы. Эпикурейский взгляд на мир, прихотливое сочетание гедонизма и атомизма, рассматривал ощущения как основу знания и считал их впечатлениями души, происходящими от образов, передаваемых изящными фильмами, составленными из атомов, которые испускают ощущаемые объекты. Атомический взгляд на структуру материи и ощущения предстал перед восприимчивой и утомленной тиранами и богами римской публикой в дидактической, написанной искусными гекзаметрами, эпической поэме Тита Лукреция Кара (около 95-55) De rerum natura (О природе вещей), которую можно рассматривать как первое руководство по физической химии. Этот текст считался утраченным вплоть до пятнадцатого века, но после его нового обретения он подвигнул умы многих современников этого события опять обратиться к атомизму.
Платон и его ученик Аристотель были ярыми противниками атомизма, и их авторитетный, хотя и пагубно влияющий взгляд на мир доминировал на всем протяжении Средних веков, ни в малейшей степени не считаясь с сильным течением материализма и атеизма эпикурейского толка. Аристотель полагал, что атомизм, который он считал чистым вымыслом и поэтому — не в пример его собственным чистым вымыслам — заслуживающим лишь презрения, не способен дать объяснение богатейшему узору чувственного опыта, который характеризует реальный мир. Кроме того, он наложил анафему на пустоту, которая была бы необходима, если бы атомы должны были двигаться. Ведь в пустоте, как он думал, не может поддерживаться движение, ибо в пустоте нет тягловой силы, а движения без тягловой силы не бывает (см. главу 3).
Сила авторитета Аристотеля была такова, что его взгляды, с небольшими дополнительными вкраплениями, формировали мировосприятие людей целых два тысячелетия. Они поддерживали алхимиков в их ложно направленных и по большей части бесплодных усилиях, а его взгляды на движение душили также и физику. И так же, как в семнадцатом веке, мир пробудился и осознал пустоту аристотелевской физики из кресла, людям постепенно стало приходить в голову, что его химия из кресла тоже пуста. Однако, хотя мы можем осмеивать Аристотеля с наших позиций, лежащих далеко вниз по течению от его интеллектуального наследия и отделенных от его образа мыслей несколькими научными революциями, мы не станем переадресовывать наши похвалы эпикурейцам, несмотря на то, что, как кажется на первый взгляд, они были ближе к истине. Эпикурейцы тоже были ограничены своими креслами, и их атомизм был столь же произвольной спекуляцией, как и антиатомизм Аристотеля. Все ранние постулаты об атомах были чистыми догадками: это была спекулятивная философия, а не наука.
Науке потребовалось больше времени, чтобы прийти к пониманию природы вещества, чем к пониманию движения вещества. Сама по себе природа материи оказалась более неуловимой, чем движение материи в пространстве, поскольку, хотя можно без труда прикрепить числа к положениям в пространстве и времени и приколоть таким образом динамику к лацкану физики, далеко не ясно, как числа можно прикрепить к веществу. В самом деле, а приложимы ли числа вообще к свойствам, которые обычно называют химическими? Не суждено ли природе материи навсегда остаться лишь материей для анекдотов и спекуляций?
Ключом к проблеме оказался баланс (рис. 5.2). В руках Антуана Лорана де Лавуазье (1743-94), который широко известен как отец современной химии и «носитель духа счетоводства, поднявшийся до гениальности», химические весы превратились в скальпель, который стало возможно употребить для глубокого проникновения в тайну вещества. Тщательная и вдумчивая проработка дала возможность употребить весы для прикрепления чисел к веществу и ввести химические реакции в царство арифметики.

Рис. 5.2. Классические химические весы, не слишком отличающиеся от тех, которые Лавуазье использовал в своих исследованиях, позволивших ему привязать к веществу числа и этим превративших химию в физическую науку, и их современный двойник.
В частности, появилась возможность использовать весы для определения масс веществ, участвующих в реакции. В результате на основе этих данных начали появляться модели, а модели, как мы уже видели, являются живой кровью науки и зародышами теорий.
Модель масс для соединяющихся элементов стала желудем на ветке дуба атомической гипотезы Дальтона. Джон Дальтон (1766-1844), мрачный, не различавший цвета сын ткача-квакера, в двенадцать лет школьный учитель и педантичный наблюдатель погоды, не имел других развлечений, кроме боулинга по вечерам каждый четверг. Возможно, подсознательная память о шарах боулинга и привела его к теории, которую он впервые представил на лекции в Королевском обществе в декабре 1803 г. и опубликовал в 1807 г. Его гипотеза заключалась в том, что вещество состоит из атомов, которые не могут быть сотворенными или разрушенными, что все атомы данного элемента идентичны и что в химических реакциях атомы просто меняют партнеров. Главной его концепцией было то, что каждый атом имеет характерную массу и что химические весы являются поэтому счетчиком изменений массы, происходящих при смене атомами своих партнеров. Это был шаг, называемый философами науки трансдукцией, в котором концепция на микроскопическом уровне связана с наблюдаемым макроскопическим свойством. Большая часть современных физики и химии является результатом трансдукции, так что наблюдаемое интерпретируется в терминах воображаемого, а определенные измерения, сделанные в масштабе, соизмеримом с человеком, интерпретируется в терминах сущностей, которые в миллиарды раз меньше.
Дальтон на самом деле пошел несколько дальше, чем теперь считается удобным помнить. Он полагал, что атомы различных элементов окружены различными количествами теплорода, гипотетической (и впоследствии отвергнутой) невесомой жидкости, которую мы ощущаем как тепло (глава 3). Он предполагал, что атомы газообразных элементов имеют самую толстую оболочку из теплорода, которая позволяет им передвигаться почти свободно. Атомы твердых тел имеют самые тонкие оболочки, и это означает, что они остаются на местах. Эти приводящие в легкое замешательство умопомрачительные следствия атомической гипотезы были прочно забыты.
Используя весы, Дальтон сумел составить список масс своих атомов, по отношению к принятой за 1 массе атома водорода, легчайшего из элементов. Он назвал эти относительные массы атомов атомными весами, и этим названием все еще пользуются. Его эксперименты были грубыми, а его интерпретация этих экспериментов зависела от предположений о том, как много атомов одного элемента соединены с атомами другого, и тут его догадки часто оказывались неверными (рис. 5.3). Так, используя в качестве гида простоту, он предположил, что вода состоит из одного атома кислорода и одного атома водорода, и заключил, что атомный вес кислорода равен 7 (на самом деле, исходя из его предположения, точные измерения дали бы 8); мы знаем, что в действительности вода состоит из двух атомов водорода и одного атома кислорода, поэтому истинный атомный вес кислорода равен 16, т.е. атом кислорода в 16 раз тяжелее атома водорода. Тем не менее это самая ранняя версия трансдукции во всей ее славе, когда лабораторные наблюдения выражают свойства невидимого.

Рис. 5.3. Атомистическая гипотеза возникла у Дальтона в начале девятнадцатого столетия, и он неоднократно читал о ней лекции. Здесь изображено факсимиле части оформления лекции, прочитанной Дальтоном 19 октября 1835 г. членам Манчестерского механического общества. Неудобоваримые для типографии символы элементов были заменены орфографически более простыми, к немалой досаде Дальтона.
В отличие от древнегреческих умозрений об атомной природе вещества, теория Дальтона была научной. В ней не было никаких ленивых, или даже энергичных, умствований; это были наблюдения, основанные на эксперименте и соединенные с рациональностью. Не все, однако, приняли ее в качестве характеристики реальности. Многие годы среди ученых бытовала точка зрения, что атомы — это вычислительная фикция, полезные символы для совершения расчетов, в том числе расчета масс, но безо всякого реального смысла. Большинство возражений отпало около 1858 г., когда итальянский химик и революционер Станислао Канниццаро (1826-1910) опубликовал гораздо более точный список атомных весов известных элементов, но даже в конце девятнадцатого столетия некоторые крайние консерваторы отказывались прикрепить свое знамя к атомистическому флагштоку.
Современная техника наблюдения продрались сквозь лес возражений, которые пришлось преодолевать Дальтону и его последователям. Сегодня мы имеем возможность видеть атомы как отдельные капли материи (рис. 5.4). и больше нет никаких сомнений в их существовании. Конечно, некоторые социологи науки могут размахивать своими сверхпессимистическими флагами и утверждать, что прибор, использованный для получения этих изображений, является скорее социальной конструкцией, и спроектирован он так, чтобы выражать современную парадигму; однако ученым виднее.

Рис. 5.4. Дальтон вывел заключение о существовании атомов из регулярностей масс элементов, соединяющихся друг с другом. Сегодня мы можем «видеть» атомы, и никакого сомнения в их существовании не возникает. Прибор, с помощью которого получено изображение атомов кремния на поверхности кремниевого образца, называется сканирующим туннельным микроскопом. Он, почти буквально, чувствует проходимую им поверхность, а компьютеры преобразуют сигналы, посылаемые зондом, в изображение с разрешением атомного масштаба.
Итак, что же такое атомы? На что они похожи? Как они сделаны? Дальтон, как и греки, предположил, что атомы есть предел делимости; никакой атом нельзя разрезать на куски, никакой атом не имеет более мелких составляющих. Но если бы это было так, было бы трудно понять, как можно объяснить богатый спектр свойств элементов, поскольку разнообразие свойств проистекает из богатства соединений. То, что атомы на самом деле имеют внутреннюю структуру, впервые продемонстрировал Дж. Дж. Томсон (1856-1940), который в 1897 г. показал, что из атомов могут вылетать электроны. Он объявил о своем открытии в Королевском обществе 30 апреля 1897 г. Электроны были первыми из идентифицированных субатомных частиц, частиц, меньших, чем атом, а работа Томсона в Кавендишской лаборатории в Кембридже показала, что они являются универсальной составляющей вещества и что поэтому атомы действительно обладают внутренней структурой.
В это время (в самом конце девятнадцатого века) случилось великое замешательство относительно того, как могли быть организованы электроны. Кое-кто подозревал, что один атом может состоять из тысяч электронов. Проблема осложнялась отсутствием какой-либо информации о существовании частиц с положительным зарядом, компенсирующим отрицательный электрический заряд электронов. Эту проблему отправила на покой работа новозеландца Эрнеста Резерфорда (лорд Резерфорд Нельсон, 1871-1937), который, находясь в Манчестере, наткнулся в 1910 г. на существование ядра, мельчайшего пятнышка положительно заряженного вещества, лежащего в центре атома, которое, будучи много меньше самого атома, ответственно фактически за всю его массу.
Здесь будет уместно дать представление о размерах и массах различных объектов, которые к этому времени появились на сцене. Типичный атом имеет диаметр около 3 миллиардных метра (3?10?9 м, 3 нанометра, 3 нм). Так, миллион таких атомов, выложенный в ряд, протянется на 3 мм в длину. Теперь вы, может быть, получили возможность вообразить размер этих атомов. Легче представить себе то же тире увеличенным примерно до длины 3 километра, тогда каждый атом занял бы 3 миллиметра, как икринка рыбки «морской воробей».
Как вы, вероятно, догадываетесь, атомы являются довольно большими: им приходится быть такими, потому что в них много чего набито. Большинство людей думает, что атомы очень маленькие, но это лишь потому, что мы сами очень большие: нам приходится быть такими, потому что в нас много чего набито. Когда вы начинаете думать, что атомы большие, они становятся гораздо менее устрашающими. Было бы полезно в воображении надувать атом до тех пор, пока он не достигнет примерно метра в поперечнике.
Ядро атома тоже велико, поскольку в него тоже набито много вещей. Большинство людей думает, что оно очень, очень маленькое; но это не очень хорошие мысли, потому что такие мысли мешают уму вообразить, на что оно похоже. Некоторые ученые могли бы подумать, что такая помеха очень хорошая вещь, поскольку перенесение макроскопических идей на сущности столь малые, как атомы, не говоря уж о ядре, чревато опасностью, ибо знакомые понятия просто не приложимы к столь малым объектам (как мы с лихвой убедимся в главе 7, посвященной квантовой теории). Пусть так, но давайте по крайней мере попробуем вообразить себе диаметр ядра. Эксперименты показывают, что диаметр ядра составляет примерно одну десятитысячную диаметра атома. Поэтому, если мы подумаем об атоме, как о шаре примерно с метровым диаметром, его ядро будет пятнышком с диаметром лишь в одну десятую миллиметра. Поэтому для таких увесистых творений, как мы, ядро действительно очень мало; даже для воспринимающего существа размером с атом оно казалось бы довольно маленьким, хотя и различимым. Но для физиков-ядерщиков, которым необходимо понимать устройство ядер, оно довольно большое.
Как мы отметили, ядро является большим, потому что в него так много набито. В нем располагается положительный заряд атома, который компенсирует отрицательный заряд окружающих его электронов. Здесь также располагается почти вся масса атома, так как только около 0,1 процента его общей массы находится в электронах. Когда вы поднимаете тяжелый объект, вы в действительности поднимаете ядра. Если бы атомы вашего тела могли бы лишиться своих ядер, вы весили бы всего около 20 грамм. Другая, менее известная черта ядер состоит в том, что многие из них вращаются вокруг своей оси, хотя некоторые и не вращаются. Ядра водорода и азота вращаются, ядра углерода и кислорода нет. Вращение ядра не может быть изменено, это, подобно электрическому заряду, внутреннее свойство, и каждому ядру водорода суждено вращаться вечно с одной и той же неизменной скоростью.
В начале двадцатого века стало ясно, что электрон был не первой субатомной частицей, которая была открыта. Самая первая была известна, но не опознавалась в этом качестве, уже более века. Ядро атома водорода, простейшего из всех атомов, состоит из единственной субатомной частицы, протона. Эта частица является сущностью, ответственной за свойства кислот, и когда вы ощущаете кислый вкус лимонного сока, на самом деле ваш язык щекочут протоны. К сожалению, мы не можем здесь исследовать это явление или выяснять, почему язык является хорошим детектором по крайней мере для элементарной частицы одного типа. Протон представляет собой тяжелую частицу с положительным зарядом, равным и противоположным заряду электрона, и с массой примерно в тысячу раз большей массы электрона.
Атом водорода состоит из одного протона и присоединенного к нему электрона: положительный заряд ядра компенсируется отрицательным зарядом электрона. Следующий простейший элемент, гелий, имеет ядро, построенное из двух протонов, поэтому у него два присоединенных электрона. Число протонов в ядре атома называется атомным номером элемента, так что атомный номер водорода равен 1, атомный номер гелия равен 2, и так далее. Из того факта, что атом электрически нейтрален, а такими являются все атомы, следует, что число присутствующих в нем электронов равно атомному числу, поскольку полный положительный заряд ядра компенсируется полным отрицательным зарядом присоединенных электронов.
Осознание того, что ядру элемента можно приписать номер и что этот номер можно интерпретировать в терминах состава ядра, означает, что можно наконец провести перекличку элементов. Теперь пропущенный элемент, можно идентифицировать, узнав, был ли обнаружен элемент именно с таким атомным номером, а размышления о том, существует ли какой-нибудь элемент между двумя другими, можно прекратить, если их атомные номера являются соседними. Атомные номера стало возможно определять благодаря технике, разработанной Генри Моусли (1887-1915) незадолго до его призыва на военную службу для того лишь, чтобы под Галлиполи его настигла пуля снайпера. Как написал Уилфред Оуэн перед встречей со своей собственной пулей однажды вечером на исходе той же войны:
Отвага была моей, и с ней тайна,
Мудрость моею была, и с нею власть.
Это и была власть, основанная на мудрости, сорвавшая покров тайны, и теперь мы знаем весь список элементов, знаем о ядре и числе электронов, присутствующих в каждом атоме.
Точное расположение электронов вокруг ядра все еще оставалось проблемой. На этом этапе обсуждения важно понять то, что атом представляет собой почти полностью пустое пространство. Вся его масса, как мы видели, сосредоточена в мельчайшем центральном ядре, а окружающее ядро пространство, вплоть до расстояния, составляющего примерно 10 тысяч диаметров ядра, занято горстью электронов — например, шестью, в случае углерода. Ваше тело представляет собой это почти пустое пространство, хотя, так или иначе, вы кажетесь материальным. Вы являетесь пустотой в реальном, а не ироническом смысле, думаете почти пустыми мозгами, одеваетесь в пустоту, сидите на пустоте и поддерживаетесь ею. Чтобы вообразить пустоту атома, представьте, что вы стоите на ядре размером с Землю, глядя в ясное звездное ночное небо. Пустота пространства, которое вы видите вокруг себя, не будет отличаться от пустоты атома внутри вас.
Однако эта пустота вне ядра является средоточием индивидуальности элемента. В то время как ядро является пассивным наблюдателем, просто отвечающим за размещение вокруг себя дополняющих его электронов центром контроля, дымок электронов, занимающих почти пустое пространство, является участником химических реакций.
Ученые не смогли устоять перед искушением высказать предположение, что электроны по отношению к ядру подобны планетам по отношению к звезде или Луне по отношению к Земле, и этот образ все еще столь могуществен, что было бы лучше, если бы я не упоминал о нем. «Сатурнианская» планетарная модель атома была предложена японским физиком Хантаро Нагаока (1865-1950) в 1904 г. и стала естественно предполагаемой моделью после того, как несколько лет спустя Резерфорд открыл ядро. Планетарную модель, которую теперь представляли в виде планет, вращающихся вокруг звезды, а не в виде колец вокруг Сатурна, как предлагал Нагаока, призвали к жизни в 1912 г., когда Нильс Бор использовал раннюю версию квантовой теории для описания движения одиночного электрона в атоме водорода и для своего успешного расчета спектра излучения атома. Можно лишь позавидовать, представляя себе всю глубину восторга Бора, когда он обнаружил, что его расчеты почти точно согласуются с наблюдениями.
Но даже это — планетарная модель и, как казалось, подтверждающий ее талантливый расчет Бора — было неверно. Отсюда можно извлечь два урока для науки и жизни. Во-первых, мы не можем полагаться на перенесение, без основательной оглядки, знакомых закономерностей макромира в доселе неизвестный нам микромир. Под поверхностью реальности живут драконы. Во-вторых, даже количественное согласие может, при некоторых обстоятельствах, быть недостоверным свидетельством истины. Этими некоторыми обстоятельствами, сделавшими свидетельство недостоверным, в данном примере была «красота» — термин, со смыслом которого мы встретимся в следующей главе, а пока это лишь забавная и загадочная — характеристика электрического притяжения электрона к ядру.
Вы должны выбросить из вашего сознания, а еще лучше из вашего бессознательного, образ планет, вращающихся вокруг центрального ядра: он просто неверен. Это ложная модель атома, это научная фикция, мертвая, отброшенная модель. Чтобы увидеть ее ошибочность, надо понять, что электроны не являются частицами в привычном смысле, но имеют внутренние свойства, подобные волновым. Этот двойственный характер, лежащий в сердце квантовой теории и появляющийся на сцене в главе 7, устраняет понятие траектории, в данном случае орбитального пути планетарного электрона вокруг центрального звездоподобного ядра, и делает абсолютно неприемлемым образ электрона в виде частицы на орбите.
В главе 7 мы увидим, как Эрвин Шредингер (1887-1961) создал уравнение, решения которого рассказывают нам о поведении электронов. Все, что нам необходимо знать на этом этапе, это несколько следствий из него, касающихся атомов. То, что на сегодняшний день считается достаточно точной структурой атома водорода — к другим атомам мы придем позднее, — было одним из первых результатов использования уравнения Шредингера. В серии из четырех знаменитых работ (первая в трех частях), опубликованной в 1926 г., написанной во время каникул с любовницей и названной им «поздним эротическим взрывом», Шредингер решил свое уравнение для электрона в атоме водорода и получил из совершенно других предпосылок то же выражение для его энергии, которое до этого обнаружил Бор.
Чтобы понять результат вычислений Шредингера, мы должны знать, что решения его уравнения предсказывают вероятность того, что электрон будет обнаружен в некоторой точке пространства, а не точное положение электрона в любой момент, как в классической физике. Эти решения называются атомными орбиталями. В таком названии выражен намек на планетарный электрон на орбите, но без строгого смысла этой классической концепции, здесь неприменимой.
Рисунок 5.5 показывает форму обладающей самой низкой энергией атомной орбитали в атоме водорода, орбитали электрона в нормальном (основном) состоянии атома. Иллюстрация изображает вероятность обнаружения электрона в разных участках области с помощью плотности тени в них. Как можно видеть, благодаря тому, что облако является более плотным вблизи ядра, следует считать, что электрон «роится» вокруг и вблизи ядра, как осы вокруг вазы с вареньем, и с наибольшей вероятностью находится у самого ядра. Если бы вы мысленно помещали маленький полый шар в разных местах атома, вы обнаруживали бы электрон внутри шара чаще, когда шар располагается у ядра. Облако вероятности сферически симметрично (предпочтительные направления отсутствуют), поэтому мы можем также представить орбиталь сферической поверхностью, которая охватывает большую часть облака. Однако не следует думать, что орбиталь имеет резкий край: как показывает изображение на рисунке, вероятность обнаружить электрон в определенной точке постепенно стремится к нулю и — по крайней мере в принципе — достигает нуля лишь на бесконечном удалении от атома.
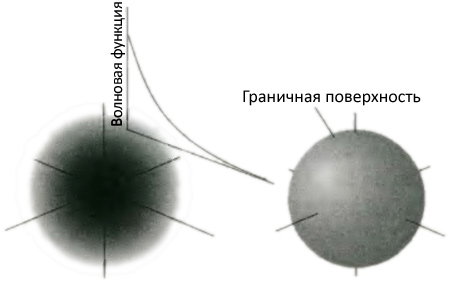
Рис. 5.5. Здесь изображены некоторые представления s-орбитали самого низкого энергетического уровня для атома водорода. Диаграмма слева показывает вероятность обнаружения электрона в каждой точке в виде плотности тени. Сопровождающий ее график показывает, как вероятность экспоненциально убывает с увеличением расстояние до ядра. Диаграмма справа показывает «граничную поверхность», представляющую собой поверхность, охватывающую 90 процентов вероятности обнаружения электрона.
С этой точки зрения все атомы бесконечно велики, что находится в резком противоречии со взглядом на атомы, как на очень маленькие. Практически, конечно, вероятность нахождения электрона далеко от ядра (больше, чем на расстоянии в несколько сот триллионных метра) пренебрежимо мала. Лучше представлять себе атом водорода с электроном, находящимся в ограниченной области пространства очень близкой к ядру (в области с радиусом около 100 триллионных метров, 100 пикометров, 100 пм). Эта сферическая орбиталь с низшим уровнем энергии называется s-орбиталью. Было бы приятно думать, и в любом случае это полезное мнемоническое правило, что s означает сферичность; но на самом деле это название создано по техническим причинам, связанным с шириной линий в спектре атома водорода.
Одна из особенностей, которая станет яснее, когда мы больше узнаем о квантовой теории, но о которой нам необходимо знать уже на этой стадии, состоит в том, что из факта сферической симметричности орбитали, изображенной на иллюстрации, следует, что электрон, который она описывает, имеет нулевой момент импульса, момент количества движения вокруг ядра. Мы встретили момент импульса в главе 3, где видели, что он подобен импульсу, но связан с движением по кругу, а не по прямой линии. Все, о чем нам надо знать на этом этапе, это о волновом свойстве орбитали, заключающемся в том, что о моменте импульса можно судить по тому, как быстро меняется плотность тени, когда мы путешествуем вокруг ядра. Этот факт может показаться лишь незначительной технической деталью, однако вскоре мы убедимся, что он составляет основу великолепия мира.
Когда Шредингер решил свое уравнение для атома водорода, он обнаружил, что существует много других атомных орбиталей, каждая из которых соответствует более высокой энергии, чем энергия основного состояния. В качестве аналогии можно привести колебания сферы с обертонами собственной частоты, соответствующими состояниям с более высокой энергией. Электрон может подняться на эти орбиты, если сообщить ему достаточную энергию, например, с помощью вспышки молнии электрического разряда или если он поглотит энергию биения фотонов, которые мы называем вспышкой света.
У этих орбиталей с более высокой энергией есть несколько характеристик, о которых нам следует знать. Во-первых, имеется целая серия s-орбиталей, каждая из которых является сферической, но с различными расстояниями от ядра: они образуют серию концентрических оболочек, подобную русской матрешке, с ядром в центре. Ни в одной из этих s-орбиталей электрон не имеет момента импульса, поэтому его можно обнаружить у самого ядра. И снова, не дайте одурачить себя, думая, что все это лишь педантичные академические детали: на таких деталях выстроены города и огромные индустрии.
Существуют также решения, не обладающие сферической симметрией, в которых облака электронной вероятности сконцентрированы в областях, находящихся в разных местах по отношению к ядру, а не распределены однородно вокруг него. Нам необходимо знать о трех типах орбиталей, показанных на рис. 5.6. Орбитали, в которых вероятность собрана в две области, называются p-орбиталями, орбитали с четырьмя областями называются d-орбиталями, а орбитали с шестью областями называются f-орбиталями. Благодаря тому, что плотность тени, изображающая вероятность нахождения электрона в данном месте, меняется, когда мы, по пути измеряя ее, движемся по кругу вокруг ядра, p-, d- и f-орбитали соответствуют состоянию с ненулевым моментом импульса электрона, который они описывают, причем d-орбитали соответствуют более высокому моменту импульса, чем p-орбитали, а еще более искривленные f-орбитали соответствуют еще более высокому моменту импульса. Момент импульса является источником центробежной силы, которая отбрасывает электрон от ядра. Есть еще один незначительный технический момент, который скоро приобретет огромное значение: в результате такого центробежного эффекта в любой из этих орбиталей никогда нельзя обнаружить электрон возле самого ядра.
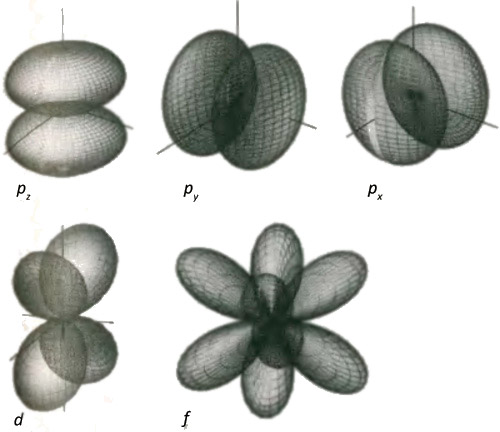
Рис. 5.6. Двудольное распределение плотности вероятности нахождения электрона (изображенное в виде граничной поверхности) является характерным для p-орбитали, четырехдольное распределение характерно для d-орбитали, а шестидольное для f-орбитали. Поскольку орбитали последовательно становятся все более искривленными (то есть соответствуют волнам обращения вокруг сферы с более короткой длиной), соответствующий им момент импульса электрона возрастает. Ни в одной из этих орбиталей не существует вероятности нахождения электрона непосредственно у самого ядра: он все больше отбрасывается от ядра по мере возрастания момента импульса.
Нам необходимо узнать еще два свойства решений, которые Шредингер получил для своего уравнения. (Я прошу прощения за эту прелюдию, но вскоре она покажется весьма уместной.) Во-первых, посмотрим на энергетическую схему, изображенную на рис. 5.7. Мы видим, что с возрастанием энергии все большие группы орбиталей становятся допустимыми, потому что чем выше частоты и чем более искривлены пути возможных колебаний сферы, тем серьезнее может искажаться ее форма. При самой низкой энергии допустима только одна орбиталь, s-орбиталь на рис. 5.5. На следующем уровне допустимы одна s-орбиталь и три p-орбитали. На следующем, еще более высоком, уровне имеются одна s-орбиталь, три p-орбитали, 5 d-орбиталей и так далее. В этой схеме нет ничего магического, это просто схема решений уравнения Шредингера для атома водорода. Группы энергетических уровней называются электронными оболочками, потому что орбитали, принадлежащие к ним, образуют концентрические распределения вероятностей расположения электрона, более или менее подобные слоям в луковице. И последняя (да!) важная вещь это то, что орбитали водорода в каждой оболочке имеют в точности одну и ту же энергию. Это очень замечательное свойство и, как можно проследить, именно «красивый» характер взаимодействия между электроном и ядром привел к тому, что концептуально ошибочные вычисления Бора оказались количественно верными.
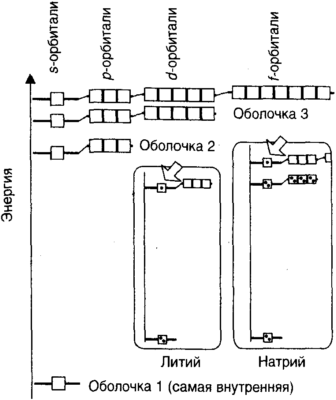
Рис. 5.7. Энергетические уровни типичных атомов. Для водорода, имеющего один электрон, все орбитали данного уровня имеют в точности одну и ту же энергию. Для отличных от водорода атомов (как изображено здесь) каждый уровень содержит орбитали с последовательно возрастающей энергией. Во всех случаях p-орбитали впервые появляются во второй оболочке, d-орбитали появляются в третьей оболочке, а f-орбитали в четвертой оболочке. Существуют оболочки более высоких энергий, чем показанные здесь. Каждый ящик представляет орбиталь, которую могут занимать не более двух электронов. Две вставки показывают аналогичные электронные структуры лития (с одним электроном вне сердцевины) и натрия (с одним электроном вне сердцевины).
Теперь я проведу вас от атома водорода сквозь строй атомов других элементов. Нам известен порядок, в котором следует обсуждать эти элементы, поскольку мы знаем их атомные номера и, следовательно, число электронов, которые должны присутствовать в каждом случае. Например, если атомный номер элемента равен 15 (это номер фосфора), то его ядро имеет пятнадцать единиц положительного заряда, и, для достижения электрической нейтральности, каждый атом должен иметь пятнадцать электронов. Основная идея заключается в том, что, с небольшими видоизменениями, которые мы скоро узнаем, электроны этих атомов будут описываться орбиталями и энергиями, подобными тем, которые Шредингер нашел для водорода. Но по ходу этого конструирования атомов мы обнаружим некоторые замечательные вещи.
Элементом с атомным номером 2 является гелий; он имеет двойной заряд ядра и два электрона. Состояние с наименьшей энергией для обоих электронов описывается такой же s-орбиталью, как и основное состояние атома водорода. Поскольку заряд ядра здесь больше, чем у водорода, эти два электрона будут притягиваться ближе к ядру; но, так как электроны отталкиваются друг от друга (частицы с одинаковым зарядом отталкиваются друг от друга), этому всасыванию будет оказываться некоторое сопротивление. В результате атом будет несколько более компактным, чем атом водорода, но не намного меньшим.
Следующим по порядку элементом, с атомным номером 3, является литий. Ядро лития имеет тройной заряд и окружено тремя электронами. Теперь возникает удивительная вещь. Эти три электрона не могут — просто не могут — занимать самую нижнюю энергетическую s-орбиталь. Есть свойство, которое мы до сих пор совершенно пропускали в нашем обсуждении, а теперь должны ввести: электрон имеет три постоянные внутренние характеристики: массу, заряд и спин. Как мы видели ранее, многие ядра вращаются, и точно так же каждый электрон во Вселенной обладает этим свойством. Для наших целей достаточно, чтобы мы представляли спин просто как классическое вращательное движение, подобное вращению планеты вокруг оси. Однако следует иметь в виду, что в данном контексте спин является чисто квантово-механическим свойством, и на самом деле его нельзя считать классическим. Например, электрон надо дважды перевернуть, чтобы он вернулся в исходное состояние! Второе квантовое свойство спина — более соответствующее стилю предыдущего обсуждения — заключается в том, что электрон (снова используя классический язык) имеет фиксированную скорость вращения, но может вращаться с этой скоростью либо по часовой стрелке, либо против часовой стрелки. Никаких промежуточных скоростей или ориентации вращения не допускается.
Третье квантовое свойство спина — и у него нету никакой классической интерпретации — это принцип запрета, предложенный в 1924 г. австрийским физиком Вольфгангом Паули (1900-58) и утверждающий следующее:
На одной орбитали может присутствовать не более, чем два электрона, и если два электрона имеют одну и ту же орбиталь, их спины должны быть парными.
Термин «парные» означает, что если один электрон вращается по часовой стрелке, то другой вращается против часовой стрелки. Этот принцип является ключевым для понимания химии. Он также является ключевым для понимания того, что объекты являются твердыми, несмотря на то, что состоят в основном из пустоты, потому что электроны одного атома не могут находиться в области, занятой электронами другого атома. Таким образом, несмотря на то, что электроны занимают ничтожную часть области, которую мы называем «атом», другие атомы не могут проникнуть в эту область. Так, объем нашего тела и наша способность отличаться от любого другого из окружающих нас предметов обусловлена в конечном счете электронным спином. Выключите спины электронов, и все вещество — все обитатели мира, все горы, океаны и леса, все существующее — коллапсирует в однородную каплю бесформенной слизи. Спин является источниками нашей индивидуальности.
Теперь мы можем завершить историю с литием. Представим себе последовательное добавление трех электронов и распределение их по орбиталям так, чтобы получить наименьший общий уровень энергии, принимая во внимание принцип запрета. Первые два электрона занимают первую s-орбиталь. Эта орбиталь теперь содержит два электрона, поэтому она полна. Поэтому третий электрон вынужден занять одну из s- или p-орбиталей следующей оболочки. Но какую орбиталь он займет, если все четыре орбитали имеют одну и ту же энергию?
То, что они имеют одну и ту же энергию, не верно. Мы утверждали это для водорода, как следствие до некоего загадочного «красивого» свойства электрического взаимодействия между ядром и электроном. Когда в атоме присутствует более чем один электрон, эта «красота» (под которой мы имеем в виду весьма специальный вид симметрии) теряется, и s- и p-орбитали больше не обладают одинаковой энергией. Причины этих различий можно усмотреть в том факте, что электрон на s-орбитали может находиться непосредственно у ядра, а электрон на p-орбитали там обнаружить нельзя.
Коротко говоря, электрон на второй s-орбитали может проникать в область, занятую двумя электронами первой s-орбитали, и испытывать полную силу притяжения тройного заряда ядра лития. Из-за центробежного влияния момента импульса, электрон на p-орбитали не может проникнуть так же близко к ядру и поэтому не испытывает его полной силы притяжения. В результате он будет иметь более высокую энергию (как показано на рис. 5.7).
Имея в виду эту разницу энергий, теперь можно сделать вывод, что атом лития содержит два электрона на s-орбитали в первой оболочке, окруженной электроном, занимающим s-орбиталь следующего энергетического уровня. Мы можем представлять себе, что эти электроны образуют две физических концентрических оболочки, причем одна прилегает к ядру в форме сферической сердцевины, а другая, окружающая ее, подобна мякоти плода вокруг косточки (рис. 5.8).
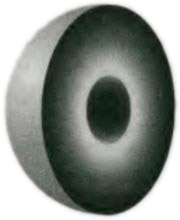
Рис. 5.8. Представление структуры атома лития. Два электрона в компактной сердцевине и один электрон во внешней оболочке.
Следующим элементом (с атомным номером 4) является бериллий с четырьмя электронами вокруг ядра. Здесь на один электрон больше, чем в литии, и этот электрон можно присоединить к последнему внешнему электрону на второй s-орбитали. Далее идет пятый элемент, бор, с атомным номером 5 и пятью электронами. Вторая s-орбиталь заполнена, поэтому пятый электрон должен попасть на одну из трех p-орбиталей. Та же ситуация сохраняется для следующих пяти элементов, поскольку имеются три p-орбитали, и на этих орбиталях можно расположить шесть электронов. Так, углерод (шесть электронов) имеет внутреннюю сердцевину из двух электронов, как у гелия, еще два электрона на окружающей ее s-орбитали и еще два электрона на p-орбиталях. Оказывается, что последним двум электронам энергетически выгоднее занимать разные p-орбитали оболочки, так как тогда они дальше располагаются и меньше отталкиваются друг от друга. Азот (семь электронов) имеет еще один электрон на p-орбитали, кислород (восемь электронов), фтор (девять электронов) и неон (десять электронов) строятся тем же способом.
На этом этапе все десять p-орбиталей оболочки заполнены, и следующий электрон (в натрии, атомный номер 11) должен занять следующую, более высокую атомную орбиталь, которая является следующей s-орбиталью. Структура атома натрия подобна структуре атома лития с заполненной внутренней сердцевиной и одиночным s-электроном, образующим концентрическую внешнюю оболочку.
Это чрезвычайный момент в нашем обсуждении, хотя я и оставил проблеск, осветивший местность, почти незамеченным. Мы видели, что структура атома гелия состоит из заполненной оболочки; нам также следует знать, что гелий является инертным одноатомным газом (то есть газом, состоящим из одиночных атомов в свободном движении). Далее мы пришли к восьмому элементу, неону, еще одному инертному одноатомному газу, каждый атом которого имеет заполненную оболочку электронов. Непосредственно вслед за неоном мы уловили вспышку, идущую от лития, легко вступающего в реакции металла; его атомная структура состоит из одного электрона вне заполненной сердцевины. И теперь на сцене появляется восьмой, считая от лития, элемент, натрий, еще один металл, легко вступающий в реакции. Структура атома натрия совершенно подобна структуре атома лития, с одиночным электроном вне заполненной оболочки. Мы пролили немного света на периодичность элементов, на осознание того, что вещество является не случайным набором разрозненных элементов, а семейством, содержащим члены с подобными химическими свойствами и подобными электронными структурами.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава пятая. Плоский трехмерный мир
Глава пятая. Плоский трехмерный мир Художник Писал свою дочь, Но она, Как лунная ночь, Уплыла с полотна... Леонид Мартынов Обезьяны любят рисовать. Обычно они чертят красками на бумаге бессмысленные полосы и закорючки. Однако в один прекрасный день молодая шимпанзе Мойя
ГЛАВА ПЯТАЯ. ГЕНЕТИКА И СЕЛЕКЦИЯ,
ГЛАВА ПЯТАЯ. ГЕНЕТИКА И СЕЛЕКЦИЯ, в которой с высот теоретических придется нам перебраться на высоты практические. Тут автор заранее просит у читателя извинения: не сможет он вместе с ним совершить траверс хребта, именуемого селекцией; он поведет читателя лишь на
Глава пятая Жизнь человекообезьян в сообществах
Глава пятая Жизнь человекообезьян в сообществах Тот, у кого в роду нет ни глупцов, ни плутов, ни попрошаек, был зачат ударом молнии. Томас Фуллер (1608–1661) В Гомбе-Стрим, в Танзании, самец-шимпанзе играет с маленьким братом. Во время игры малыш легко стоит на двух ногах, что
Глава пятая Размножение животных
Глава пятая Размножение животных - Всякое живое существо, после некоторого времени своего существования, умирает, и тело его разрушается.[65] Не прекращается органическая жизнь на земле только потому, что одновременно с этим беспрестанно появляются на свете новые
Глава пятая: Неодинозавры!
Глава пятая: Неодинозавры! Несси и плезиозавры Несси видели сотни людей: подростков и старцев, фермеров и бизнесменов, приезжих туристов и старожилов окрестностей Лох-Несс. Описания чудовища, данные очевидцами, в деталях расходятся. Однако в них есть много общего. Шеф
ГЛАВА ПЯТАЯ ЧУДО ПРИРОДЫ — КЕНГУРУ
ГЛАВА ПЯТАЯ ЧУДО ПРИРОДЫ — КЕНГУРУ Животное, которое «пудрится». — Путешествует в виде слепого эмбриона. — Пьёт морскую воду. — Топит собак. — Жуёт жвачку. — Роет колодцы. — Совершает тринадцатиметровые прыжки. — А изнего делают ботинки… Широко распространено
Глава пятая За муравьедом
Глава пятая За муравьедом Поймать гигантского муравьеда было одной из главных причин, почему мы отправились на Рупунуни: мы слышали, что ловить муравьедов в саванне куда проще, чем в гвианских лесах.Прилетев в Каранамбо, мы три дня только и говорили, что о муравьедах, и
Глава пятая. ПОЛНО ДЕРЕВО МЕДВЕДЕЙ
Глава пятая. ПОЛНО ДЕРЕВО МЕДВЕДЕЙ «Он телом нескладен, он скуден умом…» (Так часто говаривал Сторож.) «Охота Ворчуна» Температура в кабине лендровера достигла тридцати с лишним градусов, и мы изнемогали от пыли, жары и усталости. Позади был долгий путь: выехав из
Глава пятая Самоутверждение
Глава пятая Самоутверждение Если мы хотим понять природу нашей агрессивности, то должны рассматривать ее с точки зрения нашего животного происхождения. Как вид, мы в настоящее время так озабочены расширением массового производства вооружений, что склонны утрачивать
Глава пятая
Глава пятая На первых порах наш дворовый зверинец привлек благожелательное внимание соседей, они прилежно справлялись о благополучии и здоровье наших «друзей», а мы из кожи вон лезли, следя за чистотой и порядком в нашем хозяйстве и истребляя мух. Наиболее выносливые
Глава пятая На подступах к желудку
Глава пятая На подступах к желудку Кислые отношения Уильяма Бомонта и Алексиса Сент-МартинаТри известные гравюры изображают Алексиса Сент-Мартина в юности. Я видела их не раз: в биографиях его хирурга Уильяма Бомонта, в книгах, написанных самим Бомонтом, и в журнальных