31. Генетика и здоровье человека
31. Генетика и здоровье человека
Вспомните!
Что такое мутагены?
Какие наследственные заболевания вам известны?
Генетика и медицина. Современная генетика человека, основываясь на законах классической генетики, изучает явления наследственности и изменчивости на всех уровнях организации: молекулярном, клеточном, организменном и популяционном. В последнее время выявлено, что у большинства людей в течение жизни проявляются те или иные наследственные заболевания, связанные с нарушением структуры наследственного материала. Изучение молекулярной природы подобных изменений, анализ закономерностей их наследования и распространения в популяциях человека, выяснение влияния мутагенных факторов на здоровье – эти важнейшие задачи генетика человека решает в тесном сотрудничестве с медициной. Проблема здоровья людей и генетика тесно взаимосвязаны. Ежегодно в нашей стране рождается около 200 тыс. детей с наследственными заболеваниями, что сравнимо с численностью жителей областного центра. Причём количество видов этих заболеваний с каждым годом увеличивается. В 1986 г. было известно около 2 тыс. наследственных патологических состояний, а спустя несколько лет, в 1992 г., их число возросло уже до 5 тыс. Причина этого роста двояка. С одной стороны, совершенствование методов молекулярно-генетической диагностики позволяет выявлять наследственную причину заболеваний, ранее не относимых к этой категории. С другой стороны, бурное развитие науки и техники приводит к интенсивному накоплению в окружающей среде разнообразных мутагенов, способных наносить вред здоровью не только современного человека, но и будущих поколений людей.
Влияние мутагенов на организм человека. Воздействие на живой организм различных мутагенных факторов приводит к возникновению мутаций, которые оказывают, как правило, неблагоприятное влияние на жизнедеятельность как отдельных клеток, так и всего организма в целом.
Мутации, которые возникают в соматических клетках тела, вызывают преждевременное старение, сокращают продолжительность жизни, а также, в зависимости от места возникновения, влияют на определённые жизненно важные функции организма. Соматические мутации представляют очень серьёзную угрозу здоровью населения, так как это первый шаг к образованию злокачественных опухолей. Подавляющее число всех случаев заболевания раком молочной железы – результат соматических мутаций.
Под влиянием мутагенов количество изменений наследственного материала резко увеличивается. После аварии на Чернобыльской АЭС (1986 г.) в результате радиационного воздействия частота заболеваний раком щитовидной железы в Гомельской области возросла в 20 раз. Избыточное ультрафиолетовое излучение повышает риск возникновения рака кожи.
Сочетание нескольких мутагенных факторов значительно усиливает негативный эффект их воздействия на организм. Известно, что при радиационном облучении риск заболеть раком гораздо выше у курящих людей.
В дыму содержится более 4 тыс. химических соединений, из которых около 40 относятся к канцерогенам, а 10 активно способствуют развитию раковых заболеваний. Компоненты табачного дыма разделяются на твёрдые и газообразные. К первым относят никотин – компонент, вызывающий физическое привыкание, смолу (табачный дёготь), свинец, мышьяк, ртуть, цезий, золото и другие элементы таблицы Менделеева.
С твёрдыми компонентами более-менее успешно справляются сигаретные фильтры, а вот от угарного и углекислого газа, аммония, цианистого водорода и других вредных веществ в газообразном состоянии фильтры не спасают.
Генеративные мутации, т. е. нарушения структуры ДНК в половых клетках, могут приводить к спонтанным абортам (выкидышам), мертворождению и к увеличению частоты наследственных заболеваний. Причём, если эти мутации не вызывают гибели организма и не ведут к серьёзным нарушениям репродуктивной функции, они будут передаваться из поколения в поколение, постепенно увеличивая частоту встречаемости в популяции.
После Чернобыльской катастрофы в районах, подвергшихся максимальному загрязнению радионуклидами, почти в 2 раза увеличилась частота рождения детей с аномалиями развития (расщелины губы и нёба, удвоение почек и мочеточников, полидактилия, нарушения развития головного мозга и др.).

Рис. 97. Мутация, вызывающая отсутствие пигментации, – альбинизм – встречается у многих видов живых организмов: А – аксолотль; Б – мышь
Наследственные болезни человека. Причиной наследственных заболеваний человека могут быть генные, хромосомные и геномные мутации.
Генные болезни. Эти болезни возникают в результате мутации в одном гене, что приводит к изменению структуры или количества белка. Как правило, эти заболевания ведут к нарушению обмена веществ. В зависимости от расположения мутантного гена выделяют болезни аутосомного и сцепленного с полом наследования.
Рассмотрим несколько наиболее часто встречающихся аутосомных болезней. Фенилкетонурия – рецессивное заболевание, которое возникает в результате мутации гена, расположенного в 12-й хромосоме, и приводит к накоплению в организме человека избытка аминокислоты – фенилаланина. При отсутствии строгой диеты, исключающей продукты, содержащие фенилаланин, у ребёнка может развиться умственная отсталость. К рецессивным болезням относится альбинизм – врождённое отсутствие пигментации кожи, волос и радужки глаз (рис. 97). Рецессивная мутация, приводящая к изменению структуры молекулы гемоглобина, вызывает серповидноклеточную анемию. В крови таких больных обнаруживаются эритроциты серповидной формы, не способные нормально переносить кислород (рис. 98). Если мутантный ген является доминантным и подавляет «нормальный» аллельный ген, то говорят об аутосомно-доминантном заболевании. Примером такой болезни является синдром Марфана (см. § 28).
Примером заболеваний, которые наследуются сцепленно с полом, может служить одна из форм гемофилии – нарушение свёртываемости крови (см. § 29).
Хромосомные болезни. К хромосомным относят болезни, обусловленные геномными мутациями или структурными изменениями отдельных хромосом. В настоящее время у человека известно более 700 подобных заболеваний.
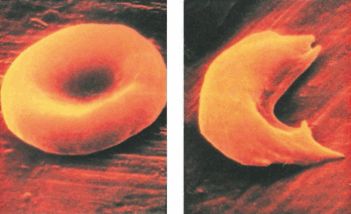
Рис. 98. Эритроциты человека: А – нормальные; Б – при серповидно-клеточной анемии
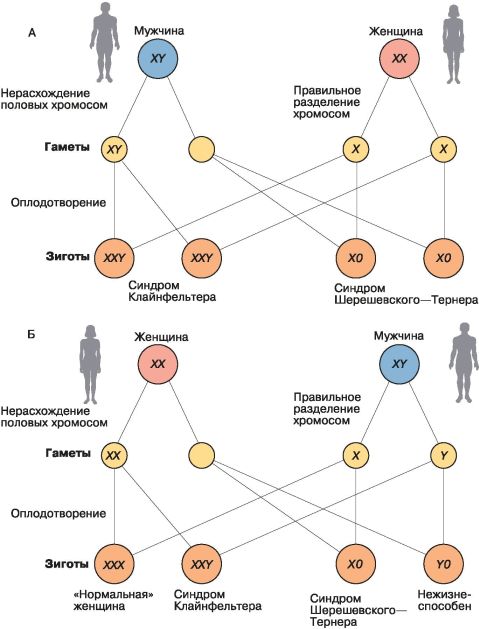
Рис. 99. Синдром Клайнфельтера и синдром Шерешевского-Тернера как результат нерасхождения отцовских половых хромосом (А) и нерасхождения материнских половых хромосом (Б)
Изменения числа хромосом, как правило, возникают в результате нерасхождения гомологичных хромосом в процессе образования половых клеток одного из родителей и вызывают серьёзные нарушения развития (рис. 99). Самой распространённой патологией такого рода является болезнь (синдром) Дауна (§ 30). Лишняя 13-я хромосома приводит к развитию синдрома Патау, который характеризуется столь тяжёлыми отклонениями в развитии, что 95 % больных детей умирает в первый год жизни. Дополнительная Х-хромосома у мужчин (XXY) вызывает развитие синдрома Клайнфельтера, который выражается в бесплодии, женском типе скелета (широкий таз, узкие плечи), нарушении умственного развития. Отсутствие одной Х-хромосомы у женщин (Х0) приводит к развитию синдрома Шерешевского – Тернера. Женщины, имеющие такой хромосомный набор, бесплодны, имеют широкую грудную клетку, короткую шею и рост в среднем не более 150 см. Интересно, что женщины с лишней Х-хромосомой (XXХ) не имеют практически никаких физических отличий от здоровых женщин, однако у них чаще наблюдаются отклонения в поведении и трудности в обучении.
Самой известной хромосомной мутацией у человека является утрата фрагмента 5-й хромосомы, которая приводит к развитию синдрома «кошачьего крика». Признаком его служит необычный плач, напоминающий мяуканье кошки, что связано с нарушением строения гортани и голосовых связок. Кроме того, у таких детей наблюдается умственное и физическое недоразвитие.
Профилактика наследственных заболеваний. В настоящее время профилактика, диагностика и лечение наследственных заболеваний приобретают очень большое значение. Наиболее эффективным методом профилактики является здоровый образ жизни будущих родителей.
Значительно снизить вероятность возникновения наследственных заболеваний позволяет медико-генетическое консультирование. Главная задача такого консультирования заключается в прогнозировании появления детей с той или иной наследственной аномалией. Поводом для консультирования могут стать близкородственные браки, работа супругов на вредном предприятии или наличие родственников, имеющих наследственные заболевания. При наличии в семье наследственных заболеваний врач-консультант составляет подробную родословную, на основании которой часто можно определить тип наследования данного заболевания и рассчитать вероятность рождения больного ребёнка.
Если в консультацию обращается супружеская пара, у которой уже родился ребёнок с наследственной патологией, работа начинается с постановки точного диагноза, после чего определяют величину риска рождения второго больного ребёнка. Современные методы позволяют исследовать генотипы родителей с целью обнаружения конкретной мутации.
Эффективность консультирования значительно возрастает благодаря использованию современных методов дородовой (пренатальной) диагностики. Ультразвуковое обследование плода, взятие крови из пуповины и анализ околоплодной жидкости, в которой всегда есть клетки эмбриона и продукты его метаболизма, позволяют на ранних этапах беременности обнаружить наследственные заболевания (рис. 100). Если диагностируется болезнь, способы лечения которой на сегодняшний день не разработаны, родители могут принять решение о прерывании беременности.
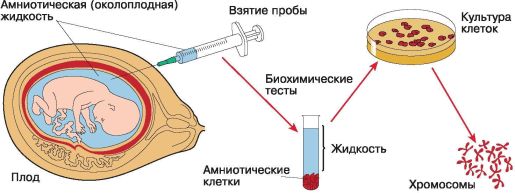
Рис. 100. Схема анализа околоплодной жидкости
В настоящее время риск рождения детей с наследственными заболеваниями может быть значительно снижен с помощью генетического консультирования и пренатальной диагностики. Применение лекарственных препаратов, корректирующих нарушенную функцию, или соблюдение определённой диеты, как в случае фенилкетонурии, позволяют компенсировать проявление многих мутаций. Последние достижения генной терапии по введению в клетки больного нормальной копии повреждённого гена позволяют надеяться, что проблема лечения многих наследственных заболеваний в будущем будет решена.
Вопросы для повторения и задания
1. Как влияют соматические мутации на здоровье людей?
2. Каковы последствия возникновения генеративных мутаций?
3. Назовите известные вам наследственные заболевания человека. Каковы их причины?
4. Какова главная задача медико-генетического консультирования? Есть ли в вашем населённом пункте медико – генетическая консультация? Если нет, узнайте, где находится ближайшая подобная организация. Выясните, какие методы диагностики в ней применяются.
5. Что относится к методам дородовой (пренатальной) диагностики?
Подумайте! Выполните!
1. Как вы считаете, в чём заключается опасность близкородственных браков?
2. Подумайте, в чём особенность изучения наследования признаков у человека.
3. Почему хозяйственная деятельность человека увеличивает мутагенное влияние среды?
4. Используя дополнительную литературу и ресурсы Интернета, подготовьте сообщение или презентацию о современных достижениях в области диагностики и лечения наследственных заболеваний.
5. «Генная терапия – медицина будущего». Согласны ли вы с этим утверждением? Аргументируйте свою точку зрения. Примите участие в дискуссии на эту тему.
6. Подготовьте доклад (реферат или презентацию) на тему «Наследственные аномалии человека, обусловленные генными, хромосомными или геномными мутациями. Причины роста числа наследственных аномалий в человеческой популяции».
7. Оцените уровень информированности населения вашего района о роли медико – генетического консультирования в формировании будущего здоровья нации. Обсудите результаты с одноклассниками, сделайте выводы и представьте их для ознакомления общественности.
Работа с компьютером
Обратитесь к электронному приложению. Изучите материал и выполните задания.
Узнайте больше
Методы генетики человека. Человек является особенным объектом генетических исследований. К нему неприменим основной метод генетики – гибридологический. Малочисленное, а порой единичное потомство затрудняет применение статистических методов в пределах одной семьи. Большая продолжительность жизни, сопоставимая с жизнью самого исследователя, и поздние сроки наступления половой зрелости тоже являются ограничивающими факторами для использования классических генетических методов.
В связи с этим в настоящее время для изучения генетических особенностей человека используют специальные методы. Существует четыре основных метода генетики человека: цитогенетический, близнецовый, генеалогический и популяционно-статистический. Наряду с ними используют и другие методы, основанные в первую очередь на современных достижениях биохимии и молекулярной биологии.
Биохимический метод позволяет изучать наследственные заболевания, обусловленные генными мутациями.
Дерматоглифический метод – изучение кожных узоров пальцев и ладоней для диагностики некоторых аномалий (результат множественного действия генов).
Иммунологический метод позволяет изучать гены, отвечающие за развитие патологий иммунной системы.
Клинический метод основан на изучении нарушения различных параметров жизнедеятельности человека.
Рассмотрим более подробно основные методы генетики человека.
Цитогенетический метод. Изучение строения и функций хромосом привело к выделению самостоятельного раздела биологической науки – цитогенетики. Началом развития цитогенетики человека можно считать 50–60-е гг. XX в., когда впервые удалось получить убедительные изображения всех хромосом человека и правильно определить их диплоидное число.
Цитогенетический метод позволяет изучать кариотип человека в норме и при различных патологиях. Кроме того, этот метод позволяет определять наличие или отсутствие полового хроматина.
Изучение кариотипа. Для изучения кариотипа используют только делящиеся клетки на стадии метафазы. Именно на этой стадии хромосомы максимально спирализованы и могут быть исследованы с помощью оптического микроскопа. Для проведения исследования можно взять пробу ткани, клетки которой находятся в состоянии деления (красный костный мозг, ростовая зона эпителия). Такое исследование является прямым. Однако можно проводить исследования и на образцах ткани, не находящейся в стадии митотического деления. В этом случае необходимо предварительно обработать ткань для стимуляции митоза. Такое исследование называют непрямым. Для непрямого исследования кариотипа обычно используют форменные элементы крови – лейкоциты. Клетки помещают в питательный физиологический раствор и стимулируют их деление. Когда клетки вступают в стадию метафазы, деление останавливают, добавляя колхицин – вещество, разрушающее веретено деления. Хромосомы окрашивают, фотографируют и сравнивают полученный кариотип с эталонным кариотипом. Таким способом можно обнаружить хромосомные и геномные мутации. А использование специального дифференциального окрашивания позволяет определить мутацию с точностью до гена.
Определение полового хроматина. Шведским исследователем Барром было обнаружено, что в ядрах соматических неделящихся клеток у самок высших животных внутри ядра около мембраны присутствует окрашенное тельце (подобной структуры в клетках самцов нет). Учёный предложил назвать эту структуру половым хроматином. Позже эту структуру стали называть тельцем Барра. Выяснилось, что половой хроматин – это суперспирализованный участок одной из Х-хромосом. За счёт наличия двух Х – хромосом женский организм содержит больше генетической информации. Для выравнивания числа генов у мужских и женских особей участок в одной Х – хромосоме суперспирализуется. Таким образом, в норме в ядре клеток женского организма находится одно тельце Барра, а в клетках мужского – ни одного. По числу телец Барра можно определить число Х – хромосом в генотипе: число Х – хромосом равно числу телец Барра плюс один. Этот метод используют для выявления или подтверждения геномных мутаций, связанных с изменением числа половых хромосом, – синдрома Клайнфельтера, трисомии по Х – хромосоме, синдрома Шерешевского-Тернера.
Близнецовый метод. Близнецовый метод позволяет изучить закономерности наследования признака, установить, обусловлено ли фенотипическое проявление признака действием только генотипа или признак развивается под влиянием факторов внешней среды.
Метод основан на сравнении двух типов близнецов. Однояйцевые, или монозиготные, близнецы, как показывает само название, развиваются из одной оплодотворённой яйцеклетки (зиготы). На ранней стадии дробления возможно отделение делящихся клеток друг от друга и разделение зародыша на две части, каждая из которых начинает развиваться самостоятельно, как отдельный организм. Разнояйцевые, или дизиготные, близнецы образуются при оплодотворении двух (и более) яйцеклеток и с самого начала развития представляют собой разные организмы.
С генетической точки зрения монозиготные близнецы полностью идентичны, у них 100 % генов одинаковые. Поэтому различия между монозиготными близнецами можно отнести только на счёт средовых влияний. Дизиготные близнецы так же близки, как обычные дети одних и тех же родителей (общими являются приблизительно 50 % генов). В отличие от монозиготных близнецов, дизиготные близнецы могут быть разнополыми. Оценивая внутрипарное сходство монозиготных и дизиготных близнецов, можно сделать вывод о том, что в первую очередь влияет на развитие конкретного признака – среда или генотип.
Существенно дополнить классический вариант близнецового метода позволяют данные по разлучённым монозиготным близнецам, которые воспитывались в разных семьях. Это даёт возможность оценить воздействие разных сред на одинаковые генотипы и тем самым сделать вывод о том, что определяет развитие конкретного признака: среда или генотип изучаемого человека.
Генеалогический метод. Генеалогический метод (метод родословных) позволяет определить характер наследования признака и прогнозировать появление признака (как нормального, так и патологического) в следующем поколении.
Метод состоит из двух последовательных этапов: составление родословной с её графическим изображением (генеалогического дерева) и анализ полученных данных.
Составление родословной. Сбор сведений о семье начинается с пробанда – индивида, чья родословная составляется. Детей одной родительской пары (братьев и сестёр) называют сибсами. Чем больше поколений вовлекается в родословную, тем она, как правило, точнее. Для графического отображения родословной используют общепринятые стандартные символы (рис. 101). Поколения обозначают римскими цифрами. Последнее (самое старшее) поколение обозначают как поколение I. Арабскими цифрами нумеруют родственников одного поколения (весь ряд). Братья и сёстры располагаются в порядке рождения (от старших к младшим), таким образом, каждый член родословной имеет свой шифр. Все индивиды одного поколения должны располагаться строго в один ряд.
Генеалогический анализ родословной. Первая задача при анализе родословной – установление наследственного характера заболевания. Если в родословной один и тот же признак (болезнь) встречается несколько раз, то можно думать о его наследственной природе. Однако следует исключить возможность фенокопии (заболевание как будто бы передаётся, в то время как его причиной является некий постоянно действующий средовой фактор).
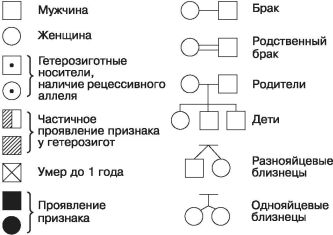
Рис. 101. Стандартные символы, принятые для составления родословных
После установления наследственного характера патологии определяется тип наследования.
Менделевским закономерностям наследования подчиняются только моногенные патологии (мутация одного гена). В зависимости от локализации и свойств гена различают аутосомно – доминантный и аутосомно-рецессивный типы наследования, когда ген расположен в одной из 22 пар аутосом (неполовых хромосом), Х – сцепленные доминантные и рецессивные типы наследования (ген расположен в Х-хромосоме), Y – сцепленное (голандрическое) наследование, а также митохондриальное (материнское, или цитоплазматическое) наследование, когда мутация происходит в геноме митохондрий.
Популяционно-статистический метод. Популяционно-статистический метод позволяет оценить частоту встречаемости признака и генотипа в определённой популяции, изучить генетическую структуру популяции (этнических групп, национальностей, групп компактного проживания).
В основе этого метода лежит закон, открытый ещё более ста лет назад. В 1908 г. его независимо друг от друга сформулировали английский математик Годфри Харди и немецкий врач Вильгельм Вайнберг. В настоящее время этот закон носит их имя – закон Харди-Вайнберга. Согласно этому закону, частота гомозиготных и гетерозиготных организмов в условиях свободного скрещивания при отсутствии давления отбора и других факторов (мутационного процесса, миграции, дрейфа генов и т. д.) остаётся постоянной, т. е. популяция находится в состоянии генетического равновесия. Таким образом, этот закон описывает взаимоотношения между частотами встречаемости аллелей в исходной популяции и частотой генотипов, включающих эти аллели, в дочерней популяции.
Рассмотрим популяцию, в которой некий ген находится в двух аллельных состояниях (A и a). Если частоту аллеля А обозначить как pA, a частоту аллеля а как qa, то pA + qa = 1. Возможные скрещивания в данной популяции можно записать следующим образом: (pA + qa)
 ?
?
 (pA + qa). Частоты трёх возможных генотипов, полученных в данных скрещиваниях, выражаются уравнением (p + q)2 = p2 + 2pq + q2 = 1, где p2 – частота организмов с генотипом АА; 2pq – частота организмов с генотипом Аа; q2 – частота организмов с генотипом аа. В этом легко убедиться, рассмотрев решётку Пеннета.
(pA + qa). Частоты трёх возможных генотипов, полученных в данных скрещиваниях, выражаются уравнением (p + q)2 = p2 + 2pq + q2 = 1, где p2 – частота организмов с генотипом АА; 2pq – частота организмов с генотипом Аа; q2 – частота организмов с генотипом аа. В этом легко убедиться, рассмотрев решётку Пеннета.
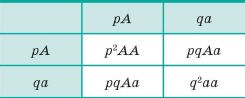
Такое соотношение частот аллелей и генотипов будет поддерживаться в популяции неопределённо долгое время. Зная частоты генотипов, можно рассчитать частоты аллелей, и наоборот, зная частоты аллелей, можно определить частоты генотипов и, следовательно, предсказать соотношение фенотипов.
Рассмотрим конкретный пример, чтобы понять, как можно использовать знание закона Харди – Вайнберга.
Наследственная метгемоглобинемия[7] наследуется как рецессивный признак. В популяции эскимосов Аляски болезнь встречается с частотой 0,09 %. Определите частоту гетерозигот (носителей рецессивного аллеля) в популяции. На какое число людей приходится один носитель рецессивного аллеля?
Больные – это люди с генотипом аа, их частота встречаемости (переводим в доли) – 0,0009, т. е. q2 = 0,0009. Следовательно, q = 0,03. Так как p + q = 1, то p = 1 – q = 1–0,03 = 0,97. Частоту гетерозигот (организмов с генотипом Аа) высчитываем по формуле 2pq = 2 ? 0,97 ? 0,03 = 0,0582 (5,82 %). Если на 100 человек приходится около 6 носителей, следовательно, один носитель приходится на 16–17 человек (100 : 6 ? 16,6). Ответ: доля носителей рецессивного аллеля метгемоглобинемии в данной популяции составляет 5,82 %. Один носитель приходится на 16–17 человек в популяции.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Психическое здоровье
Психическое здоровье Предупредить инфекционные заболевания (за некоторым исключением) можно с помощью уже известных методов лечения. Профилактика психических расстройств — еще более сложная задача. Тем не менее анализ состояния здравоохранения, даже поверхностный,
Молочнокислые микробы дарят здоровье
Молочнокислые микробы дарят здоровье …опытами над молочнокислыми микробами следует напомнить о большом количестве других опытов, произведенных над поглощением чистой молочной кислоты. Из них вытекает…, что эта кислота уменьшает кишечное гниение так же, как и
Может ли музыка влиять на здоровье человека?
Может ли музыка влиять на здоровье человека? Среди многих средств, используемых в медицине для восстановления нарушенных функций организма, давно и прочно занимает свое место музыка. Подобранные специалистами мелодии могут не только улучшать настроение и самочувствие,
Как похолодание влияет на здоровье человека?
Как похолодание влияет на здоровье человека? Сопоставление информации об изменениях погоды и о поступлении больных в приемные покои английских больниц привело специалистов к интересным и важным для практики выводам. Выяснилось, что, например, через 3 дня после
Ответственность государства за здоровье нации
Ответственность государства за здоровье нации Взяв на себя ответственность за здоровье населения, государство было вынуждено издать специальные правила, по которым регламентировалась поставка на рынок отдельных медикаментов, не прошедших тестовых испытаний или
Здоровье подрастающих щенков
Здоровье подрастающих щенков ПоносУ любого щенка время от времени может случиться понос, и к этому надо относиться серьезно. Причиной может стать «всего только» внезапное изменение диеты. Здесь следует напомнить, что новый корм в рацион щенка нужно добавлять только по
Здоровье подрастающих щенков
Здоровье подрастающих щенков ПоносУ любого щенка время от времени может случиться понос, и к этому надо относиться серьезно. Причиной может стать «всего только» внезапное изменение диеты. Здесь следует напомнить, что новый корм в рацион щенка нужно добавлять только по
Глава седьмая Забота о здоровье
Глава седьмая Забота о здоровье Телу животного, непосредственно соприкасающемуся с внешней средой, здорово достается. Удивительно, как оно выдерживает такую трепку и сохраняется так долго. Это происходит благодаря чудесной системе восстановления тканей и, кроме того,
23. Онтогенез человека. Репродуктивное здоровье
23. Онтогенез человека. Репродуктивное здоровье Вспомните!Какой тип развития характерен для человека?Что такое плацента?Как образ жизни матери во время беременности влияет на здоровье будущего ребенка?Эмбриональное развитие. Индивидуальное развитие человека, как и
Загрязнение воды и здоровье
Загрязнение воды и здоровье Вода может оказывать на здоровье людей не только положительное, но и отрицательное влияние. Прежде всего это связано с качеством употребляемой воды: ее органолептическими свойствами, определяемыми цветом, вкусом и запахом, а также химическим
Здоровье внуков — в руках деда
Здоровье внуков — в руках деда «В конце концов, гены — всего лишь марионетки в руках ферментов, которые могут включать и отключать их», — сказал еще в 2002 году в интервью «Шпигелю» Гуннар Коти, шведский специалист в области социальной медицины. Через ферменты факторы