Глава 11 Последний универсальный общий предок, происхождение клеток и первичный резервуар генов
Глава 11
Последний универсальный общий предок, происхождение клеток и первичный резервуар генов
Пер. О. Гадасиной
В предыдущих главах мы рассмотрели фундаментальные аспекты эволюции прокариот и эукариот, выделив древний мир вирусов и таким образом заложив фундамент для обсуждения ключевого момента в эволюции жизни, клеточной организации и разных типов клеток. Как точно предсказал Дарвин (Darwin, 1859) и вполне подтвердила сравнительная геномика, все дошедшие до нас клетки произошли от одного общего предка, который стал известен как LUCA (Last Universal Common Ancestor — последний общий предок всего живого)[113]. Тем не менее не существует единого мнения о природе этого общего предка и о том, насколько походят на него современные клетки. Приводились как аргументы в пользу того, что LUCA был неотличим от современных прокариот, так и сценарии, описывающие LUCA как намного более примитивный организм (Glansdorff et al., 2008).
Трудность этой проблемы невозможно переоценить. Действительно, все известные нам клетки отличаются сложностью и исключительным совершенством организации. Самые простые клеточные формы жизни, бактериальные (и единственный известный архейный) паразиты и симбионты (см. гл. 5), очевидно, произошли в результате деградации более сложных организмов, однако даже они обладают несколькими сотнями генов, кодирующими компоненты высокоразвитой мембраны, системы репликации, транскрипции и трансляции, сложный аппарат деления клетки и по крайней мере несколько центральных метаболических путей. Как мы уже обсуждали, самые простые из свободноживущих клеточных организмов намного сложнее, с геномом размером не менее 1300 генов. Единственные известные автономно воспроизводящиеся агенты, которые существенно проще, чем клетки, — это вирусы, но они являются облигатными внутриклеточными паразитами и среди них не находится ничего похожего на промежуточную стадию между клеткой и вирусом (в каком бы направлении ни шла эволюция от одних к другим). Таким образом, принимая во внимание принципы omnis cellula e cellula и omnis virus e virus, требуются какие-то радикально новые решения: принцип униформизма неприменим к происхождению клеток, которое было событием, фундаментально отличающимся от знакомых нам эволюционных процессов. Итак, здесь мы обсудим прежде всего реконструкцию генного состава LUCA и выводы о происхождении клеток, следующие из этой реконструкции.
Сравнительно-геномная реконструкция генного репертуара LUCA
Почему мы уверены, что LUCA существовал? Есть множество аргументов, поддерживающих предположение о существовании LUCA, и самым сильным из них является сохранившаяся в универсальном (одинаковом для всех организмов) виде система экспрессии генов. Действительно, все известные нам клеточные формы жизни используют один и тот же генетический код (20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах), и небольшие отклонения содержатся лишь в сильно деградировавших геномах бактериальных паразитов и органелл. Все клетки используют одинаковые рибосомы, которые состоят из трех универсально консервативных молекул РНК и примерно 50 белков, из которых 20 универсальны. В дополнение к этому, универсально сохраняющиеся компоненты системы трансляции включают около 30 транспортных РНК, несколько факторов трансляции, 18 аминоацил-тРНК-синтетаз и несколько тРНК-модифицирующих ферментов (Anantharaman et al., 2002). За пределами системы трансляции универсально консервативны только гены трех субъединиц РНК-полимеразы. Таким образом, существует всего около 100 универсально сохранившихся генов, и все они участвуют в экспрессии генов (случается, что некоторые из этих генов, особенно те, что кодируют малые рибосомные белки, отсутствуют в аннотациях вновь расшифрованных геномов [Charlebois and Doolittle, 2004]; однако, скорее всего, эти исчезновения являются ошибками расшифровки или аннотации, а не реальными потерями в геноме). Мы уже знакомы с этими (почти) универсальными генами из главы 6, где мы наблюдали весьма сходные (хотя и не тождественные) топологии их филогенетических деревьев. Универсальное сохранение генетического кода и механизма экспрессии и единство эволюционных судеб его компонентов не оставляют места для сомнений в том, что эта система является наследством некоей формы LUCA. Основной вопрос состоит, таким образом, не в том, существовал ли LUCA, а в том, каким он был, о каких свойствах этой системы мы можем сделать выводы с достаточной уверенностью, а какие (пока что) остаются неясными[114].
Ясно, что ни один организм, даже самый примитивный, не может состоять из одних механизмов экспрессии, так что необходима реконструкция остальной части генного репертуара LUCA. И методы реконструкции, и их подводные камни здесь те же, что были описаны в главах 5 и 7. В контексте эволюции прокариот, которая важна для реконструкции LUCA, следует рассматривать три типа элементарных событий: (1) «рождение» гена — появление нового гена, обычно в процессе генной дупликации, за которой следует радикальная дивергенция; (2) обогащение генами за счет ГПГ; и (3) утрата гена. Напомним, что надежной реконструкции пути эволюции и наборов предковых генов препятствует неточность, связанная с относительными вероятностями событий и скоростями разных процессов, в особенности разница скоростей утраты генов и ГПГ. В принципе даже ген, найденный во всех современных клеточных формах жизни, может не быть унаследован от LUCA: его универсальность может быть последствием многочисленных горизонтальных переносов. Более того, предположения о генном содержании предковых форм, основанные на принципе наибольшей экономии и даже наибольшего правдоподобия, консервативны, и неясно, насколько они недооценивают результат. Вопреки всем сложностям и неточностям эволюционных реконструкций, анализ наибольшей экономии совместно с менее формальными попытками реконструкции далекого прошлого конкретных функциональных систем не оставляет серьезных сомнений в том, что LUCA уже содержал несколько сотен генов (Mirkin et al., 2003; Ouzounis et al., 2006; Snel et al., 2002). В дополнение к вышеупомянутой «золотой сотне» генов, участвующих в экспрессии, этот разнообразный генный комплект состоит из множества метаболических ферментов, включающих как пути основного энергетического обмена и биосинтеза аминокислот, нуклеотидов и коферментов, так и некоторые важные белки мембран, такие как субъединицы частицы узнавания сигналов (SRP) и H+-АТФазы.
Однако в реконструкции генного состава LUCA по-прежнему зияют дыры. Более всего удивляет (1) отсутствие ключевых компонентов механизма репликации ДНК, а именно полимераз, ответственных за инициацию (праймазы) и элонгацию репликации ДНК и заполнение лакун после удаления праймера, а также основных геликаз (Leipe et al., 1999); и (2) отсутствие основных ферментов липидного биосинтеза (Pereto et al., 2004). Эти незаменимые белки не попадают в реконструированный генный репертуар, поскольку данные процессы у бактерий и архей катализируются разными, неродственными ферментами, а в случае мембранных фосфолипидов еще и образуют химически разные мембраны[115].
Таким образом, реконструированный генный набор LUCA исключительно неоднороден: в то время как отдельные системы по своей сложности почти не отличаются от аналогичных систем существующих организмов, другие системы выглядят рудиментарными или вовсе отсутствуют. Столь странная картина напоминает концепцию асинхронной «кристаллизации» различных клеточных систем на ранних стадиях эволюции, которую предложил Карл Вёзе (Woese, 1998), и подсказывает, что нужно взглянуть на проблему LUCA с более общих позиций.
По-видимому, имеет смысл думать о LUCA в двух разных плоскостях (Koonin, 2009c):
• генетическая сложность, которая может быть выражена в числе генов;
• степень структурного и биологического сходства с современными клетками. Для краткости и удобства назовем эти свойства «клеточностью».
Можно ожидать, что эти характеристики коррелируют между собой, но они не связаны жестко. В принципе вполне можно представить, что LUCA был клеточной формой жизни значительно более простой, нежели любая из современных клеток (по крайней мере свободноживущих) в смысле генетического содержания; или же, напротив, что относительная генетическая сложность была свойственна клеткам еще до появления современного типа клеточной организации — для этого сценария мы будем использовать обозначение LUCAS (Last Ancestral Universal Common State — последнее универсальное предковое состояние [всего живого]; см. рис. 11-1).
«Униформистское предположение» о том, что LUCA был более-менее обычной, похожей на современные прокариотической клеткой, негласно принимается в большинстве описаний ранней клеточной эволюции, но редко проговаривается явно. Тем не менее любая реконструкция LUCA должна учитывать и эволюцию тех свойств, которые трудно проследить вглубь до единого предка архей и бактерий, особенно два главных из них: репликацию ДНК и биогенез (и химию) мембран. Униформистские гипотезы, которые скрыто или явно основаны на предположении о «клеточности» LUCA, объясняют несохранение этих ключевых систем (на самом глубоком уровне реконструкции) одним из двух способов:
• каким-то образом LUCA комбинировал разные варианты этих систем, a впоследствии в архейной и бактериальной линиях эволюции был утерян один из вариантов, свой для каждой линии;
• LUCA обладал определенным вариантом каждой из этих систем, впоследствии замененным на неортологичный у архей или бактерий.
Точнее, говоря о биогенезе мембран, предполагают, что LUCA имел смешанную гетерохиральную мембрану, а две хиральные разновидности появились в результате последующей специализации архей и бактерий соответственно (Pereto et al., 2004). Касательно же репликации ДНК была высказана гипотеза о том, что одна из современных систем репликации является предковой, в то время как другая развивалась у вирусов и впоследствии заменила собою исходную либо у архей, либо у бактерий (Forterre, 1999, 2006).
В противоположность этому, более радикальные предположения относительно природы LUCA исходят из положения «что наблюдаемо, то и есть»: LUCA вообще не обладал этими ключевыми чертами, общими для бактерий и архей, по крайней мере не обладал ими в их современной форме (Koonin, 2009c; Koonin and Martin, 2005). Возможность того, что LUCA существенно отличался от всех известных ныне клеток, была впервые высказана в концепции «прогеноты» — гипотетической примитивной формы жизни, в которой связь между генотипом и фенотипом еще не полностью сформировалась (Doolittle and Brown, 1994; Woese and Fox, 1977). В своей первоначальной форме идея прогеноты включает примитивную неточную трансляцию — не слишком жизнеспособное предположение, с учетом обширной диверсификации белков до LUCA, которую однозначно демонстрирует анализ различных белковых семейств (см. гл. 12).
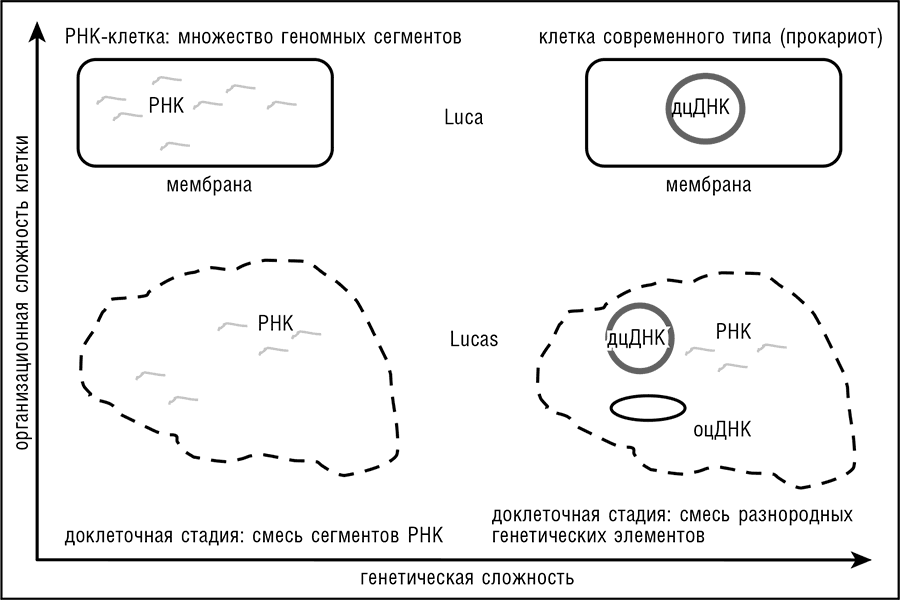
Рис. 11-1. Пространство логических возможностей для LUCA(S): генетически сложный или генетически простой, клеточный или неклеточный. Предполагается, что доклеточный пул молекул РНК генетически проще, чем смешанный пул различных генетических элементов (LUCAS), и что предполагаемая РНК-клетка проще, чем клетки современного типа (LUCA).
Более реалистично предполагать, что развитие основных черт клетки («кристаллизация» в смысле Вёзе) была асинхронной, так что LUCA сильно напоминал современные клетки в одних аспектах, но был исключительно «примитивен» в других. Результаты сравнительной геномики дают подсказки для различения «развитых» и примитивных свойств LUCA. Так, основываясь на основных областях несходства между археями и бактериями, была высказана гипотеза о том, что LUCA
• не имел типичного большого ДНК-генома;
• не был типичной, окруженной мембраной клеткой (см. рис. 11-2; Koonin and Martin, 2005).
Загадкой ДНК-генома и репликации, которую требовалось разгадать, была комбинация негомологичных и консервативных компонентов в аппаратах репликации ДНК архей и бактерий, притом что ядро механизма транскрипции универсально консервативно. Чтобы объяснить эту смешанную картину консерватизма и разнообразия, было сделано предположение о том, что у LUCA был «ретровирусоподобный» цикл репликации с консервативным механизмом транскрипции, вовлеченным в транскрипцию дцДНК провирусного типа и консервативными компонентами системы репликации ДНК, которые в данном случае играли вспомогательную роль (Leipe et al., 1999). Эта умозрительная схема сочетала в некоем гипотетическом цикле репликации консервативные белки, вовлеченные в транскрипцию и репликацию, с белками, которые, по крайней мере в современной биосфере, однозначно принадлежат к миру вирусов, как, например, обратная транскриптаза (см. гл. 10). Этот предполагаемый изначальный цикл репликации-экспрессии, хотя формально и подходит под требования универсального сохранения упомянутых белков при неуниверсальности других ключевых компонент механизма репликации ДНК, не имеет, однако, никаких аналогий в существующих генетических системах.
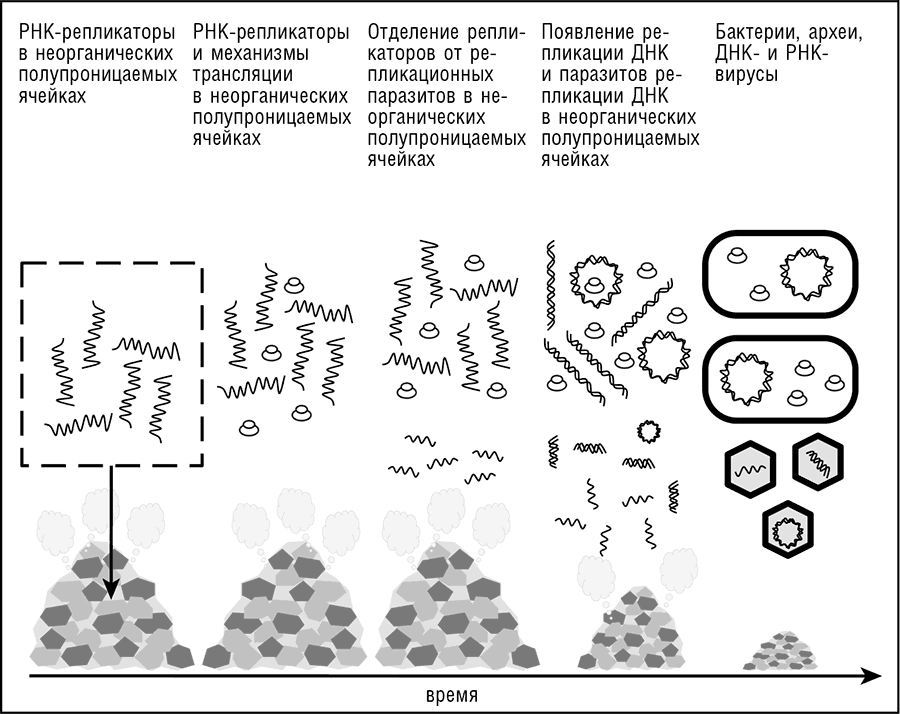
Рис. 11-2. Сценарий вирусного мира для доклеточной эволюции.
Еще одна область несходства архей и бактерий, липидный биосинтез (вместе с химией липидов), требует еще более радикальной гипотезы неклеточного, но компартментализированного LUCA (Martin and Russell, 2003; Koonin and Martin, 2005). Конкретное предположение состоит в том, что LUCA(S) был разнородной популяцией генетических элементов, существовавших в сети неорганических ячеек (в гл. 12 эти возможные инкубаторы жизни обсуждаются в подробностях). Основным затруднением для моделей безмембранного LUCA является то, что некоторые мембранные белки и даже молекулярные комплексы, такие как протонная АТФаза и частица узнавания сигнала, практически универсальны во всех современных формах клеточной жизни и, по всей вероятности, присутствовали и в LUCA.
Более тщательное рассмотрение основные проблем концепции клеточного LUCA, а именно негомологичности основных элементов системы репликации ДНК и радикального различия между фосфолипидами и ферментами липидного биосинтеза у архей и бактерий, приводит к идее о том, что две эти проблемы тесно связаны между собой (Koonin, 2009c). LUCA (реконструированный методами сравнительной геномики) как сложный организм без обширного ДНК-генома, сравнимого с геномами современных архей и бактерий, должен был бы иметь геном, состоящий из нескольких сотен РНК-сегментов (или ДНК провирусного типа), длиной в несколько тысяч оснований каждый. Это ограничение диктуется исключительно низкой стабильностью молекул РНК в сравнении с ДНК, а также тем фактом, что самые длинные РНК-геномы (принадлежащие коронавирусам) не превышают 30 Кб.
Предполагалось, что LUCA мог быть РНК-клеткой в собственном смысле слова, из которой далее произошли три основные линии РНК-клеток (предки бактерий, архей и эукариот), геномы которых независимо заменились ДНК в результате приобретения механизмов ДНК-репликации от различных вирусов (Forterre, 2006). Этот сценарий, однако, выглядит надуманным, поскольку необходимость в сотнях «хромосом» выглядит непреодолимым препятствием для РНК-клетки. Требуемая точность распределения копий такого фрагментированного генома между дочерними клетками при клеточном делении требует исключительной точности механизма сегрегации генома, превышающей даже точность соответствующего аппарата современных прокариот. В противном случае изменение в наборе генов при каждом делении клетки, безусловно, сделает размножение невозможным. Механизмы деления, которые функционируют в современных бактериях (и, вероятно, в археях), закачивают дцДНК в дочерние клетки при помощи специальных АТФаз, которые, по всей вероятности, эволюционировали совместно с дцДНК-геномами. Таким образом, если LUCA действительно имел, вместо большого генома из дцДНК, «коллективный» геном из множества РНК-сегментов, то он должен был быть формой жизни, весьма отличной от современных клеток, возможно даже неклеточной.
Другим широко обсуждаемым аспектом ранних форм жизни, включающих и LUCA, является безудержный ГПГ, который часто рассматривается как предпосылка к эволюции сложной жизни (еще одно важное предположение Карла Вёзе [Woese, 2002]). Несомненно, ГПГ — путь к быстрым новоприобретениям, а на ранних стадиях эволюции жизни новоприобретения должны были быть исключительно быстрыми. Вёзе и его коллеги предположили и проиллюстрировали на математических моделях, что сама универсальность генетического кода могла быть связана с критической ролью ГПГ на ранних стадиях эволюции (Vetsigian et al., 2006). При обширном ГПГ единый вариант кода обязательно распространится во всей популяции предковых форм, поскольку любой организм с отличающимся генетическим кодом будет неспособен получать выгоду от ГПГ и, будучи изолированным от других организмов, непременно будет отбракован отбором[116]. Постоянный бурный ГПГ — неотъемлемая черта моделей неклеточного компартментализированного LUCA(S), но, безусловно, не может быть принят как данность в рамках моделей клеточного LUCA. В следующем разделе мы рассмотрим модель неклеточного LUCA(S) подробнее.
Неклеточный компартментализированный LUCA(S): сообщество разнородных репликаторов и лаборатория ранней эволюции
Майкл Рассел и коллеги предположили, что сети микроячеек в современных и древних гидротермальных источниках, состоящие в основном из сульфида железа, могли быть идеальной средой обитания для ранней жизни (Martin and Russell, 2003; Russell, 2007). Эти сети неорганических ячеек обеспечивают градиенты температуры и рН, способствующие первичным реакциям, и предоставляют универсальные каталитические поверхности для примитивной биохимии[117]. Подробности устройства этой среды остаются предметом исследований и споров (некоторые частности разбираются в гл. 12), но мало кто сомневается, что такие сети неорганических ячеек подходят на роль инкубаторов добиологической и доклеточной биологической эволюции, от смеси органических молекул к предполагаемому изначальному миру РНК и далее до происхождения клеток, выходящих из ячеек (см. рис. 11-2). Эти отсеки могли быть населены самой разнородной популяцией генетических элементов, вначале сегментами РНК, затем более крупными и сложными молекулами РНК, включающими один или несколько белок-кодирующих генов, а еще позже — также и сегментами ДНК постепенно увеличивающегося размера (см. рис. 11-2).
Таким образом, ранние формы жизни, возможно включая LUCA(S), рассматриваются как сложные ансамбли генетических элементов, населявшие сети неорганических ячеек. Главная особенность этой модели состоит в том, что все стратегии репликации и экспрессии, использующиеся современными вирусами (см. рис. 10-1), и, соответственно, генетические элементы, кодирующие все разнообразные механизмы репликации и экспрессии, эволюционировали одновременно и в конечном итоге сосуществовали в сети, в некоторых случаях в одной и той же ячейке. Таким образом, ранняя, несколько искусственная схема, где универсально консервативные компоненты механизма репликации ДНК были вовлечены в первичный цикл репликации ретровирусного типа (Leipe et al., 1999), становится ненужной.
Рассматриваемая модель объясняет отсутствие гомологии между мембранами, системами мембранного биогенеза и механизмами репликации ДНК архей и бактерий тем, что LUCA(S) не имел единого большого ДНК-генома и не был типичной клеткой, ограниченной мембраной. Согласно этой модели, первичные, доклеточные, «коммунальные» формы жизни рассматриваются как «лаборатории», в которых были «изобретены» и опробованы различные стратегии репликации и экспрессии генома, а также рудиментарные формы биогенной компартментализации (см. рис. 11-2 и обсуждение далее в этой главе).
Главным пунктом этого сценария ранней эволюции жизни является вирусоподобная природа предполагаемой доклеточной жизни. В соответствии с этой моделью, жизнь началась как первичный вирусный мир. Как уже упоминалось в главе 10, мысль о том, что вирусы могли быть соотнесены с первыми формами жизни, почти так же стара, как сама вирусология. Следуя умозрительным предположениям д’Эрреля, Холдейн выдвинул эту точку зрения в более определенной форме в своем классическом эссе 1928 года о происхождении жизни (Haldane, 1928). Со своей неизменной и поразительной способностью к предвидению Холдейн предположил, что первые самовоспроизводящиеся агенты были вирусами или чем-то похожим на вирусы и что вирусный этап в эволюции жизни предшествовал появлению клеток: «Жизнь, возможно, пребывала в вирусной стадии многие миллионы лет, прежде чем подходящие совокупности элементарных частей объединились в первую клетку». Впоследствии, однако, идея изначального происхождения вирусов и более смелая идея первичного вирусного этапа в эволюции жизни была фактически отброшена, когда стало ясно, что вирусы — облигатные внутриклеточные паразиты, большинство функций которых зависимы от клетки-хозяина. Ее место в концепциях о происхождении и эволюции вирусов, как обсуждалось в главе 10, заняли сценарии клеточной дегенерации и беглых клеточных генов.
Вирусологический ренессанс в первом десятилетии третьего тысячелетия привел к распространению гипотез и моделей, основанных на идее о важном вкладе вирусов в происхождение и эволюцию клеток. По сценарию «трех РНК-клеток и трех ДНК-вирусов» П. Фортера, современные, основанные на ДНК клетки возникли, когда три различных ДНК-вируса заменили первоначальный РНК-геном в трех клеточных линиях (предках бактерий, архей и эукариот соответственно; Forterre, 2006). Сами эти ДНК-вирусы, по предположению Фортера, эволюционировали как паразиты первичных РНК-клеток. Однако, как уже говорилось в этой главе, гипотеза РНК-клетки вряд ли жизнеспособна. Более правдоподобный сценарий, который, возможно, примиряет выводы сравнительной геномики и общую логику доклеточной эволюции, возрождает идею Холдейна на новом уровне и включает эволюцию различных вирусоподобных элементов и даже вирусоподобных частиц, предшествующую появлению клеток современного типа.
Проблема возникновения клеток наиболее ярко отражает те трудности, с которыми сталкиваются все объяснения эволюции сложных биологических структур (см. гл. 8). Действительно, среди современных биологических объектов мы не видим никаких промежуточных форм между макромолекулами и клетками, и представление о том, какими были и как работали такие промежуточные структуры, является огромной проблемой. Как мы уже неоднократно отмечали в настоящей книге, наименьшая клетка, не являющаяся паразитом или воспроизводящимся внутри других клеток симбионтом, должна нести по меньшей мере 400 генов, в то время как автотрофные клетки вряд ли могут существовать с геномом менее 1000 генов. Эти гены находятся на одной большой хромосоме (в большинстве прокариот) или на нескольких меньших хромосомах и (или) крупных плазмидах (в меньшем числе бактерий и архей), но никогда на сегментах ДНК размером порядка оперона или гена. Фактор отбора, направляющий эволюцию к большим, протяженным геномам прост, если мы вспомним постулат Вирхова omnis cellula e cellula: эволюционирующей клетке требуется точно раздваивать геном, что практически немыслимо с геномом, состоящим из сотен сегментов. Эта эволюционная логика подсказывает, что первые клетки на самом деле должны были иметь одну хромосому, и не только потому, что это так для большинства современных архей и бактерий, но, что более важно, из-за вероятной простоты и сравнительной неточности древнего механизма клеточного деления. Эволюционный рост сложных геномов, кодирующих наименьший комплект генов, необходимых для деятельности клетки, требует некоей разновидности первичной, абиогенной компартментализации, не требующей сложного мембранного аппарата современной клетки. Эту сложность не следует недооценивать: напомним, что все клеточные мембраны являются не только сложно организованными транспортными устройствами, но и машинами по преобразованию энергии, превращающими разность электрохимических потенциалов (протонный или натриевый градиент) в химическую энергию АТФ[118].
В настоящее время серьезно рассматриваются две формы первичной, абиогенной компартментализации: липидные везикулы и сети неорганических ячеек. Сценарий липидных везикул привлекателен тем, что в нем абиогенные мембраны являются прямыми предками современных биологических мембран. Эта возможность в настоящее время широко изучается экспериментально, в первую очередь в лаборатории Джека Шостака, и были получены интересные результаты в области транспорта полярных соединений, в том числе нуклеотидов, через липидные мембраны (Mansy et al., 2008). Однако трудности, с которыми сталкивается эта модель, остаются очень большими. Эти проблемы достаточно очевидны и включают в себя не только транспорт мономеров со скоростями, достаточными для поддержания репликации и трансляции генетических элементов до появления белковых транспортеров, но и создание и поддержание мембранного потенциала для производства энергии. Кроме того, везикулярная модель, по-видимому, не способствует интенсивному ГПГ, важному аспекту всей микробной эволюции, но особенно необходимому на доклеточной стадии.
Не отказывая модели липидных везикул в потенциальной важности, рассмотрим модель происхождения клеток из вирусного мира как начального состояния, эволюционирующего в сетях неорганических ячеек. Эта модель, возможно, встречает меньше проблем, чем модель липидных везикул, и содержит ряд привлекательных черт, в том числе возможный ключ к разгадке происхождения биологических мембран и биоэнергетики. Как и биологическая эволюция в целом, доклеточная эволюция, несомненно, обусловливалась сочетанием случайного дрейфа и естественного отбора. Возможности для дрейфа изобилуют в рамках этой модели; пожалуй, самым простым и очевидным примером будет «засев» пустой ячейки случайным генетическим элементом. Отбор сразу же выходит на сцену с появлением репликаторов (см. гл. 2) — первоначально, как сейчас предполагается, молекул РНК, реплицируемых рибозимами, а впоследствии, после появления трансляции, молекул РНК, реплицирующихся с помощью белков (см. гл. 12). Одним из центральных аспектов модели вирусоподобной компартментализированной доклеточной стадии эволюции является постепенный переход от отбора на уровне отдельных генетических элементов к отбору ансамблей таких элементов[119], кодирующих ферменты, непосредственно участвующие в репликации, а также белки, отвечающие за вспомогательные функции, такие как трансляция и синтез предшественников нуклеиновых кислот. Отбор на уровне ансамблей генетических элементов, очевидно, является одной из форм группового отбора, который сам по себе является предметом давних споров среди биологов-эволюционистов и иногда отбрасывается как выдумка. Не вдаваясь глубоко в теоретические построения, отметим, что начальная эволюция, от малых генетических элементов к большим геномам, сравнимым с геномами современных клеточных форм жизни, не представляется возможной без группового отбора в той или иной форме (Koonin and Martin, 2005). Исследуя математические модели, Э. Сатмари с коллегами продемонстрировали возможность группового отбора в ансамблях репликаторов, самовоспроизводящихся в разделенной на ячейки среде (Fontanari et al., 2006; Szathmary and Demeter, 1987). Некоторые из решений, возможно доступных ансамблям «эгоистичных кооператоров», известны из теории группового отбора. Наиболее очевидным и важным представляется взаимный альтруизм, когда члены группы реализуют взаимодополнительные функции, стимулирующие репродукцию друг друга[120]. Так, в первичном ансамбле генетический элемент, кодирующий репликазу, катализировал бы репликацию элементов, кодирующих, например, компоненты систем трансляции и синтеза предшественников, — то есть функции, способствующие его собственной репликации.
Ансамбли эгоистичных кооператоров могли возникать двумя (отнюдь не взаимоисключающими) путями: (1) физическим соединением генетических элементов и (2) компартментализацией. Первый путь представляет собой начало эволюции оперонов, включая супероперон, включающий гены рибосомых белков и субъединиц РНК-полимеразы, единственный массив генов, в значительной степени сохраненный между археями и бактериями (см. гл. 5). Путь компартментализации включает эволюцию вирусоподобных частиц, которые могли содержать достаточно стабильные наборы сегментов генома, напоминающие ныне существующие сегментированные РНК-вирусы. В отличие от клеток, вирусоподобные частицы с малыми геномами, в особенности широко распространенные икосаэдрические (сферические) капсиды, являются простыми симметричными структурами, которые во многих случаях формируются путем самосборки единственного белка капсида. Таким образом, весьма привлекательна идея о том, что простые вирусоподобные частицы были первой формой настоящей, биологической компартментализации и играли большую роль на доклеточной стадии эволюции. В дополнение к преимуществам компартментализации, вирусоподобные частицы могут защитить генетические элементы (особенно РНК) от деградации и могут служить транспортом для перемещения генов между ячейками и сетями.
Большая часть сферических вирусов с относительно сложными геномами обладает молекулярными механизмами для упаковки ДНК и РНК внутри капсида; по крайней мере в некоторых случаях эти молекулярные механизмы работают и в обратном направлении, обеспечивая экспорт вирусных транскриптов из капсидов (Rao and Feiss, 2008). Вирусные механизмы упаковки и экспорта используют моторные АТФазы как минимум трех известных семейств, которые, по-видимому, имеют общую архитектуру, формируя гексамерные каналы, по которым активно (то есть за счет энергии гидролиза АТФ) перемещаются молекулы ДНК или РНК. Примечательно, что одна из групп вирусных упаковочных АТФаз является ветвью суперсемейства FtsK-HerA, которое также включает в себя прокариотические АТФазы, ответственные за транспорт ДНК в дочерние клетки во время клеточного деления, в то время как другое семейство сходно с двигательными АТФазами бактериальных нитей (pili) (Iyer et al., 2004b). В имеющих мембраны вирионах многих вирусов аппарат упаковки перемещает ДНК и РНК как сквозь капсид, так и сквозь липидную мембрану вириона. Заманчиво предположить, что вирусные механизмы упаковки были эволюционными предшественниками клеточных насосов и двигательных АТФаз. H+(Na+)-АТФазы/АТФ-синтазы, важнейшие, универсальные мембранные ферменты, краеугольный камень современной клеточной энергетики, также образуют подобные гексамерные каналы и, возможно, появились как часть механизма упаковки и экспорта в некоем, до сих пор не описанном (возможно, вымершем) классе вирусоподобных агентов.
Мембраны ионных градиентно-зависимых АТФ-синтаз представляют собой удивительный молекулярный «электродвигатель», роторный мотор, который переводит ионный градиент в механическую энергию вращения, а затем в химическую энергию ?-?-фосфодиэфирной связи АТФ. Анализ методами сравнительной геномики заставляет предположить, что предки двух основных ветвей мембранных АТФаз/синтаз, так называемые F-АТФазы, как правило обнаруживаемые в бактериях (и в эндосимбиотических органеллах эукариот), и V-АТФазы, характерные для архей и эндомембранных систем эукариот, произошли от общего предка, который функционировал как транслоказа белков или РНК (Mulkidjanian et al., 2007).
В предложенном эволюционном сценарии стадия транслоказы предваряет расхождение ветвей бактерий и архей, но мембранные АТФ-синтазы как таковые существенно различаются у архей и бактерий и, возможно, возникли дважды, независимо в разных ветвях клеточной жизни. Эти аналогии позволяют устремиться еще дальше в доклеточное эволюционное прошлое и предположить происхождение этой древней транслоказы от РНК-геликазы и мембранной поры или канала (см. рис. 11-3). Реконструкция эволюции мембранной АТФ-синтазы является основой для определения последовательности доклеточной эволюции: широкая диверсификация ферментов, содержащих петлю связывания фосфата (P-loop; см. гл. 12), которая породила, кроме множества АТФаз, еще и отдельное семейство РНК-геликаз (включающих бактериальный фактор терминации транскрипции Rho), произошла еще до развития мембранной энергетики, по крайней мере в той ее форме, которая наблюдается в современных клетках.
Весьма привлекательной кажется мысль о том, что, возможно, древнейшие вирусные мембраны могли быть промежуточными шагами в эволюции биологической компартментализации, что относит вглубь по исторической шкале время появления полноценных клеточных мембран. Действительно, в эволюции современных сложных мембран есть парадокс. Мембраны всех современных клеток являются исключительно изощренными устройствами: двойной липидный слой непроницаем даже для небольших молекул, а перенос молекул между внутриклеточным пространством клетки и внешним миром происходит при помощи мембранных белковых комплексов, таких как каналы, поры, транслоказы и вышеупомянутые градиент-зависимые АТФазы, ответственные за клеточную энергетику. Мембрана — это еще одна сложнейшая система, понимание происхождения которой сталкивается с классической дарвиновской проблемой: жизнеспособные промежуточные стадии сложно себе представить. «Дырявая» мембрана не может обеспечить целостность клеточного содержимого, в то время как непроницаемая мембрана будет бесполезна, поскольку не позволит импортировать строительные блоки для репликации. Вирусоподобные частицы могут разрешить этот парадокс, поскольку они получают выгоду от непроницаемой мембраны, если вирион снабжен транслоказой нуклеиновой кислоты[121]. Подобно тому как репликацию генома вирусоподобных объектов можно рассматривать как изначальный полигон для отработки репликационных стратегий, две из которых впоследствии были вовлечены в две основных линии клеточной жизни, вирусные частицы могли быть «лабораторией» для отработки молекулярных устройств, которые в дальнейшем встроились в мембраны развивающихся клеток.
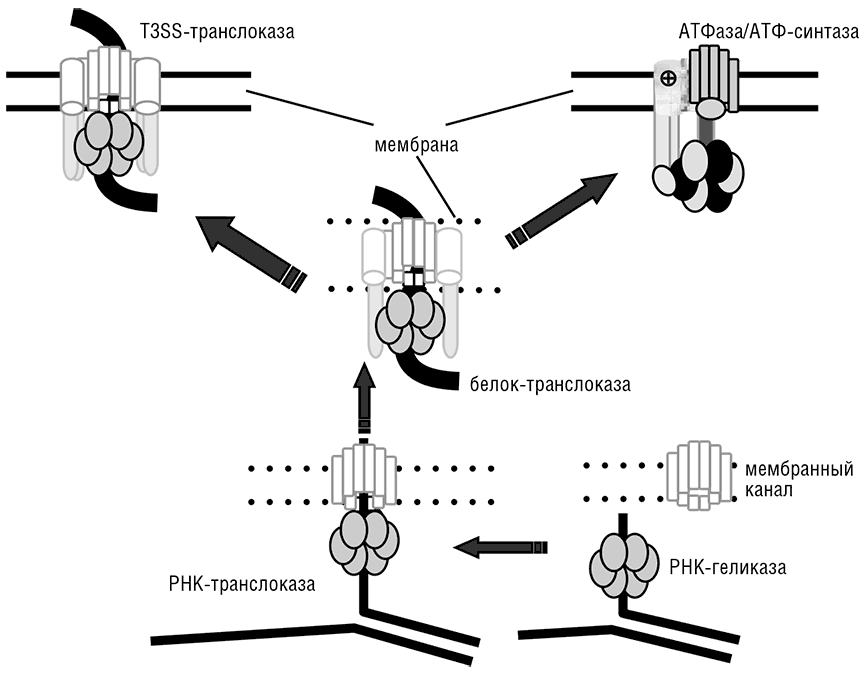
Рис. 11-3. Модель эволюции молекулярных моторов и мембранной биоэнергетики: от РНК-геликазы и мембранного канала к РНК-белковой транслоказе, и далее к ионно-градиентной АТФ-синтазе. Сплошные линии показывают современные непроницаемые для ионов мембраны, прерывистые линии показывают гипотетические «протекающие» древние мембраны. Изогнутая стрелка показывает утечку катионов из клетки. T3SS — система секреции типа 3, белковая транслоказа, распространенная у современных бактерий. В белковых транслоказах центральную позицию временно занимает перемещаемый белок, в то время как в мембранных АТФазах эту позицию занимают соответствующие белковые субъединицы. Сценарий эволюции взят из Mulkidjanian et al., 2007.
От отбора генных ансамблей прямая дорога к отбору содержимого ячеек, когда ячейки, поддерживающие быструю репликацию, «заражают» смежные ячейки и фактически распространяют свои коллективные «геномы»; первичные вирусоподобные частицы могли содействовать этому процессу (Koonin and Martin, 2005). Доклеточный эквивалент ГПГ — перенос генетического содержимого между ячейками — тоже часть этой модели, в согласии с идеей о том, что массовый ГПГ был неотъемлемой частью ранней стадии эволюции жизни. После того как в ходе эволюции эгоистичных кооператоров в сети неорганических ячеек был достигнут определенный уровень сложности, стал возможен «побег» протоклеточных организмов, имеющих сравнительно большие ДНК-геномы и мембраны, содержащие механизмы транспорта и транслокации (изначально развившиеся, согласно модели, в вирусоподобных агентах). Нельзя сказать, как много подобных попыток провалилось моментально и сколько продержалось дольше, но только археи и бактерии (согласно симбиотическому сценарию более позднего возникновения эукариот, как описано в гл. 7) дожили до сегодняшнего дня. Первый успешный «побег» клеточной жизни из гипотетического доклеточного «супа» соответствует дарвиновскому порогу клеточной эволюции, описанному Вёзе, — порогу, за которым ГПГ должен был существенно сократиться и начаться эволюция отдельных линий (видов) клеточных организмов (Woese, 2002).
Как и в других моделях ранних стадий эволюции биологической сложности и, возможно, даже более явно, сценарий «первобытного вирусного мира», описанный здесь, сталкивается с проблемой победы эгоистичных элементов. В главе 10 мы говорили о том, что появление паразитов — черта, присущая любой эволюционирующей системе репликаторов. Если бы первобытные паразиты стали слишком агрессивными, они могли бы уничтожать своих хозяев внутри ячейки и далее выживать, только инфицируя следующую ячейку (где они снова представляли бы опасность). Можно вообразить разрушительную «пандемию», прокатившуюся по всей сети и уничтожившую все ее содержимое, и, скорее всего, именно такой была судьба многих, если не большинства, первобытных «организмов». Примечательно, что математическое моделирование репликаторов заставляет предполагать, что важной движущей силой, определившей появление ДНК, которая привела к разделению роли матрицы и катализаторов на доклеточной стадии эволюции, могла быть повышенная сопротивляемость паразитов в системах со специализированными, выделенными матрицами (Takeuchi et al., 2011). Условием для выживания доклеточных форм жизни было, во-первых, появление умеренных паразитов, которые не убивали хозяина, и, во-вторых, эволюция защитных механизмов, вероятнее всего основанных на РНК-интерференции. Повсеместное распространение умеренно эгоистичных элементов и защитных систем, основанных на РНК-ин терференции, во всех ветвях клеточной жизни наводит на мысль, что эти явления появились на очень ранней, даже, возможно, доклеточной стадии эволюции.
Согласно этому сценарию, в первобытном генетическом резервуаре не существовало четко очерченных границ между эгоистичными генными элементами, которые позже стали вирусами, и большими генными ансамблями, которые в дальнейшем дали начало геномам клеточных форм жизни, хотя расхождение этих двух форм началось, когда паразиты начали «кормиться» на ансамблях «эгоистичных кооператоров». Появление клеток стало и настоящим началом мира вирусов, каким мы представляем его сегодня.
Модель доклеточной эволюции в первобытном вирусном мире, обрисованная здесь, предлагает, по-видимому, правдоподобные, хотя и весьма умозрительные решения многих загадок, связанных с происхождением клеток. Сравнительная геномика вирусов и других эгоистичных элементов дает, как мне кажется, серьезную эмпирическую поддержку этой модели. Учитывая, что, согласно такому сценарию, первые клетки произошли из неклеточного предкового состояния в ходе множественных независимых случаев возникновения протоклеток, кажется осмысленным говорить не о едином предке всех живых форм (LUCA), а о предковом состоянии (LUCAS), описывающем первобытный резервуар вирусоподобных генетических элементов.
Краткий обзор и перспектива
Все существующие формы жизни размножаются как клетки или внутри клеток. Хотя в главе 10 мы рассмотрели сильные аргументы сравнительной геномики в пользу того, что мир вирусов развивался постепенно и квазиавтономно от клеточных форм жизни на всем протяжении эволюции жизни на Земле, факт остается фактом: вирусы не могут размножаться вне клеток. Мы не знаем всех промежуточных стадий эволюции; даже самые простые клетки обладают сложной трансформирующей энергию мембраной, включающей разнообразные транспортные системы, а также обширными ДНК-геномами и сложной системой генной репликации и клеточного деления. Не существует униформистского объяснения эволюции клеток — доклеточная биота, безусловно, разительно отличалась от всей известной нам жизни. В настоящей главе мы обсуждали в основном мир вирусов в качестве сценария эволюции как вирусов, так и клеток. Согласно этой гипотезе, доклеточная стадия эволюции жизни происходила в сети неорганических ячеек, содержащих разнообразную смесь вирусоподобных генетических элементов, которые постепенно превратились в ансамбли «эгоистичных кооператоров» и истинных паразитов. Предполагается, что эти ансамбли генетических элементов были предковой стадией, из которой появились клетки; возможно, речь идет о множестве независимых «попыток», но только две из них (предки бактерий и архей соответственно) дали стабильные клеточные линии, успешные в долговременной эволюционной перспективе.
Исходя из этого гипотетического статуса первобытных форм жизни, давших начало клеткам, предлагается заменить понятие всеобщего предка (LUCA) на всеобщее предковое состояние (LUCAS). LUCA(S) мог довольно сильно отличаться от современных клеток, как нам подсказывает отсутствие гомологии ключевых компонентов репликации ДНК и биогенеза мембран (а также различий в химических структурах липидов) у архей и бактерий. Эти фундаментальные различия между двумя основными доменами клеточной жизни подразумевают неклеточную природу LUCAS. Однако не следует принимать эту модель безоговорочно: несмотря на всю правдоподобность, сценарий неклеточного LUCAS тоже сталкивается с существенными трудностями. Например, в рамках этого сценария сложно объяснить универсальное сохранение частицы узнавания сигнала, рибонуклеопротеиновой машины, которая еще до окончания трансляции встраивает образующиеся белки в мембраны[122].
Какой бы интригующей ни была возможность существования неклеточного LUCAS и как бы ни было важным реконструировать детали этого ключевого предкового состояния, это все же второстепенно для модели мира вирусов. Даже если модель неклеточного LUCAS будет убедительно опровергнута и появятся веские доводы в пользу клеточного LUCA, это не отменит модели доклеточной эволюции, которую мы обсуждаем, — только отбросит ее назад и будет свидетельствовать в пользу единственности успешного возникновения клетки. То же самое справедливо для модели сети неорганических ячеек (подробно рассматриваемых в гл. 12). Даже если эта модель окажется неправдоподобной, в то время как, скажем, модель клеточной эволюции из липидных везикул получит достоверное экспериментальное подтверждение, — и это вряд ли отменит необходимость существования первобытного резервуара генетических элементов. Кратко говоря, вирусоподобный характер генетического резервуара на доклеточной стадии эволюции жизни является логической необходимостью.
Рекомендуемая дополнительная литература
Doolittle W. F., and J. R. Brown. (1994) Tempo, Mode, the Progenote, and the Universal Root. Proceedings of the National Academy of Sciences USA 91: 6,721—6,728.
Обсуждение природы LUCA, в частности, был ли он прогенотой, на заре эры геномики.
Glansdorff N., Y. Xu, and B. Labedan. (2008) The Last Universal Common Ancestor: Emergence, Constitution, and Genetic Legacy of an Elusive Forerunner. Biology Direct 3: 29.
Подробный обзор гипотез и идей касательно LUCA. Согласно модели, предпочитаемой Глансдорфом с коллегами, LUCA был сообществом разнообразных РНК-клеток.
Koonin E. V. (2009) On the Origin of Cells and Viruses: Primordial Virus World Scenario. Annals of the New York Academy of Sciences 1,178: 47–64.
Концептуальный анализ, совмещающий модели доклеточной эволюции в сетях неорганических ячеек и вирусного мира, приводящий к предположению, что LUCAS был сообществом вирусоподобных агентов.
Koonin E. V. (2003) Comparative Genomics, Minimal Gene-Sets, and the Last Universal Common Ancestor. Nature Reviews Microbiology 1: 127–136.
Обзор и критический анализ реконструкций минимального и предкового генных наборов.
Koonin E. V., and W. Martin. (2005) On the Origin of Genomes and Cells Within Inorganic Compartments. Trends in Genetics 21: 647–654.
Модель ранней эволюции жизни, от образования первых полимеров до возникновения клеток. LUCA(S) рассматривается как неклеточное сообщество разнообразных репликаторов. Постулируется множество событий возникновения клеток, из которых, однако, только два привели к формам, выжившим в течение длительного времени и давшим начало археям и бактериям.
Morange M. (2010) Some Considerations on the Nature of LUCA, and the Nature of Life. Research in Microbiology 162: 5–9.
Обсуждение эпистемологических аспектов исследования ранних стадий эволюции жизни, включая LUCA.
Mulkidjanian A. Y., K. S. Makarova, M. Y. Galperin, and E. V. Koonin. (2007) Inventing the Dynamo Machine: The Evolution of the F-type and V-type ATPases. Nature Reviews Microbiology 5: 892–899.
Сценарий происхождения мембранных АТФаз (АТФ-синтаз), использующих трансмембранный ионный градиент для синтеза АТФ, из геликазы и белкового комплекса мембранной поры. Такой сценарий предполагает, что значительное разнообразие белков и, в частности, возникновение геликаз, содержащих фосфат-связывающую петлю, предшествует по времени возникновению мембранной биоэнергетики современного типа, так что на ранних стадиях жизни должен был действовать иной энергетический механизм.
Mushegian A. (2008) Gene Content of LUCA, the Last Universal Common Ancestor. Frontiers in Bioscience 13: 4,657—4,666.
Современные методы и результаты реконструкции генного репертуара LUCA.
Woese C. R. (2000) Interpreting the Universal Phylogenetic Tree. Proceedings of the National Academy of Sciences USA 97: 8,392—8,396.
Влиятельнейшая статья, в которой Вёзе помещает LUCA в корень универсального древа жизни, начальную стадию эволюции, когда интеграция генетических элементов стала достаточно тесной, чтобы поддерживать эволюцию клеточной линии.
Woese C. R. (2002) On the Evolution of Cells. Proceedings of the National Academy of Sciences USA 99: 8,742—8,747.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Глава II. Возникновение нервных клеток и мозга
Глава II. Возникновение нервных клеток и мозга Причиной возникновения нервной системы стала низкая скорость получения информации о внешнем и внутреннем мире организма с донервной организацией. Его ткани состояли из клеток со сходной химической, электромагнитной и
Универсальный аппарат для принятия решений
Универсальный аппарат для принятия решений Психика, она же душа, является результатом работы мозга. Мозг сделан из нервных клеток — нейронов. Мы не будем вдаваться в тонкие детали устройства нервных клеток, ведь эта книга не учебник по нейробиологии. Но несколько базовых
Общий характер домашних разновидностей. Трудности при различении разновидностей и видов. Происхождение домашних разновидностей от одного или нескольких видов.
Общий характер домашних разновидностей. Трудности при различении разновидностей и видов. Происхождение домашних разновидностей от одного или нескольких видов. Когда мы рассматриваем наследственные разновидности или расы наших домашних животных и культурных растений
Глава IX ПОСЛЕДНИЙ ИЗ НЕАНДЕРТАЛЬЦЕВ
Глава IX ПОСЛЕДНИЙ ИЗ НЕАНДЕРТАЛЬЦЕВ Генетика особенно могущественна, когда дело доходит до разбирательств между соперничающими теориями. В Тихом океане она решительно встала на сторону сторонников азиатского происхождения полинезийцев в ущерб теории американского
ГЛАВА 3 ОБРАЗОВАНИЕ ПОЛОВЫХ КЛЕТОК
ГЛАВА 3 ОБРАЗОВАНИЕ ПОЛОВЫХ КЛЕТОК Размножение становится возможным лишь по достижении животным половой зрелости. Половая зрелость животных наступает с момента начала активного образования половых клеток. Сроки наступления ее у собак сильно варьируют и зависят от
Происхождение и развитие половых клеток животных
Происхождение и развитие половых клеток животных Гаметогенез у животных проходит в несколько этапов (табл. 4.1).Таблица 4.1. Этапы гаметогенеза у животных На 1-м этапе (период размножения) первичные клетки (сперматогонии и оогонии) делятся митозом.На 2-м этапе (период роста)
Универсальный код
Универсальный код Когда выяснилось, что у E. coli все же есть половой процесс, ученые впервые получили возможность ближе познакомиться с устройством хромосомы. Оказалось, что половой акт у E. coli протекает довольно своеобразно. Одна из бактерий выбрасывает нитевидный вырост,
Предок царицы цветов
Предок царицы цветов Слышишь, как всюду весною раздается лишь сладостный шепот радости и любви: то шелест соловья, читающего книги роз! Саади Поздней весной начинает цвести шиповник. Крупные розовые цветки его полны аромата. Видимо, из цветков шиповника, среди которых
5.4. Существовал ли последний общий предшественник, то есть был ли единый ствол у дерева жизни?
5.4. Существовал ли последний общий предшественник, то есть был ли единый ствол у дерева жизни? Прежде чем вернуться к дереву жизни, следует упомянуть высказывания, ставящие под сомнение само понятие “последний общий предшественник”. Группа авторов полагает, что
Живой предок
Живой предок «Мы думаем, однако, что можно согласиться с тем, что загадочные тупайи действительно представляют живую модель того раннего предка, который когда-то сделал первые шаги от насекомоядных к приматам и, значит, принадлежит к ряду наших предков» (доктор Курт
Прямой предок — тарпан
Прямой предок — тарпан Бок о бок с домашними в Европе долго еще жили дикие лошади. Римлянин Варрон (II век до нашей эры) и грек Страбон (он жил на сто лет позже Варрона) пишут, что эти животные водились даже в Испании и Альпах. Древнегерманские и скандинавские героические
Глава 6 Разведение генов
Глава 6 Разведение генов Древние греки уподобляли человеческую жизнь тонкой нити, которую прядут, отмеряют и перерезают три богини – Парки. Современные биологи ищут секреты человеческой судьбы в другой нити, вернее, в двух нитях – нитях молекулы ДНК, сплетенных
Глава 6. Разведение генов
Глава 6. Разведение генов …воспитывавшихся в разных приемных семьях. Bouchard et al., 1990.…чем у изучавшихся пар людей, выбранных случайным образом. Строго говоря, корректное сравнение следует проводить с двумя представителями различных пар однояйцевых близнецов, выросших