Глава 12 Происхождение жизни. Возникновение трансляции, репликации, метаболизма и мембран: биологический, геохимический и космологический подходы
Глава 12
Происхождение жизни. Возникновение трансляции, репликации, метаболизма и мембран: биологический, геохимический и космологический подходы
Пер. А. Неизвестного
В предыдущей главе мы обсудили возможные сценарии возникновения клеток и (будем надеяться) достигли определенной степени убедительности, рассмотрев сценарий клеточной эволюции из первичного вирусного мира. Однако эта модель имеет дело с относительно поздними стадиями эволюции, на которых репликация генетического материала и трансляция уже сформировали белковое разнообразие. Ценность этих моделей останется сомнительной, пока мы не разработаем возможного объяснения происхождения фундаментальных процессов передачи информации.
Происхождение жизни — наиболее сложная проблема, стоящая перед эволюционной биологией и, можно утверждать, перед биологией в целом. Несомненно, проблема эта столь сложна, а текущее положение вещей столь трудно, что некоторые исследователи предпочитают отказывать этой проблеме в научности на том основании, что единичные события не подлежат научному исследованию. Такая позиция, однако, является глубоко неудовлетворительной, в особенности из-за того, что, хоть мы и знаем с уверенностью, что жизнь на этой планете возникла лишь однажды (см. гл. 11), у нас нет ни малейшего представления, уникальна ли (или, напротив, обычна) жизнь во Вселенной в целом. Если принимать вопрос происхождения жизни как научный, то нельзя отрицать, что это вопрос огромной значимости, в сравнении с которым прочие биологические проблемы, пожалуй, малосущественны.
Естественно потребовать, чтобы, коли мы начинаем рассуждать о происхождении некоего явления, само явление было определено. В научной и философской истории давалось множество определений жизни[123], и сам этот вопрос отдает эссенциализмом (см. прил. I)[124]. Однако в контексте обсуждения в предыдущих главах прийти к определению того, что следует считать живым, удивительно просто: любой стабильный во времени репликатор является формой жизни. Любая репликаторная система может — и непременно будет — эволюционировать благодаря комбинации дрейфа и естественного отбора (принцип подверженной ошибкам репликации, гл. 2). Не отмеченный явно, но важный аспект такого определения — наличие обратной связи генотип—фенотип, когда некоторые мутации, то есть ошибки репликации, влияют на ее эффективность (см. гл. 2). Такого рода обратная связь вполне вообразима в гипотетическом мире РНК. Во всех известных формах жизни, однако, разделение генотипа и фенотипа более явное: в то время как генотип выражается в молекулах нуклеиновых кислот, фенотип заключается в белковых молекулах, обладающих исключительно исполнительной функцией, но не несущих информационной (матричной)[125] функции.
Следовательно, хотя происхождение трансляции в принципе и не является неотъемлемой частью вопроса о происхождении жизни (поскольку обитатели мира РНК должны считаться полноценными формами жизни), на практике два этих вопроса связаны прочной и, вероятно, неразразрывной связью. В этой главе мы обсудим загадку происхождения репликации и трансляции. Поскольку механизмы трансляции универсально сохраняются, этот вопрос следует считать ключевым в проблеме происхождения жизни.
Вопрос о происхождении жизни по природе своей не может быть только биологическим, поскольку до того, как возникла жизнь (даже в простейшем ее воплощении), существовала «предбиологическая» химия, которая должна рассматриваться с точек зрения химии, геохимии и геофизики. Данные этих областей обширны и сложны и в основном лежат за пределами моей профессиональной компетенции. Поэтому здесь мы приведем лишь краткий обзор, подчеркивающий наиболее важные результаты.
Наконец, не без понятной робости, мы коснемся чрезвычайно общих аспектов вероятности «уникальных событий» в рамках современных космологических теорий. Это рассуждение позволит нам, по крайней мере, выработать определенные идеи касательно распространенности жизни в космосе.
Происхождение репликации и трансляции и мир РНК
Цикл Дарвина—Эйгена
Главной целью разработанной Манфредом Эйгеном теории самореплицирующихся систем было построение простой модели, объясняющей происхождение биологической информации и, следовательно, самой жизни. Теория Эйгена вскрыла существование фундаментального предела, ограничивающего достоверность репликации (порог Эйгена): если произведение частоты ошибок (мутаций) и информационной емкости системы (размер генома) ниже порога Эйгена, происходит стабильное наследование и, следовательно, эволюция; если же эта величина выше порога, то мутационная катастрофа и вымирание неизбежны (Eigen, 1971). Порог Эйгена лежит где-то в интервале от 1 до 10 мутаций на цикл репликации (Tejero et. al., 2011), но, каков бы он ни был, для стабильного поддержания репликации, что является необходимым условием начала биологической эволюции, система должна непрерывно оставаться над этим порогом (см. рис. 12-1а). Само происхождение первых организмов создает по меньшей мере видимость парадокса, поскольку для репликации необходима некоторая минимальная сложность, а репликация с высокой точностью требует кодирования еще большего объема информации (Penny, 2005). В то же время уровень точности репликации в данной точке эволюционной траектории ограничивает объем информации, которая может быть закодирована в геноме. Таким образом, на первый взгляд рост сложности генома представляется невозможным. Однако комбинация естественного отбора и генетического дрейфа превращает этот, казалось бы, порочный круг в (казалось бы) бесконечную спираль возрастающей сложности (цикл Дарвина—Эйгена в терминологии Д. Пенни; Penny, 2005). Даже малые приобретения в точности репликации идут системе на пользу, хотя бы потому, что они увеличивают число жизнеспособных копий генома и тем понижают репродукционные издержки. Сам по себе большой геном является скорее обузой для системы из-за высоких репродукционных издержек. Однако умеренное увеличение генома, такое как дупликация частей генома или рост вследствие рекомбинации, способно закрепляться в малых популяциях. Репликаторы, обладающие достаточно высокой точностью, могут использовать этот случайно закрепленный и изначально бесполезный генетический материал для эволюции новых функций, не срываясь при этом с «обрыва Эйгена» (рис. 12-1б). Среди этих новых, улучшающих приспособленность функций будут и повышающие точность репликации, что позволяет затем увеличить объем кодируемой информации. Таким образом, цикл Дарвина—Эйгена повторяет себя в спиральной прогрессии, приводя к непрерывному увеличению размера генома (рис. 12-1а).
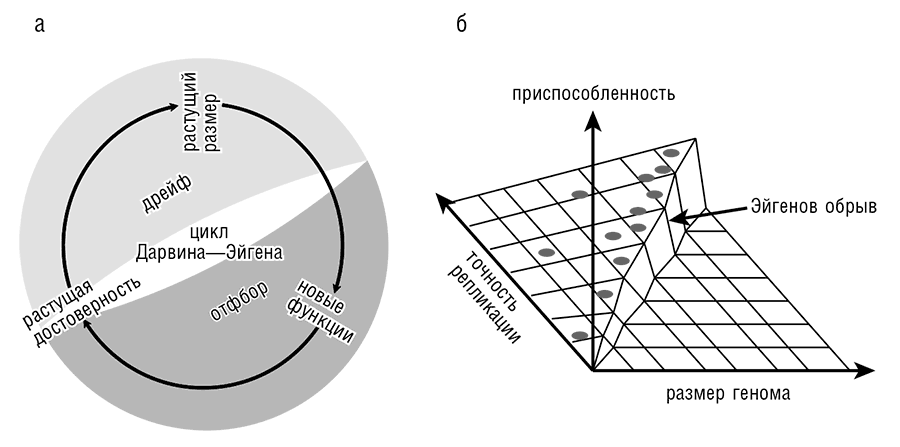
Рис. 12-1. Точность репликации и эволюция: а — цикл Дарвина—Эйгена; б — эволюция и край обрыва Эйгена.
Решающим в изучении происхождения жизни является вопрос о том, как начался цикл Дарвина—Эйгена, то есть как именно была достигнута наименьшая сложность, необходимая для приемлемой репликации. Даже в простейших современных системах, таких как РНК-вирусы, точность репликации в которых составляет всего 10–3 (то есть в среднем одна ошибка на 1000 нуклеотидов), и вироидах, реплицирующихся с наименьшей известной на сего дня среди всех репликонов точностью (около 10–2; Gago et al., 2009), репликация катализируется сложными белковыми полимеразами. Сами эти полимеразы (репликазы) синтезируются в результате трансляции соответствующих мРНК при посредстве чрезвычайно сложного рибосомного аппарата. Отсюда следует драматический парадокс происхождения жизни: для достижения минимальной начальной сложности, необходимой для того, чтобы биологическая система начала движение по Дарвину—Эйгену, эта система должна обладать гораздо большей начальной сложностью. В рамках обычного эволюционного мышления невозможно даже представить решения этой головоломки, поскольку это мышление относится исключительно к системам, уже находящимся на спирали. Таким образом, решение непременно окажется неординарным. В следующих разделах этой главы мы сначала рассмотрим потенциал подхода сверху вниз, то есть основанного на анализе современных генов, для получения указаний на возможное происхождение систем репликаторов. Затем мы обсудим подход снизу вверх.
Изучение эволюции белковых доменов дает аргументы в пользу сложного мира РНК: взгляд сверху вниз
Как уже упоминалось выше, система трансляции — единственный сложный ансамбль генов, сохранившийся во всех современных клеточных формах жизни. Современная трансляционная система, содержащая около 60 универсальных белок-кодирующих генов и 40 генов структурной РНК, представляет собой наилучшим образом сохранившийся остаток LUCA(S) и лучшее свидетельство того, что в какой-то форме LUCA(S) действительно существовал (см. гл. 11). В силу исключительной консервативности системы трансляции анализ ортологических последовательностей дает крайне мало для понимания ее происхождения, которое находится за горизонтом сравнения современных форм. Реконструкция генного состава LUCA(S) указывает на сложную трансляционную систему, включающую по меньшей мере 18 из 20 аминоацил-тРНК-синтетаз (АРСаз), несколько факторов трансляции, не менее 40 рибосомных белков и некоторое число ферментов, модифицирующих рРНК и тРНК. По-видимому, у LUCA(S) ядро системы трансляции было уже полностью сформировано (Anantharaman et al., 2002).
Однако сравнение последовательностей и структур белковых компонентов и РНК внутри самой системы трансляции оказывается информативным благодаря большому числу паралогов среди соответствующих генов. Когда в реконструированном генном наборе LUCA(S) обнаруживается пара паралогичных генов, давшая ей начало дупликация, естественно, относится к более ранней стадии эволюции, и, таким образом, реконструкция последовательности древнейших дупликаций позволяет взглянуть на очень ранние этапы эволюции. История паралогичных АРСаз особенно показательна. АРСазы образуют два класса по 10 специфичностей каждый (то есть каждый класс отвечает за распознавание и активацию 10 аминокислот), с неродственными каталитическими доменами и различными наборами вспомогательных доменов. Каталитические домены АРСаз классов I и II принадлежат, соответственно, к укладкам Россмана и биотин-синтазы[126]. Анализ эволюционной истории этих белковых укладок приводит к существенным выводам о ранней эволюции трансляционных систем, и не только об этом (Aravind et al., 2002). Каталитические домены АРСаз класса I образуют лишь небольшую ветвь эволюционного древа доменов укладки Россмана. Таким образом, появлению общего предка АРСаз предшествовало множество ветвлений эволюционного пути от примитивного древнего домена к состоянию с высоким разнообразием, соответствующему LUCA(S). Существенное разнообразие доменов укладки Россмана возникло еще до серии дупликаций, приведших к возникновению, еще до эпохи LUCA(S), АРСаз различных специфичностей (см. рис. 12-2а). Подобная эволюционная картина обнаруживается и при анализе домена биотин-синтазы, давшего начало АРСазам класса II. Даже при рассмотрении только этих двух укладок становится очевидно, что огромное структурное и функциональное разнообразие белковых доменов возникло еще до того, как появилась полноценная, состоящая из РНК и белков система трансляции современного типа.
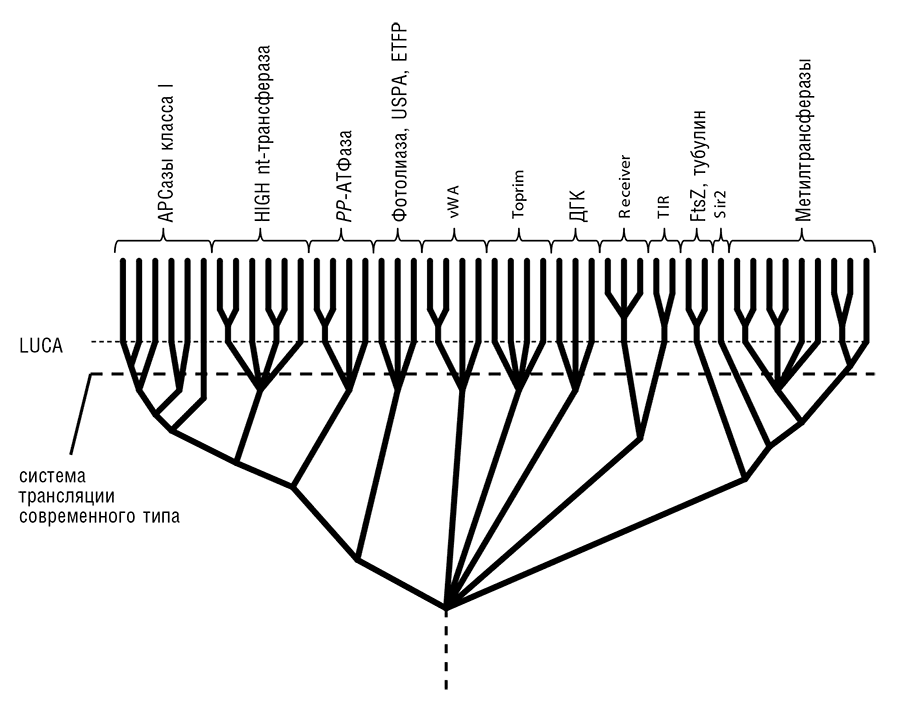
Рис. 12-2а. Разнообразие белковых доменов, кристаллизация системы трансляции и LUCA(S): эволюция нуклеотид-связывающих доменов укладки Россмана. Указаны только достаточно хорошо изученные белки. USPA — универсальный фактор стресса A; ETFP — электронтранспортный флавопротеин; vWA — фактор фон Виллебранда A; Toprim — каталитический домен топоизомераз, праймаз и некоторых нуклеаз; ДГК — дегалогеназа галоидных кислот; Receiver — компонент двухкомпонентной сигнальной системы прокариот; TIR — широко распространенный домен белок-белкового взаимодействия в сигнальных системах прокариот и эукариот; Sir2—деацетилаза белков (в частности, гистонов). Подробное описание см. Aravind et al., 2002 и ссылки в этой статье.
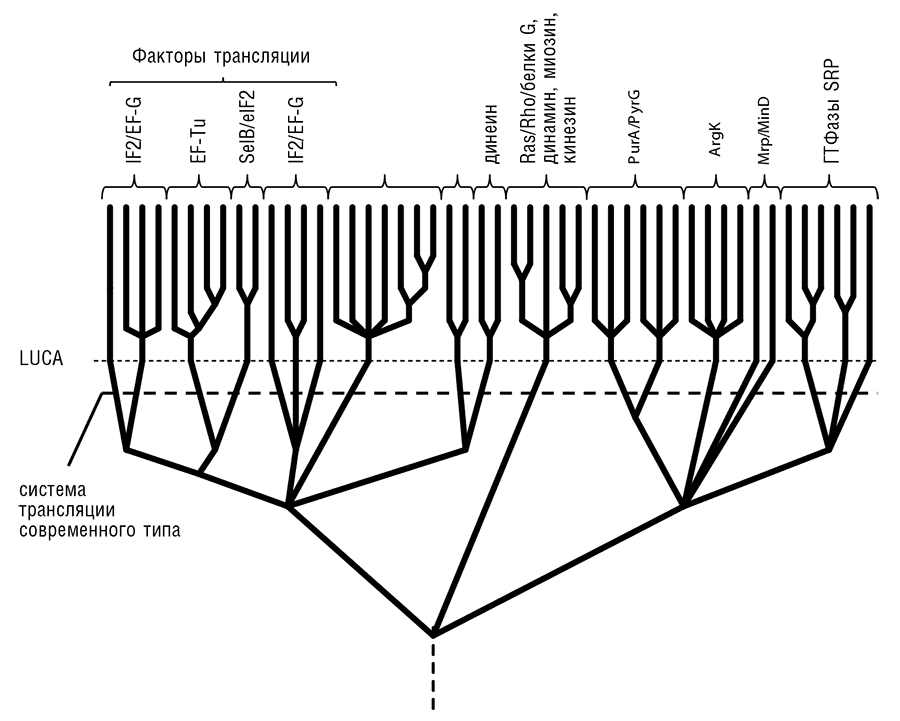
Рис. 12-2б. Эволюция нуклеотид-связывающих доменов ГТФаз и родственных им АТФаз, по данным из Leipe et al., 2002. Указаны только хорошо изученные белки. Динеин, динамин, кинезин и миозин — моторные ГТФазы и АТФазы, ассоциированные с цитоскелетом; Ras/Rho — сигнальные ГТФазы, ассоциированные, в частности, с эндомембранной системой эукариот; G-белки — ассоциированные с мембраной ГТФазы, функционирующие совместно с G-белок-сопряженными рецепторами; PurA и PyrG — ферменты метаболизма нуклеотидов; ArgK, аргинин-киназа, — фермент метаболизма аминокислот; Mrp и MinD — АТФазы, участвующие в клеточном делении прокариот; SRP — частица узнавания сигналов.
Эволюционный анализ обширнейшего класса фосфат-связывающих доменов (известных также как P-петли) ГТФаз, в котором множество трансляционных факторов образует компактные семейства, приводит, в сущности, к тому же результату: в последовательности эволюционных бифуркаций (ветвлений эволюционного древа), представляющей историю ГТФазного домена, трансляционные факторы также возникли сравнительно поздно (см. рис. 12-2а; Leipe et al., 2002). ГТФазы образуют лишь одну из многих больших ветвей эволюционного древа укладки, содержащей P-петлю, которая включает огромное разнообразие белковых доменов, связывающих НТФ (нуклеозидтрифосфаты — чаще всего субстратом является АТФ, гораздо реже ГТФ и изредка — другие НТФ) и расщепляющих ?-?-фосфодиэфирную связь (см. рис. 12-2б). Эта укладка является самым распространенным доменом во всех прокариотах (Wolf et al., 1999b), и во всех реконструкциях генетического разнообразия LUCA(S) выявляется несколько десятков содержащих P-петлю белков. Таким образом, интенсивная эволюция домена, содержащего P-петлю, предшествовала не только LUCA(S), но и, что еще более удивительно, современной системе трансляции. Сама P-петля (известная также под названием мотива Уолкера A[127], рис. 12-3), богатая глицином петля, оборачивающая фосфатный конец НТФ-субстрата, является наиболее консервативным мотивом среди всех белковых последовательностей, несомненно зафиксированным на самых ранних стадиях белковой эволюции (Gorbalenya and Koonin, 1989; Trifonov et al., 2006).
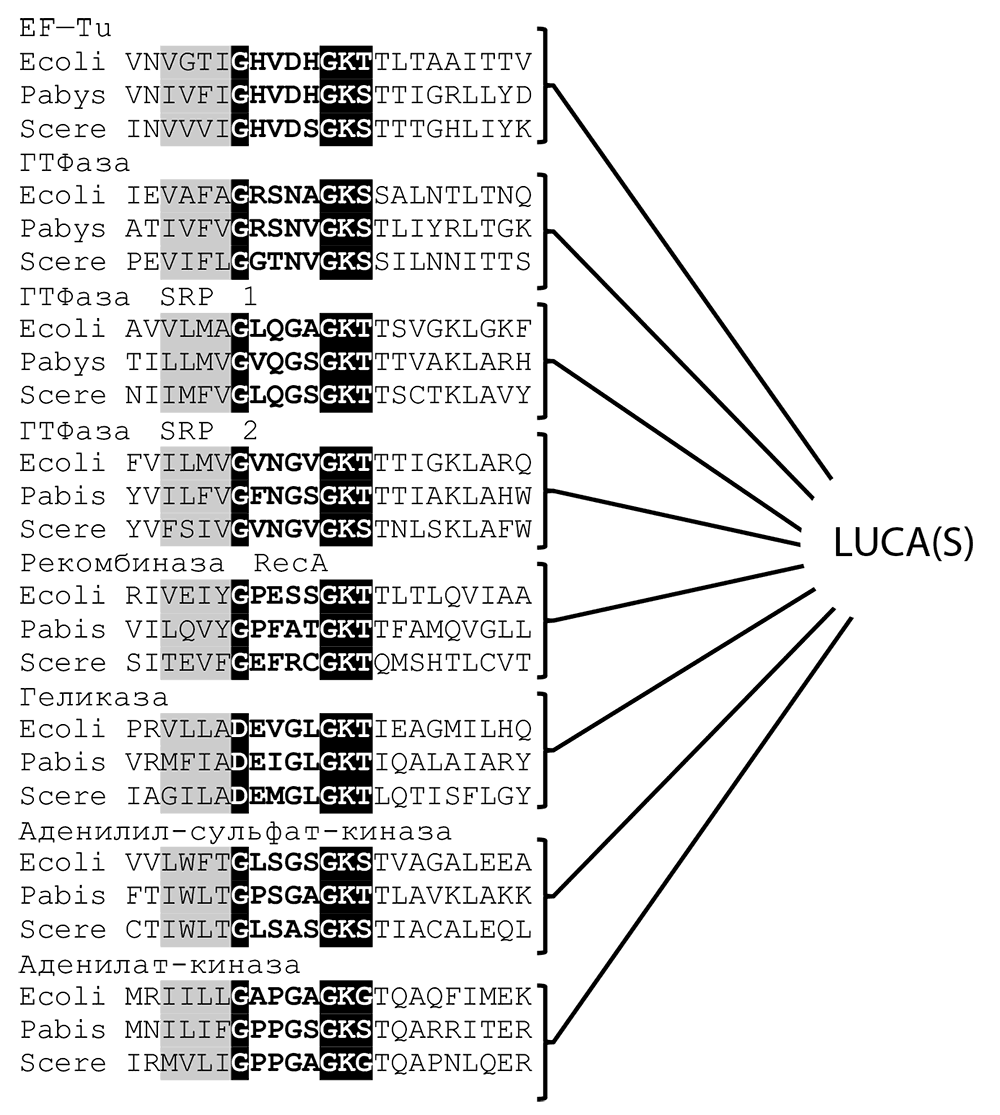
Рис. 12-3. P-петля, древнейший и самый распространенный в белковых последовательностях мотив. На рисунке изображено выравнивание Р-петель восьми древних НТФаз, каждая из которых, по данным эволюционных реконструкций, была представлена в LUCA(S) (Mirkin et al., 2003). Для каждой линии представлены три последовательности: бактерии (Escherichia coli, Ecoli), археи (Pyrococcus abyssi, Pabys) и эукариота (дрожжи Saccharomyces cerevisiae, Scere). Белыми буквами на черном фоне обозначены аминокислотные остатки, напрямую взаимодействующие с фосфатным концом НТФ, а серым фоном — характерная гидрофобная ?-последовательность, предшествующая ФСП. SRP — частица узнавания сигналов.
Таким образом, из сравнительного анализа древних паралогических отношений между белковыми компонентами системы трансляции следует бесспорный, хоть и парадоксальный, вывод: за интересным исключением основных рибосомных белков, все белки, играющие главную роль в современной трансляции, возникли в результате долгой и сложной эволюции различных белковых доменов. Возникает замкнутый круг: для возникновения этих белков требуется точная и эффективная система трансляции. Древняя система трансляции могла быть и не столь совершенной, как современная, но несомненно, что она отличалась от нее не более чем на порядок по точности и скорости, иначе белковая эволюция не стала бы возможной. Однако из всего, что нам известно о современной системе трансляции, такой уровень точности невообразим без сложного и специализированного белкового аппарата.
Итак, система трансляции ярко высвечивает парадокс Дарвина—Эйгена, присущий любому анализу возникновения сложных биологических систем: для работы эффективной и точной системы трансляции современного типа требуется множество различных белков, но для того, чтобы эти белки могли возникнуть, нужна система трансляции почти столь же совершенная, как современная. По-видимому, существует только одно возможное разрешение этого парадокса, а именно через отказ от первой части противопоставления: следует заключить, что трансляционная система, сравнимая с современной по точности и скорости, работала в отсутствие значительного разнообразия белков и, возможно, вообще без белков. Таким образом, основываясь на сравнительном анализе составных частей системы трансляции, мы должны сделать предположение о существовании сложного и разнообразного мира РНК, в котором уже действовала некая разновидность цикла Дарвина—Эйгена.
Это не все, что может нам дать сравнительный анализ: сравнение самих РНК также вскрывает важные явления и загадывает поразительные загадки. Так, анализ большой рибосомной субъединицы РНК 23S выявил иерархический сценарий последовательности дупликаций, способной привести от простой древней шпильки РНК к современной, сложной, универсально консервативной структуре рРНК (Bokov and Steinberg, 2009).
Консерватизм структуры определенных элементов последовательностей (таких как псевдоуридиновая петля) и даже сайтов модификации тРНК всех специфичностей (и, разумеется, всех видов) не оставляет сомнений в том, что все они эволюционировали от общего предка (Eigen et al., 1989). Отсюда, при сравнении современных последовательностей и структур, возникает второй парадокс эволюции трансляции. Если на некоторой стадии эволюции существовал единственный предок тРНК всех специфичностей, то как могла подобная трансляционная система действовать, точнее, как она могла обеспечивать специфичность кодирования аминокислотных последовательностей нуклеотидными? Если же на этом этапе трансляционной системы еще не существовало, то что привело к эволюции специфичной к аминокислотам тРНК?
Мы обратимся к этим и смежным вопросам ниже, но сначала следует хотя бы кратко рассмотреть центральное понятие в области исследования происхождения жизни: мир РНК.
Рибозимы и мир РНК
Центральная догма молекулярной биологии (Crick, 1970) постулирует, что информация передается от ДНК к белку посредством РНК (Фрэнсис Крик дополнил ее возможностью обратной передачи информации от РНК к ДНК после открытия обратной транскрипции):
ДНК?РНК ? белок
Очевидно, размышляя о происхождении первых живых форм, мы оказываемся перед вопросом типа «курица или яйцо»: что появилось первым — ДНК или белок? ген или его продукт? В такой постановке вопрос, естественно, неразрешим из-за парадокса Дарвина—Эйгена: чтобы реплицировать и транскрибировать ДНК, нужны функционально активные белки, но производство этих белков, в свою очередь, требует точной репликации, транскрипции и трансляции нуклеиновых кислот. Если строго следовать центральной догме, невозможно вообразить, каким мог быть начальный материал для цикла Дарвина—Эйгена. Даже вынесение ДНК из триады и постулат о том, что изначальный генетический материал состоял только из РНК (и сведение, таким образом, триады к диаде), хоть и является ценной идеей (см. следующую главу), но не помогает разрешить парадокс. Чтобы эволюция в сторону усложнения началась, система должна каким-то образом вступить в цикл Дарвина—Эйгена до того, как установится связь между РНК-матрицами (информационной частью системы) и белком (исполнительной частью).
Блестяще остроумное и, по-видимому, единственное решение было предложено независимо К. Вёзе, Ф. Криком и Л. Оргелом в 1967–1968 годах (Crick, 1968; Orgel, 1968; Woese, 1967): ни курица, ни яйцо, но то, что между ними, — одна РНК. Уникальным свойством РНК, делающим ее вероятным и, скорее всего, наилучшим кандидатом на главную роль в древнейшей репликационной системе, является ее способность сочетать в себе информационные и каталитические функции. Было очень заманчиво предположить, что первые репликаторные системы — первые формы жизни — состояли только из молекул РНК, действующих и как носители информации (геномы и гены), и как катализаторы различных реакций, включая в том числе синтез их самих и их предшественников. Это смелое предположение получило блестящее подтверждение с открытием и последующим изучением рибозимов (ферментов РНК): Томас Чек и коллеги в 1982 году открыли автокаталитическое расщепление интрона рРНК инфузории Tetrahymena, а в 1983 году Сидней Альтман и коллеги показали, что РНКаза P является рибозимом. Следом за этими эпохальными открытиями изучение рибозимов выросло в огромную самостоятельную и растущую область исследований (Cech, 2002; Doudna and Cech, 2002; Fedor and Williamson, 2005).
Открытие рибозимов сделало чрезвычайно привлекательной идею о том, что первые репликаторы целиком состояли из молекул РНК, катализировавших свою собственную репликацию. В 1986 году Уолтер Гилберт ввел термин «мир РНК» для обозначения этой гипотетической стадии эволюции жизни, и гипотеза мира РНК завоевала широкую популярность, став ведущей и самой популярной гипотезой о ранних стадиях эволюции. (Различные аспекты гипотезы мира РНК и подтверждающие ее данные основательно рассмотрены в одноименной книге, вышедшей в 2010 г. в 4-м издании: Atkins et al., 2010.)
Популярность гипотезы мира РНК еще более стимулировала исследования рибозимов, нацеленные на поиск разнообразных каталитических активностей РНК — в первую очередь, пожалуй, активности РНК-репликазы. Заслуживает внимания тот факт, что главным экспериментальным подходом к получению рибозимов с желаемой активностью является отбор in vitro, который, во всяком случае концептуально, воспроизводит дарвиновскую эволюцию, происходившую, как полагают, в первичном мире РНК (Ellington et al., 2009). Эксперименты по направленному отбору строятся таким образом, чтобы в случайной популяции последовательностей РНК амплифицировались только те из них, которые катализируют заданную реакцию. В многостадийных экспериментах по отбору были получены рибозимы, катализирующие весьма обширное разнообразие реакций.
В табл. 12-1 перечислены некоторые из наиболее биологически значимых реакций, катализируемых рибозимами. Примечательно, что все три элементарные реакции, необходимые для трансляции, — (1) активация аминокислот через образование аминоацил-АМФ, (2) аминоацилирование (т)РНК и (3) транспептидация (реакция пептидилтрансферазы) — успешно моделируются с помощью рибозимов. Реакция авто-аминоацилирования, принципиально важная для возникновения первичных РНК-адаптеров (аналог АРСазы в мире РНК), была отобрана in vitro с относительной легкостью. Поразительно, что лучшие из полученных рибозимов катализируют эту реакцию с большей скоростью и специфичностью, чем соответствующие АРСазы, и что были отобраны очень короткие олигонуклеотиды, обладающие этой активностью (Turk et al., 2010).
Таблица 12-1
Некоторые из функций рибозимов, потенциально важные для биологической эволюции
[Реакция] / Свойства рибозима
[Синтез аминоацил-аденилатов] Низкоэффективное образование лейцил- и фенилаланил-аденилатов наблюдалось со 114-нуклеотидным рибозимом.
[Авто-аминоацилирование] Авто-аминоацилирование 43-нуклеотидного рибозима фенилаланином с Фен-АТФ в качестве субстрата. 77-нуклеотидная РНК катализирует ту же реакцию с более высокими избирательностью и скоростью авто-аминоацилирования, чем Фен-РСаза.
[3’-аминоацилирование РНК in-trans] Минимальный рибозим, способный к не избирательному аминоацилированию тРНК, состоит из 29 нуклеотидов. Был получен 45-нуклеотидный рибозим с широким спектром действия на разнообразные тРНК и аминокислоты. Сообщается также о высокоизбирательном и эффективном аминоацилировании более длинных рибозимов.
[Рибозимы-пептидилтрансферазы, отобранные in vitro] Отобрано несколько рибозимов, образующих дипептиды из аминокислоты, связанной эфирной связью с АМФ, или олигонуклеотида и свободной аминокислоты. Обнаружено структурное сходство между рибозимами пептид илтрансферазы и соответствующим участком 23S рРНК. Описано образование Фен-Фен-тРНК 29-нуклеотидным аминоацилирующим рибозимом.
[Рибосомная пептидилтрансфераза] В больших рибосомных субъединицах центр пептидилтрансферазы картируется в участке, содержащем только РНК, подводя к заключению о том, что реакция катализируется рибозимом; идентификация активных остатков, однако, пока не удается.
[РНК-лигаза] Многие рибозимы способны лигировать молекулы РНК, прикрепленные рядом к молекуле рибозима при помощи спаривания оснований.
[РНК-полимераза] Из числа РНК-лигируюших рибозимов были отобраны способные к удлинению предварительно отожженного праймера на 10–14 нуклеотидов.
Заимствовано с дополнениями из Wolf and Koonin, 2007.
По понятным причинам, основные усилия сосредоточились на подтверждении полимеризации нуклеотидов и, в конечном счете, репликации РНК, катализируемой рибозимами, то есть ключевых процессов в гипотетическом первичном мире РНК. Результаты экспериментов, нацеленных на создание рибозимов-репликаз, до сих пор неоднозначны (Cheng and Unrau, 2010). Получены рибозимы, способные достраивать праймер после его гибридизации с матрицей (Johnston et al., 2001); на начальном этапе такие рибозимы могли действовать только путем спаривания части молекулы рибозима с матрицей, но затем были получены, путем дополнительного отбора, и общие рибозимы-полимеразы данного класса (Lincoln and Joyce, 2009). Результаты последнего прорыва в области рибозимов-полимераз были опубликованы в то время, когда окончательно редактировалась настоящая глава: рибозим-эндонуклеаза получена с использованием рибозима-полимеразы, в свою очередь построенной рекомбинацией двух уже существующих рибозимов, что в принципе представляет собой правдоподобный путь добиологической эволюции (Wochner et al., 2011). Невзирая на серьезные успехи, полученные до сих пор рибозимы-полимеразы все еще весьма далеки от достаточно точных (в смысле порога Эйгена) процессивных репликаз, способных катализировать репликацию экзогенных матриц и самих себя. Ферменты с такими свойствами, по всей видимости, являются conditio sine qua non для развития гипотетического мира РНК. Кроме того, даже имеющиеся рибозимы с ограниченными способностями РНК-полимераз довольно сложны: их молекулы состоят из приблизительно 200 нуклеотидов, и эволюция таких молекул в добиологических условиях была бы нетривиальной.
Концепция мира РНК опирается не только на каталитические способности рибозимов. Процессы мира РНК и по сей день просматриваются в живых формах, пусть и многократно затмеваемые разнообразием белков с их каталитическими и структурными функциями (Doudna and Cech, 2002). Реакции, катализируемые рибозимами, пусть малочисленные и гораздо менее разнообразные, чем катализируемые белковыми ферментами, имеют важнейшее значение в современных клетках. Первейшим примером естественных рибозимов является сама рибосома, где ключевая пептидилтрансферазная реакция катализируется рРНК большой субъединицы без непосредственного участия белков (Beringer and Rodnina, 2007)[128]. В вездесущем ферменте процессинга тРНК, РНКазе P, собственно катализатором служит молекула РНК, в то время как белковые субъединицы играют роль кофакторов, стабилизирующих каталитическую РНК и способствующих реакции (McClain et al., 2010). Далее, самосплайсирующиеся интроны групп I и II, широко распространенные у бактерий и в органеллах растений, грибов и простейших, являются рибозимами, катализирующими свое собственное вырезание из РНК-транскриптов, часто при помощи особых белков, именуемых матуразами (см. также гл. 7). Практически не подлежит сомнению, что бесчисленное множество эукариотических сплайсосомных интронов, а также малые ядерные (мя)РНК, составляющие активные элементы эукариотических сплайсосом, произошли от интронов группы II (см. гл. 7). Таким образом, сплайсинг, вездесущий процесс в эукариотических клетках, основан на рибозимной каталитической реакции.
В мельчайших из известных инфекционных агентов, вироидах, катализируемые рибозимами реакции непосредственно участвуют в репликации: хотя полимеризация нуклеотидов и катализируется белковой полимеразой, процессинг промежуточных продуктов репликации с образованиме зрелых геномов катализируется рибозимом, содержащимся в самой молекуле РНК вироида (Flores et al., 2004). Существование и центральное значение в современных клетках этих (и, вероятно, других, все еще неоткрытых) РНК-катализируемых реакций предполагает большую роль РНК-катализаторов в начале эволюции жизни. Все эти свидетельства, конечно, далеки от доказательства реальности древнего мира РНК, как он был определен ранее — сообщество разнообразных РНК, обладающих разнообразными каталитическими свойствами и реплицируемых рибозимами-полимеразами. Тем не менее свойства современных РНК, в первую очередь рибозимная активность, полностью совместимы с таким эволюционным этапом и значительно увеличивают его привлекательность. В частности, тот основополагающий факт, что пептидилтрансферазная реакция в рибосоме катализируется рибозимом, наводит на мысль о том, что система трансляции возникла как рибозимная машина.
Таким образом, три независимые группы свидетельств сходятся в поддержку важнейшей роли РНК — а именно РНК-катализа — на самых ранних этапах истории жизни и совместимы с реальностью сложного древнего мира РНК, который Вёзе, Крик и Оргел постулировали вначале на чисто логических основаниях.
1. Сравнительный анализ белковых компонентов системы трансляции и их гомологов, выполняющих другие функции, наводит на мысль о том, что широкое разнообразие белкового мира сформировалось, когда система трансляции состояла в основном из РНК.
2. В современных клетках действует несколько классов рибозимов, и их свойства совместимы с гипотезой о том, что они являются реликтами первичного мира РНК.
3. Хотя рибозимы и менее универсальны, чем белковые ферменты, и обычно значительно уступают им в каталитической активности, они, как было показано в экспериментах по отбору, способны катализировать значительное разнообразие реакций, включая и те, что играют центральную роль в эволюции трансляции (см. табл. 12-1).
Невзирая на все эти аргументы в ее поддержку, гипотеза мира РНК сталкивается с серьезными трудностями. Во-первых, несмотря на все приложенные усилия, отобранные in vitro рибозимы оказываются (относительно) слабыми катализаторами большинства реакций; отсутствие эффективных процессивных рибозимов-полимераз представляется особенно тяжелой проблемой, но имеется также и серьезная нехватка других видов активности, в частности необходимых для синтеза нуклеотидов. Нужно признать, что было бы нереалистичным ожидать от экспериментов по эволюции рибозимов in vitro легкого воспроизведения фактической сложности изначального мира РНК. Хотя эти эксперименты и ставят на службу мощь отбора, они, очевидно, выполняются в совершенно другом временном масштабе и в условиях, неспособных точно воспроизвести (неизвестные) условия в начале жизни (мы обсудим потенциальные экологические ниши для возникновения жизни ниже в этой главе).
Исследование Э. Сатмари и сотрудников дает количественную оценку сложности, которая может быть достигнута в мире РНК, и точности репликации, необходимой для достижения этого уровня сложности (Kun et al., 2005). Оценка, основанная на функциональной устойчивости к мутациям хорошо известных рибозимов, показывает, что при частоте ошибок 10–3 на нуклеотид за цикл репликазы (это примерно соответствует точности РНК-зависимой РНК-полимеразы современных вирусов) РНК-«организм», состоящий из примерно сотни «генов» размером с тРНК (80 нуклеотидов), будет устойчивым. Такой уровень точности всего лишь на порядок выше, чем у самых точных рибозимов-полимераз, полученных отбором in vitro. Данную величину можно положить приближенной верхней границей сложности ансамблей совместно развивающихся «эгоистичных кооператоров», которые могли представлять собой «организмы» мира РНК.
Даже в лучшем случае мир РНК вряд ли обладал потенциалом эволюции дальше чрезвычайно простых «организмов». Для достижения большей сложности потребовались изобретение трансляции и «белковый прорыв» (перенос основной каталитической активности на белки). Однако силы отбора, лежащие в основе возникновения системы трансляции в мире РНК, остаются неясными, и реконструкция пути к трансляции крайне сложна. Это отсутствие ясности в отношении непрерывности эволюции от мира РНК к РНК-белковому миру является второй по значимости проблемой гипотезы мира РНК, возможно даже более существенной, чем ограниченный каталитический арсенал и (как правило) низкая эффективность рибозимов. Далее мы обсудим возможные пути выхода из этой ситуации.
Природа и происхождение генетического кода
Природа и происхождение значения кодонов универсального генетического кода имеют решающее значение для понимания того, как могла возникнуть трансляция. Эволюция кода остро интересовала исследователей еще до того, как код был полностью расшифрован, и уже самые ранние работы по этой теме отчетливо различали три (возможно, и не взаимоисключающие) эволюционных модели: (1) стерическая комплементарность, обеспечивающая специфическое взаимодействие между аминокислотами и соответствующими им кодонными или антикодонными триплетами нуклеотидов, (2) «застывшая случайность», то есть закрепление случайного кода, который стало практически невозможно существенно изменить позже, и (3) адаптивная эволюция кода, начавшаяся с первоначально случайного соответствия кодонов аминокислотам (Crick, 1968).
Структура кода явственно неслучайна: кодоны родственных аминокислот в основном смежны в кодовой таблице, что обусловливает высокую (хотя и не наивысшую возможную) устойчивость кода к мутациям и ошибкам трансляции, как впервые отметил Вёзе (Woese, 1967), а С. Фриленд и Л. Херст впоследствии показали количественно (Freeland and Hurst, 1998). Высокая надежность кода опровергает сценарий «застывшей случайности» в его крайней форме (случайная привязка кодонов к аминокислотам без последующей эволюции), однако и стереохимическая модель, и модель отбора, и их сочетание, и «застывшая случайность» с последующей адаптацией способны в принципе объяснить наблюдаемые свойства кода (Koonin and Novozhilov, 2009).
Положение осложняется тем, что неизвестно, существует ли стереохимическое соответствие между аминокислотами и соответствующими триплетами нуклеотидов (кодонами). Ответ на этот кажущийся простым вопрос оказывается на удивление трудноуловимым. Ранние попытки обнаружить избирательность взаимодействия (поли)аминокислот и полинуклеотидов были безрезультатны, что говорит о том, что если специфическое сродство и существует, то отнюдь не строгое, и взаимодействие, вероятно, слабо и зависимо от внешних факторов. Хотя и имеются некоторые сообщения о неслучайных взаимодействиях аминокислот с олигонуклеотидами, но в целом попытки продемонстрировать такое взаимодействие напрямую оказались неудачными (Saxinger and Ponnamperuma, 1974).
Интерес к стереохимической гипотезе возродился с появлением метода усиления отбора (SELEX) для выделения олигонуклеотидов (аптамеров), избирательно связывающихся с аминокислотами (Yarus et al., 2005, 2009). Для восьми аминокислот с большими боковыми цепями были выделены аптамеры, значительно обогащенные триплетами нуклеотидов, идентичными либо кодонам, либо антикодонам соответствующей аминокислоты. Результаты этих экспериментов, правда, несколько неубедительны, так как для одних аминокислот аптамеры содержат в основном кодоны, тогда как для других — в основном антикодоны. Рассматриваемые в совокупности, данные по сродству аптамеров к аминокислотам считаются серьезным аргументом в поддержку стереохимической гипотезы происхождения кода, однако реальная надежность и значимость этих результатов остаются под большим вопросом.
Наличие как кодонов, так и антикодонов в аптамерах для нескольких аминокислот затруднительно интерпретировать в терминах стереохимической комплементарности. Кроме того, аминокислоты, для аптамеров которых получены подробные данные, имеют сложные боковые цепи (которые, предположительно, необходимы для избирательного взаимодействия с аптамерами) и, вероятно, являются поздними добавлениями к генетическому коду (Trifonov, 2004). До тех пор, пока не будут получены аналогичные результаты для простых, предположительно древних аминокислот, эксперименты по отбору аптамеров затруднительно рассматривать как убедительный аргумент в пользу стереохимической гипотезы происхождения кода.
Итак, ключевой вопрос о том, играло ли роль в происхождении кода прямое взаимодействие между аминокислотами и специфическими нуклеотидными триплетами, все еще ждет ответа. В следующем разделе, при обсуждении происхождения трансляции, мы будем максимально объективны, рассматривая происхождение кода либо через избирательное взаимодействие между аминокислотами и соответствующими нуклеотидными триплетами, либо через случайное соответствие между аминокислотами и кодонами, то есть из «застывшей случайности».
Происхождение трансляции: ключевые идеи и модели[129]
За 40 лет, прошедших со времени открытия механизма трансляции и расшифровки генетического кода, были предложены многочисленные — неизбежно спекулятивные, иногда надуманные и часто весьма остроумные теоретические модели происхождения и эволюции различных компонентов трансляционной системы и разных аспектов процесса трансляции. Представить здесь тщательный критический анализ этих моделей нереально. Вместо этого мы рассмотрим несколько центральных идей, имеющих прямое отношение к происхождению трансляции, а затем обсудим несколько более подробно единственные два известных мне убедительных сценария.
Главное общее положение эволюции трансляции состоит в том, что отбор на синтез белков не мог быть основной движущей силой эволюции трансляционной системы. Чтобы эта сложная система эволюционировала дарвиновским путем, необходимы многочисленные шаги, а белки появляются лишь на последних из них; до этого момента организм «не знает», какие эволюционные преимущества может нести с собой использование белков. Как отмечалось в главе 9, существует много ситуаций, в которых эволюция как будто обладает возможностью некоего предвидения; эти случаи, однако, основаны фактически на экстраполяции, тогда как в случае трансляции нет еще ничего, из чего можно были бы экстраполировать.
Возникновение сложного механизма трансляции путем случайного дрейфа также не реалистично — во всяком случае, в рамках стандартных представлений эволюционной биологии (см. обсуждение в конце этой главы). Таким образом, единственный возможный путь для появления трансляции, по-видимому, экзаптация: промежуточные этапы эволюции трансляционной системы должны быть отобраны для иных функций, нежели синтез белка. Различные сценарии возникновения трансляции исходят из различных предположений о природе экзаптируемых функций.
Простая и потенциально плодотворная идея состоит в том, что в мире РНК аминокислоты и пептиды функционировали в качестве кофакторов рибозимов. Сатмари первым разработал гипотезу, основанную на этом предположении, и предложил, что «кодирующие коферментные олигонуклеотиды» (ККО; олигонуклеотиды-рибозимы с различными каталитическими активностями, использующие аминокислоты в качестве кофакторов) могли быть эволюционными предшественниками тРНК (Szathmary, 1993, 1999). Предполагается, что ККО собирались с участием содержащихся в них протоантикодонов на эволюционных предшественниках мРНК, однако детали этой стадии остаются неясными. Гипотеза ККО связывается с представлением о том, что тРНК возникла в ходе эволюции в результате двух последовательных дупликаций связывающих аминокислоты шпилек. Вариант гипотезы ККО, предложенный Р. Найтом и Л. Ландвебер, включает эволюцию аминоацилирующих рибозимов (возможность, хорошо подтверждаемая экспериментальными данными, см. табл. 12-1) и возникновение безматричного, опосредованного рибозимами синтеза пептидов в качестве промежуточного этапа эволюции трансляции (Knight and Landweber, 2000).
Майкл Ярус (Yarus, 1998) предложил модель прямого связывания РНК в качестве альтернативы ККО как сценария происхождения трансляции. Согласно этой модели, изначальной формой взаимодействия аминокислот и прото-тРНК было непосредственное связывание, предположительно через кодонные триплеты. Затем непосредственное связывание вытеснилось адапторным механизмом, вероятно, при участии аминоацилирующих рибозимов, как в варианте ККО Найта—Ландвебер.
Взяв за основу гипотезу ККО, мы с Юрием Вольфом разработали обобщенную, но детализированную модель возникновения трансляционной системы в мире РНК (Wolf and Koonin, 2007). Эта модель включает в себя как дарвиновский отбор, так и аспекты конструктивной нейтральной эволюции (см. гл. 8), наряду с экзаптацией и субфункционализацией.
Отправной точкой всех сценариев происхождения трансляции является реплицирующийся ансамбль эгоистичных кооператоров, состоящий из молекул РНК с различными рибозимными активностями и существующий в сети неорганических ячеек (см. дальнейшее обсуждение в следующем разделе). Эти рибозимы исполняют, в числе прочих функций, и функцию репликазы; вероятно, представлены и другие функции, такие, например, как синтез предшественников РНК. Наш эволюционный сценарий включает в себя следующие этапы (см. рис. 12-4).

Рис. 12-4. Концептуальный сценарий происхождения трансляционной системы посредством экзаптации и субфункционализации. Шаги модели, описанные в тексте, обозначены цифрами в скобках.
1. Рибозим R является частью ансамбля эгоистичных кооператоров в ячейке. Этот рибозим достаточно сложен для катализа реакции (X ? Y), скорость которой влияет на приспособленность ансамбля, и имеет определенное число позиций, способных к эволюции, так что возможна эволюция новых функций. Две или более абиогенных аминокислоты, присутствующие в ячейке, связываются с R. Избирательное связывание аминокислот обеспечивается активным центром, случайно присутствующим в R. Участие стереохимического протокода (кодон/антикодон) на данном этапе возможно, но не повлияет на ситуацию существенным образом. Присоединенные аминокислоты стимулирует реакцию X ? Y, катализируемую R. In vitro были получены рибозимы, сильно стимулируемые пептидами что дает экспериментальное обоснование этому принципиальному шагу (Robertson et al., 2004). В контексте эгоистично-кооперативной эволюции (см. гл. 11) естественный отбор будет отбирать аминокислоты, стимулируемые R, приводя к постепенному совершенствованию пространственного выравнивания аминокислот на R и отбору последовательности и структуры оптимальных для связывания аминокислот.
2. R приобретает дополнительную активность лигазы пептидной связи, формируя олигопептид P из соседних аминокислот, связанных с R. Отбором in vitro были получены рибозимы с высокой активностью пептидной лигазы, хотя и с низкой избирательностью. По-видимому, рибозимы этого класса способны синтезировать только короткие пептиды, состоящие из, самое большее, четырех или пяти аминокислот. Селекционным преимуществом этого новоприобретения будет повышение стабильности реактивного комплекса, приводящее к дальнейшему усилению реакции X ? Y. Естественно задаться вопросом, откуда на этом шаге берется энергия, необходимая для формирования пептидной связи. В экспериментально описанных рибозимных пептидных лигазах один из субстратов является активированным производным (аминоацил-аденилат), так что используется энергия эфирной связи. Это напоминает современную трансляцию, в которой АРСазы используют аминоацил-аденилаты для аминоацилирования специфической тРНК, а высокоэнергетичная эфирная связь аминоацил-тРНК используется для транспептидации. Гипотетические древнейшие пептид-лигазы, возможно, действовали таким же образом, используя аминоацил-аденилаты или другие активированные производные аминокислот, произведенные другими рибозимами. И действительно, были получены рибозимы, катализирующие каждую из этих реакций, от аденилирования аминокислот до синтеза пептидов (см. табл. 12-1). Эти рибозимы, несомненно, зависят от энергии фосфодиэфирной связи в АТФ или иной формы энергии.
3. Спонтанная диссоциация или распад R высвобождает пептид P обратно в ячейку. Если P обладает неспецифической способностью стимулировать и (или) стабилизировать рибозимы, он может быть захвачен другим рибозимом E, катализирующим другую реакцию (U ? V). Интересным примером мог бы быть пептид, содержащий пару отрицательно заряженных аминокислот и образующий комплекс с двухвалентным катионом, аналогично разнообразным, неродственным современным ферментам метаболизма нуклеиновых кислот (полимеразы, нуклеазы, лигазы, топоизомеразы, и др.). Если P повышает каталитическую активность E, он снова увеличивает приспособленность всего ансамбля.
4. В то время как активность E по-прежнему зависит от наличия P, копия R (RL) может потерять исходную функцию катализа X ? Y при сопутствующем усилении функции аминокислотной лигазы, в то время как другая копия (R0) сохраняет исходную функцию, все еще усиливаемую пептидом Р. Заметим, что это типичная субфункционализация, основной путь эволюции дуплицированных генов в современных геномах (см. гл. 8). Субфункционализация, возможно, была важна уже в мире РНК, когда выгода усиленного катализа R0 и Е перевешивала увеличение затрат на репликацию.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
VI. Возникновение жизни на Земле
VI. Возникновение жизни на Земле Из опытов Спалланцани и Пастера мы уже знаем, что при высокой температуре жизнь прекращается. Большинство организмов погибает уже при 70–80 градусах тепла. Значит, для их жизни требуются определенные условия температуры. Требуются для
ВОЗНИКНОВЕНИЕ ЖИЗНИ
ВОЗНИКНОВЕНИЕ ЖИЗНИ Происхождение жизни, ее сущность — одна из наиболее трудных загадок науки, ибо жизнь — это самое сложное из известных нам явлений природы. Никто не видел и не наблюдал ее возникновения; более того, в природе не сохранилось никаких прямых или косвенных
Глава VI Этнология, происхождение и история человеческой половой жизни до брака
Глава VI Этнология, происхождение и история человеческой половой жизни до брака Самым важным, как мы видели, при изучении полового вопроса является умение оставаться в пределах объективности, избегая также сентиментального многословия, как эротизма. Но в истории половой
Глава 1. Происхождение жизни
Глава 1. Происхождение жизни Вопрос о происхождении жизни волнует всех, и очень жаль, что он пока еще далек от разрешения. Основная сложность тут в том, что путь от неорганических молекул к первой живой клетке был долгим и трудным. За один шаг такие превращения не
ГЛАВА 4 Происхождение жизни: абиогенез и панспермия. Гиперцикл. Геохимический подход к проблеме
ГЛАВА 4 Происхождение жизни: абиогенез и панспермия. Гиперцикл. Геохимический подход к проблеме Рассмотрев вопросы, связанные с эволюцией самой Земли, мы приступаем теперь к изучению эволюции жизни на ней. Сразу оговорюсь: я не собираюсь ни углубляться в дебри
ДОПОЛНЕНИЕ К ГЛАВЕ 4 Термодинамические подходы к сущности жизни. Второе начало термодинамики, энтропия и диссипативные структуры
ДОПОЛНЕНИЕ К ГЛАВЕ 4 Термодинамические подходы к сущности жизни. Второе начало термодинамики, энтропия и диссипативные структуры Нам придется начать издалека. В 1847 году Г. Гельмгольц сформулировал закон сохранения энергии (ЗСЭ). Следует помнить, что ЗСЭ является всего
ГЛАВА 5 Ранний докембрий: древнейшие следы жизни на Земле. Маты и строматолиты. Прокариотный мир и возникновение эукариотности
ГЛАВА 5 Ранний докембрий: древнейшие следы жизни на Земле. Маты и строматолиты. Прокариотный мир и возникновение эукариотности В «Происхождении видов» Ч. Дарвин честно и четко сформулировал вопросы, на которые его теория не давала (при тогдашнем уровне знаний)
Глава 27. Регуляция и взаимосвязь метаболизма
Глава 27. Регуляция и взаимосвязь метаболизма Для нормального функционирования организма должна осуществляться точная регуляция потока метаболитов по анаболическим и катаболическим путям. Все сопутствующие химические процессы должны протекать со скоростями,
Глава 2. Возникновение жизни: самозарождение и панспермия
Глава 2. Возникновение жизни: самозарождение и панспермия Трудно создать хорошую теорию, теория должна быть разумной, а факты не всегда таковы. Джордж У. Бидл, генетик, лауреат Нобелевской премии 1958 г. в области физиологии и медицины Физик Филипп Моррисон как-то заметил,
Глава 3. Происхождение жизни: химическая эволюция
Глава 3. Происхождение жизни: химическая эволюция Ничтожное ничто — начало всех начал. Теодор Рётке, "Вожделение" Теория химической эволюции — современная теория происхождения жизни — также опирается на идею самозарождения. Однако в основе ее лежит не внезапное (de novo)
Глава 1. Происхождение жизни
Глава 1. Происхождение жизни Планета бешено вращалась. Ночь и день сменяли друг друга с головокружительной быстротой: день длился всего пять-шесть часов. Тяжелая Луна угрожающе висела в небе (гораздо ближе, чем сегодня), отчего казалась крупнее. Звезды выглядывали редко,
5.1. Современные подходы к построению дерева жизни
5.1. Современные подходы к построению дерева жизни До 60-х годов прошлого века степень родства между видами определяли исключительно по анатомическим, морфологическим и поведенческим признакам. Принадлежность животных, как существующих, так и вымерших, тому или иному
4.1. Образование мембран – основа начала жизни
4.1. Образование мембран – основа начала жизни Рассматривая гигантское многообразие современных живых организмов, можно прийти к выводу, что существовало множество путей развития, берущих начало от реликтовых форм жизни. На самом деле исследования молекулярной эволюции
1.8. Происхождение и эволюция эндо- и экзотрофии Трофика и происхождение жизни
1.8. Происхождение и эволюция эндо- и экзотрофии Трофика и происхождение жизни В свете современных знаний ясно, что механизмы эндотрофии и экзотрофии родственны, а не противоположны, как представлялось ранее, когда экзотрофию рассматривали в качестве гетеротрофии, а
1.8. Происхождение и эволюция эндо- и экзотрофии Трофика и происхождение жизни
1.8. Происхождение и эволюция эндо- и экзотрофии Трофика и происхождение жизни В свете современных знаний ясно, что механизмы эндотрофии и экзотрофии родственны, а не противоположны, как представлялось ранее, когда экзотрофию рассматривали в качестве гетеротрофии, а