Пути обмена аминокислот в тканях
Пути обмена аминокислот в тканях
Аминокислоты – это бифункциональные соединения, содержащие аминную и карбоксильную группу. Реакции по этим группам являются общими для различных аминокислот.
К ним относят:
1. по аминной группе – реакции дезаминирования и трансаминирования;
2. по карбоксильной группе – реакции декарбоксилирования.
Кроме этих общих путей возможны реакции по углеводородному радикалу аминокислот, которые являются специфическими для каждой аминокислоты.
Катаболизм большинства аминокислот начинается с отщепления a-аминогруппы, которое возможно в реакциях трансаминировани и дезаминирования.
Трансаминирование аминокислот
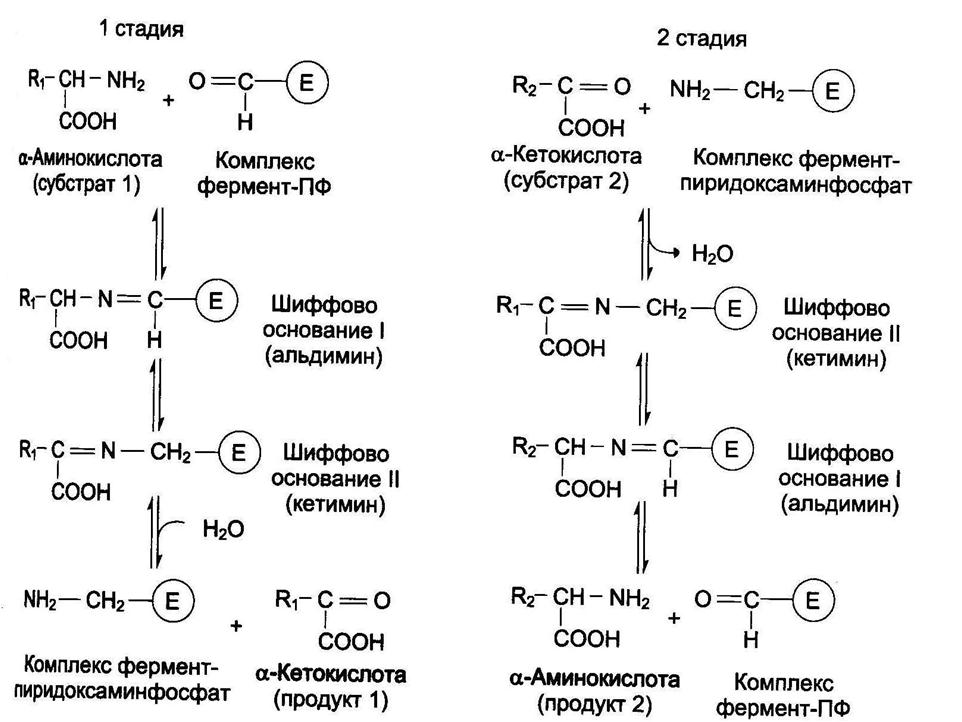
Трансаминирование – реакции переноса a-аминогруппы с аминокислоты на a-кетокислоту, в результате чего образуются новая кетокислота и новая аминонокислота. Реакции катализируют ферменты аминотрансферазы. Это сложные ферменты, коферментом которых является производное витамина В6 – пиридоксальфосфат, который обратимо может переходить в пиридоксаминфосфат. Реакции трансаминирования обратимы, и могут проходить как в цитоплазме, так и в митохондриях клеток. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.
Реакции трансаминирования протекают в 2 стадии. На первой стадии к пиридоксальфосфату в активном центре фермента присоединяется аминогруппа от первого субстрата – аминокислоты. Образуется комплекс фермент- пиридоксаминфосфат и кетокислота – первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований (альдимин и кетимин).
На второй стадии пиридоксаминфосфат соединяется с новой кетокислотой (второй субстрат) и снова через промежуточное образование 2 шиффовых оснований передает аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота – второй продукт реакции.
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных – глутамат, аланин, аспартат. Наиболее распространенными в большинстве тканей являются аланинаминотрансфераза (АлАТ) и аспартатаминотрансфераза (АсАТ).
Наибольшая активность АсАТ обнаруживается в клетках сердечной мышцы и печени, в то время как в крови обнаруживается только фоновая активность АлАТ и АсАТ. Поэтому можно говорить об органоспецифичности этих ферментов, что позволяет их широко примененятьих с диагностической целью (при инфарктах миокарда и гепатитах).
Биологическое значение трансаминирования
Трансаминирование – первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование – заключительный этап синтеза заменимых аминокислот из соответствующих кетокислот, если они необходимы в данный момент клеткам. В результате происходит перераспределение аминнного азота в тканях. При трансаминированиии общее количество аминокислот в клетке не меняется.
Оксидазы D-аминокислот.
При физиологических значениях рН в тканях высоко активны оксидазы D-аминокислот. Они также обнаружены в почках и печени и находятся в микросомах. Роль оксидаз D-аминокислот невелика и до конца не понятна, потому что в белки пищи и тканей человека входят только природные L-аминокислоты.
В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования серина, треонина, цистеина и гистидина неокислительным путем.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Глава 496. Почему кодируемых аминокислот двадцать? (XII)
Глава 496. Почему кодируемых аминокислот двадцать? (XII) Неискушенному Читателю может показаться, что элементы машины генетического кодирования описаны в предыдущей главе настолько детально, что к концу чтения он стал даже как-то утомляться, чувствуя, что несколько
Всасывание аминокислот.
Всасывание аминокислот. Происходит путем активного транспорта с участием переносчиков. Максимальная концентрация аминокислот в крови достигается через 30–50 мин после приема белковой пищи. Перенос через щеточную каемку осуществляется целым рядом переносчиков, многие
Наследственные нарушения транспорта аминокислот
Наследственные нарушения транспорта аминокислот Болезнь Хартнупа – нарушение всасывания триптофана в кишечнике и его реабсорбции в почечных канальцах. Так как триптофан служит исходным продуктом для синтеза витамина РР, то основные проявления болезни Хартнупа –
Расщепление белков в тканях
Расщепление белков в тканях Осуществляется с помощью протеолитических лизосомальных ферментов катепсинов. По строению активного центра выделяют цистеиновые, сериновые, карбоксильные и металлопротеиновые катепсины. Роль катепсинов:1. создание биологически активных
Превращение аминокислот микрофлорой кишечника
Превращение аминокислот микрофлорой кишечника Микроорганизмы кишечника располагают набором ферментативных систем, отличных от соответствующих ферментов тканей организма человека и катализирующих самые разнообразные превращения пищевых аминокислот и не
Трансаминирование аминокислот
Трансаминирование аминокислот Трансаминирование – реакции переноса a-аминогруппы с аминокислоты на a-кетокислоту, в результате чего образуются новая кетокислота и новая аминонокислота. Реакции катализируют ферменты аминотрансферазы. Это сложные ферменты, коферментом
Дезаминирование аминокислот
Дезаминирование аминокислот Дезаминирование аминокислот – реакция отщепления a-аминогруппы от аминокислоты с выделением аммиака. Различают два типа реакций дезаминирования: прямое и непрямое.Прямое дезаминирование – непосредственное отщепление аминогруппы от
Непрямое дезаминирование аминокислот
Непрямое дезаминирование аминокислот Большинство аминокислот не способно дезаминироваться в одну стадию, подобно глутамату. Аминогруппы таких аминокислот перносятся на ?-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому
Декарбоксилирование аминокислот
Декарбоксилирование аминокислот Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию. Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами, нуждающимися в пиридоксальфосфате в качестве кофермента.
Пути катаболизма углеродного скелета аминокислот
Пути катаболизма углеродного скелета аминокислот Трансаминирование и дезаминирование аминокислот ведет к образованию безазотистых углеродных скелетов аминокислот – ?-кетокислот. В состав белков входят 20 аминокислот, различающихся по строению углеводородного
Глава 25. Метаболизм отдельных аминокислот
Глава 25. Метаболизм отдельных аминокислот Метаболизм метионина Метионин – незаменимая аминокислота. Метильная группа метионина – мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий
Распад нуклеиновых кислот в желудочно-кишечном тракте и тканях
Распад нуклеиновых кислот в желудочно-кишечном тракте и тканях Нуклеиновые кислоты поступают в организм с пищей главным образом в составе нуклеопротеинов и высвобождаются в результате действия протеолитических ферментов желудочно-кишечного тракта. Далее под
Роль печени в обмене аминокислот и белков
Роль печени в обмене аминокислот и белков Печень играет центральную роль в обмене белков и других азотсодержащих соединений. Она выполняет следующие функции:1. синтез специфических белков плазмы: - в печени синтезируется: 100 % альбуминов, 75 – 90 % ?-глобулинов, 50 %
Обмен свободных аминокислот в головном мозге
Обмен свободных аминокислот в головном мозге Аминокислоты играют важную роль в метаболизме и функционировании ЦНС. Это объясняется не только исключительной ролью аминокислот как источников синтеза большого числа биологически важных соединений, таких как белки,
Глава 496. Почему кодируемых аминокислот двадцать? (XII)
Глава 496. Почему кодируемых аминокислот двадцать? (XII) Неискушенному Читателю может показаться, что элементы машины генетического кодирования описаны в предыдущей главе настолько детально, что к концу чтения он стал даже как-то утомляться, чувствуя, что несколько