Что происходит при заражении?
Что происходит при заражении?
Иммунная система развивалась для борьбы с острыми инфекционными заболеваниями. Возбудитель, попадая в организм, начинает размножаться, но то же самое делают и его враги — Т- и В-лимфоциты. Исход болезни зависит от того, у кого скорость размножения выше. Теперь мы кратко рассмотрим, каковы роли некоторых действующих лиц в этом состязании.
Антитела относятся к классу растворимых белков, называемых иммуноглобулинами (сокращенно Ig). Их продуцируют и выделяют в кровь и тканевую жидкость белые кровяные клетки, которые называются В-лимфоцитами. В элиминации чужеродного агента участвуют и некоторые дополнительные факторы, которые вызывают лизис (разрушение) бактериальных клеток, покрытых антителами. Антитела могут нейтрализовать вирусные частицы, прочно связываясь с ними и тем самым препятствуя их проникновению в клетки-мишени. Кроме того, специальные клетки, называемые фагоцитами, могут заглатывать покрытые антителами частицы и разрушать их. Этот процесс изображен на рис. 3.1. Выгодно, если антитело связывается с антигеном при очень низких концентрациях того и другого, то есть на ранних стадиях инфекции, когда в организме присутствует только очень небольшое число болезнетворных агентов. Однако это возможно лишь в том случае, если защитные антитела прочно связываются с антигеном, или обладают высокой авидностью. Если авидность антитела низкая, связывания при низких концентрациях антигена или антитела может и не произойти.
Если заболевание вызвано вирусом, иммунная система реагирует также образованием «клеток-убийц» (цитотоксических Т-лимфоцитов). Каждый Т-лимфоцит несет на поверхности специфические рецепторы, сходные с антителами. Эти рецепторы называются рецепторами Т-клеток — ТкР. Они распознают и связывают измененные молекулы на поверхностной мембране инфицированных вирусом клеток, что приводит к лизису этих клеток. Цитотоксические Т-клетки не вредят нормальным незараженным клеткам, так как не могут связывать их своими ТкР.
К сожалению, не у всех из нас иммунная система работает надежно и эффективно. Кто-то страдает от астмы или аллергии из-за того, что в отношении какого-либо внешнего раздражителя иммунная система заходит слишком далеко. Другие живут с рассеяным склерозом, потому что иммунная система разрушает их собственные нервные волокна, или страдают от иммунного дефицита, который затрудняет борьбу с инфекциями.
К концу 1960-х годов исследования естественных иммуноде-фицитов человека показали, что существует две основные категории острых нарушений иммунитета. Дети, не способные производить антитела (агаммоглобулинемия), не могут бороться с обычными бактериальными инфекциями, но нормально переносят детские вирусные инфекции, например корь. И наоборот, дети, у которых не было нормального тимуса (атимиче-ские), производят антитела и удовлетворительно справляются с бактериальными инфекциями, но не способны излечиваться от вирусных инфекций. В конце 1960-х гг. Боб Бландэн, работавший в Центре медицинских исследований имени Джона Кертина в Канберре, экспериментально показал, что излечение от острых вирусных инфекций у мышей зависит от ответа Т-лимфоцитов на инфекцию. К началу 1970-х гг. Боб совместно с другими исследователями из его лаборатории обнаружил, что Т-лимфоциты убивают инфицированные вирусом клетки до завершения цикла репликации вируса, пресекая, таким образом, инфекцию в зародыше. Другие исследователи показали, что Т-лимфоциты выделяют растворимые факторы (интерфероны), которые предотвращают размножение вируса в окружающих клетках. Интерфероны и другие растворимые цитокины сейчас производят с помощью клонирования и экспрессии генов цитокинов в бактериальном хозяине. Чистые цитокины назначают пациентам, страдающим некоторыми формами иммунного дефицита, для увеличения активности костного мозга и Т-клеток и, следовательно, улучшения ответа на инфекцию.
В 1973 г. Питер Догерти и Ролф Цинкернагель, также работавшие в Центре медицинских исследований имени Джона Кертина, показали, что в процессе распознавания Т-лимфоцитами инфицированных вирусами клеток участвуют не только вирусные антигены (что ожидалось), но и основные антигены гистосовместимости, или тканевой совместимости, самой клетки (что было неожиданным). Антигены гистосовместимости — это молекулы, ответственные за отторжение чужих тканей. Они различны у разных людей и вызывают сильный ответ Т-лимфо-цитов. Однако пересадка чужих тканей — не естественное явление, так что истинная биологическая функция этих антигенов была неизвестна до открытия Догерти и Цинкернагеля. Это открытие произвело коренные перемены в клеточной иммунологии, а Догерти и Цинкернагель получили Нобелевскую премию по физиологии и медицине в 1996 г.
Антигенспецифичные рецепторы Т-клеток (ТкР) распознают вирусные антигены, ассоциированные с главными антигенами гистосовместимости. Антител, связывающихся с такой ассоциацией, не образуется. Таким образом, Т-клетки и антитела никогда в норме не конкурируют за одни и те же сайты на поверхности клетки. Это можно продемонстрировать простым экспериментом. Если искусственно создать антитела к сайтам, узнаваемым Т-клетками, и добавить их к смеси инфицированных клеток и Т-клеток, то лизиса клеток не происходит, и вирусная инфекция успешно развивается. Этот эксперимент иллюстрирует селективные преимущества иммунной системы позвоночных, в которой Т-клетки и антитела не конкурируют за связывание с одними и теми же сайтами на поверхности инфицированной клетки.
Изучение описанных выше естественных иммунодефицитов у человека показало, что в отсутствие тимуса (и Т-лимфоцитов, которые развиваются в тимусе) могут образовываться антитела против бактериальных инфекций. Эти антитела относятся к классу иммуноглобулинов IgM. Секретируемая форма IgM, появляющаяся в ответ на бактериальную инфекцию без участия Т-лимфоцитов, представляет собой пентамер, то есть состоит из пяти молекул, структура которьк показана на рис. 3.2. Каждая из этих молекул имеет два антигенсвязывающих центра. Таким образом, пентамерный IgM имеет десять антигенсвязывающих центров (рис. 3.5).
Важная аксиома биологии гласит, что эффективность биохимической реакции зависит от степени связывания или сли-пания разных молекул. Взаимодействие между отдельным центром связывания антитела с комплементарным ему антигеном можно оценить количественно. Для этого в пробирке смешивают антиген и антитело в разных концентрациях и определяют, какая часть смеси находится в связанной форме (комплекс антиген—антитело), а какая — в несвязанной (рис. 3.6). Этот метод дает возможность оценить аффинность (сродство) антигенсвязывающего центра. Когда связывается больше одного центра, как у IgG или мономера IgM, имеющих по два центра, или у пентамера IgM с десятью центрами, в действие вступает новый фактор. Если чужеродный агент имеет на поверхности множество идентичных структур (как у бактериальных или вирусных частиц), то, как только происходит одно взаимодействие антиген—антитело, вероятность второго возрастает, и так далее (рис. 3.7). Таким образом, пентамер IgM может прилипать к поверхности бактерии, даже если аффинность отдельного антигенсвязывающего центра низка (из-за относительно плохого соответствия антигену). Сила такого множественного связывания антигена с антителом называется авидностью. Итак, высокая авидность IgM обеспечивает организму селективные преимущества, так как он образуется в первые часы и дни инфекции и способен связывать бактерии в крови и вызывать их элиминацию.

Рис. 3.6. Схема образования комплексов антиген-антитело. Комплексы антигенов и антител часто нерастворимы и осаждаются из раствора (рис. 3.3). Такие комплексы связываются с поверхностной мембраной клеток, например, фагоцитов, константной областью Н-це-пи антитела, давая клетке возможность поглотить их и переварить (рис. 3.1). В центрах размножения особые клетки, которые называются фолликулярными дендритными клетками (ФДК), представляют такие комплексы для отбора мутантных вариабельных областей с высокой аффинностью (рис. 5.4). Детали описаны в табл. 3.1.
Пентамерный IgM — крупная молекула, которая не может проникать через стенки кровеносных сосудов. Необходимы антитела помельче; это — иммунноглобулины класса IgG. Обычно IgM-ответ длится несколько дней, а затем происходит переключение на образование более мелких антител класса IgG , которые имеют только два антигенсвязывающих центра вместо десяти (рис. 3.8). Это переключение достигается в результате ряда сложных молекулярных событий, которые затрагивают определенные ДНК-последовательности генов IgG (молекулярные детали этого процесса мы не рассматриваем).
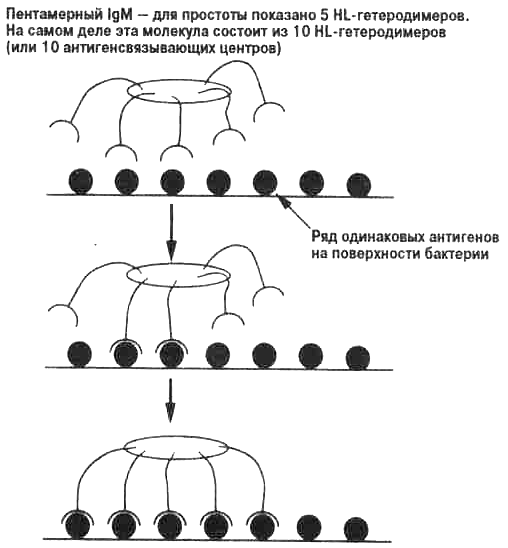
Рис. 3.7. Связывание пентамерного IgM с рядом одинаковых антигенов. Пентамерный IgM имеет много одинаковых антигенсвязывающих центров, у каждого из которых может быть низкая аффинность (рис. 3.5). Однако в результате множественного связывания с поверхностью антигена, например, с бактериальной клеткой (которая представляет собой ряд одинаковых антигенных эпитопов) пентамерный IgM связывается очень прочно (имеет высокую авидность). На рисунке показано множественное связывание высокой авидности. Если один центр связывается с антигеном, вероятность связывания соседнего центра возрастает. Когда сцеплены множественные антигенсвязывающие центры, общая сила связывания (авидность) оказывается много выше, чем у одного связывающего центра.
Переключение с синтеза IgM на синтез IgG иллюстрирует одну аксиому иммунологии, которая признается еще не всеми иммунологами. Эта аксиома утверждает, что единственное эволюционное селективное преимущество, которое дает специфичность в системе приобретенного иммунитета (антитела и ТкР), это возможность различения своего от не-своего. Так, IgM полезны, потому что, несмотря на низкую специфичность и низкую аффинность (плохое соответствие) отдельного связывающего центра, десять связывающих центров пентамерного IgM дают возможность одному и тому же антителу связывать множество родственных антигенов различных инфекционных агентов. Однако нужда в мелких, проникающих через стенки сосудов, антителах привела к появлению механизма переключения с производства IgM на производство IgG. Два антигенс-вязывающих центра IgG должны иметь большую аффинность, чем десять центров пентамерного IgM. В процесс переключения вовлекаются В-клетки с самой высокой аффинностью. Отбор таких клеток основан на конкуренции за связывание антигена в особых участках лимфоидной ткани (гл. 5). Еще одно селективное преимущество, которое дает механизм переключения, связано с эволюцией других классов антител (IgA, IgE), выполняющих свои специфические функции в различных тканях организма.
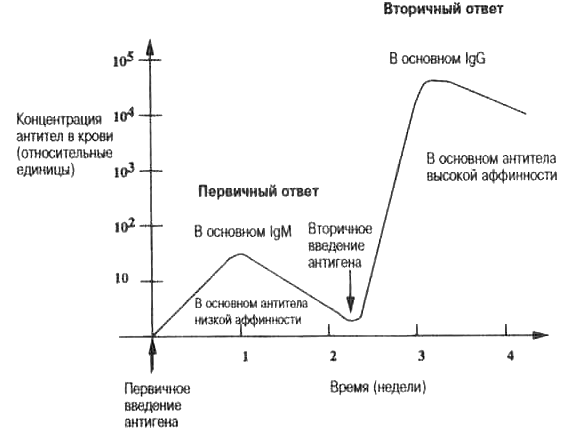
Рис. 3.8. Первичный и вторичный гуморальный ответ. Типичная зависимость от времени гуморального ответа у лабораторных мышей. На практике у человека вторичное введение антигена отделено от первичного месяцами или даже годами. Аффинность антител первичного ответа обычно ниже, чем антител вторичного ответа, «ответа памяти». Антитела, образованные во вторичном ответе, обычно оказываются соматически мутировавшими молекулами IgG или IgM , которые имеют более высокую аффинность, чем IgG- или lgM-антитела, образованные ранее (см. табл. 3.1 и гл. 5).
Наша иммунная система распознает большое число различных антигенов и реагирует на них. Чаще всего антигены — это белки и углеводы. (Углеводы — это полимеры, состоящие из разного числа молекул глюкозы или других Сахаров.) Следовательно, мир потенциальных биологических антигенов огромен. Иммунная система характеризуется способностью синтезировать почти безграничное число специфичных антител против чужеродных белков и углеводов. Каждое антитело способно отличить чужеродный антиген от собственных антигенов и участвует в элиминации чужеродных антигенов из организма.
В отличие от этого практически безграничного репертуара антител Т-лимфоциты узнают только короткий фрагмент (пептид) чужого белка, связанный специальной полостью в молекуле МНС антигена на поверхности клетки. Репертуар рецепторов Т-лимфоцитов (ТкР) ограничен вариациями МНС антигенов, которые создаются при связывании их с коротким чужеродным пептидом. Сложный многоэтапный процесс отбора развивающихся в тимусе Т-лимфоцитов обеспечивает создание этого ограниченного репертуара рецепторов в популяции функционирующих Т-клеток. Другой ряд сложных процессов, вовлеченных в образование антител в В-лимфо-цитах, приводит к тому, что не образуется антител против измененных МНС антигенов. Таким образом, антитела и рецепторы узнают разные стороны мира чужих антигенов.
Как достигается эта удивительная способность распознавать целый мир различных чужеродных антигенов и в то же время избегать ответа против собственных антигенов? Ответ на этот вопрос удалось получить в результате 40 лет иммунологических исследований. Мы рассмотрим его в следующей главе при обсуждении «клональной селекции».
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
1. Что происходит при возникновении различий
1. Что происходит при возникновении различий В 20-е годы немецкий ученый Фогт сумел проследить судьбу разных частей яйца в развитии. Для этого он окрашивал небольшие участки бластулы амфибий безвредными витальными красителями и наблюдал движение этих участков во время
Что происходит на тетеревином току
Что происходит на тетеревином току Все мы, конечно, слышали о тетеревиных токах, но далеко не каждый представляет себе воочию, насколько это эффектное и незабываемое зрелище. Вот как еще в прошлом веке описывал весенний ток тетеревов блестящий знаток русской природы
Что происходит на старости лет?
Что происходит на старости лет? — Действительно, что происходит на старости лет? Все системы изнашиваются, сердце начинает плохо работать, слабеют мышцы, зрение, память. А как иммунная система? Как этот страж, это «недреманное око», следящее за тем, чтобы не пробрался в
Как происходит гонка вооружений
Как происходит гонка вооружений Эволюционная «гонка вооружений» — один из самых мощных двигателей эволюции. Если бы среда обитания оставалась строго постоянной, отбор, скорее всего, привел бы строение и физиологию организма к локальному оптимуму, после чего
Причеши меня, и я твоя: у яванских макак секс происходит в обмен на косметический уход
Причеши меня, и я твоя: у яванских макак секс происходит в обмен на косметический уход Многие посетители зоопарка считают капуцинов и павианов более привлекательными и забавными по сравнению с человекообразными обезьянами, такими как шимпанзе и гориллы. Но вот найти
Как происходит так называемое отгадывание мыслей на подмостках театров?
Как происходит так называемое отгадывание мыслей на подмостках театров? Уже не один десяток лет на подмостках второстепенных театров и балаганов даются представления так называемого ясновидения или отгадывания мыслей. Представления эти состоят в том, что на сцене
Что происходит в голове шимпанзе?
Что происходит в голове шимпанзе? В голове шимпанзе, так же как и у человека, находится мозг. Мозг управляет всеми нашими поступками, хотя мы, люди, и не замечаем этого. По поведению животного можно судить о том, что происходит в его мозге. Опыты с множественным выбором
Почему вы полагаете, что выбирающей является женщина? Ведь у животных какой пол ярче украшен, того и выбирают, а у людей ярче украшены женщины. Как же по вашему происходит выбор?
Почему вы полагаете, что выбирающей является женщина? Ведь у животных какой пол ярче украшен, того и выбирают, а у людей ярче украшены женщины. Как же по вашему происходит выбор? Даже у тех видов, у которых самки выглядят полностью подавленными, «последнее и решающее слово»
Что происходит
Что происходит Итак, Папа Римский дает Европе рецепты тоже в духе Маркса, но из его речи видно видение церковью причин упадка европейцев: «Открыть себя не только земному, но и небесному, а не измерять человека как вещь юридическими, медицинскими и социологическими
Глава 16. Жизнь, какой мы (не)знаем ее Что, черт возьми, сейчас происходит?
Глава 16. Жизнь, какой мы (не)знаем ее Что, черт возьми, сейчас происходит? В конце 1950-х Пол Доти, биохимик, специализирующийся на ДНК (член клуба галстуков РНК), прогуливался по Нью-Йорку, думая о своем, когда увидел уличного торговца сувенирами и в недоумении остановился. На