Ген обретает плоть
Ген обретает плоть
Мы предлагаем вашему вниманию структуру соли дезоксирибонуклеиновой кислоты (ДНК). Эта структура имеет некоторые новые свойства, которые представляют значительный биологический интерес.
Ф. Крик и Дж. Уотсон
Мутации и энергия
V Международный генетический конгресс, состоявшийся в 1927 году, — знаменательная веха в истории биологии. Кроме Четверикова, одним из героев его стал американский генетик Герман Меллер, впервые получивший точковые мутации у дрозофилы искусственным путем, при помощи рентгеновских лучей. До того генетики находились в положении физиков, изучавших радиоактивность, — они могли лишь наблюдать естественный мутагенез, как физики — самопроизвольный ядерный распад. Впрочем нет — отличие, и весьма существенное, имелось. В то время физики еще не могли ускорить радиоактивный распад. Самые высокие доступные тогда температуры были бессильны нарушить структуру атомных ядер.
Иное дело — гены. Не зная химической структуры гена, исследователи уже догадывались, почему спонтанный, естественный мутагенез все-таки происходит. Хотя структура гена и необычайно прочна, ее можно нарушить. Гены окружены молекулами, находящимися в состоянии хаотического теплового движения. Для каждой температуры характерна своя скорость, своя средняя кинетическая энергия молекул. Но это именно средняя энергия.
При нормальных, пригодных для жизнедеятельности организмов температурах львиная доля молекул не имеет достаточно энергии, чтобы нарушить структуру гена. Однако не все молекулы движутся с одинаковой скоростью: одни из них более медленные, другие — более быстрые. Ничтожной доле молекул удается в результате столкновений обрести запас энергии, способной что-то сделать с геном.
Если мы повысим температуру до верхнего предела существования жизни, частота возникновения мутаций должна возрасти. Так и получалось в экспериментах (у нас первые такие опыты ставили П. Ф. Рокицкий и А. Н. Промптов). Это сразу наводило на глубокую, принципиальной важности аналогию с химической реакцией. Ведь химические реакции также ускоряются температурой. Чем она выше, тем больше молекул, обладающих нужной для свершения реакции энергией (как говорят физико-химики — способных преодолеть энергетический барьер реакции).
Получалось как будто бы, что мутация — не что иное как химическая реакция с очень высоким энергетическим барьером.
Удалось и ориентировочно оценить высоту барьера. В физической химии есть понятие температурного коэффициента Вант-Гоффа (обозначается Q10). Q10 показывает, во сколько раз возрастает скорость реакции, если мы повысим температуру на 10°.
Если вместо скорости реакций мы подставим в уравнение частоты возникновения мутаций, то получится, что Q10 мутагенеза дрозофилы оказывается в среднем порядке 5. Для одних мутаций, для одних генов он выше, для других ниже — а это означает, что разные гены различаются по устойчивости.
Каков же все-таки энергетический барьер мутагенеза? Для Q10 = 5 он равен 2,5–3 эв. Электрон-вольт (эв) — единица энергии; такую энергию получает электрон, движущийся в электрическом поле с напряжением 1 вольт. 3 эв — величина как будто ничтожная; этой величины не хватит, чтобы стряхнуть пепел с конца сигареты. Однако в микромире клетки 3 эв — величина огромная. При комнатной температуре средняя энергия теплового движения молекул всего 1/40 эв. Это-то и объясняет относительную редкость возникновения мутаций, да и само существование жизни на Земле. Могла ли жизнь вообще возникнуть, будь структура гена менее стабильной? Это равносильно попытке построить высотное здание из мыльных пузырей.
Подобные предварительные исследования сразу дали три принципиально важных вывода:
1. Разные гены различаются по стабильности. Потому-то одни локусы мутируют чаще, а другие — реже.
2. Мутагенез по своей природе статистичное, вероятностное явление. Ведь невозможно предсказать, какая из молекул обретет способную преодолеть энергетический барьер скорость, и по какому из тысяч генов она ударит. Поэтому дарвиновская неопределенная изменчивость прямо вытекает из максвелловского распределения молекул по скоростям.
3. Энергией свыше двух с половиной электрон-вольт обладают кванты жесткого излучения — начиная с ультрафиолетового. Значит, мутацию можно вызвать облучением клетки! Ультрафиолет может поглощаться клеточными оболочками, но уже для мягкого рентгена нет преград. По этому пути устремились сразу несколько исследователей, и приз, то есть Нобелевскую премию, получил Г. Меллер — ученик Моргана, впоследствии ряд лет работавший в Советском Союзе.
Радиогенетика и проблема случайного и необходимого
В те «добомбовые» 20–30-е годы нашего столетия ядерные грибы еще не вздымались над поверхностью Земли, и почти единственными источниками жестких излучений были рентгеновские трубки и препараты радия. Первые опыты Н. В. Тимофеева-Ресовского и Д. Д. Ромашова не увенчались успехом, так как исследователи не имели достаточно чистых линий дрозофилы, и возникающие мутации не были видны на фоне генетических рекомбинаций, банальных перетасовок аллелей.
Однако уже в 1925 году появилась работа советских исследователей Г. А. Надсона и Г. С. Филиппова — работа во всех отношениях примечательная. Эти авторы облучали рентгеновскими лучами колонии плесневых грибов (в том числе обыкновенного мукора — той плесени, которая возникает на залежавшемся хлебе). То, что лучи Рентгена и радий тормозят рост плесеней, было уже известно. Но Надсон и Филиппов получили впервые мутантную форму мукора с четкими наследственными признаками. Плесень, как всем известно, белая; этот мутант оказался ярко-оранжевым и не образовывал половых органов и зигот, размножаясь только вегетативно.
Впоследствии Надсон и Филиппов получили рентгеномутанты у других низших грибков — дрожжевых.
Казалось бы, полный успех. Однако путь признания в науке не прямой. Эти работы не получили известности ни у нас, ни за границей, хотя и печатались на французском языке. Кто знает, как сложилось бы дело, если бы смерть обоих исследователей не оборвала их успешную деятельность. Лишь в 40-х годах за рубежом Г. Бидл и Е. Тэтум, исследовав мутации другой плесени — нейроспоры, завершили создание биохимической генетики; они окончательно доказали, что для построения одного фермента требуется действие по меньшей мере одного гена (знаменитый афоризм: «один ген — один фермент»). Судьба опережающих в науке свое время редко бывает счастливой. Впрочем, отстать от времени еще хуже: первых не признают при жизни, вторых забывают еще при ней.
Поэтому пальма первенства досталась Меллеру, который использовал классический объект тогдашней генетики — дрозофилу. В одном популярном произведении 40-х годов опыт Меллера описывался донельзя примитивно. Он-де направил на пробирку с дрозофилами «зеленоватый сноп рентгена» и получил безглазых, бескрылых и безногих мушек.
Такая популяризация приводит лишь к засорению науки случайными людьми — в самом деле, как просто получить Нобелевскую премию! Оставим на совести автора «зеленоватый сноп» невидимых рентгеновских лучей; вспомним, что подавляющее большинство мутаций рецессивно по отношению к дикому типу и в гетерозиготах не проявляется. Облучению предшествовала длинная и кропотливая работа, в процессе которой Меллер получил чистую линию дрозофил, у которой мутировавшие самки не давали в потомстве самцов. Головоломная задача по выявлению рецессивных мутаций была разрешена им блестяще.
Второй американский генетик Р. Стадлер в 1927 году получил рентгеномутанты у ячменя и кукурузы. С этого года начался бурный рост радиогенетики — одной из важнейших современных отраслей генетики. Значение ее для практической деятельности человечества огромно. Облучая организмы, можно резко повысить частоту возникновения мутаций — значит, селекционеру предоставляется обильный материал.
Но этого мало. Несмотря на то что наземные испытания ядерного оружия запрещены международными соглашениями, развитие ядерной промышленности резко увеличило радиоактивный фон нашей планеты — а ведь человечеству предстоит еще массовый выход в космос, продолжительное обитание на орбитальных станциях и межпланетных кораблях. Это не может не отягощать наш генетический фонд скрытыми мутациями. Да еще и врачи-перестраховщики, гоняющие больных на рентген по любому поводу!
В нашу задачу не входит подробный анализ всех достижений радиогенетики, тем более что на эту тему в последнее время вышло несколько хороших книг — и просто научно-популярных, и строго научных, но написанных популярно.
Остановимся лишь на крайне важном для проблемы изменчивости выводе, полученном Н. В. Тимофеевым-Ресовским и К. Циммером, Начнем с примитивной аналогии. Допустим, где-нибудь на Марсе космонавты обнаруживают крупное и опасное существо, убить которое можно только попаданием в одно-единственное место, незначительное по сравнению с размерами самого существа. Нечто вроде героя троянской войны Ахилла, у которого уязвима была только пятка. Как оценить размеры этой ахиллесовой пяты?
Напрашивается самый простой метод. Размеры существа известны. Выпустим по нему возможно большее количество пуль. Тогда, зная частоту попадания, количество потребных для этого зарядов и размер существа, можно оценить нужную нам величину.
Заменим марсианского зверя гаметой дрозофилы, автомат — рентгеновскими лучами и будем определять частоту мутаций. Зная объем клетки, плотность потока квантов и частоту мутаций, нетрудно оценить размеры той структуры, изменения которой вызывают точковую мутацию. Эта величина, так называемый радиус эффективного объема, порядка 10–7 см (десятимиллионная доля сантиметра). Однако размеры атома около стомиллионной доли сантиметра (мы говорим «около», потому что атом не имеет четких размеров). Значит, на ахиллесовой пяте гена укладывается всего 10 атомов.
Что из этого следует? То, что для описания процесса мутагенеза классическая механика, в которой можно точно измерить траекторию и энергию тела, а затем рассчитать время и место события, не годится. Она должна быть заменена квантовой механикой, одно из основных положений которой — принцип неопределенности, сформулированный великим немецким физиком Вернером Гейзенбергом.
Принцип этот прост: на уровне атомов и слагающих их частиц мы не можем определить одновременно координаты микротела и его импульс (энергию) без определенной погрешности. Погрешность эта ничтожна, и в макромире мы можем ею пренебречь, применяя механику Ньютона.
Но ведь мутации происходят в микромире. Чтобы предсказать наступление единичного наследственного изменения со 100-процентной вероятностью, нужно одновременно и абсолютно точно знать координаты и энергию частицы, атакующей ген. А это как раз нам и запрещено природой, так же как создание вечного двигателя и многих других вещей.
Должен оговориться: связь между генетикой и квантовой механикой не столь прямая, как следует из этого популярного изложения, но я был вынужден упростить его, не загружая текст словами вроде «квантовый скачок» и «туннелирование протона». В последнее время лауреат Нобелевской премии М. Эйген также пришел к выводу о связи между случайностью мутаций и квантовомеханической неопределенностью.
Далеко не всем это может понравиться. А. Эйнштейн, например, не желал признавать квантовой механики («Я не могу представить, что господь бог играет с миром в кости»). Но и всей гениальности Эйнштейна не хватило для того, чтобы опровергнуть квантовую механику, поэтому наивными кажутся попытки некоторых биологов «запретить» ее применение.
Возвратившись на две тысячи лет назад, вспомним спор Демокрита с Эпикуром. Мир Демокрита жестко детерминирован, все явления связаны причинными связями, в нем нет места свободе воли. В мире Эпикура случайное, непредсказуемое отклонение атомов уничтожает слепую необходимость Демокрита — судьбу, перед которой бессильны и люди и боги. Мне лично мир Эпикура более импонирует. Фактически Гейзенберг и завершил дело Эпикура, уничтожив механический детерминизм на атомном уровне.
Итак, причинность в микромире статистическая. Мы можем говорить лишь о вероятности того или иного явления, в данном случае мутации. Выводы квантовой механики ежечасно подтверждаются практикой (без них невозможен был бы расчет любого ускорителя или ядерного реактора). Заключение может быть только одно — квантовая механика постулирует принципиальную ненаправленность, случайность генетических изменений, которые носят характер дарвиновской неопределенной изменчивости.
Из всего этого вытекает еще одно любопытное следствие. В неживом мире один-единственный квантовый скачок ничего не значит. Значение имеет лишь квантовый скачок, приводящий к мутации; он может существенно изменить свойства и структуру макротела — организма, а впоследствии — популяции и обрести воистину глобальные масштабы.
Этот принцип, названный Н. В. Тимофеевым-Ресовским принципом усиления, можно продемонстрировать на таком примере. В результате мутации появляется новый штамм вируса гриппа, против которого бессильны защитные системы человеческого организма. Возникает эпидемия, прокатывающаяся по городам и селам, странам и континентам. Участковые врачи, подобно почтальонам, заходят в каждую квартиру, не успевая выписывать бюллетени. Падает выработка национального продукта, отменяются многие планы, снижается эффективность хозяйства — и все это следствие мутации, вызванной, например, одним-единственным квантом ультрафиолетового излучения Солнца.
Если бы на пути «принципа усиления» — а это не что иное, как положительная обратная связь — термин кибернетики, под который подпадает и взрыв, и скат горной лавины — не вставали отрицательные обратные связи, жизнь была бы невозможной. Отрицательные связи, гасящие колебания, обеспечивают относительную стабильность нашего существования. Но порой они оказываются недостаточными — ведь вспышки гриппа и иных болезней объясняются в первую очередь концентрацией людей в городах и развитием транспорта, К плодам цивилизации мы, право, еще не успели приспособиться.
Гены и химия
Изменить структуру гена пытались и химическим путем, воздействуя на клетки разными химикалиями. Этот метод имел свои преимущества: определив, какие вещества ускоряют мутагенез, мы можем с достаточной долей вероятности говорить не только о стабильности, но и о химическом составе гена. Однако успеха в этом направлении долго не удавалось добиться — слишком сильнодействующие химикалии убивали саму клетку, а иные мутагенез не ускоряли.
Геномные мутации — удвоение хромосомного набора — были получены И. И. Герасимовым еще в 1892 году в клетках нитчатой водоросли спирогиры под воздействием низкой температуры, хлороформа и хлоралгидрата. Об этих опытах забыли. Лишь в 1937 году А. Блексли установил, что вещество, выделенное из ядовитого растения безвременника (по-латыни колхикум, от старого названия Закавказья — Колхида, отсюда и вещество назвали колхицином), препятствует расхождению хромосом по клеткам во время деления. Обработка колхицином стала стандартным способом получения полиплоидов. Еще древние римляне пытались лечить колхицином подагру; ныне им лечат, иногда с успехом, некоторые формы рака. Однако механизм действия колхицина стал известен лишь в последние годы.
При делении клетки хромосомы растягиваются в разные стороны сокращающимися нитями специального образования, возникающего в клетке при митозе, — митотического веретена. Колхицин, присоединяясь к этим белковым нитям, блокирует их сокращение, отчего хромосомы не расходятся, а остаются в одной клетке. Механизм митоза и мейоза очень консервативен, поэтому действие колхицина одинаково на все клетки животных и растений. Но есть и исключение: обычное лабораторное животное — сирийский, или золотистый, хомячок. Он весьма устойчив к колхицину, так как сформировался как вид в пустынной местности, где ему часто за неимением иной пищи приходилось питаться безвременником. Это, кстати, хороший пример могущества естественного отбора. Даже столь древний признак, как белок веретена, сформировавшийся не менее миллиарда лет назад, подвержен изменчивости; а как только появляется новый фактор отбора, он сможет отобрать приспособленных мутантов.
Но вернемся к химическому мутагенезу. Еще в 1932–1934 годах советские генетики В. В. Сахаров и М. Е. Лобашов независимо друг от друга впервые получили точковые мутации у дрозофилы с помощью йода и других веществ. Эффективность первых мутагенов по сравнению с рентгеном была весьма низкой, поэтому открытие прошло незамеченным — все научные силы были брошены на исследование мутаций, вызванных рентгеновским излучением. Ученые, разрабатывающие новую отрасль, нередко напоминают игроков плохой футбольной команды, которые, сломя голову, кучей бегут за мячом, не видя ничего вокруг. А жаль! Хотя первые мутагены были и малоэффективны, они вызывали одни мутации чаще, чем другие. Иными словами, они действовали специфично, а это недвусмысленно говорило о различиях в химическом составе генов. Удалось также установить, что в одни периоды жизни клетки гены более доступны, чем в другие, что могло пролить свет на механизм действия гена.
Скачок в изучении химического мутагенеза произошел тогда, когда советский генетик И. А. Рапопорт открыл мутагенное действие формальдегида (1946), а впоследствии открыл супермутагены, вызывающие мутации почти у 100 % обработанных ими особей. Ш. Ауэрбах установила, что сходный эффект вызывают некоторые производные иприта. В последнее время химический мутагенез усиленно изучается и имеет большое практическое значение.
Специфичность действия мутагенов породила необоснованные надежды на возможность получения желаемых мутаций «по заказу». В печати иногда появляются сообщения о синтезе чудодейственных мутагенов, вызывающих направленные мутации. Это неверно: мутагены, как и излучение, могут вызвать желаемую мутацию лишь случайно. Чтобы получить мутацию «по заказу», нужно заставить мутаген прореагировать с определенным местом нужного гена (а генов в клетке много тысяч, мы не знаем расположения большинства из них и лишь в редких случаях можем предсказать ожидаемый фенотипический эффект). Поэтому проблема так называемых направленных мутаций вряд ли будет решена в обозримом будущем. Парадоксально, но направленно изменить наследственность оказалось проще другим путем: синтезировать ген заново и включить его в геном изменяемой клетки (оба этапа этой работы уже выполнены на модельных объектах).
Таким образом, исследования по химическому и радиомутагенезу лишний раз подтвердили принципиальную ненаправленность, случайность генетических изменений. Адекватности (соответствия) при мутациях не наблюдается, они носят характер дарвиновской неопределенной изменчивости. Самым важным в этих работах оказалось, однако, то, что они позволили оценить порядок величины генов и их стабильность. Как писал в то время Т. Морган, «мы легко можем оказаться на дороге в обетованную землю, где биологические явления могут рассматриваться как явления физические и химические».
До обетованной земли — молекулярной биологии — оставались считанные годы. Точнее, она уже тогда существовала, но никто, за исключением немногочисленных предтеч — в первую очередь академика Н. К. Кольцова, — не мог предвидеть ее грядущего величия.
Разгадка состава гена
Быть может, все началось с эффекта трансформации. Американский бактериолог Ф. Гриффитс в 1928 году изучал пневмококки, вызывающие воспаление легких у мышей. В его распоряжении было два штамма. Кокки одного исправно убивали мышей; их клетки могли одеваться капсулами (S-штамм). Второй штамм — R болезни у хвостатых мучеников науки не вызывал и капсул не образовывал.

Схема опыта по трансформации бактерии. Активный штамм S убивает мышей (1), неактивный R — не убивает (2). Убитые подогревом бактерии S не действуют на мышей, но если смешать их с неактивными R, передают им смертоносность (3, 4).
Гриффитс убил клетки S-штамма нагреванием, смешал с живыми клетками R-штамма и вспрыснул мышам. Через 3–5 дней мыши погибли, и из крови были выделены живые закапсулированные кокки S-штамма.
Опыт мог толковаться однозначно: убитые кокки выделяют какое-то вещество, которое внедряется в клетки живых, передавая им наследственные свойства. Легко было предположить, что это и было загадочное «вещество наследственности» — материал, из которого состоит ген. Однако, что это за вещество — никто не знал, хотя выбор был достаточно ограничен. Хромосомы всех организмов состоят из двух веществ — белка и дезоксирибонуклеиновой кислоты (ДНК), в то время именовавшейся тимонуклеиновой, или просто тимонуклеином. Наш замечательный биолог Н. К. Кольцов еще в 1927 году предсказал, что гены должны быть огромными нитевидными молекулами, соединяющимися в хромосоме в одномерную последовательность. Далее он уверенно говорил о самоудвоении гена, его матричном синтезе. И лишь в одном Кольцов ошибся: субстратом гена он считал белок, ибо тимонуклеин в те годы казался чересчур простым соединением: «Наиболее специфическая окраска для хроматина, так называемая фельгеновская, оказалась реактивом на тимонуклеиновую кислоту, то есть сравнительно простое органическое соединение, которому было бы странно приписывать роль носителя наследственных свойств. Притом же в промежутках между двумя делениями клеток это вещество пропадает (то есть перестает окрашиваться специфической краской — реактивом Фельгена. — Б. М.), между тем как структуры, приписываемые хромосомам генетиками, настолько сложны, что было бы безумием допускать возможность хотя бы и временного их распада».
С точки зрения всего уровня тогдашних знаний вывод Кольцова казался безупречным. Большинство исследователей склонялось к нему (за ДНК без особых на то оснований стоял лишь известный генетик М. Демерец).
Так было до 1944 года, когда О. Эйвери, С. Мак-Леод и М. Маккарти после десяти лет чудовищной по сложности работы очистили вещество, изменяющее свойства пневмококков и условно названное фактором Гриффитса, в количестве, достаточном для биохимического анализа. Им оказалась ДНК. С этого времени и начался бурный взрывоподобный рост новой отрасли естествознания — молекулярной биологии. В истории наук не было прецедента, когда люди за столь короткий срок узнавали так много нового (пожалуй, за исключением эпохи создания атомной физики и квантовой механики).
Автор еще застал этот период молодости новой науки. Трудно описать атмосферу необыкновенного энтузиазма, когда каждый месяц (да что там — каждый день!) открывал что-то новое, когда ходившие среди нас живые классики еще не имели нимбов и не уверовали в свою непогрешимость — и все чувствовали себя равными богам. Быть может, такие чувства испытывают солдаты, после затяжной осады и кровопролитного штурма бегущие по улицам завоеванного города.
Теперь положение в молекулярной биологии несколько стабилизировалось, темп открытий замедлился (все верхние золотоносные жилы выбраны, начались глубинные разработки), а впереди проступают неясные перспективы новой, субмолекулярной биологии.
Впечатляющие успехи новой отрасли естествознания изложены во многих хороших книгах, содержание которых нет нужды здесь дублировать. Нас будет интересовать лишь то новое, что внесла молекулярная биология в теорию эволюции. Но перед этим нужно отдать должное тем, кто наполнил слово «нуклеин» новым содержанием.
Как из нуклеина сделали ДНК
В 1868–1869 годах в знаменитой Тюбингенской лаборатории немецкого химика Э.-Ф. Гоппе-Зейлера стажировался молодой швейцарский ученый Иоганн Фридрих Мишер. Его особенно интересовало химическое строение клеточного ядра — уже тогда наиболее дальновидные умы понимали значение этой структуры для жизни клетки. Объектом его опытов был гной — материал малоприятный, но благодарный: ведь гной состоит из полуразрушенных белых кровяных телец — лейкоцитов, из которых уже сами «выделились» ядра. Получив ядра в более или менее чистом виде, Мишер выделил из них некое новое вещество.
Оно осаждалось спиртом и кислотами и само было довольно сильной кислотой, имело значительный молекулярный вес и содержало много фосфора. Так как ядро по-латыни — нуклеус, молодой швейцарец, не мудрствуя лукаво, окрестил его нуклеином (так же, как вещество, выделенное из белладонны — латинское атропа, назвали атропином, а из кофе — кофеином).
Гоппе-Зейлер — химик с большим кругозором и чутьем, как говорят — с загадом, оценил открытие своего ученика. Стажеры Тюбингенской лаборатории попытались — и попытки эти увенчались успехом — выделить нуклеин из других объектов: дрожжей, эритроцитов птиц и пресмыкающихся. Эти клетки — ядерные; а вот из эритроцитов млекопитающих нуклеин выделить почти невозможно. Я сказал почти, потому что по последним данным в эритроцитах млекопитающих есть загадочная ДНК, связанная с их оболочками, хотя эти клетки безъядерны.
Вернувшись на родину, в Базель, Мишер продолжил исследования на новом объекте — сперме рейнского лосося. По-видимому, он умел выбирать объекты — сперматозоиды почти на 50 % состоят из ДНК. Мишер быстро установил, что нуклеин — вещество сложное, нечто вроде соли, где роль щелочи играет белок — протамин, а кислоты — загадочное, богатое фосфором вещество. Догадываясь, что в проблеме наследственности нуклеин имеет первостепенное значение, швейцарский Колумб молекулярной биологии не успел этого доказать.
Но еще до смерти Мишера (1895) А. Коссель установил, что кислый компонент нуклеина содержит фосфорную кислоту, азотистые пуриновые и пиримидиновые основания и углеводы. Более широко известные углеводы — гексозы содержат 6 атомов углерода (глюкоза, фруктоза). Углеводы нуклеина оказались пятичленными — пентозами.
В 1891 году Э. Фишер и Пилоти выделили из всем известного клея — гуммиарабика — арабоновую кислоту, а из последней — новую, названную рибоновой. Из рибоновой кислоты и была выделена одна из первых пентоз — рибоза. Близкий по строению углевод, у которого по сравнению с рибозой не хватало одного атома кислорода, был назван дезоксирибозой (обескислороженной рибозой).
В дальнейшем все погубило пристрастие биохимиков к стандартным объектам. Нуклеиновые кислоты стали выделять из дрожжей (растительный материал) и зобной железы (тимуса) теленка (животный материал). Первую кислоту, по предварительным грубым анализам содержащую рибозу, окрестили растительной нуклеиновой кислотой, а вторую — с дезоксирибозой — животной, или тимонуклеиновой. Эти названия и продержались до 40-х годов нашего века.
За первые тридцать лет XX столетия группа, возглавляемая А. Левиным (Рокфеллеровский институт, США), установила, что нуклеиновые кислоты — длинные цепочки сахаров-пентоз, сшитые остатками фосфорной кислоты (фосфорная кислота — Н3РО4; два гидроксила ОН идут на присоединение пентоз, а третий — свободный и придает нуклеину кислые свойства). К каждой пентозе присоединено азотистое основание — аденин, тимин, гуанин, цитозин и урацил. Тимин (как следует из названия) был выделен только из тимонуклеиновой кислоты и был верным ее индикатором.
Ошибкой школы Левина было то, что ученые доверились результатам в то время еще грубых анализов, из которых как будто бы следовало, что нуклеиновые основания имеются во всех кислотах в равном количестве. Так возникла тетрануклеотидная теория, утверждавшая, что все нуклеиновые кислоты — продукты полимеризации четырех нуклеотидов (азотистое основание + сахар называется нуклеотидом). Тимонуклеиновая кислота обозначалась, например, (АГЦТ) n, где n — число этих оказавшихся мифическими звеньев, а А, Г, Ц, Т — соответственно аденин, гуанин, цитозин и тимин. В «растительной» нуклеиновой кислоте тимин замещался урацилом. Такое вещество — полимер из четырех оснований — действительно казалось слишком простым, чтобы быть материальным фактором наследственности. Простота строения, конечно, не может быть препятствием: теория информации свидетельствует, что любую структуру можно закодировать лишь двумя сигналами, например, единицей и нулем в разных сочетаниях. Но тогда еще не было теории информации.
Первую лопату земли в пропасть, разделявшую «растительную» и «животную» нуклеиновые кислоты, бросили не биохимики, а специалисты по химии клетки — цитохимики. В 1924 году Р. Фельген открыл цветную реакцию на тимонуклеиновую кислоту — знаменитый реактив Фельгена, окрашивающий ядро клеток на микроскопических препаратах. Оказалось, что ядра растительных клеток также красятся «по Фельгену». Оставалось сделать последний шаг, как правило, самый трудный, — выделить из растительных клеток животную нуклеиновую кислоту и тем самым доказать ее общность для живой природы.
К сожалению, знающие себе цену биохимики не очень охотно занимались нуклеиновыми кислотами, где все казалось ясным после работ Левина. То ли дело загадочные белки, несомненная основа жизни, а стало быть, и наследственности! Культ личности никогда не доводил до добра, даже если эта «личность» оказывалась химическим веществом. Тем не менее, продолжали находиться, по тогдашней мерке, чудаки, те, кто и на линованой бумаге пишут поперек и для которых вопросы «модности» объекта и методики первостепенными не являются.
К числу их относился молодой биохимик, лишь недавно перебравшийся в Московский университет из Ташкента, Андрей Николаевич Белозерский. Опираясь на данные цитохимии, он предпринял весьма трудную по тем временам попытку — выделить тимонуклеин из растительных клеток. Многим это казалось попросту диким — все равно что попытаться выделить хлорофилл из животных клеток.
Опыт удался: переработав совместно с И. И. Дубровской многие килограммы проростков конского каштана, А. Н. Белозерский получил в 1936 году чистую тимонуклеиновую кислоту из растения. Тем самым пропасть, разделявшая царства растений и животных, была уничтожена навсегда.
Годом позже Фельген с сотрудниками выделили тимонуклеин из проростков ржи. Стандартный объект для выделения «растительной» нуклеиновой кислоты — дрожжи — также содержал «животную». Обе нуклеиновые кислоты оказались общими для всего живого (кроме вирусов, но о них после). К этому времени и стали употребительными названия дезоксирибонуклеиновая и рибонуклеиновая кислоты и их сокращения: ДНК и РНК, ныне известные каждому школьнику.
На пути дальнейших исследований в этом направлении лежало бревно тетрануклеотидной теории. Убрать его удалось лишь Дж. Гулланду с сотрудниками через 10 лет после работ Белозерского. Тщательно определив содержание аденина, тимина, гуанина и цитозина в ДНК ряда объектов, они показали, что отношение их отличается от 1: 1: 1: 1.
Это стимулировало работы другого исследователя — классика химии нуклеиновых кислот Э. Чаргаффа. Чаргафф разработал методы, позволяющие определять состав ДНК и РНК в весьма малых количествах вещества (десятки граммов, по тем временам — огромный скачок; это сейчас ухитряются определять состав ДНК в кусочке отдельной хромосомы).
Чаргафф сам признает, что стремление изучать ДНК у него возникло после работ Эйвери, Мак-Леода и Маккарти, показавших, что именно она является тем самым загадочным фактором Гриффитса, изменяющим наследственность бактерий. В результате трехлетних работ его лаборатории от тетрануклеотидной теории ничего не осталось. И ДНК и РНК разных видов растений, животных и микроорганизмов оказались различными по составу. Этого мало — Чаргафф сформулировал свои знаменитые правила для ДНК, которые для будущей молекулярной биологии оказались тем же, что и эмпирические законы Кеплера для астрономии.
Именно: состав ДНК изменяется в довольно широких границах. Разумеется, мы говорим о составе, имея в виду азотистые основания — остатки фосфорной кислоты и углеводы во всех ДНК одинаковые.
Согласно Чаргаффу, сумма содержания аденина и гуанина в ДНК всегда равна сумме цитозина и тимина (А + Г = Ц + Т). Так же и содержание гуанина и тимина равно содержанию аденина и цитозина. Изменяться в ДНК мог лишь процент суммы гуанина и цитозина (% ГЦ). Состав РНК не был так жестко запрограммирован.
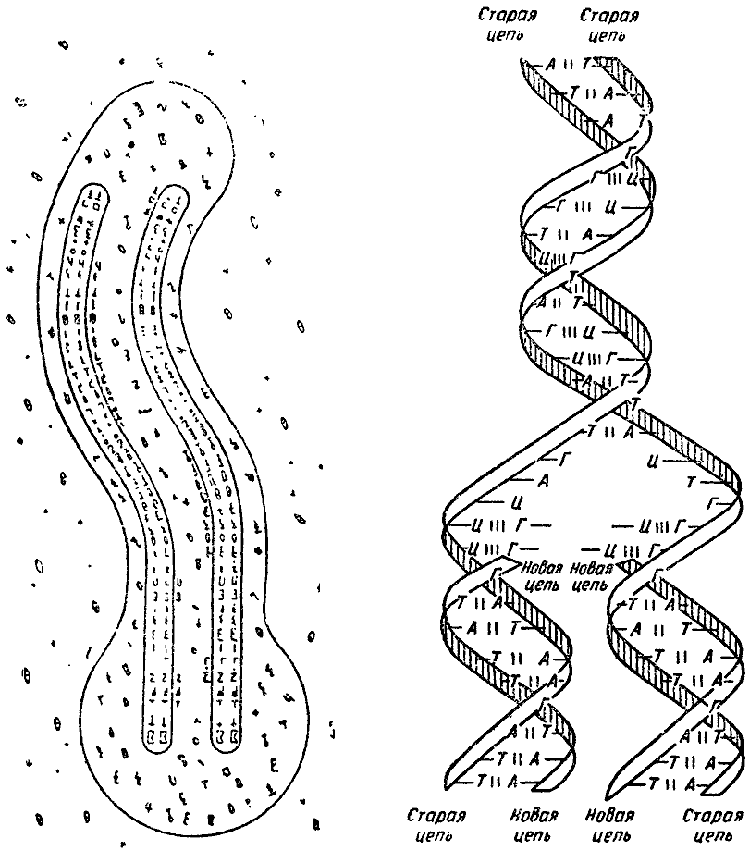
Слева — матричный синтез гена, как он представлялся Н. К. Кольцову в 1929 г. Справа — современная схема репликации ДНК.
Правила Чаргаффа, наряду с рентгенографическими исследованиями английских физиков М. Уилкинса и Р. Франклин, дали возможность физику Ф. Крику и генетику Д. Уотсону в Кембриджской лаборатории разгадать структуру ДНК — она оказалась двойной спиралью, легко разделяющейся на две половинки. В этом строении был великий смысл: отсюда автоматически вытекала возможность самоудвоения, репликации молекулы, репликации гена. Именно этот процесс протекает в клетках при делении, и именно его предсказал Н. К. Кольцов (только он полагал, что ген — белковая молекула). Так протянулась на сто лет цепь от исследователя к исследователю; Крик и Уотсон завершили дело, начатое Мишером в лаборатории Гоппе-Зейлера. Но эстафету от Мишера к ним на протяжении века передавали друг другу Коссель и Левин, Фельген и Белозерский, Гулланд и Чаргафф; лишь наше поколение достигло цели (я хотел написать — финиша, но финиша в науке нет, есть только следующий старт).
Жизнь на уровне молекул
Итак, гены оказались гигантскими, хорошо различимыми в электронный микроскоп нитевидными молекулами нуклеиновых кислот — ДНК и РНК. ДНК — генный материал подавляющего большинства организмов. В норме она двуцепочечна — это скрученная в спираль двойная нить, вернее, цепочка, структура которой поддерживается водородными связями, возникающими между смежными азотистыми основаниями нитей. При этом гуанин присоединяется к цитозину, а аденин к тимину. Г всегда столько же, сколько Ц, а А столько же, сколько Т. Из такой структуры автоматически вытекают правила Чаргаффа.
Однако ДНК не всегда двуцепочечна. Некоторые вирусы имеют одноцепочечную ДНК. В такой ДНК правила Чаргаффа не соблюдаются. У множества других вирусов в качестве генного материала выступает РНК (как двуцепочечная, так и одноцепочечная). Встречается у вирусов также и ДНК, содержащая рибозу вместо дезоксирибозы, и РНК с тимином вместо урацила.
Трудно сказать, какая из двух нуклеиновых кислот возникла первой в процессе становления жизни. На этот счет существуют разные мнения. Вернее всего, вначале было нечто среднее: икс-НК, сополимер рибоз и дезоксирибоз, который удается получить сейчас в эксперименте. Впоследствии роль главного носителя генетической информации взяла на себя ДНК по простой причине — она была более устойчива из-за отсутствия одного из гидроксилов в ее пентозе и двуспиральности. Генетическая информация закодирована лишь в одной из цепей. Вторая, комплементарная, нужна для репликации (удвоения) и репарации. Последний термин требует пояснения. Если из какой-либо цепи ДНК в результате мутационного процесса будет вырвано звено, специальные ферменты, репаразы, «исправят» разрыв, вставив основание, комплементарное к оставшемуся соседу: аденин пристроят к тимину, а гуанин — к цитозину.
Вирусы с одноцепочечными нуклеиновыми кислотами вряд ли были первыми обитателями нашей планеты. Все они — паразиты и размножаться могут только в клетках хозяев. У них нет механизмов для репликации ДНК и синтеза белковых молекул, слагающих оболочку. Все это они заимствуют у хозяев. Поэтому, быть может, справедливо мнение, что организация вирусов — результат вторичного упрощения. Они отказались от белоксинтезирующих систем как многие паразитические черви, обитающие в кишечнике, отказались от ставшей ненужной пищеварительной системы. Образно выражаясь, каждая вирусная частица подобна магнитофонной кассете с записью, а клетка, начиная с бактериальной, — целому магнитофону.
У вирусов нуклеиновые кислоты — относительно короткие цепочки. Наименьшие из известных имеют всего 1000–3000 пар звеньев. Начиная с бактерий геном существенно усложняется, хотя бактериальная ДНК также представлена одной молекулой, образующей единственную хромосому. Звеньев в ее цепи уже около трех миллионов. Бактериальные хромосомы — кольцевые, концы их состыкованы.
При делении клетки хромосома удваивается. Этот процесс осуществляет молекула фермента ДНК-полимеразы, похожая несколько на пуговицу с двумя отверстиями. ДНК-полимераза надевается на хромосому и движется по ней, пристраивая к каждой половине ДНК комплементарную ей половину. Эта реакция требует затраты энергии. Естественно, кольцо хромосомы должно при этом разорваться и потом воссоединиться, иначе дочерние кольца останутся связанными и не разойдутся по клеткам.
Каждая новая хромосома имеет одну половину от старой, а другую — синтезированную заново. Такое деление называется полуконсервативным.
Так же удваиваются гены в хромосомах высших организмов с оформленным ядром. Однако геном животных, растений и простейших устроен много сложнее, чем у бактерий, и содержит, кроме ДНК, комплексированные с нею белки. О структуре его до сих пор идут весьма оживленные дискуссии. Механизм многих явлений, наблюдавшихся издавна цитологами, пока еще остается неясным. Мы даже не знаем, состоит ли хромосома ядерных организмов из одной или нескольких молекул ДНК. На этом основании многие считают, что называть хромосомами генный аппарат бактерий неправильно, и предлагают другой термин — генофор, носитель генов. Но, в конце концов, дело не в названии.
РНК досталась не менее важная роль посредника между ДНК и белком, она же отвечает за перенос аминокислот к фабрикам белка — рибосомам и входит в состав тех же рибосом. Лишь у некоторых групп вирусов РНК переносит генетическую информацию от поколения к поколению. Трудно сказать, всегда ли гены этих вирусов были РНКовыми или же это явление вторично. Во всяком случае многие вирусы, в том числе первый из открытых — вирус табачной мозаики, отлично обходятся без ДНК.
Но так бывает далеко не всегда. Во многих случаях вирус не подавляет клетку своим бурным размножением, а предпочитает встроиться в геном хозяина, передаваясь его дочерним клеткам при каждом новом их делении. Разбойник становится приживальщиком. Это легко сделать ДНК-содержащим вирусам, но как быть РНК-содержащими? Выход один — стать ДНК-содержащими. В белковых оболочках таких вирусов есть особый фермент (обратная транскриптаза, или, как его еще называют, ревертаза), который синтезирует ДНК на нити РНК, и вновь синтезированная ДНК встраивается в геном хозяина. Это явление сейчас усиленно изучается — ведь оно широко распространено у онкогенных вирусов!
Одним из важнейших достижений биологии XX столетия является разгадка способа, при помощи которого генетическая информация закодирована в ДНК, и путей, которыми она передается на белок, а через белок определяет все признаки фенотипа. «Алфавит» жизни, генетический код, представляет тройные сочетания четырех нуклеотидов. Всего может быть 64 таких сочетания; из них 61 кодирует двадцать используемых в белках аминокислот, а три знаменуют окончание «белкового слова», на них синтез белка обрывается. Каждая из аминокислот кодируется несколькими сочетаниями нуклеотидов (триплетами, или, как их иногда называют, кодонами). Такой код называют вырожденным.
Слово «вырожденный» звучит неприятно и даже обидно. Однако ничего обидного в нем нет. Оно просто означает, что на каждую аминокислоту приходится не один, а несколько кодонов. Аналогию можно найти в языке — в соотношениях между звуками и буквами. Нередко одному звуку соответствует несколько букв. Так, в старорусской орфографии было два обозначения для звука «ф» (ферт и фита) и целых три для «и» («и» просто, «и» с точкой и редко применявшаяся ижица). Реформа 1917 года резко снизила вырожденность нашей орфографии, но не уничтожила ее. Именно поэтому Маяковский мог рифмовать — ленив, лифт, прилив — «в» и «ф» в конце слова читаются одинаково.
Какое же значение имеет вырожденность генетического кода для эволюции? Весьма большое — она значительно повышает надежность передачи информации с ДНК на белок. Сначала на матрице ДНК синтезируется так называемая информационная ДНК — так с исходных чертежей снимаются рабочие копии. При этом перекодировки не происходит — лишь тимин заменяется урацилом. На нити информационной РНК (сокращенно иРНК) синтезируются крошечными фабриками белка — рибосомами белковые молекулы. Как раз отсутствие рибосомного аппарата и заставляет вирусы быть облигатными, обязательными, паразитами.
Рибосома «считывает» генетическую информацию с иРНК, причем алфавит из 64 триплетов сменяется алфавитом из 20 аминокислот. Большая часть последних нуклеотидов в триплете необязательна для точного прочтения. Поэтому, если точковая мутация или ошибка считывания изменит третий нуклеотид, то беды не будет — в белок будет включена та же аминокислота и в том же месте.
А если мутация затронет первый или второй нуклеотид? Здесь положение сложнее, но отнюдь не безнадежно. Эта проблема — лишь часть гораздо более общего вопроса о так называемой неизбежной вредности мутаций.
Данные молекулярной биологии позволили по-новому оценить значение мутаций в эволюции. До сих пор распространено мнение о неизбежной вредности мутаций (излюбленная аналогия — попытка улучшить ход часов, ударяя их об стену). Сама по себе эта точка зрения довольно бессмысленна и недиалектична. Мутация вредна — но в каких условиях? Мы уже видели, что для обезьяны в условиях ее обычной диеты мутация в гене фермента, синтезирующего витамин С из глюкозы, безразлична, а у человека может стать причиной цинги. Есть и более эффектные примеры. Известны случаи, когда концентрация гена, летального для гомозигот, тем не менее поддерживается в популяции на высоком уровне, потому что гетерозиготы обладают большим селективным преимуществом.
У человека известна мутация, вызывающая серповидноклеточную анемию (ген S). При этой болезни эритроциты гомозигот имеют форму не круглой лепешки, а серпа. Кислород эти клетки связывают плохо, и рецессивные гомозиготы гибнут в младенчестве от анемии. Согласно уравнению Харди — Вейнберга, концентрация гена S должна быть низкой. На деле она достигает 36–40 % у ряда африканских племен. Оказалось, что гетерозиготы не заболевают малярией или сравнительно легко переносят ее. Установлена прямая связь между заболеваемостью малярией и частотой носительства гена S. Сходный эффект вызывают гены Т (средиземноморские страны) и некоторые другие. Любопытно, что гены, не обеспечивающие иммунитет к малярии, отбором не закрепляются (мутанты гемоглобина Пенджаб, Аравия, Сан-Хозе, названные так по месту обнаружения, и ряд других). Почему же ген S дает устойчивость к малярии?
Оказалось, что в гене S произошла точковая мутация, вызвавшая в строго определенном положении замену глутаминовой кислоты на другую аминокислоту — валин. В результате гемоглобин для малярийного плазмодия стал ядовитым.
Отсюда видно, что отбор исходит из интересов всей популяции и как бы равнодушен к судьбам отдельных особей. В результате вырабатывается механизм, при котором гомозиготы SS гибнут (в данном случае до миллиона детей ежегодно), но в целом популяция приспособлена к среде, где важным фактором является возбудитель малярии, из-за мутации, летальной для значительной ее части[10].
Кроме того, разные мутации по-разному изменяют фенотип. Сравним мутацию — с ампутацией: ампутация головы летальна, ампутация конечности понижает жизнеспособности организма. Но ведь возможны ампутация пальца, мозоли, злокачественной опухоли; они могут быть не только нейтральными, но и полезными.
В классической генетике чаще всего использовались для анализа мутации, довольно резко изменяющие строение фенотипа. Такие изменения генома действительно существенно снижали жизнеспособность фенотипа — вплоть до нуля. Анализ аминокислотных замен в белках открыл перед генетиками всю широту мутационных изменений. Прежде всего вырожденность кода приводит к тому, что далеко не каждая мутация изменяет аминокислотную последовательность. Если же замена произошла, например, не в функциональной части молекулы фермента и не изменила существенно ее структуры, свойства белка меняются очень незначительно. Эти-то ничтожные изменения, приводящие к сдвигу оптимальной зоны действия фермента, снижению или повышению его активности, большей или меньшей избирательности субстрата, и являются основным материалом для эволюционного процесса. Так по-новому осмысливается положение Дарвина: «Природа не делает скачков». Хотя каждая мутация — скачкообразное, качественное изменение генома (нуклеотид в триплете может быть либо тем, либо другим — середины нет), подавляющее большинство этих скачков лишь незначительно изменяют фенотип и создается неверное представление о постепенных количественных изменениях. Причина слабого воздействия большинства мутаций на фенотип — сохранение при мутации полярности аминокислот.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК