Глава 15. КАТАЛИЗАТОРЫ ЖИЗНИ
Глава 15.
КАТАЛИЗАТОРЫ ЖИЗНИ
Удобно также рассматривать дыхание и горение как родственные процессы, а человеческий организм — как аналог костра, раздуваемого кислородом и производящего углекислый газ. Но на самом деле между огнем и живым организмом существуют и значительные различия.
Во-первых, огонь — механизм однонаправленный: он превращает дерево или иное топливо в углекислый газ и воду, оставляя лишь пепел, и синтезировать новое топливо не способен. А живой организм, извлекая энергию из распада углеводов, жиров и белков в ходе реакций, схожих с горением, в то же время умеет и создавать запасы новых жиров и углеводов, а также — строить новые белки взамен старых (этот процесс я опишу позже). В растущем организме все эти сложные молекулы строятся даже быстрее, чем поглощаются, ведь в организме десятилетнего ребенка перечисленных веществ содержится больше, чем в организме семилетнего, хотя вроде бы они активно расходовались с того момента на протяжении трех лет.
При создании сложных молекулярных составляющих ткани уровень свободной энергии увеличивается (как мы вскоре увидим), и энтропия соответственно уменьшается. То есть происходит процесс обратный тому, какой в терминологии термодинамики называется спонтанным.
Еще в конце главы 5 я выдвинул предположение о том, что, возможно, принципиальное различие между живой и неживой материей заключается в возможности первой вызывать локальное уменьшение энтропии. Тогда я упоминал только об энтропии механической энергии («совершение усилий») и приводил в качестве примера способность живых существ двигаться против силы тяжести. Теперь мы видим также, что живая материя может вызывать уменьшение энтропии и относительно энергии химической, обладая способностью сформировывать крупные сложные молекулы из более простых, хотя все спонтанные реакции протекают, наоборот, от большого к малому.
Связь между жизнью и уменьшением энтропии становится еще нагляднее, но до четкого определения нам пока еще далеко. В главе 5 я уже указывал, что солнечное тепло испаряет океанскую воду, а силы, действующие в земной коре, воздвигают горы, и ни в первом, ни во втором случае явно не задействовано никаких структур, которые можно было бы отнести к «живым».
Помимо этих «безжизненных» примеров из области механической энергии можно найти аналогичные и из области энергии химической. Облучение растворов простых молекул ультрафиолетом приведет к образованию более сложных молекул, и множество фактов свидетельствует о том, что в первые миллионы лет существования Земли именно так и происходило в массовом порядке — жизни еще не было в принципе, а Солнце яростно облучало ультрафиолетом Мировой океан. На самом деле именно этим «безжизненным» процессам уменьшения энтропии применительно к химической энергии, скорее всего, и обязана своим возникновением сама жизнь.
Так искомый принцип различения снова ускользает от нас.
Однако не стоит обескураживаться. Ведь между огнем и живым существом есть и еще одно очевидное различие.
Огонь — очень горячий, а человек — нет. Да, человек поддерживает некоторое тепло в своем организме, но эти 37 °С ни в какое сравнение не идут с температурами пламени — 700 °С и выше. А в организмах холоднокровных животных процесс поглощения кислорода и производства углекислоты может проходить и при температурах около 0 °С.
Соответственно тут же вспоминаются условия, при которых реакции подобные горению могут запускаться при низких температурах. Вряд ли горючее, используемое организмом, воспламеняется легче, чем обычное топливо костра. Если взять те же самые пищевые продукты и просто положить их на стол при комнатной температуре, они не загорятся никогда и процесс соединения с кислородом будет происходить в них не быстрее, чем в древесине или угле. А вот в организме реакции соединения почему-то происходят достаточно легко и при температурах, которые никогда не поднимаются выше просто теплых.
Ученым XIX века оставалось только сделать единственно логичный вывод о существовании в живой ткани неких катализаторов, работающих по схеме, которую я описал в главе 12. На самом деле именно те катализаторы, которые вызывают горение в лабораторных условиях — палладий и платина, — в живой ткани не встречаются, но это может означать лишь то, что существуют и другие. И опять можно было задаться все тем же вопросом: являются ли эти биологические катализаторы таковыми в полном смысле слова и в соответствии с законами термодинамики, действуя так же слепо, как и порошок платины, или все же в данном случае нам удастся обнаружить некую «жизненную силу», стоящую над термодинамикой.
В среде химиков XIX века этот вопрос вызвал ожесточенные споры, и только благодаря ряду реакций, известных человечеству с доисторических времен, опыт перевесил аргументы сторонников существования «жизненной силы».
Во фруктовых соках, как и в замоченном зерне, как правило, со временем происходят некоторые изменения. Не всегда они оказываются желательными, но в некоторых случаях — и это обнаружили еще доисторические люди — человек, выпивший такую «подпортившуюся» жидкость, чувствовал приятное тепло и легкость. Со временем люди выяснили, что можно не просто выставлять сок и надеяться, что получится нужный результат, а добавлять в емкость с соком небольшое количество уже достигшей нужного состояния жидкости из предыдущей порции, и тогда изменения, во-первых, идут в нужном направлении, а во-вторых — гораздо быстрее.
Так же и в тесте, из которого пекут хлеб, иногда происходят реакции, приводящие к формированию углекислого газа. Пузырьки газа образуются по всей массе теста, и получающиеся в результате лепешки разительно отличаются от обычных — плотных и тяжелых. И в этом случае тоже перенос кусочка теста с пузырьками в емкость с обычным тестом приводит к распространению реакции по всему объему теста.
Все эти изменения вызываются такой вещью, как дрожжи. Образование пузырьков газа как в вине, так и в тесте очень похоже на «медленное кипение» вещества. В связи с этим в современной терминологии процесс, при котором поднимается тесто, фруктовый сок превращается в вино, а закваска зерновых — в пиво, называется «ферментацией», от латинского слова, означающего «кипеть».
С точки зрения химика XIX века действие дрожжей очень похоже на действие катализаторов. Кроме того, они явно отличаются от обычных лабораторных катализаторов своей органической природой и тем, что катализируют реакции близкие к происходящим в живой ткани. Логично было предположить, что если в живой ткани и предполагается обнаружить какие-то катализаторы, то они должны быть сродни скорее дрожжам, чем платине.
Но дрожжи оказались не просто катализатором — они сами по себе до странного походили на живое существо. Они не только оставались нерасходуемыми в ходе реакции, как обычные катализаторы, — они ухитрялись при этом еще и увеличиваться в объеме! В Первом послании к коринфянам о том же говорит и апостол Павел: «Малая закваска квасит все тесто».
Так и есть — а когда все тесто заквашено, то достаточно отщипнуть от него маленький кусок, чтобы с его помощью заквасить другое тесто, и так далее.
Но, несмотря на все свидетельства, принять дрожжи действительно за живое существо оказалось очень сложно. Широкое население запросто верило в существование множества невидимых глазу живых существ (ангелов, демонов, эльфов и прочих), но вот представление о том, что вполне обычные, не сказочные существа могут оказаться невидимыми только из-за своих крайне малых размеров, почему-то оказалось для общества гораздо менее приемлемым.
Но вот в XVII веке был изобретен микроскоп, и в 1675 году величайший из первых микроскопистов, голландский купец Антони ван Левенгук, сумел разглядеть в него «микроскопических животных». Это были одноклеточные существа, ныне именуемые «простейшими», длиной 0,005 см и менее, но не менее живые, чем мы с вами. Открытие Левенгука взбудоражило все научное сообщество до такой степени, что торговца-иностранца даже приняли в Лондонское королевское общество — элиту ученых джентльменов.
В 1680 году Левенгук, с неизмеримым терпением и любовью изучавший под микроскопом все вокруг, обратил свой взор и на дрожжи и выяснил, что они состоят из крошечных шариков. Факт существования микроорганизмов в то время просто заставлял искать жизнь где угодно, но дрожжевые шарики уж совсем никак не были похожи на активно плавающих простейших.
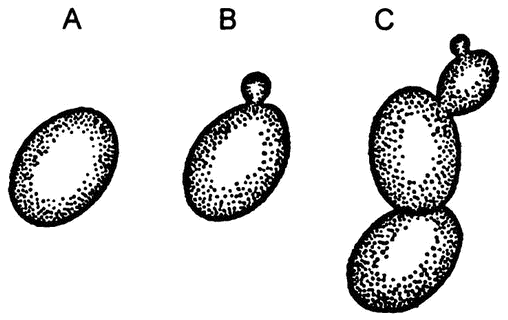
Рис. 22. Этапы размножения дрожжевых клеток почкованием
Однако в 1837 году французский физик Шарль Каньяр де Латур, изучая все те же дрожжи под микроскопом (а это был уже не тот примитивный микроскоп, с которым работал Левенгук), сумел застать эти крошечные шарики в момент отпочковывания (рис. 22). Почкование — это размножение, а где размножение, там и жизнь! Таким образом было получено свидетельство тому, что дрожжи — это одноклеточные существа, более близкие растениям, нежели животным, потому и неподвижные.
В 50-х и 60-х годах XIX века французский химик Луи Пастер в ряде своих классических опытов показал, что ферментизация — это результат жизнедеятельности таких микроорганизмов. Порча продуктов — например, образование кислого вина — это результат деятельности одних видов дрожжей, а получение нужных — например, хорошего вина — других. Да и гниение мяса Пастер наконец-то смог убедительно приписать результату жизнедеятельности микроорганизмов (не то чтобы до него об этом никто не догадывался, но никому не удавалось предоставить убедительных доказательств).
Короче говоря, реакции, которые раньше принято было объяснять работой «органических катализаторов», теперь оказались результатом деятельности живых существ. Сторонники теории «тайны жизни» воспрянули духом.
Конечно, занять старые позиции и вновь утверждать, что «жизненная сила» — это принципиальный критерий различения органической и неорганической материи, было уже невозможно, но вот вторая линия обороны уже казалась вполне надежной. Нельзя было отрицать, что химик в своей лаборатории может искусственно воспроизвести синтез органического вещества, но оставалась вера в то, что он не может сделать это тем же путем, что и природа. Химик прибегает для этого к помощи высоких температур и давлений, сильнодействующих химических веществ или не встречающихся в природе катализаторов. И лишь существа, наделенные жизненной силой, могут формировать те же органические вещества при нормальных условиях с использованием весьма слабых химикатов.
Опасность для таких воззрений появилась с другой стороны. Кроме газообмена кислорода и углекислоты при дыхании к числу наиболее доступных для изучения химических процессов, происходящих в человеческом организме, принадлежат процессы пищеварения.
Причиной тому факт, что организм по форме своей похож на булочку для хот-дога. И пищеварительный тракт — как отверстие для сосиски — пронизывает его насквозь, от начала до конца. Поскольку поместить что-то в отверстие для сосиски — это не то же самое, что заковырять это что-то в булочку, то и процессы пищеварения, проходящие в пищеварительном тракте, можно считать «внешними» для организма.
Практическая ценность этого факта заключается в том, что анализ содержимого пищеварительного тракта можно производить через ротовое отверстие без нанесения обследуемому каких-либо повреждений.
Еще в 1752 году Реомюр, изобретатель температурной шкалы Реомюра, занимался изучением процессов пищеварения у сокола. Целью его работы было установить, что же именно совершается в желудочно-кишечном тракте: просто ли механически перетирается пища или происходят какие-то более тонкие изменения. Ученый заставлял сокола глотать металлические трубочки, внутри которых находились кусочки мяса. Металлическая трубочка была призвана защищать мясо от любого механического воздействия; по торцам трубки были закрыты проволочными сетками, сквозь которые легко мог проходить желудочный сок.
После того как сокол отрыгивал трубки (хищные птицы, как правило, заглатывают пищу целиком, а потом отрыгивают непереваренное), Реомюр видел, что мясо растворилось, а трубки полны чистой жидкостью. При этом запаха гниения не наблюдалось, так что ученый сделал вывод, что здесь имеет место некая другая реакция, не гниение, а что-то сродни ферментации.
Другие исследователи в течение последующих десятилетий установили, что содержание желудка — кислотная среда, а в 1824 году Уильям Прут выяснил, какая именно кислота в нем представлена — соляная. К тому времени было уже хорошо известно, что кислота — это хороший катализатор таких реакций, как распад крахмала и белков на мелкие молекулы, так что ответ на вопрос о механизмах пищеварения родился сам собой — это кислотный катализ.
Однако дальнейшие исследования показали, что в желудочном соке содержатся и другие вещества, раствор которых оказывает разлагающее действие на мясо и которые не являются при этом кислотами. В 1835 году немецкий натуралист Теодор Шванн выделил из желудочного сока порошок, не являющийся кислотой, но при этом очень активно разлагающий мясо. Ученый назвал его «пепсином», от греческого слова, означающего «переваривание».
Это открытие оказалось новостью. Пепсин представлял собой одновременно и катализатор, и вещество совершенно органической природы. Такой органический катализатор назвали ферментом, поскольку тогда казалось, что ферментизация и пищеварение — явления одной природы.
В это же время двое французских ученых, Ансельм Пайен и Ж.-Ф. Персо, произвели нечто подобное в отношении экстракта из солода (вымоченного ячменя). В 1833 году они получили фермент, способный расщеплять крахмал на сахар. Сахар этот получил название «мальтоза», от английского «malt» — «солод», а сам фермент — «диастаза». Пайен оказался первопроходцем в деле присвоения имен классам химических веществ. Введенный им термин «целлюлоза» завел моду на окончание «-оза» для Сахаров, а со введением названия «диастаза» и все остальные ученые стали давать открываемым ферментам названия, заканчивающиеся на «-аза» (правда, в течение какого-то периода ферментам, задействованным в пищеварении, все же давали окончания на «-ин», по аналогии с пепсином).
А выделение различных ферментов — продолжалось. Немецкий химик Юстус фон Либих, вместе с Вёлером, занимался изучением экстрактов горького миндаля — к тому моменту было уже известно, что его действие приводит к распаду вещества растительного происхождения под названием «амигдалин». К 1837 году ученые решили, что в экстракте содержится некий фермент, которому было дано название «эмульсин». Тогда же французский химик Опост Пьер Дюбранфо сумел выделить из дрожжей экстракт, с помощью которого можно было вызывать распад сахарозы на более простые сахара — глюкозу и фруктозу. Он назвал это вещество «инвертазой».
Как оказалось, механизмы действия ферментов, как и катализаторов, совершенно не нарушают законов термодинамики. Ферменты изменяют лишь скорость реакции, но никак не положение точки равновесия (см. главу 9). В этом отношении оказалось, что живые организмы не имеют особенных свойств, которых был бы лишен мир неживой природы.
Однако позицию сторонников «жизненной силы» такие рассуждения могли лишь пошатнуть, но не разрушить. Да, все эти выделенные ферменты — органические вещества, и они способны катализировать определенные реакции, но лишь те (по крайней мере, так казалось в тот момент), которые сходны с расщеплением продуктов в пищеварительном тракте. А все процессы, происходящие в пищеварительном тракте, нельзя рассматривать как «жизненные» в полном смысле слова, поскольку они проходят вне живых тканей.
Далее сторонники «жизненной силы» настаивали на том, что изолированные ферменты не способны и никогда не будут способны катализировать реакции, происходящие внутри самих тканей, например превращать раствор сахара в спирт. На такое способны только цельные живые клетки дрожжей, и внутриклеточный энергообмен все еще оставался делом загадочным.
Для того чтобы еще больше подчеркнуть важность «духа жизни», они ввели разделение ферментов на две категории — на участвующие и не участвующие в процессах жизнедеятельности, назвав первые «организованными ферментами», а вторые, соответственно, «неорганизованными».
В 1876 году немецкий физиолог Вильгельм Кюне продвинулся еще на один шаг дальше. Он предложил оставить термин «фермент» только для жизненных процессов, а все неорганизованные ферменты, действующие и в отсутствие какой-либо жизни, назвать по-другому, «энзимами», что по-гречески означает «в дрожжах», поскольку одним из источников добычи этих ферментов могут служить дрожжи.
Итак, сторонники «жизненной силы» мудро отступали, сдавая одну позицию за другой, но сохраняя при этом нетронутым сам принцип своей веры, на протяжении всего XIX века. Принцип же этот заключался в том, что живая материя вследствие присутствия в ней «жизненной силы» подчиняется иным законам, нежели те, что известны нам из наблюдений и экспериментов над неживой природой.
Но вот в 1897 году немецкий химик Эдуард Бухнер решил как-то раз приготовить себе для экспериментов как можно более цельный дрожжевой экстракт. Для этого ученый тщательно перемолол дрожжевые клетки песком и профильтровал полученную массу, получив таким образом чистый сок дрожжей без единой живой клетки.
По принятым в те годы воззрениям сторонников «жизненной силы», такой дрожжевой сок являлся мертвым, а значит — и неспособным к ферментированию сахара. Так что Бухнер решил, что лучшим способом предохранить экстракт от бактериального заражения будет залить его насыщенным раствором сахарозы, известной своим свойством консервировать продукты. Однако, к его вящему удивлению, добавленная в экстракт сахароза принялась ферментироваться. Сначала в растворе стали заметны пузырьки углекислого газа, а потом — обнаружился спирт.
Процесс такой ферментации, до того считавшийся прерогативой исключительно живых существ, в данном случае оказался вызванным мертвыми химическими веществами, и именно этот факт оказался смертельным ударом по представлениям о «жизненной силе». Оказалось, что с точки зрения энергетического обмена поведение «организованных» и «неорганизованных» ферментов ничем не различается. Так стало очевидно, что законы термодинамики работают и в клетках, и вне клеток, и вообще везде.
Ферменты производятся, как правило, живыми существами, но сами по себе они таковыми не являются, и действие их не имеет никакого отношения к жизни.
Но просто назвать органические катализаторы, являющиеся свойством живой материи, «ферментами» или «энзимами» — явно недостаточно, чтобы объяснить механизм их действия.
Умы биохимиков конца XIX — начала XX века были заняты вопросом о том, какова же на самом деле природа ферментов. Как свидетельствует накопленный к этому времени уже в достаточном количестве опыт работы с катализаторами реакций неорганической химии, для осуществления реакции требуется присутствие крайне малого количества катализатора, так что вполне вероятно было предположить, что экстракты ферментов способны полноценно катализировать реакции, содержа при этом слишком мало самого фермента, чтобы его можно было полноценно проанализировать. (Впоследствии оказалось, что так оно и есть.) Кроме того, любая вытяжка из живой ткани содержит столько различных веществ сложнейшего строения, что надо обладать терпением Иова и мудростью Соломона, чтобы понять, какое же из них является ферментом, если он вообще присутствует.
Так что оставалось только изобретать непрямые подходы. Если реакция идет, значит, фермент присутствует, если реакция не идет, значит, фермент отсутствует; тогда любое условие, при котором реакция останавливается (кроме, конечно, замены самих реагирующих веществ), можно трактовать как выключение действия фермента.
К примеру, слабое нагревание до температур, еще далеких до температуры кипения воды, как правило, приводит к тому, что через несколько минут катализируемая ферментом реакция останавливается. На реагирующие вещества при этом никакого эффекта не оказывается, поскольку если их отдельно нагреть, потом остудить, а потом опять добавить к ним раствор фермента, то реакция сразу же начнется снова. А вот если нагреть, а потом остудить раствор фермента и добавить его к реагирующим веществам, то никакой реакции не произойдет. Значит, нагревание однозначно воздействует как-то на молекулу фермента, которая обладает слабой устойчивостью к высоким температурам.
Таким свойством обладают вещества одной группы — белки. Значит, ферменты — это белки? Начался сбор данных, свидетельствующих в пользу этого предположения. Стали пробовать другие виды воздействий, известных свойством приводить к распаду сложных белковых молекул (например, повышение кислотности среды или механическое взбивание раствора), и все они тоже приводили к прекращению реакций, катализируемых ферментами. Тот же эффект на реакцию оказывало и воздействие химических веществ, имеющих свойство связывать белки. Часто к прерыванию реакций, катализируемых ферментами, приводило и воздействие других ферментов, катализирующих распад белков. На основе всех этих косвенных данных в начале XX века общепринятым стало представление о том, что ферменты — это белки.
Однако в 1920 году немецкий химик Рихард Вильштеттер результатами своих работ заставил усомниться в справедливости такого воззрения. Он задался целью получить как можно более концентрированную вытяжку фермента, очистить ее от всего, от чего только получится. В итоге у ученого получился раствор с высокой каталитической активностью (что свидетельствует о наличии высокой концентрации фермента), но полностью лишенный какой бы то ни было белковой составляющей. Вильштеттер использовал все известные тесты на наличие белка в полученном растворе — и все они давали отрицательный результат. Белка не было.
Конечно, можно было предположить, что сам фермент содержится в растворе в неуловимо малом количестве, или сослаться на несовершенство тестов того времени (собственно, и то и другое впоследствии подтвердилось), но Вильштеттер оказался не столь скрупулезен. Он сделал четкий вывод: чем бы ни был фермент, это уж точно не белок. Ко мнению Вильштеттера — известного химика, лауреата Нобелевской премии — не могли не прислушаться, и представление о том, что фермент — это белок, исчезло из научной картины мира лет на десять.
А между тем в Америке мирно работал биохимик по имени Джеймс Батчеллор Самнер, занимаясь изучением растения под названием «карна-валия мечевидная». Из этого растения ученый извлек вытяжку, которая катализировала распад мочевины на аммиак и углекислоту. По общепринятым правилам, новооткрытый фермент получил название «уреаза». Дальше Самнер выделил из уреазы маленькие кристаллики, раствор которых в чистой воде, как обнаружил химик, к своему удивлению, оказывал то же действие, что и сама уреаза.
Как ни старался Самнер в дальнейшем добиться действия вытяжки в отсутствие кристаллов, этого сделать не удалось. Разрушались кристаллы — прекращалось и действие, и в конце концов Самнер решил, что в кристаллической форме ему удалось выявить сам фермент. А поскольку результаты всех тестов свидетельствовали о том, что кристаллы состоят из белкового вещества, то пришлось признать, что как минимум один конкретный фермент — уреаза — все же является белком.
Авторитет Вильштеттера был так велик, что сперва открытию Самнера особого значения никто не придал. Но в 1930 году еще один американский биохимик, Джон Говард Нортроп, объявил, что ему с коллегами удалось выделить в кристаллической форме еще несколько ферментов, и среди них — пепсин. Тут же последовал ряд аналогичных достижений со стороны других ученых, и всякий раз выделенные кристаллы оказывались белками.
Так теория Вильштеттера рассыпалась под напором фактов, и в 30-х годах XX века навсегда было установлено, что ферменты принадлежат к белкам. Так что сейчас мы смело можем говорить о том, что ферменты — это «белковые катализаторы», или «катализирующие белки».
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава XIX Бастионы Реки жизни
Глава XIX Бастионы Реки жизни Кровь — надежный защитник человека от множества болезней. Самыми разнообразными способами, подчас столь неясными, что нам приходится лишь догадываться о них, кровь защищает нас от кишащих повсюду патогенных организмов.Некоторые элементы
Глава 4 Классификация жизни
Глава 4 Классификация жизни Спонтанное размножениеОткрытия, сделанные благодаря микроскопу, высветили различия между живой и неживой материей. Вновь стали актуальными вопросы, которые казались закрытыми. Эти вопросы касались возникновения жизни или, по крайней
Глава 1. Происхождение жизни
Глава 1. Происхождение жизни Вопрос о происхождении жизни волнует всех, и очень жаль, что он пока еще далек от разрешения. Основная сложность тут в том, что путь от неорганических молекул к первой живой клетке был долгим и трудным. За один шаг такие превращения не
Глава 10. О правильном дереве жизни
Глава 10. О правильном дереве жизни Эта книга посвящена эволюции, как, главным образом, решению проблемы сложности «проекта»; эволюции, как правильному объяснению явлений, которые Пали полагал доказательствами существования божественного часовщика. Именно поэтому я всё
Глава 14 ПОЧВА НА СЛУЖБЕ ЖИЗНИ
Глава 14 ПОЧВА НА СЛУЖБЕ ЖИЗНИ Проницательный Карвер нашел способ восстановить истощенные хлопком почвы Алабамы путем чередования культур и внесения натуральных органических удобрений. Однако после его смерти химические корпорации начали массированную обработку
Глава II. Вирусы в природе и жизни человека
Глава II. Вирусы в природе и жизни человека
Глава 2 Вода — основа жизни
Глава 2 Вода — основа жизни Жизнь возникла благодаря воде. Химические реакции, происходящие в живых тканях, требуют участия молекул, плавающих в воде или находящихся на поверхности мембран, которые омываются водой. Эти реакции часто и происходят с участием самих молекул
Глава 2. Молекулярные основы жизни
Глава 2. Молекулярные основы жизни Фундаментальную роль в структуре живой материи играет первый уровень ее организации – молекулярный. На этом уровне анализируются химические вещества, составляющие живой организм, взаимосвязь их структуры и функции.Все имеющиеся в
Глава 1. Росчерк жизни
Глава 1. Росчерк жизни Я держу в руках прозрачную круглую коробочку и смотрю в окно. Всюду жизнь: двор зарос овсяницей и клевером, зверобой тянет листочки к солнцу и приманивает цветками жужжащих шмелей. Рыжий кот притаился под кустом сирени и, задрав голову, выслеживает
Глава 1. Происхождение жизни
Глава 1. Происхождение жизни Планета бешено вращалась. Ночь и день сменяли друг друга с головокружительной быстротой: день длился всего пять-шесть часов. Тяжелая Луна угрожающе висела в небе (гораздо ближе, чем сегодня), отчего казалась крупнее. Звезды выглядывали редко,
Глава V. Дерево жизни
Глава V. Дерево жизни Идея построения дерева эволюции восходит к Чарльзу Дарвину, допустившему возможность происхождения всего многообразного живого мира от единственной клетки (Рис. 4А). Это суждение для середины девятнадцатого века было еще более революционным, чем
Глава 4. Сущность жизни
Глава 4. Сущность жизни Дать краткое определение «жизни» или «живого» не просто. Конечно, под «живым» я не обязательно имею в виду думающее или чувствующее существо, поскольку для биолога растения несомненно являются живыми, а некоторые люди (не считая немногих
Глава 4. Поле нашей жизни
Глава 4. Поле нашей жизни Гравитация как носитель информации При обсуждении одной из тем этой книги нетерпеливый комментатор выразил неудовольствие, которое, думаю, могут выразить и другие читатели: «Читаю-читаю, жду-жду, когда же вы все-таки к результату-то придете, а вы