Глава 7. ЧАСТИЦЫ, УДЕРЖИВАЕМЫЕ ВМЕСТЕ
Глава 7.
ЧАСТИЦЫ, УДЕРЖИВАЕМЫЕ ВМЕСТЕ
Соблазнительно было бы думать о человеческом организме (и вообще о живой ткани) как о механизме, извлекающем работу из равномерно нагретой системы просто в силу каких-то особых своих свойств, позволяющих противодействовать энтропии. Ведь в конце пятой главы я уже начал было описывать живую материю в терминах энтропии.
Однако давайте не будем сосредоточиваться на тепле исключительно как на источнике работы только потому, что этим занимались на заре возникновения термодинамики. Формулировка второго закона этой науки, выдвинутая Кельвином, гласила, что тепло невозможно перевести в работу при условии отсутствия разности температур, но ведь, помимо тепла, существуют еще и другие виды энергии! Падающий камень совершает работу, несмотря на тот факт, что температура его в точности равняется как температуре вершины скалы, на которой он лежал, так и температуре подножия, на которое он падает. Важна не разность температур, а разность потенциалов энергии.
В таком случае остается установить, какую же именно энергию используют живые организмы, извлекая из нее работу. Но жизнь — слишком сложное явление, чтобы постичь его с наскоку, и для начала надо взять что-нибудь попроще.
Вернемся к тепловым машинам и зададимся вопросом: откуда берется энергия для изначального нагрева горячей камеры? Ответ прост — она получается в процессе горения. Дерево, уголь, нефтепродукты или газ сжигаются, и полученная в этом процессе энергия нагревает воду до состояния пара, что и делает возможным функционирование тепловых машин. Да, для того, чтобы запустить процесс горения, любое топливо надо сначала поджечь, но количество энергии, получаемой во время горения, во много раз больше, чем количество энергии, изначально затраченной на поджигание. Так откуда же берется эта энергия?
Это крайне важный для нас вопрос, поскольку, как я расскажу позже, достаточно давно было подмечено, что между горением угля и дыханием живых существ есть что-то общее. Казалось, что, если удастся найти источник энергии, таящейся, скажем, в холодном угле, нашедший его окажется на прямом пути к открытию источника энергии человеческого организма.
Так или иначе, давайте попробуем.
В XVIII столетии, на пике популярности теорий неуловимых флюидов, считалось, что уголь — это пример вещества полного флогистона. Считалось, что в процессе горения флогистон высвобождается и именно этот процесс и порождает выделение тепла и света, составляющих горение. Однако эта теория содержала в себе неустранимые внутренние противоречия, за что Лавуазье ее и разгромил.
Теперь требовалось новое объяснение того, каков же источник высвобождаемой при горении энергии, и до появления теории атомов этот пробел так и не был заполнен.
Ключевую подсказку к правильному ответу я уже привел в предыдущей главе, там, где упоминал эффект Джоуля—Томсона. (Напомню: газ, расширяющийся в вакууме, производит работу, поскольку молекулам при центробежном движении приходится преодолевать существующую между ними слабую силу притяжения.)
Значит, между молекулами существует сила притяжения, так же как и между небесными телами. Как существование силы гравитационного притяжения является основой для самого понятия о «потенциальной энергии», так и существование межмолекулярного притяжения является основой для некоего понятия, которое можно по аналогии назвать «химической энергией».
Возьмем, скажем, лед. Он состоит из молекул воды, находящихся в непосредственном контакте друг с другом и расположенных в строгом порядке. (Я не буду углубляться в доказательство этих фактов, упомяну лишь, что такой порядок атомов или молекул называется «кристаллическим» и что большую часть твердых веществ можно привести к кристаллическому виду.)
При заданной температуре ниже 0 °С отдельные молекулы в составе кристалла вибрируют в рамках выделенного им места. Однако кинетической энергии подобных вибраций недостаточно, чтобы преодолеть силу межмолекулярного притяжения, которое удерживает молекулы вместе так, что все молекулы продолжают оставаться на своих местах.
Если лед начать нагревать, молекулы будут вибрировать все быстрее и кинетическая энергия, которой они обладают, будет становиться все больше. По достижении температуры в 0 °С кинетическая энергия молекул становится достаточно мощной, чтобы преодолеть силу межмолекулярного притяжения, и кристалл льда распадается. Отдельные молекулы начинают свободно перемещаться по общему объему вещества — они больше не привязаны к конкретному месту в общей структуре. Короче говоря, твердый лед начинает таять и превращается в жидкую воду.
По мере дальнейшего нагревания тающего льда поступающее тепло не переходит в увеличение кинетической энергии отдельных молекул и, соответственно, температура не повышается. Вместо этого вся поступающая тепловая энергия тратится на преодоление силы межмолекулярного притяжения, так что лед продолжает таять. Молекулы талой воды в образующейся слякоти не обладают большей кинетической энергией, чем те молекулы воды, что еще связаны в кристаллической структуре, так что температура образующейся жидкости не выше температуры еще не растаявших кристаллов льда. Тем не менее в какой-то форме вода все же должна содержать больше энергии, чем лед, ведь молекулы воды сумели преодолеть силу, удерживающую их в кристалле, а молекулы льда — нет. Эта форма энергии и есть та «химическая» энергия, о которой я упомянул.
Таким образом, молекулы жидкой воды при температуре 0 °С содержат больше химической энергии, чем молекулы льда при той же температуре. Когда лед тает, получаемое тепло переводится в химическую энергию, а не в кинетическую, поэтому в процессе таяния температура льда не повышается. Лишь после того, как весь лед растает, получаемое тепло снова будет переходить в кинетическую энергию и приводить к дальнейшему повышению температуры.
На процесс перевода грамма льда с температурой 0 °С в грамм воды с той же температурой тратится 80 калорий, так что каждый грамм жидкой воды содержит на 80 калорий химической энергии больше, чем грамм льда с той же температурой. Именно это латентное тепло плавления открыл Блэк в период господства теории теплорода. Он не сумел внятно объяснить этот феномен (хотя и совершил героическую попытку сделать это), поскольку в своей теоретической базе использовал лишь «невесомые флюиды». Нам в этом отношении повезло больше.
Но ведь это еще не все. В жидкой воде (как и в любой жидкости) составляющие ее молекулы не закреплены в каком-либо определенном месте, но продолжают оставаться в непосредственном контакте, скользя друг по другу. От обретения дальнейшей независимости молекулы все же удерживаются некими силами. Дальнейшее нагревание жидкости приводит к двум следствиям. Часть тепла переводится в кинетическую энергию, так что молекулы начинают вибрировать быстрее, и температура жидкости повышается. Другая часть переходит в химическую энергию, придавая молекулам способность оторваться от остальных без повышения температуры. Так образуется пар.
При любой температуре вода (как и любая жидкость) в тех или иных масштабах испаряется. Если жидкость находится в закрытом сосуде, то часть пара обязательно конденсируется обратно в жидкость и устанавливается некое равновесие, так что при каждой заданной температуре существует свойственное ей определенное давление пара. Чем выше температура, тем выше это давление.
В обычных обстоятельствах атмосферное давление выше, чем давление водяного пара, и оно не дает молекулам воды масштабно отрываться от жидкости. Однако при температуре 100 °С давление пара сравнимо по силе с атмосферным, и вода, преодолев атмосферное сопротивление, начинает испаряться с максимальной интенсивностью — мы называем этот процесс кипением. Естественно, при более низком атмосферном давлении давление пара уравнивается с ним при более низкой температуре. Поэтому на большой высоте вода кипит при меньших температурах, и задача сварить яйцо вкрутую там приобретает особую сложность.
Пока вода кипит, все получаемое тепло переходит в химическую энергию, и вода с температурой 100 °С переводится в пар с такой же температурой. И опять же, грамм пара с температурой 100 °С содержит на 540 калорий больше, чем один грамм воды с той же температурой. Это латентное тепло кипения.
Естественно, когда пар конденсируется обратно в воду, он должен вернуть эту химическую энергию, которая переводится при этом снова в тепло. Поскольку грамм конденсирующегося пара отдает при этом 540 калорий, а грамм воды, остывающей затем со 100 °С до 0 °С, — всего 100, становится понятно, что большая часть работы, производимой паровым двигателем, получается за счет конденсации пара, а не за счет последующего остывания воды.
Водяной пар при любой температуре содержит больше химической энергии, чем жидкая вода при той же температуре. Именно поэтому при потении тело охлаждается. Химическая энергия, необходимая для испарения пота, берется из тепловой энергии тела, так что тело в результате остывает. Когда влажность воздуха так высока, что конденсация влаги практически уравновешивает ее испарение, пот собирается в капли, и мы говорим: «Проблема не в жаре, а во влажности».
Но и это еще не все. Молекула воды сама по себе не является простейшей частицей — нет, она состоит из трех атомов. Два из них — атомы водорода, один — кислорода. Три атома удерживаются воедино с помощью сил гораздо более крепких, чем те, что обеспечивают притяжение между соседними молекулами, настолько более крепких, что на ум сразу же приходят аналогии с веревками и канатами. Поэтому внутримолекулярные силы притяжения называют «химическими связями».
По мере нагревания воды (рис. 6) не только молекулы набирают кинетическую энергию и ускоряют вибрации — то же самое происходит и с составляющими эти молекулы атомами. Но даже когда вода нагревается достаточно для того, чтобы молекулы смогли разорвать все соединяющие их связи, полученной энергии еще недостаточно атомам, составляющим молекулу, чтобы разорвать куда более прочные внутримолекулярные связи. Даже водяной пар продолжает состоять из целых молекул воды.
Однако при температуре в несколько тысяч градусов энергия вибрации атомов приобретает достаточную силу, чтобы разорвать химические связи, и вода начинает разлагаться на водород и кислород. При температуре 3000 °С около четверти молекул воды распадаются на водород и кислород. Соответственно смесь водорода и кислорода содержит в себе больше химической энергии, чем аналогичная масса воды при той же температуре.
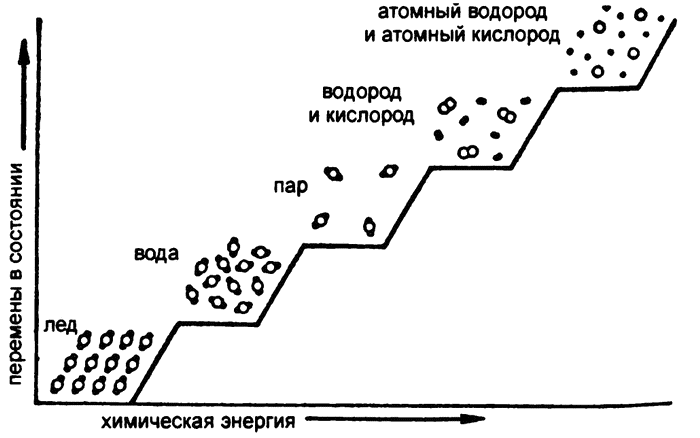
Рис. 6. Химическая энергия и распад молекул воды
Но и водород с кислородом, образующиеся из распавшейся воды, тоже еще не являются простыми частицами! Пока что это газы, молекула каждого из которых состоит из двух связанных между собой атомов. Связи между этими атомами тоже могут распасться, если вещество нагреть еще больше. При температуре около 3500 °С около четверти молекул кислорода распадается на единичные атомы (с получением так называемого «атомного кислорода»), а доля молекул водорода, распадающихся при той же температуре на атомный водород, — еще больше, около трети. И опять же, в атомной форме водород и кислород содержат больше химической энергии, чем молекулярный водород и кислород при той же температуре.
При еще более высоких температурах атомы и водорода и кислорода могут распадаться на еще более мелкие частицы, но в рамках нашей книги мы на этом остановимся.
Из всего сказанного видно, что связи межатомного и межмолекулярного притяжения имеют различную силу и что при разрыве или образовании одной конкретной связи или ее замещении на другую всегда происходит некое изменение (в ту или иную сторону) содержания в веществе химической энергии. В случаях, когда химическая энергия набирается, надо учитывать энергию, поступающую в других формах (чаще всего в тепловой), чтобы не создавалось впечатления нарушения первого закона термодинамики.
Теперь мы можем дать ответ на вопрос, откуда же берется энергия горящего угля. Тепло и свет, испускаемые при горении, возникают за счет потерь химической энергии, причиной которых являются изменения в природе химических связей в угле и атмосферном кислороде.
Для того чтобы дальше говорить о подробностях типов взаимодействий с учетом изменений в природе химических связей (то есть о химических реакциях), при которых производится энергия в форме тепла и света, нам необходимо выучить язык химических записей. Это нужно не для того, чтобы «наукообразить» наше повествование, а, наоборот, для того, чтобы читать было удобнее. К счастью, язык химических записей очень логичен и прост.
Начнем с того, что на данный момент известно 103 различных химических элемента, то есть 103 различных вида атомов. В рамках этой книги все 103 нам не понадобятся. Достаточно будет около дюжины самых важных.
У каждого элемента есть конечно же собственное название, будь то простое, например «железо», или сложное, например «празеодимий». Кроме названия, известного всем химикам в мире, у каждого элемента есть еще и всемирно принятое краткое обозначение. Это одна-две буквы латинского алфавита — первая буква названия элемента по-латыни плюс, в большинстве случаев, еще одна буква из названия.
Уже самые первые исследования структуры атомов показали, что основной параметр, по которому атомы разных видов различаются между собой, — это их масса. То есть отдельный атом углерода всегда в двенадцать раз массивнее отдельного атома водорода; отдельный атом магния в два раза массивнее отдельного атома углерода и так далее. Поэтому атомам различных химических элементов присвоены также номера, отражающие их относительную массу. Массе атома кислорода было произвольно присвоено значение 16,0000, исходя из чего с учетом пропорций и все прочие атомы получили свой «атомный вес»[3].
В таблице 1 я привожу несколько химических элементов, с которыми мы будем дальше иметь дело в этой книге, — их символические обозначения и атомные веса. Для последних приводятся самые точные значения по новым, 1961 года, стандартам. Однако нет никакой необходимости запоминать все десятые, сотые и тысячные доли. Большая часть значений атомных весов с легкостью округляется до целых единиц, и принято считать, что атомный вес водорода — 1, углерода — 12, натрия — 23, серы — 32 и так далее. Пожалуй, единственными случаями, когда десятичные цифры стоит брать в расчет, являются хлор с его 351/2 и магний с его 241/2.
Писать «С» вместо «углерод» или «Н» вместо «водород» быстрее и проще, особенно это важно для химиков, которые тратят большую часть времени
Таблица 1
СИМВОЛИЧЕСКИЕ ОБОЗНАЧЕНИЯ И АТОМНЫЕ ВЕСА
Элемент …… Обозначение … Атомный вес
Водород …… Н … 1,00797
Углерод …… С … 12,01115
Азот …… N … 14,0067
Кислород …… О … 15,9994
Натрий …… Na … 22,9898
Магний …… Mg … 24,312
Фосфор …… Р … 30,9738
Сера …… S … 32,064
Хлор …… Cl … 35,453
Калий …… K … 39,102
Железо …… Fe … 55,847
Йод …… I … 126,9044
при написании своих работ на указание названий элементов. Когда же речь заходит об обозначении молекул, состоящих из различных сочетаний атомов, экономия становится просто невероятной. Здесь использование символики перестает уже быть вопросом одной лишь экономии сил и времени, а становится важной составляющей ясности подхода; вы и сами поймете это по ходу книги.
Возьмем, к примеру, кислород. В нормальных условиях это газ, состоящий из молекул, каждая из которых состоит, в свою очередь, из 2 атомов кислорода. Следовательно, если мы просто говорим «кислород», то непонятно, что именно мы имеем в виду: атомы или молекулы. Можно, конечно, вносить ясность путем добавления уточняющих определений — говорить «атомный кислород» или «молекулярный кислород», но опять же, мало того что мы при этом чрезмерно усложняем речевой оборот, так к тому же цель еще и остается при этом не полностью достигнутой. Ведь есть еще, например, такая форма молекулярного кислорода, как озон, в котором молекула состоит не из двух, а из трех атомов.
Для упрощения и конкретизации вопроса нужно всего лишь дописать к символу — обозначению элемента циферку, и мы получаем химическую формулу вещества, которая сама по себе говорит нам о строении молекулы. Таким образом, просто О обозначает атомный кислород (совсем уж дотошные педанты могут записывать его как О2 но по умолчанию и так принято считать, что если символ написан без дополнительных цифровых обозначений, то подразумевается «1»).
Молекулярный кислород обычного типа пишется O2, а озон — О3.
Точно так же азот, водород и хлор — все они в обычном виде тоже представляют собой газы, состоящие из двухатомных молекул, и записываются так: N2, H2 и Cl2.
Не всегда предмет состоит из молекул четко определяемого состава. Например, кусок углеродного материала (например, угля) состоит из множества атомов углерода, объединенных между собой очень сложными химическими связями. В принципе кусок угля можно рассматривать как единую огромную молекулу. Однако для простоты химические элементы в твердом состоянии обозначает просто как атомы, игнорируя при этом реальные связи между этими атомами. Поэтому углерод в его твердом естественном состоянии обозначается просто как С.
Буквенно-цифровую систему можно использовать и в том случае, если молекула состоит из атомов нескольких разновидностей (такие вещества называют «сложными»). Так, например, формула сложного вещества хлороводорода (это газ, состоящий из двухатомных молекул, один из атомов которой — водород, а второй — хлор) записывается так: НСl.
Молекула воды, состоящая из 2 атомов водорода и 1 атома кислорода, записывается как Н2O (эту формулу знают все, даже те, кто не имеет ничего общего с химией), а формула углекислоты, состоящей из 1 атома углерода и 2 — водорода, обозначается как СO2.
Каждая молекула имеет свой молекулярный вес, равный сумме атомных весов всех составляющих ее атомов. Молекулярный вес молекулы кислорода, O2, равняется 16 + 16, то есть 32. Молекулярный вес углекислоты — 12 + 16 + 16 то есть 44, и так далее.
Формулы можно использовать для описания химических реакций более быстрым и точным образом, чем в словесном рассказе. Например: уголь, представляющий собой практически чистый углерод, при горении вступает в соединение с содержащимся в воздухе кислородом, в результате чего получается углекислота. Химическая реакция в данном случае записывается так:
С + O2 ? СO2.
Это можно перевести как «углерод плюс кислород равно углекислота», и является прекрасным примером химического выражения.
Таким же образом, водород вступает в соединение с кислородом, в результате чего получается вода. Это можно записать таким образом:
Н2 + O2 ? Н2O.
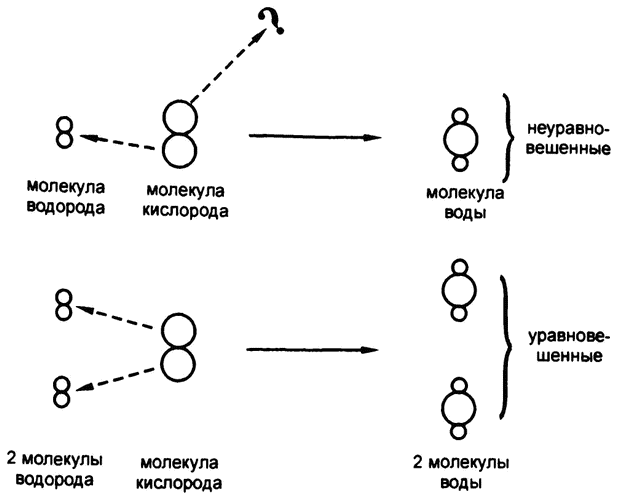
Рис. 7. Уравновешенные химические выражения
Но химиков такая запись не может полностью удовлетворить, и вот почему.
В первой из двух вышеприведенных реакций, где речь шла о сочетании углерода и кислорода, видно, что ни один атом не «остался без дела», все они закономерно перешли из левой части уравнения в правую. У нас изначально имеется 1 атом углерода (представляющий собой уголь) и 2 атома кислорода (представляющие собой молекулу кислорода), а в результате мы получаем 1 молекулу углекислоты, в которой содержатся и тот самый атом углерода, и те самые 2 атома кислорода.
Но вот во втором выражении, где речь идет о соединении водорода и кислорода, дело обстоит иначе. Здесь у нас с самого начала имеется 2 атома водорода (представляющие собой молекулу водорода) и 2 атома кислорода (представляющие собой молекулу кислорода), но в результате мы получаем молекулу воды, включающую в себя оба атома водорода, но при этом лишь один из двух атомов кислорода. Такая «неуравновешенная» запись процесса может ввести в заблуждение, поскольку позволяет предположить, что 1 атом кислорода просто исчез, чего на самом деле, понятно, случиться не могло. Более того, для того, чтобы использовать такие выражения для количественного расчета, они должны быть уравновешенными (рис. 7).
Для того чтобы уравновесить выражение, надо указать соответствующее количество для каждого участвующего в реакции элемента. Вот как выглядит уравновешенное выражение для соединения водорода и кислорода:
2Н2 + O2 ? 2Н2O.
В этом случае мы изначально берем 4 атома водорода и 2 атома кислорода и в результате имеем те же 4 атома водорода и 2 атома кислорода. Все сходится!
Конечно, можно написать
4Н2 + 2O2 ? 4Н2O
или
12Н2 + 602 ? 12Н2O
и, таким образом, тоже уравновесить выражение, но принято все же использовать наименьшую цифру из возможных.
Впрочем, если и принято использовать только целые числа в химических выражениях, то это правило не является универсальным. Когда речь идет о вырабатываемой в ходе химической реакции энергии (а именно об этом я и собираюсь рассказывать), часто удобнее бывает обозначать единый атом кислорода как 1/2O2. Это не совсем хорошо, поскольку может навести на мысль о том, что «полумолекулы» существуют на самом деле, а это не так. Однако с таким отображением удобнее вести энергетические расчеты, так что выражение для соединения водорода и кислорода можно записать и так:
H2 + 1/2O2 ? H2O.
В этом выражении мы изначально имеем 2 атома водорода и 1 атом кислорода (полмолекулы), а в результате получаем 2 атома водорода и 1 атом кислорода, так что выражение получается сбалансированным.
Можно привести пример подобного выражения и без участия кислорода. Водород и хлор вместе могут образовывать хлороводород, а натрий и хлор — хлорид натрия (это привычная нам поваренная соль). Эти процессы описываются такими выражениями:
Н2 + Cl2 ? 2НСl,
2Na + Cl2 ? 2NaCl.
Очевидно, что использование целых чисел — простейший способ записать выражения в уравновешенном виде.
Итак, ход химических реакций благодаря применению специальных обозначений стал нам понятнее, и теперь мы можем, как я уже говорил, использовать эти выражения для различного рода вычислений.
Возьмем, к примеру, выражение, представляющее соединение водорода и хлора:
Н2 + Cl2 ? 2НСl.
Оно показывает, что в ходе химической реакции одна молекула водорода реагирует с 1 молекулой хлора для создания 2 молекул хлороводорода. В реакцию вступают равные количества молекул водорода и хлора — один к одному, два к двум, десять к десяти, миллиард к миллиарду. Однако это не значит, что и массы вступающих в реакцию газов будут одинаковы, поскольку одна молекула хлора гораздо тяжелее, чем одна молекула водорода; соответственно и масса участвующего в реакции хлора будет больше, чем реакция участвующего в ней же водорода.
Поскольку атомный вес водорода равен 1, а хлора — 351/2, то молекулярный вес Н2 равен 1 + 1, то есть 2, а молекулярный вес Cl2 равен 351/2 + 351/2, то есть 71. Вне зависимости от того, сколько пар молекул — по одной молекуле хлора и водорода — вступают в реакцию, отношение их масс всегда будет составлять 2:71. Так, две унции водорода вступят в реакцию с 71 унцией хлора; два фунта водорода — с 71 фунтом хлора; две тонны водорода — с 71 тонной хлора и так далее.
Удобнее всего, конечно, рассматривать, как и принято в химической науке, 2 грамма водорода и 71 грамм хлора.
Еще до того, как были установлены подробности касательно атомного строения молекул, химики уже выяснили путем точных измерений, что 2 грамма водорода вступают в реакцию с 71 граммом хлора. И только после того, как в результате долгих наблюдений они поняли, что хлор с водородом соединяются 1:1, был сделан вывод о том, что молекула хлора в 351/2 раза тяжелее молекулы водорода и что атом хлора в 35У2 раза тяжелее атома водорода. Именно отношение весов в сочетаниях и позволило впервые установить значения атомных весов различных химических элементов.
Впоследствии оказалось, что количество молекул водорода в 2 граммах этого вещества равняется примерно 6O2 000 000 000 000 000 000 000.
Это огромное число принято называть «числом Авогадро», поскольку установлено оно было в ходе исследований, которые проводил итальянский химик Амадео Авогадро примерно в 1810 году. Число Авогадро обычно обозначают N, и, поскольку это гораздо проще, чем писать его целиком, именно так я и буду его в дальнейшем приводить.
Таким образом, можно сказать, что N молекул Н2 весят 2 грамма. Поскольку отдельная молекула Cl2 в 351/2 раза массивнее, чем отдельная молекула Н2, то N молекул Cl2 тоже должны весить в 351/2 раза больше, чем N молекул Н2. Поэтому вес N молекул Cl2 должен составлять 2 х 351/2, то есть 71 грамм.
Подобные рассуждения справедливы для любых молекул. Вес N молекул любого вещества относится к весу N молекул водорода как вес одной молекулы этого вещества к весу N молекул водорода.
Число N было выбрано по той причине, что вес N молекул водорода равняется молекулярному весу водорода в граммах. То есть молекулярный вес водорода — 2, а вес N молекул водорода — 2 грамма. И, согласно описанным в предыдущем абзаце пропорциям, N молекул любого вещества будут иметь вес равный молекулярному весу этого вещества, выраженному в граммах. Как уже быkо установлено, N молекул Cl2 весит 71 грамм, а молекулярный вес хлора — 71.
Поскольку молекулярный вес воды, H2O, равен 1 + 1 + 16, то есть 18, то мы сразу же можем сказать, что N молекул воды будут весить 18 граммов, а N молекул углекислоты (молекулярный вес которой — 44) будут весить 44 грамма.
Вес равный молекулярному весу вещества, только в граммах, называют «грамм-молекулярным», или «молярным», а количество вещества в таком случае получило название «моль». Так что N молекул любого вещества — это 1 моль этого вещества. Один моль водорода весит 2 грамма, 1 моль воды — 18 граммов, 1 моль углекислоты — 44 грамма и так далее. Веса во всех этих случаях различны, но количество вещества определяется не весом, а количеством молекул.
Естественно, все вышеизложенное справедливо и для отдельных атомов. Так, N атомов углерода (С) весят 12 граммов, а N атомов серы (S) весят 32 грамма. Атомный вес, выраженный в граммах, правильнее было бы называть «грамм-атомным» весом. Однако простоты ради я буду использовать термин «моль» применительно и к грамм-молекулярному, и к грамм-атомному весу.
Таким образом, химические выражения могут трактоваться двояко. Они описывают как поведение одного атома или одной молекулы, так и поведение N атомов или молекул. К примеру, выражение
2Н2 + O2 ? 2H2O
можно читать как «две молекулы водорода плюс одна молекула кислорода переходят в две молекулы воды», а можно как «два моля водорода плюс один моль кислорода переходят в два моля воды». Поскольку молекулярные веса водорода, кислорода и воды составляют 2,32 и 18, то 1 моль каждого из них весит соответственно 2 грамма, 32 грамма и 18 граммов. Так что вышеприведенное выражение можно прочесть и так: «4 грамма водорода плюс 32 грамма кислорода переходят в 36 граммов воды».
Как видно, закон сохранения материи при этом не нарушается. Изначально мы имеем 36 граммов водорода и кислорода, а в итоге — 36 граммов воды. Это справедливо только тогда, когда выражение записано в уравновешенной форме.
Еще раз: видя перед собой выражение типа
С + O2 ? CO2,
мы можем прочесть его трояко:
а) «один атом углерода плюс одна молекула кислорода переходят в одну молекулу углекислоты»;
б) «один моль углерода плюс один моль кислорода переходят в один моль углекислоты»;
в) «12 граммов углерода плюс 32 грамма кислорода переходят в 44 грамма углекислоты».
Вот мы и освоили язык химических формул в том объеме, который будет необходим нам для рассуждений об изменении энергетического содержания веществ в ходе химических реакций аналогичных (хочется верить) тем, что происходят в организме человека.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
ГЛАВА V.
ГЛАВА V. Влияние обработки на образование слоя плодородной почвы. Какое значение для земледелия будет иметь учение, утверждающее, что при обработке верхний слой почвы надо оставлять на поверхности? Обогатит ли вообще новая система обработки перегноем почву, в частности
ГЛАВА VII.
ГЛАВА VII. Условия усваивания растениями питательных веществ, находящихся в почве и атмосфере. Недостатки глубокой обработки. Проницаемость почвы для воздуха.В предыдущей главе мы указали, что почва и атмосфера содержат питательные для растений вещества в количестве,
ГЛАВА IX.
ГЛАВА IX. Углекислота в почве.Многие ученые объясняют богатую растительность древних времен тем, что тогда атмосфера содержала больше кислоты, чем теперь. Поэтому-то Либих был того мнения, что и в настоящее время, если желаем получить самый обильный урожай наших
10. Вместе тесно, а врозь скучно
10. Вместе тесно, а врозь скучно Если посмотреть глубже, то окажется, что во всякой гармонии интересов таится скрытый и только отложенный конфликт. Ибо там, где господствует только личный интерес, ничто не сдерживает сталкивающиеся эгоизмы, каждое «я» находится
Вместе, вместе!
Вместе, вместе! Локомоционные движения наиболее простые и однообразные, поскольку они обусловлены субстратом, по которому передвигается животное. Врожденный характер локомоционных движений проявляется четко. Животное только совершенствует эти движения и учится
НАМ ЖИТЬ ВМЕСТЕ
НАМ ЖИТЬ ВМЕСТЕ Феромоны — лишь часть программы биологических методов в применяемой ныне системе защиты урожая от вредителей. Им в настоящее время уделяют все большее и большее внимание во всех странах.Дело в том, что проблема взаимодействия пестицидов и окружающей
В каком диапазоне Земля по яркости сравнима с Солнцем и многократно превосходит все остальные планеты Солнечной системы, вместе взятые?
В каком диапазоне Земля по яркости сравнима с Солнцем и многократно превосходит все остальные планеты Солнечной системы, вместе взятые? В своей книге «Вселенная, жизнь, разум» И. С. Шкловский замечает, что если бы марсианские астрономы, подобно земным, исследовали
Глава 2. ДНК
Глава 2. ДНК На стене паба “Орел” в Кембридже висит синяя мемориальная доска, установленная в 2003 году в честь пятидесятилетия одного случая, когда разговоры в этом пабе приняли не совсем обычный оборот. Во время обеда 28 февраля 1953 года два завсегдатая “Орла”, Джеймс
Вместе, вместе!
Вместе, вместе! Локомоционные движения наиболее простые и однообразные, поскольку они обусловлены субстратом, по которому передвигается животное. Врожденный характер локомоционных движений проявляется четко. Животное только совершенствует эти движения и учится
Издательство «Аста-пресс ltd™» впервые публикует в полном объеме труды В. Н. Волошинова и П. Н. Медведева, в 1920-1930-е гг. работавших вместе с М. М. Бахтиным над вопросами социологической поэтики, лингвистики, литературоведения и психоанализа
Издательство «Аста-пресс ltd™» впервые публикует в полном объеме труды В. Н. Волошинова и П. Н. Медведева, в 1920-1930-е гг. работавших вместе с М. М. Бахтиным над вопросами социологической поэтики, лингвистики, литературоведения и психоанализа Работы В Волошинова и П.
Семья, которая остаётся вместе
Семья, которая остаётся вместе Мы уделили много внимания краткосрочным сексуальным стратегиям женщин (кстати довольно малозначимо, одинокие ли это женщины, соглашающиеся на однократную встречу, или замужние, таящиеся от своего мужа). В социобиологических дискуссиях 70-х,
Глава XIII. ПОЧЕМУ ВИАГРА СПАСЛА БОЛЬШЕ БРАКОВ, ЧЕМ ВСЕ ПСИХОТЕРАПЕВТЫ, ВМЕСТЕ ВЗЯТЫЕ?
Глава XIII. ПОЧЕМУ ВИАГРА СПАСЛА БОЛЬШЕ БРАКОВ, ЧЕМ ВСЕ ПСИХОТЕРАПЕВТЫ, ВМЕСТЕ ВЗЯТЫЕ? ЯЛВ: Поговорим о событии, изменившем мир. Эта революция, в определенном смысле сексуальная революция, произошла в 1998 году. Ее по значимости можно сравнить с синтезом в пятидесятые годы
Глава 6. ДВИЖУЩИЕСЯ ЧАСТИЦЫ
Глава 6. ДВИЖУЩИЕСЯ ЧАСТИЦЫ Еще со времен Джоуля, Кельвина, Майера, Гельмгольца и Клаузиуса, со времен открытия двух великих законов термодинамики, точного представления о том, что же такое тепло, не существовало. По крайней мере, такого, которое удовлетворило бы
Нам жить вместе
Нам жить вместе Мир насекомых на нашей планете огромен и разнообразен. Сложно они устроены, сложны и связи насекомых с окружающей природой — растениями, почвой и другими животными. Эти связи обоюдны и неразрывны: растения и разные животные суши не только дают возможность