Глава 20. ЖИЗНЬ БЕЗ ВОЗДУХА
Глава 20.
ЖИЗНЬ БЕЗ ВОЗДУХА
Как видите, многое о процессах, происходящих в живой ткани, можно сказать на одной лишь основе рассмотрения веществ, которые мы имеем на входе в организм и на выходе из него. Мы решили, что должен существовать некий общий строительный «кирпичик», из которого создаются и белки, и жиры, и углеводы. Мы пришли к выводу, что все структурные единицы пищи — глюкоза, жирные кислоты, аминокислоты и прочие — либо катаболизируются на углекислый газ и воду, либо анаболизируются в крахмал, белки или жиры. Мы даже установили, что одни вещества, такие как аланин, вырабатываются организмом самостоятельно, а другие, такие как лизин, — нет.
Это все, до чего мы могли додуматься, или есть еще резервы?
Ну, например, мы можем воспроизвести такое умозаключение: фермент может катализировать реакцию только в точке равновесия, причем не важно, с какой стороны идет реакция (см. главу 12). Следовательно, когда сложные вещества, поступающие с пищей, подвергаются гидролизу с помощью пищеварительных ферментов, то это тоже происходит в точке равновесия реакции. И известно, что гидролиз проходит полностью, поскольку практически все содержащиеся в пище сложные вещества в итоге оказываются гидролизованными и впитываются организмом.
Впитываются! По мере впитывания организмом аминокислоты жирные кислоты и простые сахара исчезают со сцены. Остаются только сложные вещества. Они тоже распадаются и так далее. Иными словами, соблюдается закон действия масс (см. главу 9) — путем удаления конечных продуктов точка равновесия сдвигается все дальше в сторону гидролиза.
Позволяют ли нам эти данные выдвинуть какие-то предположения о происходящем в клетках? Внутри тканей присутствуют только продукты гидролиза, так что можно представить те же самые ферменты катализирующими обратную реакцию в той же самой точке равновесия. Вместо разрыва связей путем добавления воды, от одной из аминокислот, скажем, отнимается атом водорода, а от другой — соединение атома водорода с атомом кислорода, тогда у обеих аминокислот освобождается по одной возможности для образования пептидной связи (см. формулу после рис. 29). Такой «антигидролиз» называют «конденсацией». Если конечные продукты этой реакции (белок и воду в данном случае) удалять из клетки с той же скоростью, с какой они образуются, то реакция конденсации может идти сколько угодно, вплоть до полной обработки всех имеющихся веществ.
Картинка, при которой одни и те же ферменты управляют процессами как анаболизма, так и катаболизма, в зависимости от того, какие именно вещества удаляются с места прохождения реакции, конечно, выглядит красиво. Но насколько она соответствует реальности?
В частности, в пользу этого предположения свидетельствует тот факт, что в лабораторных условиях пищеварительные ферменты можно заставить катализировать анаболитические реакции. К примеру, если аминокислоты подвергнуть при соответствующих условиях воздействию пепсина или химотрипсина, то действительно, происходит некий синтез, и в итоге получается нерастворимое белкообразное вещество пластеин. Пластеин — это смесь пептидов с малой молекулярной массой, цепочки которых состоят не более чем из десяти—двенадцати аминокислот; но вполне вероятно, что внутри живых тканей условия для формирования белков более благоприятны, чем в лабораторной пробирке, и там могут создаваться более крупные и сложные белки.
Но, увы, в целом теория имеет и ряд серьезных недостатков. Во-первых, пищеварительные ферменты в живых тканях никогда не встречаются. Какая разница, может пепсин или химотрипсин способствовать формированию белка или нет, если и тот и другой все равно отсутствуют в клетках, где это формирование происходит?
И опять же, нельзя забывать о свободной энергии. В целом реакции катаболизма сопровождаются снижением ее уровня. В случае гидролиза это снижение невелико по сравнению с другими видами реакций катаболизма, о которых чуть позже, но все же достаточно велико в целом. При гидролизе пептидной связи свободная энергия уменьшается на величину от 0,5 до 4 килокалорий на моль вещества, в зависимости от того, какие именно аминокислоты были задействованы в разорванной связи.
Это означает, что гидролиз белка — реакция, направленная «вниз с холма», и точка равновесия при ней сильно смещена в сторону полного гидролиза. Уровень свободной энергии снижается достаточно сильно, чтобы обратимость реакции не оказывалась ярко выраженной. На самом деле в точке равновесия подвергнувшимися гидролизу оказывается около 99 процентов белков.
Это не означает, что реакцию совсем нельзя обратить — надо просто создать для этого правильные условия. В лабораторной пробирке обеспечивается удаление воды сразу же по мере ее формирования (вода является одним из продуктов реакции конденсации). Соответственно, реакция сдвигается в сторону белка и идет производство пластеина. Однако в живой клетке образующаяся в большом количестве вода не может удаляться с нужной скоростью, и удалять с такой скоростью образующийся белок тоже сложно. Так что, если описанный путь — единственно возможный, значит, надо искать, как организм решает задачу быстрого удаления из клетки образующихся веществ. Вообще-то живая ткань преподносит много сюрпризов, и вполне возможно, что данная задача тоже нашла у природы какое-то оригинальное решение. Но все же, может быть, в живой ткани происходит не простое «обращение реакции», а какой-то иной процесс?
Что ж, если при реакции катаболизма уровень свободной энергии, как правило, снижается, то при имеющей обратную направленность реакции анаболизма он должен повышаться. Вместо того чтобы с безумной скоростью удалять продукты и клетки для того, чтобы сдвинуть точку равновесия ради протекания реакции в обратном направлении, не проще ли напрямую затратить на осуществление реакции немного энергии? В этом случае реакция пойдет куда надо, в зависимости не от состава веществ в клетке, а от приложения энергии. Не поступает энергия — идет реакция катаболизма; подали энергию — идет реакция анаболизма.
Откуда же возьмется в таком случае энергия? Самый простой ответ — из дальнейшего катаболизма структурных единиц. Из превращения глюкозы в углекислоту и воду можно получить на единицу веса в сотни раз больше энергии, чем из гидролиза гликогена на глюкозу (и, соответственно, чем требуется для конденсации глюкозы в гликоген). Следовательно, пожертвовав на катаболизм одной молекулой глюкозы, можно добиться соединения сотни других молекул глюкозы в гликоген.
Хорошо, но каков же тогда конкретный механизм, перевода энергии катаболизма на полезные цели — на проведение энергоемких реакций анаболизма? Чтобы ответить на этот вопрос, надо сначала подробно рассмотреть катаболизм. Никуда теперь от этого не деться. Необходимо понять, что происходит с питательными веществами после того, как их структурные единицы впитываются клетками. Пора проникнуть в тайны промежуточного метаболизма.
Одним из видов катаболизма, интересовавшим ученых с давних пор и послужившим исходной точкой для исследования промежуточного метаболизма, является факт ферментации глюкозы дрожжами. Во-первых, ферментация дрожжами Сахаров всегда, начиная с доисторических времен, имела для человечества большое практическое значение, так что мотивация для изучения этого явления была вполне достаточной. А во-вторых, дрожжевая ферментация — все же достаточно простое явление, которое можно изучать, не сталкиваясь с теми осложнениями, которые возникают при рассмотрении тканей животных. Ферментирующее действие дрожжей приводит к распаду глюкозы на этиловый спирт с высвобождением углекислого газа, так что выражение для этого процесса можно записать так:
С6Н12O6 ? 2С2H6O + 2CO2.
Обратите внимание — это выражение уравновешено! Каждая молекула глюкозы в процессе катаболизма распадается на две молекулы этилового спирта и две молекулы углекислого газа. Больше ничего.
Это кажется удивительным. После того как Лавуазье продемонстрировал, что животные не могут существовать без кислорода, казалось естественным, что при всех важных реакциях катаболизма должен быть как-то задействован и кислород. Однако здесь его нет.
А в других реакциях, происходящих с участием дрожжей? И на этот вопрос был дан отрицательный ответ. Такой приговор вынес Луи Пастер в 1861 году — он показал, что все без исключения процессы жизнедеятельности дрожжей проходят при полном отсутствии кислорода. Он назвал это «la vie sans air» — «жизнь без воздуха».
Превращение глюкозы в этиловый спирт и углекислый газ — пример «гликолиза» (что по-гречески значит «расщепление сахара»), а для подчеркивания того факта, что этот процесс проходит «без воздуха», его часто называют еще «анаэробным гликолизом», где «анаэробный» по-гречески и означает «без воздуха».
Начиная с наблюдений за горящим топливом весь опыт человечества говорит о том, что получение энергии связано с соединением углесодержащих веществ с кислородом, но не будем же слишком строги в этом отношении. Энергию можно производить и другими способами.
При расщеплении одного моля глюкозы на этиловый спирт и углекислый газ высвобождается около 36 килокалорий свободной энергии. Это, конечно, гораздо меньше, чем можно было бы получить путем полного превращения этого же количества глюкозы в воду и углекислый газ; в последнем случае изменение уровня свободной энергии составило бы 686 килокалорий, так что при гликолизе производство энергии составляет лишь двадцатую часть от возможного. Однако для жизнедеятельности дрожжей этого оказывается достаточно.
Более того, вполне вероятно, что когда-то давным-давно никакого кислорода в атмосфере Земли не было, так что единственными способами выработки энергии для тогдашних живых существ были методы, родственные гликолизу. Даже сегодня сложные организмы, обычно получающие энергию за счет катаболизма глюкозы до уровня воды и углекислого газа с потреблением кислорода, при особых обстоятельствах могут временно переключиться и на гликолиз.
В качестве примера можно назвать мышечную ткань. В начале XX века было обнаружено, что мышцы содержат в небольшом количестве молочную кислоту, трехуглеродное соединение с эмпирической формулой С3H6O3. (Раньше это вещество обнаруживали только в прокисшем молоке, отсюда и название.) Выяснилось также, что в процессе работы мышц содержание молочной кислоты в них повышается.
В 1918 году немецкий биохимик Отто Майерхоф показал, что повышение содержания в мышцах молочной кислоты сопровождается снижением содержания в них гликогена. Казалось очевидным, что мышечная деятельность подразумевает расщепление гликогена на глюкозу и превращение последней в молочную кислоту. Реакцию перевода глюкозы в молочную кислоту можно записать так:
С6Н12О6 ? 2С3H6O3.
И снова перед нами уравновешенное выражение. Одна молекула глюкозы расщепляется на две молекулы молочной кислоты без какого-либо участия кислорода. Наверное, именно эта или очень похожая реакция происходит и при прокисании молока, когда попавшие в него бактерии превращают молочный сахар в лактозу. Результат, получаемый в мышцах или в прокисшем молоке, отличается от результата, получаемого в дрожжах, поскольку в последнем случае молочная кислота продолжает расщепляться дальше:
С3Н6О3 ? С2Н6О + СО2,
то есть на этиловый спирт и углекислый газ. Однако с точки зрения энергетики это маловажная деталь, поскольку на этом дополнительном шаге не вырабатывается какого-либо существенного объема энергии.
Хорошо, что этого не происходит в мышцах. Спирт — гораздо более ядовитое вещество, чем молочная кислота, и его присутствие в клетке было бы гораздо опаснее. Дрожжи могут себе позволить вырабатывать спирт, ведь они выбрасывают его в окружающую среду; но даже при этом они умирают, когда концентрация спирта в окружающей среде достигает около 18 процентов. А мышцам пришлось бы выбрасывать спирт в кровь, так что организм очень быстро опьянел бы и умер. В принципе, наверное, и приспособиться к высокой концентрации спирта в крови организм мог бы, но этого не произошло. Очевидно, более выгодным в процессе эволюции многоклеточных оказалось избавиться от завершающего этапа гликолиза, чем вводить механизмы ликвидации его последствий.
Майерхоф не просто показал, что сложные организмы способны проводить анаэробный гликолиз, несмотря на то что, как правило, они пользуются более эффективными реакциями с задействованием кислорода. Он обнаружил также, что и дрожжи, и мышцы пользуются при этом одними и теми же коферментами. Стало ясно, что и глюкоза в клетках обоих видов расщепляется с помощью сходных реакций. Так постепенно становилось ясно, что метаболические механизмы всех живых существ в принципе сходны и различия между ними не так уж существенны. Все проводимые со времен Майерхофа исследования только подтверждают эту точку зрения.
Легко понять, зачем мышцам нужна способность к гликолизу. Конечно, мышцы могут получить из глюкозы гораздо больше энергии путем полного расщепления ее на воду и углекислый газ — так они и делают в условиях отсутствия особой нагрузки. Однако для этого им, естественно, необходим кислород. Он попадает в мышцы с потоками крови, и если бы вся требуемая мышцам энергия могла вырабатываться только путем «правильного» полного расщепления, то их работоспособность была бы ограничена скоростью поступления кислорода.
Когда мышцы начинают расходовать больше энергии (например, при занятиях спортом), организм начинает ускорять кровоток. Человек принимается глубже и чаще дышать, сердце бьется чаще и сильнее. Естественно, скорость поступления в мышцы кислорода тоже повышается, и в них начинает вырабатываться больше энергии. Однако скорость дыхания и сердцебиения не может возрастать безгранично. А вдруг мышцам требуется еще больше энергии, чем они могут произвести с использованием всего поступающего объема кислорода, пусть и увеличенного?
«Ничего не получится» — теоретически вполне допустимый с научной точки зрения ответ, но на самом деле это не так. Эволюция всегда приводит к распространению механизмов, позволяющих их носителям хоть чуть-чуть, да опередить конкурентов. Так что с точки зрения выживаемости мышцам оказалось «выгодно» сохранить устаревшую способность к анаэробному гликолизу, ведь она позволяет вырабатывать «еще чуть-чуть» энергии дополнительно к получаемой с помощью кислородозависимых реакций.
Конечно, это неэффективный способ. Для того чтобы добиться того же эффекта, что при расщеплении одной молекулы глюкозы на воду и углекислоту, путем расщепления той же глюкозы на молочную кислоту, нужно потратить девятнадцать молекул против одной. Но в случае необходимости лучше неэффективно растратить запас глюкозы, чем оказаться в ситуации, когда какого-то мизерного количества энергии не хватает, чтобы спасти, скажем, собственную жизнь.
Этот процесс тоже имеет свои ограничения. Молочная кислота накапливается в мышцах по мере их работы, и, хотя она и не столь токсична, как спирт, все же и ее присутствие можно терпеть лишь до определенной концентрации. В мышцах, находящихся в состоянии покоя, концентрация молочной кислоты — 0,02 процента. В процессе работы она может доходить до 0,25 процента, но не более. Мы ощущаем возрастание молочной кислоты как один из признаков усталости, и в итоге любая мышца, как ее ни стимулируй, должна прекратить свою деятельность. Она не выдержит большего количества молочной кислоты.
Что же далее происходит с молочной кислотой? Ведь в процессе отдыха мышца должна, очевидно, восстановиться? Британский физиолог Арчибалд Вивиен Хилл показал, что после насыщения молочной кислотой мышца начинает больше обычного потреблять кислород. Такое ощущение, что кислород, которого так не хватало для сжигания глюкозы во время работы, теперь стремится наверстать упущенное. Получается нечто вроде возмещения «кислородного долга», и именно благодаря этому мы еще долго продолжаем тяжело дышать, а наше сердце — усиленно биться уже после того, как работа завершена. Теперь кислород необходим нашим тканям уже не для совершения работы, а в качестве «возмещения долга».
Химически это «возмещение долга» выражается в расщеплении молочной кислоты на воду и углекислоту. При этом вырабатываются те самые оставшиеся восемнадцать девятнадцатых энергии, потенциально скрытые в расщеплении глюкозы:
2С3H6O3 + 6O2 ? 6СO2 + 6H2O
?F = -650 ккал.
При этом вырабатывается гораздо больше энергии, чем, требуется для того, чтобы снова собрать из двух (Молекул молочной кислоты молекулу глюкозы:
2C3H6O3 ? C6H12O6
?F = +36 ккал.
Если предположить, что вырабатываемую при катаболизме молочной кислоты энергию можно пустить на формирование глюкозы из других молекул молочной кислоты, то понятно, что катаболизма одной молекулы молочной кислоты хватит для анаболизма множества других молекул. Даже если эффективность передачи энергии при этом будет составлять процентов 50, все равно достаточно расщепить на воду и углекислоту одну молекулу молочной кислоты, чтобы десять других объединить в молекулы глюкозы.
В итоге, когда «кислородная задолженность» ликвидирована, большинство молекул молочной кислоты снова оказываются в составе гликогена, наготове для следующего этапа работы, а потери гликогеновых запасов компенсируются бесконечным притоком глюкозы из печени.
Катаболизм молочной кислоты, благодаря которому становится возможным анаболизм других ее же молекул, является примером «парной реакции» (рис. 44). В целом реакция сопровождается снижением уровня свободной энергии. То есть, несмотря на то что при формировании глюкозы из молочной кислоты уровень свободной энергии повышается, это происходит не иначе как в ответ на распад молочной кислоты на углекислоту и воду, а при этом процессе уровень свободной энергии снижается, причем общая величина снижения за счет реакций второго типа — больше, чем общая величина повышения за счет реакций первого типа, так что в целом мы наблюдаем снижение, как и всегда при любых других проявлениях жизнедеятельности.
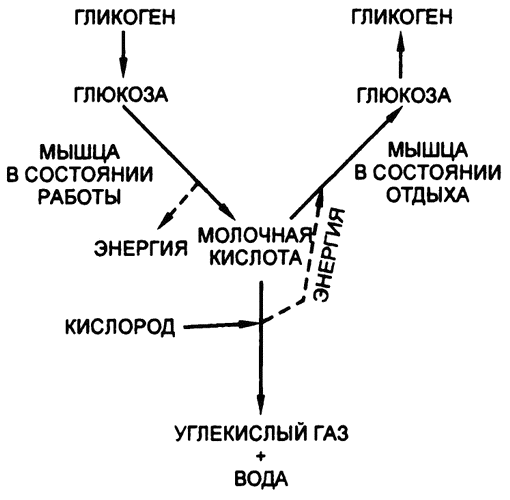
Рис. 44. Молочная кислота в мышцах
Легко говорить о парности реакций катаболизма и анаболизма молочной кислоты, но как именно такая парность обеспечивается? Каким образом энергия, вырабатываемая при одной реакции, передается другой?
Первая подсказка была получена в 1905 году. Английские химики Харден и Янг (те самые первооткрыватели зимазы) обнаружили, что если скорость производства дрожжами углекислого газа падает, то ее можно вернуть на прежний уровень, если добавить в дрожжи неорганический фосфат (примером такого вещества может служить фосфат калиевой кислоты, КН2РO4). Более того, по мере выработки углекислого газа количество фосфата в растворе уменьшалось!
Харден и Янг решили, что единственное, куда мог деваться фосфат, — это соединяться с каким-то органическим веществом. В этом случае он действительно перестал бы встречаться в виде простого иона и, соответственно, реагировать с тестовым реагентом. Ученые принялись анализировать смесь на предмет наличия в небольших количествах какого-нибудь органического вещества с содержанием фосфатной группы — и нашли такое вещество! Фосфатная группа оказалась связанной с молекулой сахара с помощью некоей связи, характерной для подобных соединений, именуемых «эфирами». Соответственно, данное вещество получило название «эфир Хардена—Янга». Со временем было установлено и точное строение этого вещества; оказалось, что это простой сахар, фруктоза, к которому крепятся две фосфатные группы. Теперь его так и называют — фруктозодифосфат.
Фруктозодифосфат является примером «метаболического посредника», вещества, встречающегося в схеме обмена веществ где-то посередине между известным исходным веществом (в данном случае это глюкоза) и легко определяемым итоговым веществом (в данном случае это этиловый спирт и углекислота). Определение и установление метаболических посредников крайне важно для правильного понимания процессов обмена веществ, происходящих в живой ткани, так что можно сказать, что с 1905 года начался отсчет систематического изучения метаболических посредников.
Вскоре были обнаружены и другие органические фосфаты, и, ко всеобщему изумлению, стало ясно, что именно фосфатные группы имеют непосредственное отношение практически к каждому шагу метаболизма. Ранее считалось, что фосфатные группы в живых организмах встречаются только в костях как часть неорганического скелета, а об их присутствии в большом количестве в мягких тканях по большей части не подозревали, а если ученые их там и обнаруживали, то не придавали этому факту особого значения. Теперь же фосфаты вдруг оказались в центре всеобщего внимания, поэтому и нам не грех будет посвятить им целую главу.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава 6. Жизнь в карикатуре
Глава 6. Жизнь в карикатуре Несколько полушутливых строчек, предваряющих каждую главу нашего повествования, уже стали, как нам кажется, своеобразной традицией: хорошей или дурной — судить читателю. Но, честное слово, готовясь к рассказу о функциональной роли белковых
Глава пятая Жизнь человекообезьян в сообществах
Глава пятая Жизнь человекообезьян в сообществах Тот, у кого в роду нет ни глупцов, ни плутов, ни попрошаек, был зачат ударом молнии. Томас Фуллер (1608–1661) В Гомбе-Стрим, в Танзании, самец-шимпанзе играет с маленьким братом. Во время игры малыш легко стоит на двух ногах, что
Глава III. Есть ли жизнь на Земле?
Глава III. Есть ли жизнь на Земле? Оро:…Как сказал один шутник, по теории вероятностей мы все должны были быть мертвецами. Тем не менее, мы живы. Чаргафф: Но мы все-таки умрем. Мора: В том-то и беда. Из дискуссии на Флоридской конференции по происхождению жизни Там, где вечно
Глава 6 ЖИЗНЬ РАСТЕНИЙ, УВЕЛИЧЕННАЯ В 100 МИЛЛИОНОВ РАЗ
Глава 6 ЖИЗНЬ РАСТЕНИЙ, УВЕЛИЧЕННАЯ В 100 МИЛЛИОНОВ РАЗ а восточном побережье Индии, в старинном штате Бенгал, на полутора гектарах земли неподалеку от Университета Калькутты расположился комплекс зданий из серо-лилового песчаника в классическом до мусульманском
…воздуха…
…воздуха… Первые живые существа появились в воде, затем они освоили сушу. Воздух начал осваиваться ими более 300 миллионов лет назад. Первыми крылатыми существами были насекомые. Размах крыльев гигантских стрекоз достигал почти метра! А в эру ящеров, мезозой, начали
Глава 3 Дыхание и жизнь
Глава 3 Дыхание и жизнь Из всего разнообразия веществ, находящихся в окружающей среде, воздух, или, точнее, кислород, является самым жизненно необходимым. Если нужно, мы можем несколько дней обходиться без воды, а без пищи неделями. Я не хочу сказать, что это приятный
Глава 1. Что такое жизнь?
Глава 1. Что такое жизнь? Не так уж много времени прошло с тех пор, как генетика и биохимия стали самостоятельными науками, каждая из которых… пытается подобрать ключ к феномену жизни. Биохимики обнаружили ферменты, а генетики — гены. Уильям Хеш, "Генетика бактерий и
Глава 4. Есть ли жизнь на других планетах?
Глава 4. Есть ли жизнь на других планетах? Тем не менее большинство планет, несомненно, обитаемы, а необитаемые со временем будут населены. Таким образом, я могу все изложенное выше выразить в следующем общем виде: вещество, из которого состоят обитатели различных планет, в
Глава 8. Жизнь в Солнечной системе
Глава 8. Жизнь в Солнечной системе Нам суждено спускаться вновь и вновь. В тот край, откуда началась дорога, Чтобы опять взглянуть… и в изумленьи Его увидеть, словно в первый раз. Т. С. Элиот, "Легкое головокружение" Убежденность в существовании жизни на планетах Солнечной
Глава 23. ЖИЗНЬ С ВОЗДУХОМ
Глава 23. ЖИЗНЬ С ВОЗДУХОМ При рассмотрении реакций, проходящих с участием атмосферного кислорода, естественно возникает желание разобраться в самом процессе впитывания кислорода живой тканью (ну, наполняет он легкие, и что дальше?).Из таких разных существ, как картошка и
Глава 10. Как давно могла зародиться жизнь?
Глава 10. Как давно могла зародиться жизнь? До сих пор мы обсуждали, где могла бы появиться жизнь во Вселенной и насколько маловероятным могло быть это событие. Мы совсем не обсуждали, когда она могла зародиться и сколько времени потребовалось на совершенствование древних
Короткая жизнь для человека, но длинная жизнь для человечества
Короткая жизнь для человека, но длинная жизнь для человечества Бактерии и люди многим отличаются. Если одно поколение бактерий живет двадцать минут, то между одним поколением человека и следующим проходит много лет. Если человек зарождается за счет слияния яйцеклетки и
Глава 16: Жизнь, какой мы (не)знаем ее
Глава 16: Жизнь, какой мы (не)знаем ее Caplan, Arthur. What If Anything Is Wrong with Cloning a Human Being? // Case Western Reserve Journal of International Law. 35 (Fall 2003): 69–84.Segerstr?le, Ullica. Defenders of the Truth. Oxford University Press, 2001.Wade, Nicholas. Before the Dawn. Penguin, 2006.* Среди прочих, Николас Уэйд предлагал добавить еще одну пару
Глава 17 Голубая планета и новая жизнь
Глава 17 Голубая планета и новая жизнь Земная жизнь в безбрежном лоне вод Среди пещер жемчужных океана Возникла, получила свой исход, Росла и стала развиваться рано; Сперва в мельчайших формах все росло, Не видимых и в толстое стекло, Которые, киша, скрывались