Глава 23. ЖИЗНЬ С ВОЗДУХОМ
Глава 23.
ЖИЗНЬ С ВОЗДУХОМ
При рассмотрении реакций, проходящих с участием атмосферного кислорода, естественно возникает желание разобраться в самом процессе впитывания кислорода живой тканью (ну, наполняет он легкие, и что дальше?).
Из таких разных существ, как картошка и мышь, добывались образцы тканей, системы ферментов в которых оставались в достаточной степени нетронутыми, чтобы продолжать катализировать положенные им реакции с использованием кислорода даже в отрыве от самого организма. Для некоторых целей нет необходимости сохранять клетки нетронутыми, поскольку реакции, потребляющие кислород, могут происходить и в достаточно чистых растворах ферментов.
Такие реакции обычно проводят в маленьком закрытом контейнере, так чтобы изменения давления в нем оказывались ощутимыми. Такой контейнер состоит из двух частей, в одной из которых находится раствор субстрата, а в другой — раствор фермента или образцы тканей. Стоит чуть-чуть покачать контейнер — и начнется реакция.
В обычных условиях начал бы потребляться кислород и выделяться углекислый газ. В результате потребления кислорода в контейнере мог бы образоваться частичный вакуум, но благодаря производству углекислого газа (что всегда происходит, когда речь идет о живых клетках) потеря возмещается и нормальное давление газа сохраняется. Однако, если внутри контейнера есть еще и небольшая ниша, в которой находится некий раствор, быстро поглощающий углекислый газ, то возмещения общего объема газа в контейнере происходить не будет. Общее снижение давления будет свидетельствовать о потреблении кислорода.
Контейнер герметично соединен с U-образной трубкой, открытой в атмосферу, нижняя часть которой заполнена цветной жидкостью. С одной стороны трубки на жидкость давит воздух, содержащийся в контейнере, с другой — обычное атмосферное давление. По мере протекания в контейнере катализируемой ферментом реакции и потребления кислорода давление в нем падает, и баланс между внутренним и внешним давлением нарушается. Жидкость в трубке со стороны атмосферы ползет вниз, а со стороны, присоединенной к контейнеру, — вверх.
Естественно, в таких случаях принимаются все меры к тому, чтобы движение жидкости осуществлялось только под воздействием возрастающей разреженности воздуха в контейнере. Контейнер помещен в теплую ванночку и содержится при постоянной температуре во избежание изменения объема воздуха в связи с изменениями температуры. Рядом находится такой же контейнер, но лишенный фермента, — контрольный, чтобы экспериментаторы видели, насколько на колебания жидкости в трубке влияют посторонние факторы, например небольшие колебания атмосферного давления.
В конечном итоге точно фиксируется сдвиг уровня жидкости в трубке и по нему определяется количество потребленного в результате катализируемой ферментом реакции кислорода. Только что описанное устройство в самом распространенном виде изобрел в 1923 году немецкий биохимик Отто Варбург, поэтому его иногда называют «респирометром Варбурга». Слово «респирометр» происходит от слов «дыхание» и «мерить».
Если в респирометр Варбурга поместить растолченную мышцу, то по мере того, как содержащиеся в ней ферменты будут катализировать реакции, кислород будет потребляться. Однако через некоторое время потребление кислорода начинает снижаться до весьма низких значений. Казалось, что ферменты денатурировались и утратили активность. Впрочем, потеря активности наблюдалась и в том случае, когда ферментам создавались все условия для того, чтобы они не денатурировались. Тогда возникло предположение, что замедление реакции связано с полной выработкой субстрата.
В последнем случае потребление кислорода снова возросло бы с добавлением субстрата, — оставалось только решить, что же именно является необходимым субстратом. Видимо, субстрат для некоторых ферментов находился не в растворе, помещенном в контейнер, а в самой мышце, так что в контейнер стали по очереди добавлять обнаруживаемые в ней вещества.
В 1935 году венгерский биохимик Альберт Сент-Дьёрдьи установил, что потребление кислорода возобновляется в том случае, если к толченой мышце добавить одно любое из четырех веществ — янтарную кислоту, фумаровую кислоту, яблочную кислоту или щавелево-уксусную кислоту. Молекулярное строение этих веществ сходно, как видно из рис. 58. Все они являются «двухосновными кислотами», поскольку молекула каждой содержит по две карбоксильных группы.
Очевидно, каждое из этих веществ каким-то образом задействуется в реакциях с потреблением кислорода. Однако они не могут использоваться просто как строительный материал, поскольку объем кислорода, который начинает потребляться после добавления любого из этих веществ, значительно превышает необходимый для связывания всего вновь добавленного количества. Видимо, начинает происходить не одна реакция, а ряд реакций, при которых используемое вещество (к примеру, янтарная кислота) возобновляется с той же скоростью, что и расходуется, так что ее участие скорее следует счесть каталитическим. По мере продолжения серии реакций становится понятно, что запас янтарной кислоты возобновляется не полностью, так что идет ее медленное растрачивание, и, в конце концов, для продолжения реакций оказывается необходимым добавление новой порции янтарной кислоты извне.
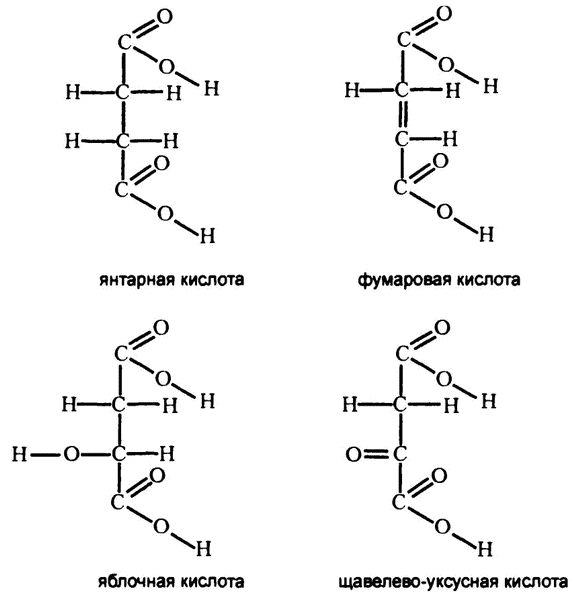
Рис. 58. Двухосновные кислоты
Дальше мы увидим, что четыре перечисленных вещества принимают участие не в четырех различных реакциях, а в одной и той же. Доказательство этого факта было получено благодаря малоновой кислоте.
Если в толченую ткань добавить янтарной кислоты для того, чтобы возобновить потребление кислорода, то стоит только после этого добавить малоновой кислоты, как потребление кислорода тут же снова прекращается. Это вполне ожидаемый эффект, поскольку малоновая кислота является конкурентным угнетателем янтарной (см. главу 18). Однако после добавления малоновой кислоты останавливалось потребление кислорода и возобновившееся после добавления любого из трех остальных веществ. А ведь напрямую подавлять реакции, проходящие с участием яблочной или щавелево-уксусной кислоты, малоновая кислота не может. Значит, будучи добавленной в растолченную ткань, она останавливает общий ход реакции за счет того, что где-то в нем используется часть именно янтарной кислоты. После того как было проведено много исследований в этом направлении, немецкий биохимик Ханс Адольф Кребс сумел продемонстрировать, что добавление и других веществ, в частности — лимонной кислоты (в которой содержится шесть атомов углерода и три карбоксильные группы, а не четыре атома углерода и две карбоксильные группы, как в четырех установленных Сент-Дьёрдьи кислотах), тоже приводит к возобновлению реакций с потреблением кислорода. В 1940 году Кребс разработал схему, в которой все необходимые вещества заняли свое логическое положение, и с тех пор эта схема претерпевала лишь самые незначительные изменения.
По понятным причинам эта серия химических реакций получила название «цикл Кребса», но есть названия и более описательные — «цикл трикарбоновых кислот», или «лимоннокислый цикл», поскольку лимонная кислота обладает тремя карбоксильными группами.
Давайте посмотрим, стараясь обойтись как можно меньшим числом формул и подробностей, как же работает цикл Кребса.
При анаэробном гликолизе, как я объяснял в главе 20, молекула глюкозы превращается в две молекулы молочной кислоты, производя при этом две высокоэнергетические фосфатные связи, принимающие в итоге вид АТФ. Далее предстоит катаболизм молочной кислоты с образованием дополнительных высокоэнергетических связей.
Этот процесс начинается с устранения из молочной кислоты двух атомов водорода (дегидрогенизации) с образованием пировиноградной кислоты, как показано на рис. 59.
Сочетание С=О называется «кетоновой группой», или, короче, «кетогруппой», а сочетание СООН, вам, я надеюсь, уже знакомое, — «карбоновокислой группой». Любое химическое соединение, где, как, например, в пировиноградной кислоте, содержатся обе эти группы, называется «кетокислотой».
В организме кетокислоты практически неизбежно подвергаются химической реакции, в ходе которой теряют один атом углерода. Опустив подробности, скажем лишь, что в результате пировиноградная кислота (с тремя атомами углерода) превращается в уксусную (с двумя атомами углерода), как показано на рис. 59.
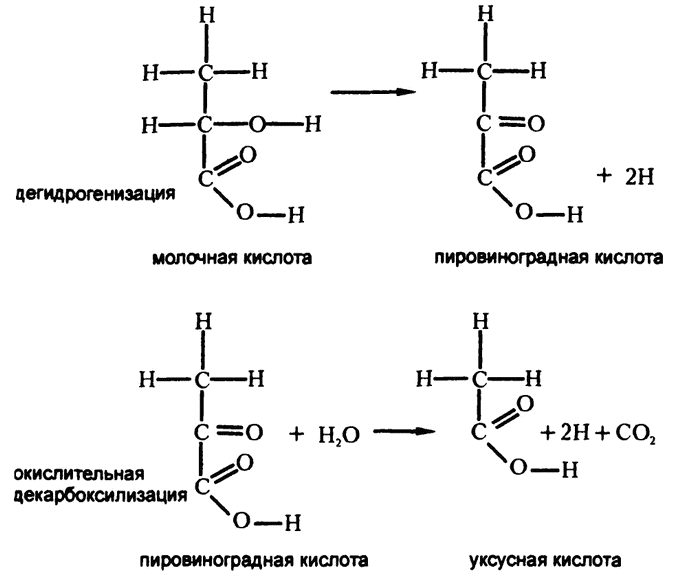
Рис. 59. Дегидрогенизация и окислительная декарбоксилизация
Такая реакция является примером «окислительной декарбоксилизации». Окислительной — потому что при ней удаляется два атома водорода, а декарбоксилизации — потому что углекислота при этом тоже удаляется. Конкретно эта реакция окислительной декарбоксилизации катализируется ферментом, в котором используется кофермент, содержащий группу атомов, представляющую собой довольно сложную молекулу «тиамин». Это и есть тот самый витамин В1? отсутствие которого вызывает у человека болезнь берибери. Именно дефицит этого витамина Эйкман изучал в 90-х годах XIX века (см. главу 18), и именно связанные с ним исследования положили начало изучению витаминов в целом. И вот пример того, для чего нужен витамин, — без него реакция превращения пировиноградной кислоты в уксусную не состоится и вся метаболическая цепочка реакций начнет пробуксовывать.
При переводе органических веществ в воду и углекислый газ вода образуется в ходе реакций дегидрогенизации, поскольку атомы водорода, теряемые такими веществами, как молочная кислота, в итоге объединяются с кислородом. Углекислый газ формируется по большей части в ходе реакций окислительной декарбоксилизации кетокислот.
Именно на этапе дегидрогенизации и производится используемая организмом энергия. Само по себе устранение из вещества углекислоты не позволяет получить достаточно энергии для формирования высокоэнергетических фосфатных связей. Значит, можно сделать вывод, что организм получает энергию за счет сжигания водорода, а сжигание углерода — в общем-то случайное побочное явление. Это неудивительно, поскольку, как я уже писал (см. главу 8), при сжигании водорода высвобождается гораздо больше тепла, чем при сжигании углерода.
Следующим этапом уксусная кислота добавляется в щавелево-уксусную и попадает в цикл Кребса (как вы помните, щавелево-уксусная кислота оказалась одним из первых веществ, участие которого в цикле стало известно).
В начале 40-х годов XX века подробности процесса добавления были еще неизвестны. Однако уже в 1947 году Липман (первооткрыватель высокоэнергетических фосфатных связей) сумел выделить вещество, служащее коферментом для данной реакции, и назвал его «кофермент А».
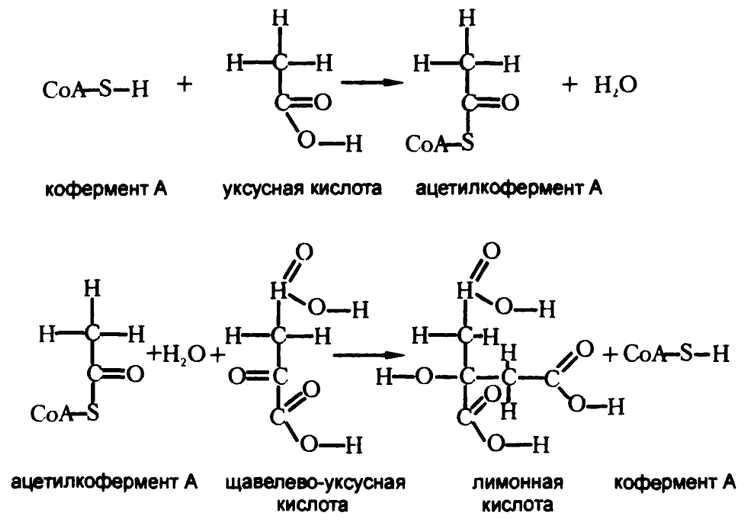
Рис. 60. Кофермент А
Молекула кофермента А достаточно сложна, и я не буду вас мучить. Большая часть ее — это пантотеновая кислота, витамин В3, который организм сам производить не умеет, а значит — должен получать с пищей.
Та часть кофермента А, которая участвует в реакции, — это тиоловая группа (— S — Н). Поэтому молекулу кофермента А часто обозначают так:
CoA — S — Н.
Кофермент А конденсируется с уксусной кислотой, как показано на рис. 60, образуя ацетилкофермент А. На самом деле он участвует в реакции окислительной декарбоксилизации пировиноградной кислоты, так что сама уксусная кислота здесь образоваться не может. Сразу получается ацетилкофермент А.
Ту часть молекулы уксусной кислоты, которая присоединена к коферменту А, иногда называют «двухуглеродным фрагментом». Это дань традиции, происходящей из тех времен, когда точное строение этой части еще было неизвестно.
В организме происходит много реакций, при которых двухуглеродный фрагмент переходит от одного вещества к другому, и в каждом случае именно кофермент А является той рабочей лошадкой, которая выполняет эту задачу. Позже было установлено, что кофермент А участвует и в реакции с альфа-кетоглютаровой кислотой, тоже задействованной в цикле Кребса, и там выполняет задачу переноса уже четырехуглеродного фрагмента. Не стоит считать, что кофермент А может иметь дело только с двухуглеродными фрагментами, и мы еще вернемся к этой теме, когда речь зайдет о других его задачах по переносу.
Добавление к щавелево-уксусной кислоте ацетилкофермента А показано и на рис. 60. Эта сложная реакция (но при тщательном рассмотрении вы сами убедитесь, что каждому атому слева соответствует атом справа), в результате которой образуется лимонная кислота со своими шестью атомами углерода, а кофермент А формируется заново и отправляется за следующей молекулой уксусной кислоты.
После образования лимонной кислоты она проходит через ряд реакций и в итоге избавляется-таки от добавленного к ней двухуглеродного фрагмента. Таким образом, лимонная кислота превращается обратно в щавелево-уксусную. Теперь щавелево-уксусная кислота снова может приобрести двухуглеродный фрагмент, который снова будет утерян при следующей итерации цикла Кребса, и так далее.
Формулы, которые я приводил в данной главе, иллюстрируют основные этапы процесса: окислительную декарбоксилизацию, дегидрогенизацию, катализируемый перенос коферментами и так далее. Так что теперь мы можем перейти, уже без формул, к схеме-иллюстрации процесса катаболизма молочной кислоты. Эта схема приведена на рис. 61, и, уверяю вас, там показаны только самые основные моменты.
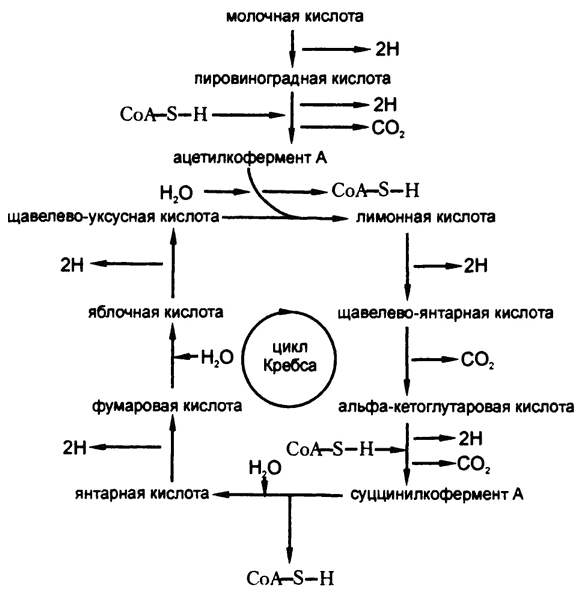
Рис. 61. Катаболизм молочной кислоты
Как видите, молочная кислота сначала подвергается одной дегидрогенизации, превращаясь таким образом в пировиноградную, затем — второй в процессе образования ацетилкофермента А, а затем — еще четырем в процесс цикла Кребса. Всего получается шесть дегидрогенизаций, в ходе которых теряется двенадцать атомов водорода.
Но ведь в молекуле молочной кислоты всего шесть атомов водорода, как вы сами можете убедиться, взглянув на формулу, изображенную на рис. 59. Как же она ухитряется потерять двенадцать?
Как показывает общая схема цикла Кребса, на входе в него на трех разных участках поступают три молекулы воды. Они-то и предоставляют те самые недостающие шесть атомов водорода.
Кроме того, серия изменений, которым подвергается молочная кислота и вещества, в которые она последовательно превращается, включает в себя де-карбоксилизацию в процессе образования ацетил-кофермента А и еще две декарбоксилизации в ходе цикла Кребса для образования всего трех молекул углекислоты.
Соответственно, общее выражение будет выглядеть так:
С3H6O3 + 3H2O ? 3CO2 + 12H.
молочная кислота
Возникает несколько вопросов. Во-первых, давайте вернемся к судьбе наших атомов водорода. Понятно, что должен использоваться кислород, поскольку, в конце концов, и сам цикл Кребса был открыт только благодаря исследованиям процессов потребления кислорода. Однако кислород ведь не принимает атомы водорода напрямую, поскольку эксперименты показывают, что перекись водорода не образуется в тканях, даже если ткани бедны каталазой.
Значит, кислород принимает атомы водорода через какое-то посредничество, так чтобы в итоге получалась не перекись водорода, а вода. Остается предположить, что атомы водорода сначала принимает какая-то другая молекула, не кислород, а затем — передает кислороду. Так же как кофермент А переносит двухуглеродные фрагменты, какой-то другой кофермент должен переносить и атомы водорода.
На самом деле такие «переносчики водорода» были открыты еще за поколение до того, как был обнаружен кофермент А. Первым из переносчиков водорода был вообще самый первый из открытых коферментов — козимаза, обнаруженная Харденом и Янгом (см. главу 18). В начале 30-х годов XX века была установлена и молекулярная структура козимазы. Я не буду сейчас углубляться в подробности, как и в отношении кофермента А, но основные моменты перечислю.
Прежде всего, в состав козимазы входит молекула сахара из пяти атомов углерода, две фосфатные группы и азотсодержащее атомное кольцо. Все это позволяет отнести молекулу к классу нуклеотидов. Азотсодержащее кольцо имеет пиридиновую форму, как я уже упоминал в главе 18, так что вся молекула получила научное название «дифосфопиридиннуклеотид», или, в сокращенной записи, ДПН. В 1934 году Варбург, изобретатель респирометра, выделил очень похожий кофермент, который отличался от козимазы только тем, что в его состав входят три, а не две фосфатные группы. Соответственно, это вещество получило название «трифосфопиридиннуклеотид», в сокращении ТПН.
И в ДПН, и в ТПН входит особый вариант пиридинового кольца, известный как никотинамид, который организм может образовывать только на основе похожего вещества — никотиновой кислоты. Значит, либо никотинамид, либо никотиновая кислота тоже должны присутствовать в пище — это тоже витамины группы В.
На протяжении 30-х и 40-х годов XX века ученые выделяли все больше и больше ферментов, катализирующих дегидрогенизацию различных веществ, и все открытые ферменты получили общее название «дегидрогеназы». В состав большой части дегидрогеназ входят в качестве необходимого кофермента либо ДПН, либо ТПН. Поэтому дегидрогеназы получили еще одно название, свидетельствующее о важности для их строения пиридинового кольца: «пиридин-ферменты».
Активной группой, «режущей кромкой», так сказать, каждого пиридин-фермента является именно ДПН или ТПН. Однако специфику фермента определяет все же аминокислотная составляющая (апофермент). Именно она представляет собой решающий фактор, благодаря которому вступить в контакт с коферментом, а значит — послужить субстратом, могут только особые вещества. То есть десяток разных пиридин-ферментов, в состав которых входят десять различающихся между собой аминокислот, будут катализировать дегидрогенизацию десяти разных веществ, и ни один из ферментов не сможет повлиять на девять «соседских» субстратов.
Вообще говоря, из шести процессов дегидрогенизации, включенных в катаболизм молочной кислоты, пять проходят с помощью пиридин-ферментов, причем каждый раз разных. Шестая же дегидрогенизация проходит с участием янтарной кислоты, и об этом чуть позже.
Функция ДПН и ТПН — принимать атом водорода, отдаваемый субстратом. Субстрат отдает атом водорода и окисляется, а ДПН или ТПН — принимает и восстанавливается. Восстановленный ДПН или ТПН можно обозначить, не вдаваясь в тонкости строения, просто как ДПН- 2Н или ТПН- 2Н. Таким образом, дегидрогенизацию молочной кислоты в пировиноградную, катализируемую пиридин-ферментом «дегидрогеназой молочной кислоты», можно представить, не вдаваясь в подробности (поскольку структурные формулы молочной и пировиноградной кислот вы можете посмотреть на рис. 59), так:
С3Н6О3 + ДПН ? С3Н4О3 + ДПН ? 2Н
молочная кислота пировиноградная кислота
ДПН?2Н далее передаст оба атома водорода другому веществу и будет снова окислен до состояния обычного ДПН. Теперь он готов снова принять два атома водорода, чтобы опять передать их дальше, и так далее.
Так что же это за «другое вещество», которому ДПН отдаст водород? Кислород?
Давайте посмотрим. Если пиридин-фермент принимается за работу по дегидрогенизации субстрата, например, молочной кислоты, при отсутствии других ферментов и субстратов и в азотистой атмосфере, то реакции не произойдет. Да, атомы водорода ДПН примет, но передать их будет нечему. А общее количество присутствующих в системе молекул ДПН настолько мало по сравнению с количеством молекул молочной кислоты, что даже полное восстановление всего запаса ДПН не отразится сколь-нибудь заметным окислением молочной кислоты. Пока ДПН не сможет отдавать получаемые атомы водорода, реакция не запустится.
Исправить положение удается, если добавить в систему кислород, из чего становится ясно, что кислород принимает водород в реакциях с участием пиридин-фермента.
Однако, если добавить в систему другие вещества, например метиленовую синь, то реакция состоится и в отсутствие кислорода. Метиленовая синь будет принимать атомы водорода у ДПН ? 2Н. Это вещество, как понятно из названия, имеет синий цвет, но восстановленная метиленовая синь — бесцветна. Так что за ходом реакции можно следить по постепенному обесцвечиванию метиленовой сини.
Это, конечно, интересно, но практического решения проблемы нам не дает, поскольку в живой ткани метиленовая синь не встречается. Эти экспериментальные данные свидетельствуют лишь о том, что ДПН и ТПН могут при определенных обстоятельствах отдавать атомы водорода другим веществам, но каким же именно веществам они отдают атомы в живой ткани?
Отвлечемся ненадолго, а потом продолжим.
В 30-х годах XX века (а то и раньше) ученые нередко выделяли из тканей желтое вещество, получившее название «флавин», от латинского «желтый». К концу десятилетия было установлено строение этих веществ — обнаружилось, что они содержат систему из трех колец, которую организм сам создать не в силах и, опять же, должен получать с пищей в виде «рибофлавина» — одной из разновидностей витамина В.
Варбург показал, что флавины связаны с системами ферментов, которым и передают свой желтый цвет, и первый обнаруженный фермент такого рода получил название «старый желтый фермент Варбурга». В составе флавинов были в конечном итоге найдены два важных кофермента — «флавинмононуклеотид» (ФМН) и «флавинадениндинуклеотид» (ФАД).
Ферменты, в состав которых входят ФМН или ФАД, называются «флавоферментами», и, как оказалось, они, как и ферменты, включающие в себя ДПН или ТПН, катализируют дегидрогенизацию. К примеру, дегидрогенизация янтарной кислоты (единственная, как я уже говорил, во всем цикле катаболизма молочной кислоты, обходящаяся без пидидин-фермента) происходит именно под каталитическим действием «дегидрогеназы янтарной кислоты», коферментом которой является ФАД.
В этом случае, как и в предыдущем, предназначение коферментов — также принимать из субстрата атомы водорода, становясь при этом ФМН- 2Н или ФАД- 2Н, а затем отдавать этот водород чему-то еще.
Но есть и разница. Коферменты флавинов могут отдавать атомы водорода кислороду с образованием перекиси водорода. Вследствие этого дегидрогеназы флавоферментов называют еще «аэробными дегидрогеназами», поскольку они могут осуществлять каталитическую деятельность в присутствии кислорода, как единственного принимающего водород вещества. А дегидрогеназы пиридин-ферментного класса называют «анаэробными дегидрогеназами», потому что они не умеют этого делать.
Таким образом, если в систему, содержащую пиридин-ферменты, добавить флавофермент и субстрат (которые сами по себе в реакцию не вступают), то флавофермент примет атом водорода у пиридин-фермента и передаст его кислороду. Сам по себе флавофермент в прямой контакт с субстратом не вступает, а пиридин-фермент — не вступает в контакт с кислородом. Однако вместе они успешно катализируют дегидрогенизацию субстрата и восстановление кислорода в перекись водорода, как схематически изображено на рис. 62.
Перенос проходит, как видите, в три этапа, на каждом из которых происходит своя окислительно-восстановительная реакция. Как я уже объяснял в конце предыдущей главы, атомы водорода постепенно движутся по пути увеличения окислительного потенциала.
Почему же атомы водорода не могут сразу от ДПН?2Н переходить к кислороду? Такой процесс тоже подразумевал бы увеличение окислительного потенциала. Зачем же нужен промежуточный процесс? Тут можно воспользоваться следующей аллегорией: если сила тяжести тянет человека вниз, он может, подчиняясь ей, сделать два шага по ведущим вниз ступенькам, а может и один — через ступеньку. Как правило, необходимость в промежуточном восстановленные формы окисленные формы
этапе обусловливается понижением энергии активации. Видимо, организм не может предоставить сразу достаточное количество энергии для того, чтобы преодолеть порог, необходимый для прямой передачи атомов водорода от органического вещества к кислороду. Так что приходится пользоваться промежуточным этапом в виде неорганического посредника.
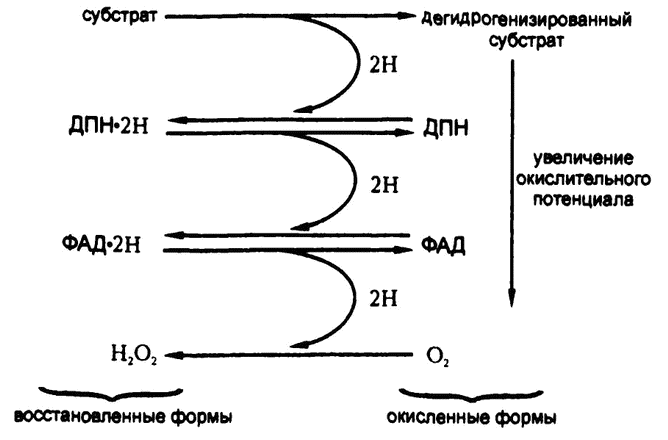
Рис. 62. Этапы дегидрогенизации
В 50-х годах XX века было обнаружено, что в флавоферментах содержатся атомы металла, а в пиридин-ферментах — нет. То есть, например, дегидрогеназа янтарной кислоты имеет в своем составе атомы железа, другие флавоферменты — атомы меди или молибдена. Железо может принимать форму как двух-, так и трехвалентного иона (Fe2+ и Fe3+). Приняв один электрон, трехвалентный ион железа превращается в двухвалентный, а тот, потеряв электрон, — обратно в трехвалентный. Так, переключаясь из одной формы в другую, атом железа может выступать переносчиком электронов. Такую же работу может выполнять и медь, переключаясь из состояния одновалентного иона меди (Cu+) в состояние двухвалентного (Cu2+) и обратно. Молибден тоже обладает подобным свойством.
Такой перенос электронов могут осуществлять только металлосодержащие флавоферменты, а чисто органические пиридин-ферменты — не могут. И видимо, перенос электронов — необходимая часть процедуры снижения энергии активации переноса водорода к молекуле кислорода. Ничего точнее сказать, увы, по сей день невозможно.
Можно подумать, что теперь ситуация с атомами водорода, полученными в ходе катаболизма, благополучно прояснена, но это, конечно, не так. Когда кислород принимает атомы водорода из флавоферментов, образуется перекись водорода. Однако в целом нам известно, что перекись водорода в организме не образуется, так что приведенная схема явно не завершена. Должно быть что-то еще.
В 1925 году британский биохимик Д. Кейлин занимался изучением того, как размешанные в растворе взвеси истолченных тканей различных видов — от бактериальных до нервных тканей высших животных — поглощают свет. Он обнаружил около полудюжины разных полос поглощения и приписал их наличие предположительному существованию вещества, которое назвал «цитохром» (от греческих слов, означающих «клетка» и «цвет»). Дальнейшие исследования показали, что полосы поглощения существуют попарно, и каждая пара полос поглощения привязана к своему веществу. Естественно, они получили названия «цитохром a», «цитохром b» и «цитохром с». Со временем выяснилось, что даже такое деление не совсем точно, было вещество близкое к цитохрому a, но все же не полностью с ним идентичное, и оно получило название «цитохром a3».
Единственным цитохромом, который удалось достаточно легко выделить из взвеси тканей, оказался цитохром с. Обнаружилось, что это сравнительно простой белок, молекулярный вес его — около 13 000, и каждая молекула этого вещества содержит один атом железа. Этот атом является частью гема, такого же гема, какой входит и в состав гемоглобина (см. главу 18). Дальнейшие исследования показали, что и в других цитохромах тоже содержится железо — и в каждом случае оно входило в состав либо гема, либо очень похожей на гем группы атомов.
Соответственно, цитохромы получили видовое название «гемоферменты». Каталаза, как я уже упоминал в предыдущей главе, тоже является примером гемофермента, но она не выполняет функций цитохромов. Гемоглобин — это гемосодержащий белок, но не гемофермент. Не все ферменты, в составе которых имеется железо, — гемоферменты. К примеру, в состав дегидрогеназы янтарной кислоты тоже входит атом железа, но не как часть гемовой группы.
Когда была установлена схема передачи водорода («дыхательная цепочка»), вскоре стало ясно, что цитохромы должны быть в нее где-то включены. Они присутствуют практически во всех клетках, за исключением разве что клеток некоторых «обязательно анаэробных» бактерий — то есть таких, которые могут жить только при отсутствии кислорода. Факт того, что в их клетках цитохромы отсутствуют в сочетании с тем, что эти бактерии не могут использовать кислород, сам по себе уже свидетельствует в пользу важности роли цитохромов в дыхательных цепочках.
И опять же, любое вещество, препятствующее деятельности цитохромов — а особенно колебаниям атома железа между двух- и трехвалентным состоянием, что прекращает передачу электрона, — препятствует и поглощению кислорода. Воздействие цианидных групп (—С=N) таких веществ, как синильная кислота (HCN) или цианистый калий (KCN), приводит к прочному застыванию атома железа в одном из состояний, в результате чего дыхание быстро и навсегда прекращается (именно поэтому цианиды так ядовиты).
О положении цитохромов в цепочке можно судить по окислительным потенциалам, приведенным в таблице 9. Очевидно, цитохромы стоят где-то после флавинов, принимают электроны от атомов водорода и передают их по одному путем колебания железа между двух- и трехвалентным ионным состоянием, от «b» к «c», от «c» к «a», от «a» к «a3».
Возможно, при этом передаются и сами атомы водорода, хотя в этом отношении точных данных нет.
Однако где-то ведь цепочка должна закончиться! На каком-то этапе водород должен быть передан кислороду — и это этап цитохрома a3. Окислительный потенциал системы «кислород/вода» равен +0,80, и он в конце концов берет свое. Поскольку цитохром a3 может использовать кислород в качестве получателя водорода, в результате чего образуется вода, а не перекись водорода (получается, вот он, фермент, катализирующий разрыв связи О—О!), то его можно назвать «оксидазой». На самом деле именно под этим названием цитохром a3 и известен по большей части — «цитохромоксидаза».
Все, получили воду, можно теперь расслабиться. Теперь дыхательная цепочка собрана до конца.
Опять возникает вопрос: почему же она оказывается такой длинной? Почему же требуется так много коферментов и простетических групп, чтобы перенести атомы водорода от субстрата к ферменту?
Таблица 9
ОКИСЛИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ
Окислительно-восстановительная система … Окислительный потенциал
ДПН/ДПН?2Н … - 0,32
ФАД/ФАД- 2Н … - 0,22
b(Fe3+)/b(Fe2+)* … - 0,05
c(Fe3+)/c(Fe2+)* … + 0,25
a(Fe3+)/aFe2+)* … + 0,29
a3(Fe3+)/a3(Fe2+* … + 0,30
* цитохромы
Как я уже говорил, при дегидрогенизации вещества уровень свободной энергии снижается на 35—70 килокалорий на моль вещества, но организм не может использовать высвобождающуюся энергию, если только не запасет ее в виде высокоэнергетических фосфатных связей. Насколько известно, в ходе одной реакции может образоваться только одна высокоэнергетическая связь. Поскольку запасти таким образом можно только 8 килокалорий на моль вещества, то перевод одной реакции дегидрогенизации в одну реакцию образования высокоэнергетической фосфатной связи означал бы потерю семи восьмых энергии.
Наличие длинной дыхательной цепочки позволяет живой ткани разбить процесс уменьшения свободной энергии на фрагменты, на каждом из которых можно создавать по одной высокоэнергетической фосфатной связи. В начале 50-х годов XX века достаточно убедительно было показано, что таким образом в среднем на основе одной реакции дегидрогенизации удается создать по три высокоэнергетических фосфатных связи. Таким образом, эффективность использования энергии достигает хотя бы 35 процентов.
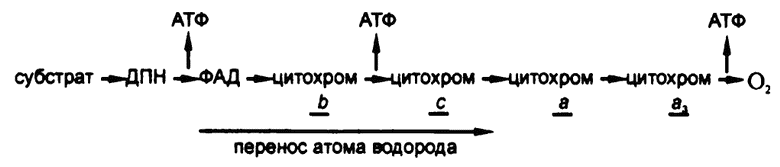
Рис. 63. Окислительное фосфорилирование
Естественно, возникает вопрос, а где же именно, на каком участке дыхательной цепочки формируются высокоэнергетические фосфатные связи. Для ответа на этот вопрос попытаемся действовать методом исключения.
Система с участием дегидрогеназы молочной кислоты производит три высокоэнергетические фосфатные связи на каждую потребляемую молекулу молочной кислоты. Однако система с участием дегидрогеназы янтарной кислоты произведет лишь две высокоэнергетические фосфатные связи на каждую потребляемую молекулу янтарной кислоты. Дегид-рогеназа янтарной кислоты — флавофермент, так что при дегидрогенизации янтарной кислоты из процесса выпадает этап пиридин-фермента. Поскольку этому выпадению соответствует потеря одной реакции образования высокоэнергетической фосфатной связи, то остается сделать вывод, что одна такая связь образуется именно при переходе от ДПН к ФАД.
Путем добавления в дыхательную систему различных химических веществ можно исключать из цепочки те или иные звенья и отмечать, сократится ли при этом количество образуемых высокоэнергетических фосфатных связей. Итоговые предположения об участках образования этих связей приведены на рис. 63.
Каковы же механизмы реакций «окислительного фосфорилирования» (то есть производства высокоэнергетических фосфатных связей путем окисления, представленного в виде переноса атомов водорода)? Это до сих пор неизвестно. Если излагаемая в данной книге информация производит впечатление, что наука сумела решить все проблемы, то заверяю вас — это впечатление ошибочно.
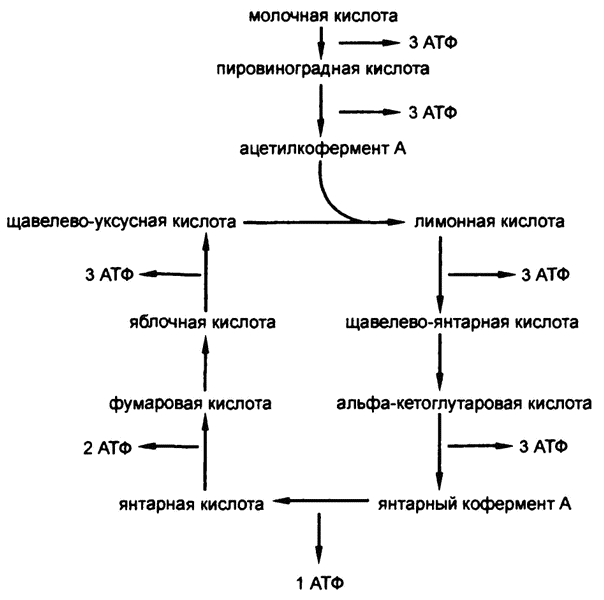
Рис. 64. АТФ и цикл Кребса
Без знания точных подробностей производства высокоэнергетических связей тем не менее возможно подсчитать количество производимого на каждой стадии катаболизма молочной кислоты — результаты приведены на рис. 64.
Как видите, результатом катаболизма молочной кислоты на углекислоту и воду, в отношении которого калориметр показывает цифру в 325 калорий на моль вещества[9], являются 18 молекул АТФ. Если считать, что при формировании каждой высокоэнергетической фосфатной связи уровень свободной энергии возрастает на 8 килокалорий на моль вещества, то в целом в результате катаболизма каждого моля молочной кислоты организм переводит в высокоэнергетические фосфатные связи и запасает 144 килокалории химической энергии. 144 из 325 — это около 45 процентов, в общем, неплохая эффективность.
В какой же части клетки проходят процессы окислительного фосфорилирования? В данной книге я еще ни разу не предпринимал попыток описать устройство клетки. А клетка устроена очень сложно, она обладает множеством специализированных частей (органелл) со специализированными свойствами, и чем более тонкие инструменты оказываются в руках цитологов, тем более тонкие свойства органелл удается обнаружить.
Начнем с того, что каждая неповрежденная клетка имеет внутреннюю часть небольшого объема, которая носит название «клеточное ядро», тонкой мембраной отделенное от остальной части клетки (цитоплазмы). Главная задача ядра — обеспечение размножения клеток и точный перенос генов, управляющих химическими свойствами, от материнской клетки к дочерней. Однако к процессу производства энергии ядро никакого отношения не имеет и ни флавоферментов, ни цитохром не содержит. Для дегидрогенизации как таковой не требуется ничего, кроме пиридин-ферментов, которые сами по себе кислород не используют. Иными словами, ядро — система анаэробная, так что искать место проведения энергопроизводящих реакций с потреблением кислорода следует в цитоплазме.
Различные органеллы цитоплазмы (да и ядра) реагируют на разные красители по-разному — одни поглощают, другие нет, так что их можно «помечать» с помощью соответствующих красителей, специфичных для каждой из органелл. Тогда клеточные частицы, обычно неразличимые глазом, начинают сверкать всеми цветами радуги.
В 1898 году немецкий цитолог С. Бенда с помощью комплекса красителей сумел обнаружить, что небольшие гранулы в цитоплазме огромного множества клеток окрашиваются подозрительно контрастно. Он назвал эти гранулы «митохондриями» (от греческого «хрящевые нити»). Название было неудачным, поскольку к хрящам эти нити никакого отношения не имеют. Тем не менее название это прижилось, как и многие другие ошибочные имена, и мы пользуемся им по сей день.
На протяжении примерно одного поколения функции митохондрий оставались неизученными, и они были для всех просто «еще одним видом клеточных частиц». Однако в 30-х годах XX века с развитием ультрацентрифуг (см. главу 16) стало возможным разложение клетки на составляющие путем ее разрушения и осаждения по очереди различных содержащихся в ней веществ. Таким образом были получены и суспензии, состоящие из одних митохондрий.
А в 40-х годах XX века появились и новые микроскопы с небывалой увеличительной мощностью. Теперь вместо лучей света, фокусируемых с помощью оптических линз, стали использоваться пучки электронов, фокусируемые с помощью магнитных полей. С помощью таких электронных микроскопов наконец-то стало возможным как следует рассмотреть митохондрии, диаметр которых составляет всего один-три микрона, то есть в тысячу раз меньше самой клетки.
Использование электронного микроскопа позволило установить, что митохондрия окружена двойной мембраной, рассекающей тело органеллы, разделяющей ее на части и многократно увеличивающей, таким образом, площадь поверхности митохондрии.
В ходе экспериментов выяснилось, что суспензия митохондрии катализирует все без исключения реакции, входящие в цикл Кребса. Так стало ясно, что «электростанцией» клетки служит именно митохондрия, мембраны которой представляют собой скопление ферментов и коферментов, необходимых для катаболизма пищевых веществ и производства высокоэнергетических фосфатных связей. Было подсчитано, что в среднем отдельная митохондрия представляет собой около 10 000 «сборочных пунктов», на каждом из которых может происходить полный цикл катаболизма, отщепляться атом водорода и создаваться высокоэнергетическая фосфатная связь.
Более подробная информация о молекулярном устройстве митохондрии наверняка еще появится по мере разработки более мощных научных инструментов.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава 6. Жизнь в карикатуре
Глава 6. Жизнь в карикатуре Несколько полушутливых строчек, предваряющих каждую главу нашего повествования, уже стали, как нам кажется, своеобразной традицией: хорошей или дурной — судить читателю. Но, честное слово, готовясь к рассказу о функциональной роли белковых
Глава пятая Жизнь человекообезьян в сообществах
Глава пятая Жизнь человекообезьян в сообществах Тот, у кого в роду нет ни глупцов, ни плутов, ни попрошаек, был зачат ударом молнии. Томас Фуллер (1608–1661) В Гомбе-Стрим, в Танзании, самец-шимпанзе играет с маленьким братом. Во время игры малыш легко стоит на двух ногах, что
Глава III. Есть ли жизнь на Земле?
Глава III. Есть ли жизнь на Земле? Оро:…Как сказал один шутник, по теории вероятностей мы все должны были быть мертвецами. Тем не менее, мы живы. Чаргафф: Но мы все-таки умрем. Мора: В том-то и беда. Из дискуссии на Флоридской конференции по происхождению жизни Там, где вечно
Мезозойская эра — средневековье земли Жизнь овладевает сушей и воздухом
Мезозойская эра — средневековье земли Жизнь овладевает сушей и воздухом Что изменяет и совершенствует живые существа? О многом уже рассказали нам коллекции окаменелостей, собранные в геолого-минералогическом музее: о глубинах кембрийского моря, где жили похожие на
Глава 6 ЖИЗНЬ РАСТЕНИЙ, УВЕЛИЧЕННАЯ В 100 МИЛЛИОНОВ РАЗ
Глава 6 ЖИЗНЬ РАСТЕНИЙ, УВЕЛИЧЕННАЯ В 100 МИЛЛИОНОВ РАЗ а восточном побережье Индии, в старинном штате Бенгал, на полутора гектарах земли неподалеку от Университета Калькутты расположился комплекс зданий из серо-лилового песчаника в классическом до мусульманском
Глава 3 Дыхание и жизнь
Глава 3 Дыхание и жизнь Из всего разнообразия веществ, находящихся в окружающей среде, воздух, или, точнее, кислород, является самым жизненно необходимым. Если нужно, мы можем несколько дней обходиться без воды, а без пищи неделями. Я не хочу сказать, что это приятный
Глава 1. Что такое жизнь?
Глава 1. Что такое жизнь? Не так уж много времени прошло с тех пор, как генетика и биохимия стали самостоятельными науками, каждая из которых… пытается подобрать ключ к феномену жизни. Биохимики обнаружили ферменты, а генетики — гены. Уильям Хеш, "Генетика бактерий и
Глава 4. Есть ли жизнь на других планетах?
Глава 4. Есть ли жизнь на других планетах? Тем не менее большинство планет, несомненно, обитаемы, а необитаемые со временем будут населены. Таким образом, я могу все изложенное выше выразить в следующем общем виде: вещество, из которого состоят обитатели различных планет, в
Глава 8. Жизнь в Солнечной системе
Глава 8. Жизнь в Солнечной системе Нам суждено спускаться вновь и вновь. В тот край, откуда началась дорога, Чтобы опять взглянуть… и в изумленьи Его увидеть, словно в первый раз. Т. С. Элиот, "Легкое головокружение" Убежденность в существовании жизни на планетах Солнечной
Глава 20. ЖИЗНЬ БЕЗ ВОЗДУХА
Глава 20. ЖИЗНЬ БЕЗ ВОЗДУХА Как видите, многое о процессах, происходящих в живой ткани, можно сказать на одной лишь основе рассмотрения веществ, которые мы имеем на входе в организм и на выходе из него. Мы решили, что должен существовать некий общий строительный «кирпичик»,
Глава 10. Как давно могла зародиться жизнь?
Глава 10. Как давно могла зародиться жизнь? До сих пор мы обсуждали, где могла бы появиться жизнь во Вселенной и насколько маловероятным могло быть это событие. Мы совсем не обсуждали, когда она могла зародиться и сколько времени потребовалось на совершенствование древних
Короткая жизнь для человека, но длинная жизнь для человечества
Короткая жизнь для человека, но длинная жизнь для человечества Бактерии и люди многим отличаются. Если одно поколение бактерий живет двадцать минут, то между одним поколением человека и следующим проходит много лет. Если человек зарождается за счет слияния яйцеклетки и
Глава 16: Жизнь, какой мы (не)знаем ее
Глава 16: Жизнь, какой мы (не)знаем ее Caplan, Arthur. What If Anything Is Wrong with Cloning a Human Being? // Case Western Reserve Journal of International Law. 35 (Fall 2003): 69–84.Segerstr?le, Ullica. Defenders of the Truth. Oxford University Press, 2001.Wade, Nicholas. Before the Dawn. Penguin, 2006.* Среди прочих, Николас Уэйд предлагал добавить еще одну пару
Глава 17 Голубая планета и новая жизнь
Глава 17 Голубая планета и новая жизнь Земная жизнь в безбрежном лоне вод Среди пещер жемчужных океана Возникла, получила свой исход, Росла и стала развиваться рано; Сперва в мельчайших формах все росло, Не видимых и в толстое стекло, Которые, киша, скрывались