Мир РНК
Мир РНК
Когда Ханс Йорнваль, секретарь стокгольмского Нобелевского комитета, 2 октября 2006 года объявил новых лауреатов этой премии по медицине, по залу прокатился ропот. Такого решения ожидали немногие зрители: лауреатами оказались двое активных ученых лет по сорок с небольшим, чьи важнейшие публикации появились за восемь лет до того. Обычно награждают более заслуженных специалистов.
Тем не менее, по мнению большинства коллег, американцы Эндрю Файер из Стэнфордского университета (Калифорния) и Крейг Мелло из Медицинской школы Массачусетского университета получили высшее признание в своей области совершенно заслуженно. Все-таки они открыли абсолютно неизвестный до этого метод контроля активности генов — так называемую РНК-интерференцию.
РНК — сокращенное название рибонуклеиновой кислоты. Так называется младшая и чрезвычайно разносторонняя сестра ДНК (дезоксирибонуклеиновой кислоты). Молекулы РНК по химической структуре почти не отличаются от ДНК, но состоят из значительно более коротких цепочек нуклеотидов и менее устойчивы к изменениям. Они выполняли роль наследственного материала первых живых организмов на Земле, а простые вирусы по-прежнему используют их в этих целях.
Все виды РНК в основном имеют четко разграниченные функции и чрезвычайно важны для биохимии клетки. В отличие от ДНК они могут состоять не из двух цепочек с попарно связанными основаниями, но из одной нити с открытыми основаниями, а порой имеют форму петли. Ввиду многообразия молекул РНК биологи благоговейно говорят о целом мире РНК, который исследован еще далеко не полностью. Самые важные представители этого мира — уже упоминавшиеся матричные (информационные) и транспортные РНК. Появились и новые звезды — микро-РНК.
До открытия Файера и Мелло последних считали побочным продуктом, своего рода информационными РНК без информации, которые образуются, когда считывающие белки по ошибке переводят какой-нибудь участок мусорной ДНК в информационную РНК. Сегодня уже известно, что этот процесс происходит не случайно, а соответствующие участки ДНК — вовсе не мусор. Скорее они представляют собой третью важную систему переключателей эпигенетического кода.
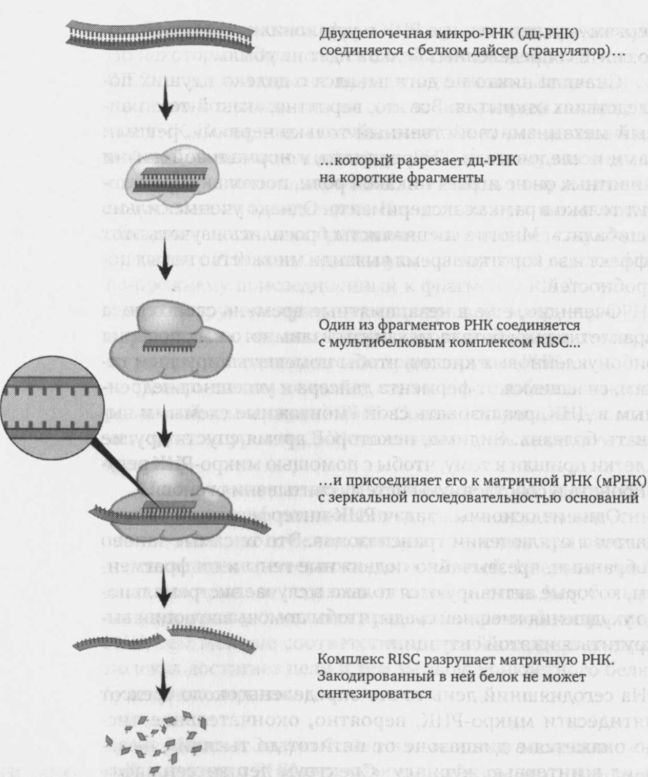
Сначала клетка синтезирует две зеркальные нити микро-РНК, которые объединяются в так называемую двухцепочечную РНК. Эти молекулы, напоминающие короткую веревочную лестницу, выглядят точно так же, как наследственный материал вторгшихся в клетку вирусов, стремящихся размножиться с помощью биохимического аппарата инфицированных клеток и таким образом вызвать болезнь. Клетка борется с РНК таким же способом, как и с вирусами: появляется фермент под названием дайсер (гранулятор) и разбивает их на кусочки длиной от 21 до 27 нуклеотидов.
Большинство таких фрагментов уничтожаются клеткой. Но некоторые соединяются с мультибелковым комплексом RISC,[4] который спасает их от уничтожения. Затем эти соединения отправляются на поиски подходящей им матричной РНК. Последняя в значительной степени идентична одной из цепочек исходной микро-РНК, а потому в ней где-то обязательно найдется участок, парный одному из многих получившихся фрагментов. Как только нужная молекула обнаруживается, она приклеивается к соответствующему фрагменту РНК, как бедная муха к липучке. В заключение по-прежнему присоединенный к фрагменту RISC осуществляет быструю расправу — он превращает матричную РНК в кучку нуклеотидного мусора, который мгновенно собирают и перерабатывают пустые транспортные РНК.
Теперь клетка не может синтезировать белок, закодированный в матричной РНК. Соответствующий ген молчит, хотя на уровне ДНК постоянно происходит его считывание.
Но и это еще не все. С помощью своих микро-РНК клетка может не только запустить или остановить синтез того или иного белка, как она это делает при помощи других эпигенетических переключателей. Клетка способна также немного подавить активность гена. Чем больше липучек она выкладывает против конкретной матричной РНК, тем меньше соответствующих ей закодированных молекул достигает цели и тем меньше конкретного белка будет синтезировано.
Крейг Мелло и Эндрю Файер назвали этот механизм генной регуляции РНК-интерференцией, потому что в ходе процесса две отвечающие друг другу молекулы — матричная РНК и микро-РНК — выключают друг друга точно так же, как во время физической интерференции взаимно ослабляются встречные волны. Исследователи выявили этот принцип в результате опыта: они вводили круглым червям двухцепочечные РНК и установили, что после этого синтез определенных белков идет на убыль.
Сначала никто не догадывался о далеко идущих последствиях открытия. Все это, вероятно, «какой-то странный механизм, свойственный только червям», решили сами исследователи. Скорее всего, в нормальной жизни животных он не играет никакой роли, поскольку происходит только в рамках эксперимента. Однако ученые сильно ошибались. Многие специалисты бросились изучать этот эффект и за короткое время выявили множество новых подробностей.
Очевидно, еще в незапамятные времена своего рода праклетка выработала механизм взаимного выключения рибонуклеиновых кислот, чтобы помешать вирусным генам, спасшимся от фермента дайсера и успешно внедренным в ДНК, реализовать свои «монтажные схемы» и вызвать болезнь. Видимо, некоторое время спустя другие клетки пришли к тому, чтобы с помощью микро-РНК регулировать и собственную систему считывания генов.
Одна из основных задач РНК-интерференции заключается в отключении транспозонов. Это те самые заново собранные, чрезвычайно подвижные гены и их фрагменты, которые активируются только в случае экстремального ухудшения внешней среды, чтобы помочь эволюции выкрутиться из этой ситуации.
«На сегодняшний день точно определены около трехсот пятидесяти микро-РНК, вероятно, окончательное число окажется в диапазоне от пятисот до тысячи», — заявил в интервью журналу «Спектрум дер виссеншафт» («Спектр науки») немецкий биохимик Томас Тушль из Рокфеллеровского университета (Нью-Йорк), один из ведущих исследователей РНК-интерференции в мире. Помимо прочего Тушль обнаружил, что выключатели из рибонуклеиновой кислоты есть и в человеческих клетках.
РНК-интерференция. Геном содержит не только гены, но и коды для микро-РНК. С помощью ферментов они разрушают соответствующие им матричные РНК и таким образом блокируют перевод гена в белок.
Сегодня уже известно, что принцип РНК-интерференции работает практически во всех живых организмах. А самые последние результаты свидетельствуют, что мир РНК куда важнее и разнообразнее, чем предполагалось. Выяснилось, что малые РНК служат также следопытами, указывая белкам вокруг ДНК те места, которые следует надежно блокировать или перепрограммировать. «Есть основания полагать, что РНК могут выполнять функцию якоря для различных белков, присоединяющих к хроматину метильные или ацетильные группы или снова удаляющих их», — разъясняет швейцарский эпигенетик Ренато Паро.
Происходит следующее: некоторые фрагменты микро-РНК попадают обратно в клеточное ядро и становятся великими устроителями эпигенома. Отрезки РНК уверенно и точно присоединяются к определенным участкам ДНК, прежде всего к своим зеркальным копиям. Причем эти удальцы тянут за собой на буксире специальные белки, побуждающие наследственное вещество, например, свернуться в клубок — деактивированный, плотно упакованный гетерохроматин. Таким образом они могут на долгое время отключать целые участки ДНК.
Томас Тушль считает, что микро-РНК способны и на большее. Вероятно, они — «важный фактор возникновения различных заболеваний». «Перспективная цель» его собственного исследования — «изобразить карту микро-РНК во всем геноме, для всех здоровых и больных тканей, и определить их функции».
В системе РНК-интерференции Тушля особенно вдохновляет то, что, наряду с метилированием ДНК и гистоновым кодом, обнаружен третий путь воздействия внешних факторов на активность генов. «Возникает вопрос, нельзя ли объяснить большую часть генетических заболеваний через процесс регуляции и можно ли как-то управлять ими, — говорит ученый. Звучит сложно, но исследователь поясняет на примере: — Гипотеза такова: возможно, чтобы добиться небольшого, но действенного изменения модели активации гена против депрессии, достаточно регулярно заниматься спортом, стабилизируя уровень дофамина, ведь это вещество — важный фактор в лечении депрессии».
Этот пример возвращает нас к главному посылу науки о втором коде: тот, кто начинает жить по-новому, меняет свой обмен веществ и гормональную систему. А эти перемены оказывают долговременное воздействие на модели метилирования, модификации гистонов и микро-РНК, что, в свою очередь, может благотворно повлиять на тело и психику. Кстати, тот факт, что физическая активность часто уменьшает депрессии, уже доказан во многих научных работах. Эпигенетика позволяет объяснить подобные положительные эффекты, наступающие в результате изменения образа жизни.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК