Влияние полного экспериментального голодания на неосаждаемую активность некоторых лизосомальных гидролаз А. А. ПОКРОВСКИЙ, Г. К ПЯТНИЦКАЯ (Москва)
Влияние полного экспериментального голодания на неосаждаемую активность некоторых лизосомальных гидролаз
А. А. ПОКРОВСКИЙ, Г. К ПЯТНИЦКАЯ (Москва)
В связи с тем вниманием, которое в настоящее время уделяется роли лизосом в развитии повреждения клеток тканей различных организмов, а также принимая во внимание приписываемую им роль внутриклеточной пищеварительной системы (1), изучение, влияния голодания на поведение кислой фосфомоноэстеразы, ?-глюкуронидазы и катапсина, характеризующихся преимущественно внутрилизосомальной локализацией, представляло для нас значительный интерес.
Согласно некоторым данным (2, 4) определение неосаждаемой активности лизосомальных гидролаз, выраженной в процентах от соответствующей- общей активности, предусматривает прямую оценку состояния лизосом в тканях органов.
В настоящих исследованиях были использованы животные разного возраста (три возрастные группы). В первую группу были включены молодые растущие крысы весом 50— 55 грамм, которые после-голодания в течение 36 часов теряли около 20% веса тела и находились в состоянии близком к коматозному. Исходный вес животных II-й группы колебался в пределах 120—130 грамм. Исследования ферментной активности проводили при двух сроках голодания: после 36 часов и 120 часов (при последнем сроке голодания животные находились в состоянии комы). В III-ю группу входили половозрелые животные с исходным весом 220—240 грамм, голодание которых продолжалось в течение 6 суток и которые были забиты в терминальном периоде голодания.
Результаты, полученные при определении активности вышеупомянутых лизосомальных ферментов, представлены в таблицах №№ 1—3.
Таблица 1
Активность катепсина, кислой фосфомоноэстераэы и ?-глюкуронидазы в надосадочной жидкости и гомогенатах печени животных весом 50—55 грамм (группа I)
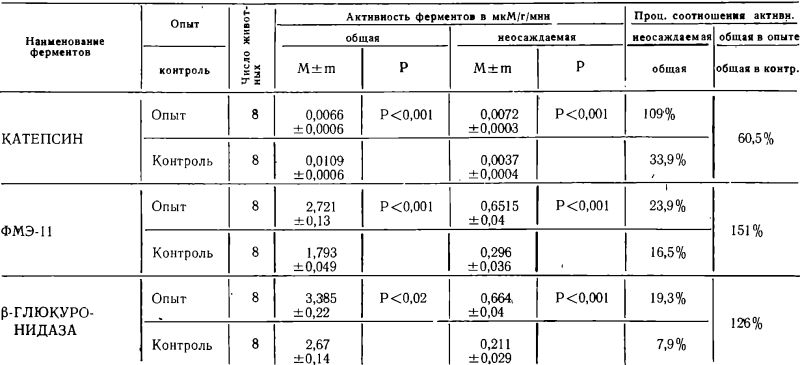
Таблица 2
Активность катепсина, кислой фосфомоноэстеразы и ?-глюкуронндазы в надосадочной жидкости и гомогенатах печени животных весом 120—130 грамм (группа II)
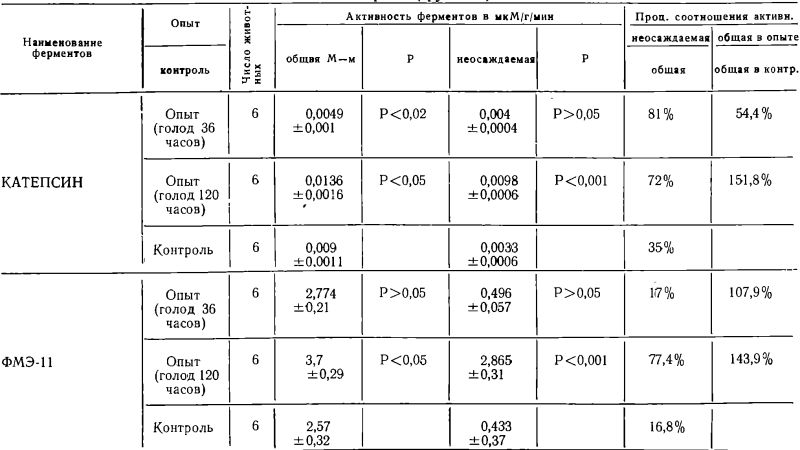
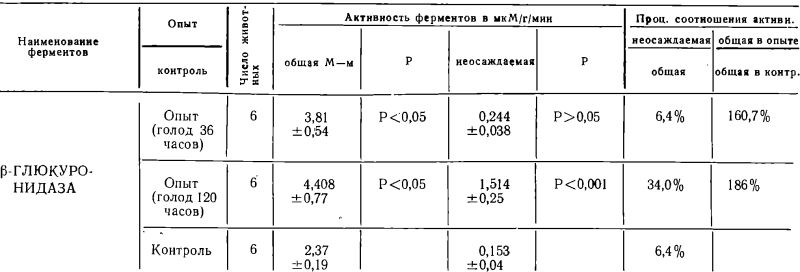
Таблица 3
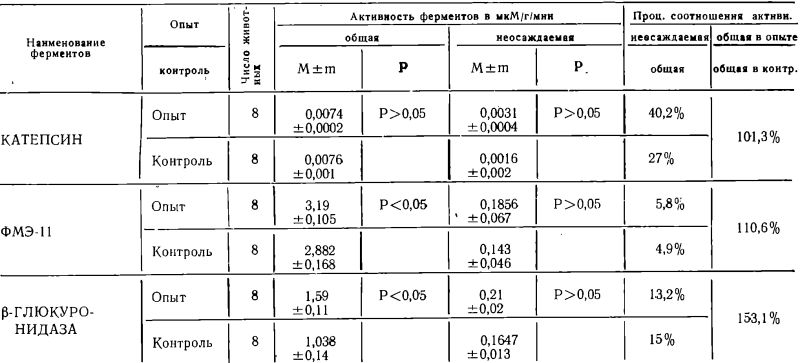
Активность катепсина, кислой фосфомоноэстеразы и ?-глюкуронидазы в надосадочной жидкости и гомогенатах печени животных весом 220—240,0 грамм (группа III)
Из данных таблицы № 1 видно, что определение активности катепсина в гомогенате печени и надосадочной жидкости у крыс — отъемышей весом 50—55 грамм (группа 1) после голодания в течение 36 часов указало на полный выход катепсина из лизосом в надосадочную жидкость у голодающих животных на фоне снижения общей активности катепсина при этом до уровня 60,5% по сравнению с контролем. Неосаждаемая активность ?-глюкуронидазы и кислой фосфомоноэстеразы у подопытных животных увеличивалась в два и полтора раза соответственно по сравнению с одновременно наблюдаемыми величинами у контрольных животных.
Как следует из данных представленных в таблице № 2, у подопытных животных И-ой группы, исходный вес которых колебался -в пределах 120—130 грамм, при голодании продолжительностью 36 часов неосаждаемая активность катепсина увеличивалась (81% и 35% соответственно у опытных и контрольных животных), в то время как общая активность катепсина у голодающих животных, так же как у животных предыдущей группы снижалась по сравнению с контролем до уровня 54,4%.
Неосаждаемая активность ФМЭ-11 и ?-глюкуронидазы у опытных животных данной группы при указанном сроке голодания почти не отличалась от величин, наблюдаемых у контрольных животных; в то же время общая активность ?-глюкуронидазы у голодающих животных увеличивалась до 160,7%, общая активность ФМЭ-11 при этом почти не отличалась от уровня активности у контрольных животных.
Особый интерес представляют результаты определения общей и неосаждаемой активности лизосомальных гидролаз, полученные у опытных животных после удлинения продолжительности голодания до 120 часов. В отношении активности катепсина важно отметить повышение общей активности катепсина у опытных животных данной группы до 150% при значительном выходе указанного фермента в надосадочную жидкость (72% от общей активности фермента). Неосаждаемая активность ФМЭ-11 составляла 77,4% (в то время как у контрольных животных на ее долю приходилось 16,8%); а неосаждаемая активность ?-глюкуронидазы —34% (у контрольных животных 6,4%).
Наименее выраженными оказались изменения неосаждаемой активности изучаемых нами ферментов у опытных животных III группы (табл. № 3). Так, например, неосаждаемая активность катепсина у голодающих животных III группы составляла 40,2% от общей активности фермента, в то время как у контрольных 27%, т. е. отмеченные изменения катепсина по своей направленности аналогичны изменениям, выявленным на животных двух предыдущих групп.
Каких-либо выраженных изменений неосаждаемой активности ?-глюкуронидазы и кислой фосфомоноэстеразы при этом не было обнаружено.
Таким образом, в надосадочной жидкости, полученной в результате центрифугирования гомогенатов печени контрольных животных, активность изучаемых нами индикаторных лизосомальных ферментов (катепсина, ?-глюкуронидазы и ФМЭ-11) была небольшая (27%—35% от общей активности для катепсина и от 6% до 16% для двух других ферментов). У голодающих животных происходил переход («солюбилизация») изучаемых ферментов в растворимую фракцию клетки, в результате чего неосаждаемая активность этих ферментов увеличивалась и составляла 40—100% от общей активности у катепсина и от 19 до 77% от общей активности у ФМЭ-11 и глюкуронидазы. Наиболее отчетливое увеличение неосаждаемой активности катепсина, ФМЭ-11 и ?-глюкуронидазы отмечено у молодых и растущих животных (I и II группы). При этом наибольшая степень выраженности указанных изменений отмечена у животных предельно голодающих и забитых в коматозном состоянии.
Определенный интерес представляет изменение неосаждаемой активности катепсина у животных III группы в сторону увеличения при отсутствии при этом изменений неосаждаемой активности ?-глюкуронидазы и кислой «фосфомоноэстеразы, принимая во внимание, что катепсину уделяется важная роль в процессах клеточного некроза и автолиза.
ЛИТЕРАТУРА
1. Дюв К. де. В кн.: «Структурные компоненты клетки». М., 1962. с. 128.
2. Дюв К. Д е. В кн.: «Структура и функция клетки». И. Л., 1964,. с. 90.
3. Duncan С. Y. «Nature», 1966, 210, 5042, pp. 1229.
4. Slatеr Т. F., Greenbaum A. L., Wang О. Y. Ciba Found Symp. «Lysosomes», 1963, pp. 311.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Влияние сенсорной стимуляции на двигательную активность эмбриона
Влияние сенсорной стимуляции на двигательную активность эмбриона Выше приводились примеры рефлекторных движений зародышей, производимых преимущественно в ответ на тактильные раздражения. Сенсомоторная активность составляет единый процесс на всех этапах жизни
Развитие идей лечебного голодания Ю. С. НИКОЛАЕВ (Москва)
Развитие идей лечебного голодания Ю. С. НИКОЛАЕВ (Москва) Можно считать, что люди еще с доисторических времен применяли голодание с лечебной целью; это подтверждается наблюдениями за животными, которые при заболевании отказываются от приема пищи, этому же инстинктивно
Опыт лечения тучности методом полного голодания Д. Д. ФЕДОТОВ, Ю. С. НИКОЛАЕВ, Ю. Л. ШАПИРО, Г. И. БАБЕНКОВ, В. Б. ГУРВИЧ (Москва)
Опыт лечения тучности методом полного голодания Д. Д. ФЕДОТОВ, Ю. С. НИКОЛАЕВ, Ю. Л. ШАПИРО, Г. И. БАБЕНКОВ, В. Б. ГУРВИЧ (Москва) Лечение ожирения остается одной из наиболее актуальных проблем современной медицины. Число больных с избыточным весом, согласно данным многих
Случай применения лечебного голодания у тучного больного, перенесшего инфаркт миокарда М.И. МИНЯЙЛЕНКО (Москва)
Случай применения лечебного голодания у тучного больного, перенесшего инфаркт миокарда М.И. МИНЯЙЛЕНКО (Москва) В литературе нам встретились ряд работ, указывающих на эффективность кратковременного воздержания от приема пищи при целом ряде соматических заболеваний.Так
О влиянии дозированного голодания на состояние слизистой желудка М. И. МИНЯЙЛЕНКО, А. И. БУХМАН, И. И. ЛУЧИНСКИЙ (Москва)
О влиянии дозированного голодания на состояние слизистой желудка М. И. МИНЯЙЛЕНКО, А. И. БУХМАН, И. И. ЛУЧИНСКИЙ (Москва) Голодание нередко приводит к изменениям со стороны желудочно-кишечного тракта. По данным Ю. С. Николаева, вторая стадия голодания сопровождается
Влияние дозированного голодания на показатели проб Торна у больных шизофренией О. Я. СИЛЕЦКИЙ (Ростов-на-Дону)
Влияние дозированного голодания на показатели проб Торна у больных шизофренией О. Я. СИЛЕЦКИЙ (Ростов-на-Дону) Давно замечено, что эффект от лечения больных шизофренией с затяжным течением наступает тогда, когда меняется реактивность организма (2, 13 и др.). Применяя лечение
Активность нейронов коры головного мозга у голодных животных Ю. А. ФАДЕЕВ (Москва)
Активность нейронов коры головного мозга у голодных животных Ю. А. ФАДЕЕВ (Москва) Успехи, современной нейрофизиологии, связанные с использованием новых тонких методов электрофизиологического исследования мозга, позволили подойти к изучению центральных механизмов
Сравнительное изучение действия полного длительного голодания И белковой недостаточности на состав периферической крови мышей СС57 Вr И. Л. ПОВЕРИЙ и В. И. ПРИЛЯЦКИЙ (Москва)
Сравнительное изучение действия полного длительного голодания И белковой недостаточности на состав периферической крови мышей СС57Вr И. Л. ПОВЕРИЙ и В. И. ПРИЛЯЦКИЙ (Москва) Полное или частичное голодание является удобной экспериментальной моделью для изучения влияния
Фагоцитарная активность лейкоцитов периферической крови при полном голодании и последующем питании людей Ю. Л. ШАПИРО, Ю. С. НИКОЛАЕВ, А Я. ТАБАХ, Л. Ф. ЛЕВИНА (Москва)
Фагоцитарная активность лейкоцитов периферической крови при полном голодании и последующем питании людей Ю. Л. ШАПИРО, Ю. С. НИКОЛАЕВ, А Я. ТАБАХ, Л. Ф. ЛЕВИНА (Москва) Изучению фагоцитарной активности лейкоцитов при длительном полном алиментарном голодании посвящены
О действии полного длительного алиментарного голодания на хромосомный аппарат лимфоцитов периферической крови К. Н. ГРИНБЕРГ, Ю, Л. ШАПИРО, Е. А. КИРИЛОВА, Р. С. КУШНИР (Москва)
О действии полного длительного алиментарного голодания на хромосомный аппарат лимфоцитов периферической крови К. Н. ГРИНБЕРГ, Ю, Л. ШАПИРО, Е. А. КИРИЛОВА, Р. С. КУШНИР (Москва) Полное алиментарное голодание успешно применяется при лечении некоторых психических и
Изменение количества и некоторых параметров полового хроматина у людей в процессе полного длительного алиментарного голодания и последующего питания С. Н. РЕЗИНА, Ю. Л. ШАПИРО (Москва)
Изменение количества и некоторых параметров полового хроматина у людей в процессе полного длительного алиментарного голодания и последующего питания С. Н. РЕЗИНА, Ю. Л. ШАПИРО (Москва) Половой хроматин — внутриядерное тельце, дающее Фельген-положительную реакцию и
Условнорефлекторные лейкоцитарные реакции в динамике лечебного голодания при некоторых нервно-психических заболеваниях С. М. ЛУРЬЕ (Москва)
Условнорефлекторные лейкоцитарные реакции в динамике лечебного голодания при некоторых нервно-психических заболеваниях С. М. ЛУРЬЕ (Москва) Учение И. П. Павлова «Об организме, как о целостной системе, как о функциональном единстве всех органов и тканей, психического и
Материалы к изучению ферментной адаптации при полном лечебном голодании А. А. ПОКРОВСКИЙ, Ю. С. НИКОЛАЕВ, Г. К. ПЯТНИЦКАЯ, Г. И. БАБЕНКОВ (Москва)
Материалы к изучению ферментной адаптации при полном лечебном голодании А. А. ПОКРОВСКИЙ, Ю. С. НИКОЛАЕВ, Г. К. ПЯТНИЦКАЯ, Г. И. БАБЕНКОВ (Москва) В течение последних лет в нашей стране и за рубежом появилось большое число сторонников применения голодания с лечебной целью при
Изменение активности некоторых Ферментов крови и печени крыс при экспериментальном голодании А. А. ПОКРОВСКИЙ, Г. К. ПЯТНИЦКАЯ (Москва)
Изменение активности некоторых Ферментов крови и печени крыс при экспериментальном голодании А. А. ПОКРОВСКИЙ, Г. К. ПЯТНИЦКАЯ (Москва) Проблема влияния голодания на разные показатели обменных процессов в организме животных и человека продолжает привлекать внимание
Влияние голодания на активность ферментов пентозофосфатного пути в печени и мозге крыс Ю. Л. ЗАХАРЬИН (Москва)
Влияние голодания на активность ферментов пентозофосфатного пути в печени и мозге крыс Ю. Л. ЗАХАРЬИН (Москва) В последние годы в клинике часто применяется с лечебными целями, в частности, для лечения психических заболеваний, полное голодание. Не вызывает сомнения, что