Анализ физиологических механизмов восходящих активирующих влияний на кору мозга у голодных животных методом аппликации различных фармакологических веществ А. И. ТУРЕНКО (Москва)
Анализ физиологических механизмов восходящих активирующих влияний на кору мозга у голодных животных методом аппликации различных фармакологических веществ
А. И. ТУРЕНКО (Москва)
Многочисленные исследования показали, что основным регулятором потребления пищи является гипоталамическая область, так называемые центры «питания» и «насыщения» (5,6,7).
На основании исследований данных авторов было установлено, что латеральный гипоталамус — центр «питания» «улавливает» изменения внутренней среды организма, связанные с уменьшением пищевых веществ в крови и, возбуждаясь, формирует пищевое поведение. Медиальный же отдел гипоталамуса выполняет функцию центра «насыщения», так как нервные клетки последнего, в противоположность центру «питания», возбуждаются при поступлении в организм пищевых веществ.
В лаборатории П. К. Анохина было установлено, что у голодавших в течение 1—2 суток кошек, находящихся под уретановым наркозом, наблюдается отчетливо выраженная избирательная активация передних отделов коры мозга, в то время как в теменных и затылочных отведениях имеет место высокоамплитудная медленная электрическая активность. Эта избирательная активация осуществляется за счет восходящих активирующих влияний гипоталамуса (2, 3).
С другой стороны известно, что реакция десинхроннзации корковой электрической активности может быть получена и в случае действия на организм раздражителей другого качества, в частности, при ноцицептивных раздражениях.
Таким образом, разные по биологической модальности реакции (пищевая и болевая) имеют более или менее сходные черты в электрических корковых проявлениях (реакция десинхронизации).
Следовательно, электрографический корковый феномен десинхронизации не позволяет судить о биологической специфике возникающей при этом реакции.
В связи с этим мы решили исследовать особенности нейрохимических механизмов синаптических организаций коры, ответственных за формирование реакции десинхранизации ЭЭГ у голодных животных методом аппликации различных химических веществ непосредственно на кору мозга. В частности, намечалось выяснить, какие нейрохимические процессы участвуют в мобилизации корковых элементов на разных этапах пищевой реакции (голод — насыщение), и сравнить их с механизмами болевого возбуждения.
МЕТОДИКА
Опыты проводились на 55 голодавших (1—4 суток) и предварительно накормленных кошках, находившихся под уретановым наркозом. Для анализа нейрохимических механизмов «голодной» активации передних отделов коры на последние с помощью фильтровальных бумажек размерами 0,3 на 0,3 см, апплицировались 0,5—1% растворы атропина, окополамнна и амизила. Фильтровальные бумажки прикладывались к исследуемым зонам коры на 2—7 минут. Для более тонкого анализа синаптических организаций, участвующих в механизмах пищевого возбуждения, в зоне аппликации в ответ на раздражение седалищного нерва регистрировался вызванный потенциал. Кроме того, непосредственно от зоны аппликации, контрольной зоны противоположного полушария, теменных и затылочных отделов обоих полушарий регистрировалась биоэлектрическая активность.
Для регистрации ЭЭГ использовался 10-канальный электроэнцефалограф фирмы «Альвар-Электроник». Вызванные потенциалы регистрировались на универсальном осциллографе «Биофаз» той же фирмы. Для болевого раздражения периферических нервов использовался универсальный стимулятор «Физиовар».
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
Опыты показали, что аппликация холинолитических веществ (атропина, скополамина и амизила) на передние отделы коры головного мозга животных, голодавших в течение 1—2 суток, т. е. на те отделы коры, в которых наиболее четко была выражена «голодная» десинхронизация, вызывала в зоне аппликации через 7—15 минут замедление частоты и увеличение амплитуды биоэлектрической активности (с 35— 40 до 2—4 гц и с 25—35 до 150—100 мкв). В это же время во всех остальных отделах коры головного мозга биоэлектрическая активность не претерпевала заметных изменений. Передние отделы противоположного полушария оставались активированными.
Нанесение болевого раздражения электрическим током на седалищный нерв вызывало у этих же животных генерализованную десинхронизацию электрической активности во всех отделах коры головного мозга, включая и зону аппликации холинолитиков.
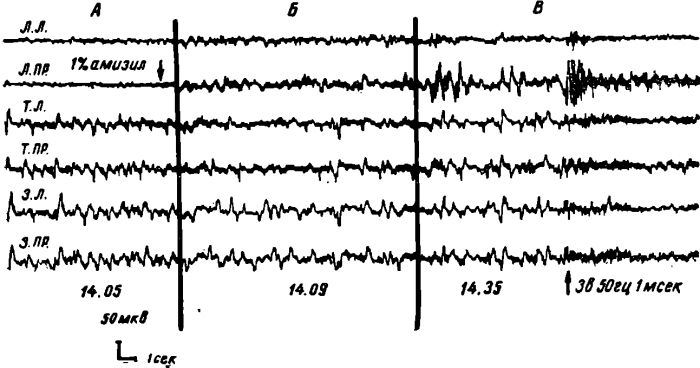
Рис. I. Изменение ЭЭГ-активности у кошки после суточного голодания, аппликации на сензомоторную область правого полушария 1% амизила и последующего нанесения болевого раздражения.
А — исходная биоэлектрическая активность и аппликация амизила; Б — через 5 минут после аппликации. В зоне аппликации наблюдается некоторое снижение частоты и увеличение амплитуды биоэлектрических колебаний; В — через 30 минут после аппликации. В зоне аппликации наблюдается высокоамплитудная медленная активность, в то же время как в остальных отведениях биоэлектрическая активность не претерпевает существенных изменении. Нанесение на этом фоне болевого раздражения вызывает диффузную десинхронизацию во всех отделах коры, включая и зону аппликации.
Описанный избирательный блокирующий эффект холинолитиков на «голодную» активацию коры мозга плохо или совсем не выявлялся у животных, голодавших более 2 суток, а также у животных с исходной диффузной активацией всей коры мозга, обусловленной, по-видимому, болевыми раздражениями, связанными с операционными манипуляциями. Только после внутримышечного введения аминазина у этих животных последующая аппликация холинолитиков на передние отделы коры мозга вызывала уменьшение частоты и увеличение амплитуды биоэлектрических колебаний в зоне аппликаций. Однако у животных, голодавших свыше 3 суток, нам редко удавалось получить уменьшение частоты и увеличение амплитуды биоэлектрической активности при аппликации холинолитиков на передние отделы коры даже после предварительного внутримышечного введения аминазина.
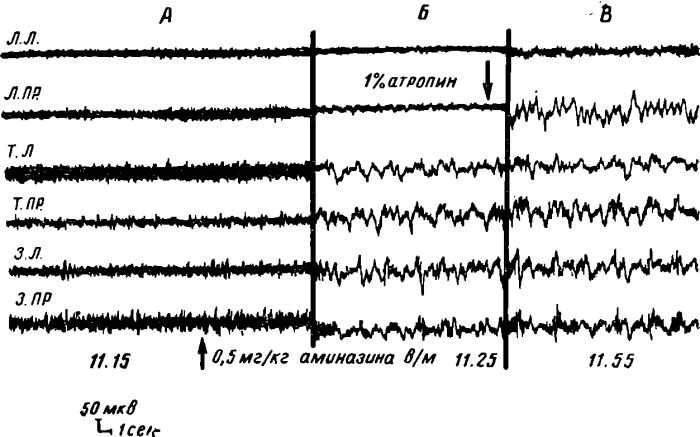
Рис. 2. Изменение биоэлектрической активности в зоне аппликации 1% атропина на фоне генерализованной десинхронизации и после введения аминазина.
А — на фоне диффузной активации холинолитики не вызывают снижения частоты и увеличения амплитуды в зоне аппликации; Б — введение аминазина голодным животным устраняет активацию в теменных и затылочных отведениях, оставляя активированными передние отделы коры мозга; В — аппликация на этом фоне атропина вызывает увеличение амплитуды и снижение частоты биоэлектрических колебаний в зоне аппликации.
Аппликация холинолитических веществ на передние отделы коры у предварительно накормленных животных, у которых регистрировалась высокоамплитудная медленная ЭЭГ активность во всех отделах коры, почти не изменяла частоту и амплитуду спонтанной электрической активности электрокортикограммы. Нанесение болевого раздражения спустя 20—30 минут после аппликации вызывало генерализованную десинхронизацию ЭкоГ, включая и зону аппликации. Обращал однако на себя внимание тот факт, что в зоне аппликации холинолитических веществ десинхронизация ЭЭГ была менее выраженной по сравнению с остальными отделами коры головного мозга. Процесс восстановления исходной биоэлектрической активности после болевой десинхронизации в зоне аппликации происходил значительно быстрее.
Для более углубленного анализа нейрохимических механизмов синаптических образований коры мозга, участвующих в пищевом возбуждении, в следующих экспериментах мы исследовали изменения соматосензорного вызванного потенциала на фоне «голодной» активации передних отделов коры и после локального устранения этой активации аппликацией холинолитических веществ. Кроме того, с целью контроля в ряде опытов вызванные потенциалы исследовались на фоне активации, вызванной нанесением болевого раздражения.
Исходя из концепции П. К. Анохина относительно природы вызванного потенциала, сущность которой состоит в том, что вызванный потенциал образуется на основе множественных посылок восходящих возбуждений (одних — к аксосоматическим синапсам четвертого слоя коры, ответственных за формирование положительной фазы первичного ответа, других — к аксодендритическим синапсам плексиморфного слоя коры и ответственных за формирование отрицательной фазы), можно предполагать, что изменение фаз первичного ответа при действии каких-либо фармакологических веществ является следствием влияния этих фармакологических веществ на синаптические организации, ответственные за генез этих фаз.
Приступая к настоящим исследованиям, мы рассчитывали на то, что если синаптические образование коры, участвующие в механизме «голодной» активации, являются холинэргическими, то при аппликации на передние отделы коры мозга голодных животных холинолитических веществ при блокаде на корковом уровне пищевого возбуждения, вызванный потенциал в ответ на раздражение седалищного нерва должен был внешне измениться приблизительно таким же образом, как и после кормления.
Как показали опыты К. В. Судакова (1964) (4), вызванный потенциал в ответ на раздражение седалищного нерва у голодных животных на фоне избирательной пищевой ЭЭГ активации передних отделов коры мозга выявляется плохо. Он регистрируется в фокусе максимальной активности, как правило, в форме положительной фазы и нестабилен. Эти данные были подтверждены и нашими экспериментами. Все это указывало на то, что система голодного возбуждения избирательно объединяла определенные синаптические образования коры мозга и тем самым ограничивала возможность мобилизации достаточного количества аксодендритическнх постсинаптических потенциалов в ответ на раздражение седалищного нерва для формирования соматосензорного вызванного ответа.
Опыты показали, что через 5—7 минут после аппликации холинолитиков на передние отделы коры мозга первичный ответ в фокусе максимальной активности начинал изменяться — начинала появляться отсутствующая до этого отрицательная фаза и к 20-ой минуте после аппликации она составляла 35—45 мкв; появлялось и вторичное положительное колебание.
Данные опыты показали, что после аппликации холинолитиков на кору мозга вызванный потенциал приобретал те же фазы, которые регистрировались и у предварительно накормленных животных. Это указывало, что в данных опытах исключалась восходящая специфическая «голодная» система возбуждений гипоталамических структур пищевого центра к определенным синаптичеоким образованиям коры мозга. Однако если у накормленных животных мы имеем снижение активности гипоталамических пищевых центров, то в опытах с аппликацией холинолитиков на передние отделы коры имела место искусственная блокада механизмов синаптического проведения восходящих возбуждений гипоталамических структур непосредственно на корковом уровне.
При нанесении болевого раздражения на седалищный нерв развивалась диффузная активация всей коры мозга. При атом изменялся и характер соматосензорного вызванного потенциала. Такие же изменения наблюдались и в зоне аппликации холинолитиков (отрицательная фаза первичного ответа полностью исчезала, вызванный потенциал становился нестабильным). Эти исследования свидетельствуют о том, что в данных условиях система болевого возбуждения мобилизовала аксодендритные синоптические образования и тем самым устраняла возможность формирования постсинаптических аксодендритных потенциалов в ответ на одиночное раздражение седалищного нерва, т. е. в данном случае имел место известный «феномен маскировки».
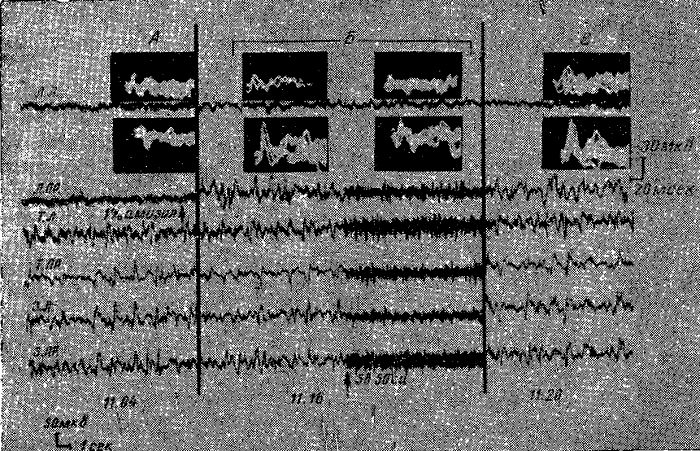
Рис. 3. Изменение ЭЭГ-активности и вызванного потенциала у кошки после суточного голодания, аппликации 1% амизила и последующего нанесения болевого раздражения.
А — исходная ЭЭГ и вызванный потенциал, регистрируемый в сензомоторной области правого и левого полушария, до и после аппликации амизила; Б — через 12 минут после аппликации амизила. В зоне аппликации наблюдается увеличение амплитуды и снижение частоты биоэлектрических колебаний, изменяется и вызванный потенциал. Нанесение болевого раздражения вызывает диффузную десинхронизацию и изменяет характер- соматосензорного вызванного потенциала в зоне аппликации; В — через 4 минуты после нанесения болевого раздражения. Обозначения: ЛЛ — лобная левая, ЛПР — лобная правая, ТЛ — теменная левая, ТПР — теменная правая, ЗЛ — затылочная левая, ЗПР — затылочная правая.
Представленные данные свидетельствуют о том, что при небольших сроках голодания (1—1,5 суток) избирательная активация передних отделов коры мозга осуществляется преимущественно за счет холинэргических аксодендритных синапсов плексиморфного слоя коры. Генерализованная активация коры мозга, являющаяся следствием операционной травмы или вызванная искусственно при раздражении седалищного нерва и избирательно блокируемая аминазином, строится, по-видимому, на основе не холинэргических, а адренэргических механизмов. Механизм активации коры мозга при длительных сроках голодания (свыше 3 суток) также, по-видимому, имеет адренергический характер.
Исследования, проведенные нами, показали, что нейрохимический механизм корковой активации даже при одном виде восходящих возбуждений не всегда един, что он лабилен и может каким-то образом изменяться при изменении исходного функционального состояния организма (болевая активация у голодного и сытого животного).
В целом, представленные данные являются новым подтверждением концепции химической гетерогенности синоптических образований коры мозга, участвующих в формировании восходящих возбуждений при реакциях различного биологического качества.
ЛИТЕРАТУРА
1. Анохин. П. К. Журн. высш. нервн. деят., 1962, 12, 3, 379.
2. Судаков К. В. Физиолог, журнал СССР, 1962, т. 48, № 2, стр. 150.
3. Судаков К. В. Физиологич. журнал СССР, 1963, т. 49, № И, стр. 1310.
4. С у д а к о в К. В. Бюлл. экспер. биологии и медицины, 1965, № 2, стр. 3.
5. А II a n d В. К. and В г о b е с k J. К. Jale J. Biol. med. 1951, 24, 123.
6. В го beck J. К. Am. N. J. Acad. Sci., 1955, 63, 44.
7. Mage г J. J. Bull. New Engl. Med. Cent., 1952, 14, 43.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
ГМ растения — продуценты фармакологических препаратов
ГМ растения — продуценты фармакологических препаратов Сегодня все реальнее выглядят перспективы сельскохозяйственной биотехнологии предоставить такие растения, которые будут использоваться как лекарства или вакцины. Трудно даже представить, какое значение это
Эволюция механизмов адаптации
Эволюция механизмов адаптации Процесс приспособления, или адаптациогенез, составляет главное содержание эволюции. Он может идти на разных уровнях: строения организма, его поведения, структуры коллектива. На всех этих уровнях можно наблюдать постепенный переход от
10.3. Анализ когнитивных способностей животных
10.3. Анализ когнитивных способностей животных Широко распространенным тестом сравнительных исследований на наличие когнитивных способностей у животных является тест на экстраполяцию. Под экстраполяцией можно понимать способность животных выносить проявления
Порочные потенциально патогенетические круги в физиологических и внутриклеточных системах
Порочные потенциально патогенетические круги в физиологических и внутриклеточных системах Биофизический анализ совокупности экспериментальных и клинических материалов о некоторых пострадиационных, возрастных и предлейкозных изменениях позволил обнаружить и
Порочные круги в физиологических системах как основа клинической предпатологии
Порочные круги в физиологических системах как основа клинической предпатологии Первый порочный круг. Ведущие процессы: уменьшение эффективности действия гормонов и недостаток гормонов. Имеются данные о возрастном повышении порога чувствительности гипоталамуса и
Сколько загрязняющих веществ выбрасывает Москва в атмосферу за год?
Сколько загрязняющих веществ выбрасывает Москва в атмосферу за год? За год в атмосферу Москвы выбрасывается около 2 миллионов тонн загрязняющих веществ. Это означает, что на долю каждого москвича приходится около 200 килограммов. Из них около 160 килограммов составляют
1.1. Сравнительный анализ причин и симптомов отклоняющегося поведения у детей и животных
1.1. Сравнительный анализ причин и симптомов отклоняющегося поведения у детей и животных Попытки проведения аналогий между онтогенезом человека и высших млекопитающих делались еще Дарвином. Во многих работах (Дарвин, Ладыгина-Котс и др.) получены данные, показывающие
Недостаток регулирующих механизмов
Недостаток регулирующих механизмов Итак, есть основания думать, что у людей, так же как и у некоторых других животных, действуют механизмы саморегуляции численности популяции и поддержания ее на оптимальном уровне. Среди них есть и жесткие, и сравнительно безобидные,
Опыт лечения тучности методом полного голодания Д. Д. ФЕДОТОВ, Ю. С. НИКОЛАЕВ, Ю. Л. ШАПИРО, Г. И. БАБЕНКОВ, В. Б. ГУРВИЧ (Москва)
Опыт лечения тучности методом полного голодания Д. Д. ФЕДОТОВ, Ю. С. НИКОЛАЕВ, Ю. Л. ШАПИРО, Г. И. БАБЕНКОВ, В. Б. ГУРВИЧ (Москва) Лечение ожирения остается одной из наиболее актуальных проблем современной медицины. Число больных с избыточным весом, согласно данным многих
Восходящие активирующие влияния на кору головного мозга у голодных животных К. В. СУДАКОВ (Москва)
Восходящие активирующие влияния на кору головного мозга у голодных животных К. В. СУДАКОВ (Москва) В последние годы благодаря применению новых методов физиологического эксперимента (электронные усилители, стереотаксическая техника) проблема голода, пищевого поведения
Активность нейронов коры головного мозга у голодных животных Ю. А. ФАДЕЕВ (Москва)
Активность нейронов коры головного мозга у голодных животных Ю. А. ФАДЕЕВ (Москва) Успехи, современной нейрофизиологии, связанные с использованием новых тонких методов электрофизиологического исследования мозга, позволили подойти к изучению центральных механизмов
Особенности возбуждения коры головного мозга у животных при длительном голодании Т. Н. ЛОСЕВА, А. А. ПАНФИЛОВ (Москва)
Особенности возбуждения коры головного мозга у животных при длительном голодании Т. Н. ЛОСЕВА, А. А. ПАНФИЛОВ (Москва) Изучению реакции организма на длительное голодание посвящено много работ. Большинство из них касается обменных процессов, биохимии синтеза и распада
Интенсивность эритродиеретических процессов при голодании людей (математический анализ) Ю. Л. ШАПИРО, В. М. ЛУГОВСКОЙ (Москва)
Интенсивность эритродиеретических процессов при голодании людей (математический анализ) Ю. Л. ШАПИРО, В. М. ЛУГОВСКОЙ (Москва) Как известно, при полном алиментарном голодании в течение довольно длительного времени (по крайней мере до сроков, характеризующихся потерями
К вопросу о реакции различных форм ожирения на голодание Д. Д. ФЕДОТОВ, Ю. Л. ШАПИРО, Ф. А. ВАЙНДРУХ (Москва)
К вопросу о реакции различных форм ожирения на голодание Д. Д. ФЕДОТОВ, Ю. Л. ШАПИРО, Ф. А. ВАЙНДРУХ (Москва) Ожирение, как и вообще проблема неправильного питания, становится в последнее время все более актуальной.В то время, как большая часть человечества (по данным ВОЗа —