2.2. Общая характеристика пищеварительных ферментов
2.2. Общая характеристика пищеварительных ферментов
Обращает на себя внимание принципиальное сходство, а иногда и поразительное совпадение ферментных систем, реализующих пищеварение у различных организмов. Поэтому те характеристики, которые будут представлены ниже, применимы для ферментных систем как высших, так и низших организмов, включая простейших. Все пищеварительные ферменты являются гидролазами и делятся на три основные группы: 1) пептид-гидролазы (КФ 3.4.—), расщепляющие пептидные связи в белках и полипептидах; 2) гликозидазы, или карбогидразы (КФ 3.2.1.—), гидролизующие глюкозидные связи в углеводах; 3) липазы (КФ 3.1. —), действующие на эфирные связи в жирах.
2.2.1. Пептид-гидролазы
Эти ферменты, называемые также протеиназы, протеазы, пептидазы, подразделяются на эндо- и экзоферменты. Первые связаны с инициацией протеолизаи расщепляют пептидные связи во внутренних областях белковых молекул, образуя более короткие полипептид-ные цепи (однако они могут также расщеплять пептидные связи, расположенные на концах молекул белков или полипептидов). Ферменты действуют как внутриклеточно (в пищеварительных вакуолях), так и внеклеточно. Экзоферменты последовательно расщепляют концевые пептидные связи полипептидных цепей, образованных эндопептидазами при гидролизе белков и более высокомолекулярных полипептидов. Они освобождают аминокислоты и образуют более короткие полипептиды, а также олиго-, три- и дипептиды. Последние вновь атакуются соответствующими экзофер-мептами, завершающими гидролиз белковой молекулы до составляющих ее аминокислот.
Эндоферменты специфичны по отношению к определенным пептидным связям, и поэтому только часть свободных внутренних пептидных связей фактически атакуется каким-либо из них. Эндоферменты (протеазы, КФ 3.4.21—24), расщепляющие до полипептидов большую часть белков пищи, обладают как сходством, так и определенными различиями с ферментами, действующими внутри клеток. Внутриклеточные протеазы, называемые катепсинами, с оптимумом активности при слабокислых значениях pH, локализованы в лизосомах и обладают относительно широкой субстратной специфичностью. Так называемые кислые протеазы (пепсин) у беспозвоночных животных практически не встречаются. У позвоночных животных пепсин (КФ 3.4.23.1) секретируется клетками желудка в форме профермента пепсиногена, который после активации соляной кислотой желудочного сока гидролизует преимущественно связи, прилегающие к остаткам ароматических или дикарбоновых L-аминокислот полипептидных цепей. Пепсин расщепляет белки главным образом до полипептидов, хотя среди продуктов гидролиза встречаются низкомолекулярные пептиды и аминокислоты.
В желудке представителей одного вида можно встретить несколько различающихся форм пепсина. У человека в желудочном соке идентифицирована еще одна протеаза — гастриксин. В желудке жвачных животных, еще сосущих молоко, обнаружен химозин, или реннин (КФ 3.4.23.4) — фермент, створаживающий молоко.
На том основании, что частично известная последовательность аминокислотных остатков пепсина, гаст-риксина и реннина весьма близка, высказано предположение, что эти ферменты произошли в ходе эволюции от одного общего предшественника — кислой протеазы — в результате удвоения гена через гипотетическую промежуточную протеазу.
У представителей всех позвоночных животных, а также у человека, клетки поджелудочной железы секретируют сериновые протеазы — трипсин, химотрипсин (несколько изоферментов) и эластазу (панкреатопепгидазу). Все эти ферменты первоначально продуцируются в неактивном состоянии в виде предшественников трипсиногена, химотрипеиногена и проэластазы (пропанкреатопептидазы). Трипсиноген после активации энтеропептидазой (энтерокиназой) или аутолитической активации расщепляет пептидные связи, образованные карбоксильными группами L-apгинина и L-лизина. Химотрипсин образуется из химотрипсиногена после активации последнего трипсином и гидролизует преимущественно пептидные связи, образованные карбоксильными группами ароматических а-аминокислот. Эластаза секретируется в виде профермента проэластазы. После активации трипсином фермент гидролизует связи, образованные нейтральными аминокислотами, особенно в эластине.
Сопоставление последовательности аминокислотных остатков у трипсина, химотрипсина и эластазы выявило ее отчетливую гомологию. Их активные центры также идентичны и включают остатки серина и гистидина. Высказана гипотеза, что эти ферменты произошли от общей нейтральной протеазы в результате эволюционного процесса, предполагаемого для пепсина.
Ферменты, обладающие трипсино- и химотрипсино-подобной активностями, обнаружены в кишечнике целого ряда беспозвоночных животных (в частности, у кишечнополостных, насекомых и др.). Следует отметить, что микроорганизмы, и в том числе актиномицеты, продуцируют ряд протеолитических ферментов. Так, у некоторых из них обнаружена кератиназа (КФ 3.4.99.11), обладающая способностью расщеплять нативный кератин.
Коллагеназа (КФ 3.4.24.3) выявлена в гепатопан-креасе некоторых крабов, а также в ядах различных змей. При этом протеазы беспозвоночных животных (например, коллагеназа и фибринолизин бактерий), а также трипсино- и химотрипсиноподобные активности по своей молекулярной структуре и молекулярным массам близки с пепсином, трипсином и химотрипси-ном позвоночных. Однако в отличие от ферментов позвоночных они продуцируются в активной форме. Эти свойства внеклеточных протеаз сходны с таковыми внутриклеточных ферментов, например таких, как ка-тепсипы. Основное различие между этими группами ферментов состоит в том, что внеклеточные ферменты требуют предварительной активации, что может рассматриваться как предосторожность против самопереваривания. Не исключено, что физиологическая роль ингибиторов Кунитца и Казеля, продуцируемых клетками поджелудочной железы позвоночных, также заключается в предупреждении внутриклеточной активации протеолитических ферментов.
В число экзопептидаз (КФ 3.4.11 —15) входит несколько групп ферментов, среди них карбоксипептидазы (КФ 3.4.12. — ), аминопептидазы (КФ 3.4.11.—) и дипептидазы (КФ 3.4.13. —), которые специфичны по отношению к одному или группе субстратов. Карбоксипептидазы А и В позвоночных секретируются клетками поджелудочной железы в неактивном состоянии как прокарбоксипептидазы А и В. Активация происходит под влиянием комбинированного действия трипсина и энтеропептидазы в случае карбоксипептидазы А и трипсина в случае карбоксипептидазы
В. Карбоксипептидаза А гидролизует пептиды, отщепляя С-концевой остаток L-аминокислоты. Карбоксипептидаза В гидролизует пептиды с остатками L-apгинина и L-лизина на С-концевом участке цепи, отщепляя эти остатки. Эти карбоксипептидазы обнаружены также в кишечнике беспозвоночных.
Аминопептидазы составляют основную часть пептидазной активности щеточной каймы клеток кишечного эпителия. Они отвечают также за ариламидазную и всю аминопептидазную активность по отношению к олигопептидам, за половину трипептидазной активности и имеют несомненное отношение к части дипептидазной активности. Ферменты этой группы содержатся также в клетках поджелудочной железы и желудка различных животных. Аминопептидазы реализуют гидролиз пептидной связи, образованной терминальной аминокислотой, имеющей свободную аминогруппу.
Завершает гидролиз белков третий тип экзопептидаз — дипептидазы, расщепляющие оставшуюся пептидную связь между двумя аминокислотными остатками. Дипептидазы обычно обладают групповой специфичностью, и одна дипептидаза может гидролизовать ряд пептидов, если они обладают общей аминокислотой. Дипептидазы участвуют в мембранном гидролизе пептидов в тонкой кишке высших животных и человека, а также в пищеварительных органах ряда беспозвоночных. Существуют сведения, что дипептидазы, локализованные в цитоплазме клеток, участвуют во внутриклеточном гидролизе дипептидов у бактерий и в тонкой кишке млекопитающих. Однако скорее внутриклеточные дипептидазы кишечной слизистой высших организмов участвуют в сложных процессах катаболизма белков, а не в расщеплении поступающих в клетку пищевых субстратов. Таким образом, дипептидазы пищеварительного аппарата в зависимости от организации животных могут участвовать как во внеклеточном, так и во внутриклеточном пищеварении.
Внутриклеточные эндо- и экзопептидазы могут встречаться и в непищеварительных органах животных. Предполагается, что их функция состоит в поддержании динамического гомеостаза между белками и другими азотистыми соединениями клетки. Важную роль в этих процессах играют синтез и деградация соответствующих ферментативно активных белков.
2.2.2. Гликозидазы
Гликозидазы (глюкозидазы, карбогидразы), принимающие участие в гидролизе углеводов, можно разделить на две группы: 1) эндоферменты (преимущественно амилазы) и 2) экзоферменты (ди- и олиго-сахаридазы). Первые расщепляют a-1,4-глюкозидные связи в молекулах полисахаридов (крахмал, гликоген, родственные им полисахариды) до олиго- и дисахаридов (количество образующейся глюкозы крайне незначительно), которые гидролизуются до моносахаридов соответствующими экзоферментами.
Многие ферменты, гидролизующие углеводы, представлены различными амилазами. К ним относятся амилаза слюны млекопитающих, в том числе человека, некоторых других хордовых и ряда беспозвоночных; панкреатическая амилаза млекопитающих (КФ 3.2.1.1.), кишечная гамма-амилаза (КФ 3.2.1.3) хордовых и беспозвоночных, внутриклеточные амилазы кишечнополостных и простейших. Все амилазы гидролизуют крахмал и гликоген, но не целлюлозу.
Крахмал растительного происхождения является смесью амилозы и амилопектина, в то время как гликоген (полисахарид животного происхождения) состоит из одного компонента, сходного с амилопектином, но имеющего более разветвленную молекулу. Амилазы в присутствии ионов хлора гидролизуют а-1,4-глюкозидные связи в молекулах амилозы, амилопектина и гликогена до декстринов (промежуточных продуктов гидролиза полисахаридов) с различной длиной цепи. Затем амилазы расщепляют декстрины до мальтозы и мальтоолигосахаридов, которые в свою очередь гидролизуются до мальтозы и глюкозы. В итоге под действием амилаз происходит полная конверсия крахмала и гликогена в мальтозу, изомальтозу и небольшое количество глюкозы.
Экзогликозидазы (а- и ?-глюкозидазы) гидролизуют олиго- и дисахариды (мальтозу и изомальтозу, образованные при гидролизе крахмала и гликогена, сахарозу, лактозу и трегалозу) до конечных продуктов гидролиза — моносахаридов. Так, мальтаза (КФ 3.2.1.20) расщепляет молекулу мальтозы на две молекулы глюкозы, изомальтаза (КФ 3.2.1.10) — изомальтозу на две молекулы глюкозы, сахараза, или инвертаза (КФ 3.2.1.26 и 3.2.1.48) — сахарозу на глюкозу и фруктозу, лактаза (КФ 3.2.1.23) — лактозу на глюкозу и галактозу и т.д. Гамма-амилаза (КФ 3.2.1.3) гидролизует мальтозу, а также отщепляет концевые глюкозидные остатки в полисахаридных цепях, принимая участие в расщеплении крахмала и гликогена.
Перечисленные экзогликозидазы синтезируются в кишечных клетках как хордовых, так и беспозвоночных животных. Важно, что внутриклеточные гликозидазы беспозвоночных животных, у которых имеет место внутриклеточное пищеварение, по своим функциям и многим характеристикам сходны с таковыми внеклеточных ферментов.
Что касается переваривания целлюлозы, составляющей большую часть пищи травоядных, то лишь небольшое число организмов обладает ферментными системами (КФ 3.2.1.4, целлюлаза), которые могут расщеплять это вещество на более простые продукты, способные к всасыванию и дальнейшему усвоению. В эту группу входит ряд брюхоногих и пластиножаберных моллюсков, некоторые ракообразные, рептилии и рыбы, насекомые, а также простейшие, использующие целлюлазу для деградации клеточных стенок зеленых водорослей и утилизации их содержимого. Целлюлаза играет важную роль в переваривании целлюлозы у кольчатых червей и иглокожих. Большинство травоядных животных (как позвоночных, так и беспозвоночных) для гидролиза целлюлозы используют симбионтные организмы. Кроме того, целлюлаза обнаружена у гнилостных бактерий и грибов.
2.2.3. Липазы
Ферменты как внеклеточные, например панкреатическая липаза и кишечная моноглицеридлипаза хордовых, так и липазы беспозвоночных животных, реализующие внутриклеточное пищеварение, расщепляют жиры. Липазы гидролизуют преимущественно триглицериды с образованием 2-моноглицеридов и жирных кислот, при этом активирующее действие оказывают соли желчных кислот.
Панкреатическая фосфолипаза (КФ 3.1.1.4) секретируется в виде профермента профосфолипазы А и активируется трипсином. Фермент гидролизует эфирную связь глицерина и- жирной кислоты у второго атома углерода, превращая лецитин в изолецитин и жирную кислоту. Кишечная моноглицеридлипаза (КФ 3.1.1.23) гидролизует эфирные связи 2-моноглицеридов, образующихся при гидролизе триглицеридов. В гидролизе жиров у беспозвоночных животных, по-видимому, участвуют преимущественно эстеразы. Эти ферменты (кроме липазы) наблюдаются в средней кишке ракообразных, у насекомых, двустворчатых моллюсков, у которых встречаются как вне-, так и внутриклеточные пищеварительные эстеразы, у брюхоногих моллюсков, в кишечнике многощетинковых червей и иглокожих, а также у простейших.
Кроме указанных групп ферментов, существует несколько других, также играющих важную роль в пищеварительных процессах. Эти ферменты известны главным образом у хордовых животных, но, возможно, существуют также и у беспозвоночных. В качестве примера могут быть приведены щелочная фосфатаза (КФ 3.1.3.1), гидролизующая моноэфиры ортофосфор-ной кислоты, а также нуклеазы (РНКаза и ДНКаза), нуклеотидазы, нуклеозидазы и другие (КФ 3.1.3.—), продуцируемые клетками поджелудочной железы и синтезируемые клетками кишечного эпителия хордовых животных. Эти ферменты расщепляют полинуклеотиды и нуклеиновые кислоты пищи до пуринов, пиримидинов, дезоксирибозы, рибозы и фосфата.
2.2.4. Молекулярная структура и некоторые характеристики мембранных пищеварительных ферментов
Основные процессы гидролиза и транспорта у высокоорганизованных животных и человека, а также у ряда беспозвоночных реализуются в кишечнике. В связи с этим рассмотрим особенности структуры пищеварительных ферментов апикальной мембраны кишечных клеток млекопитающих, которые осуществляют заключительные этапы гидролиза основных групп пищевых веществ. При этом возможна прямая экстраполяция характеристик кишечных мембранных ферментов теплокровных организмов на характеристики ферментов более низкоорганизованных животных, так как строение мембраны и ферментативно активных белков, встроенных в фосфолипидный матрикс мембраны, практически универсально.
Большинство кишечных ферментов является трансмембранными интегральными белками (точнее, гликопротеинами) с большой молекулярной массой. Так, молекулярная масса кишечной щелочной фосфатазы — около 120 000—130 000 дальтон, аминопептидазы — варьирует от 225 000 до 280 000 в зависимости от вида животного, карбогидраз, в том числе сахаразно-изомальтазного комплекса, более 200 000. Однако некоторые ферменты, например дипептидаэы апикальной мембраны кишечных клеток, могут быть периферическими интегральными белками, т.е. лишь частично включенными в фосфолипидный бислой мембраны, о чем можно судить по их спонтанной солюбилизации (рис. 1). По-видимому, в естественных условиях мембранные ферменты существуют в виде олигомеров, примером чему служит сахаразно-изомальтазный комплекс.
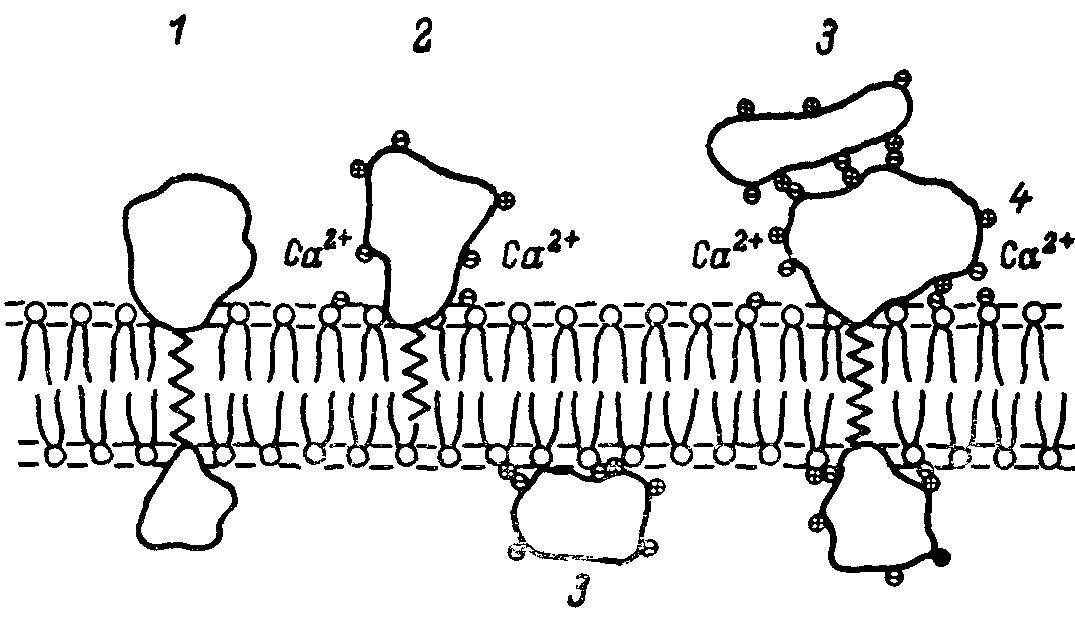
Рис. 1. Схема различных типов локализации интегральных белков в мембране.
1,4 — трансмембранные интегральные белки; 2 — периферический интегральный белок; 3 — периферический белок.
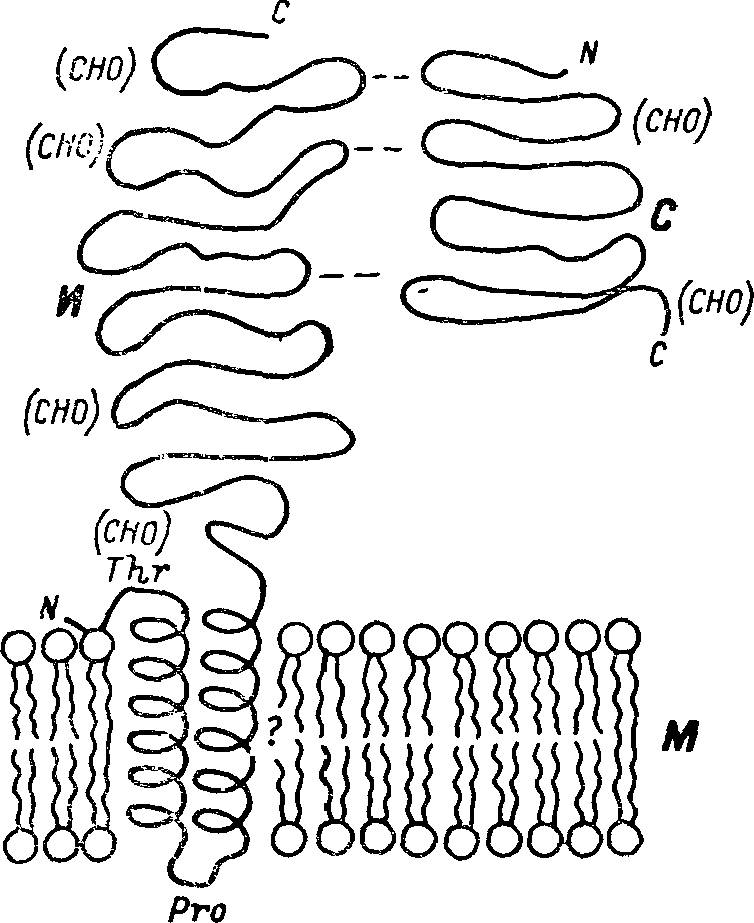
Рис. 2. Положение сахаразно-изомальтазного комплекса в щеточнокаемной мембране клеток тонкой кишки.
(СНО) — углеводные цепи; с — С-конец цепи; N—N-конец цепи; С — сахаразная субъединица; И — изомальтазная субъединица; М — мембрана.
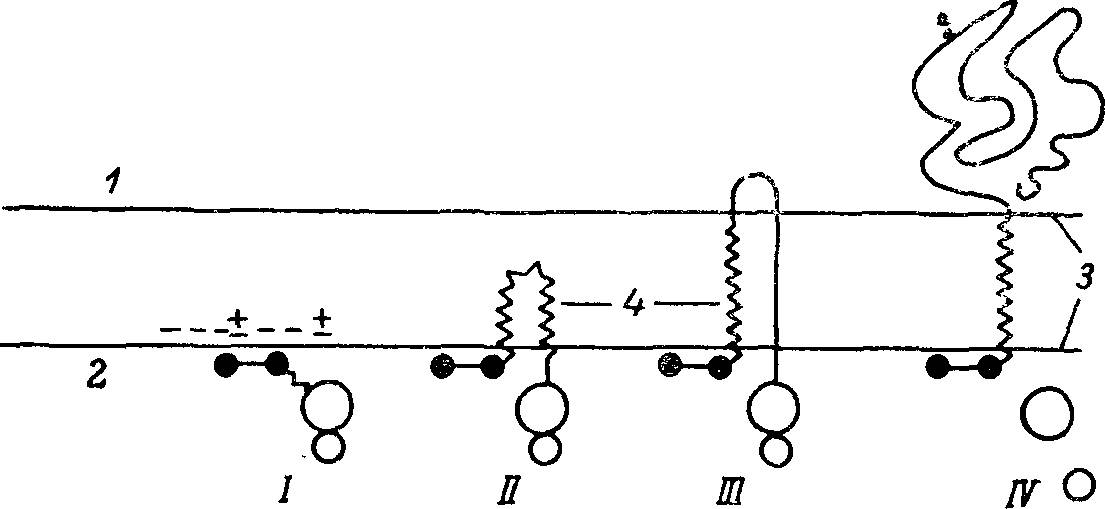
Рис. 3. Модель включения кишечной щеточнокаемной аминопептидазы в мембрану за счет N-концевых аминокислотных остатков.
1 — внеплазматическая поверхность; 2 — цитоплазматическая поверхность; 3 —мембрана; 4 — гидрофобный домен фермента, состоящий примерно из 20 аминокислотных остатков; «+» — положительно заряженный N-концевой тирозин и лизин в позиции 4; «—» — отрицательно заряженные внутренние фосфолипидные головки (или цвиттерионы). I — связывание образующейся цепи благодаря электростатическим взаимодействиям с цитоплазматической поверхностью мембраны; II — прямое перемещение гидрофобной части фермента во внутреннюю область мембраны; III, IV — дальнейший рост цепи за счет предполагаемого механизма, выдвигающего цепь на внеплазматическую поверхность мембраны.
Часть фермента может выступать над поверхностью трехслойной мембраны примерно на 10—15 нм. Простетическая группа молекулы фермента — олигосахаридная цепь (цепи) занимает наружное положение по отношению к мембране и выдается в полость тонкой кишки, возможно, принимая участие в формировании структур гликокаликса, рецепции биологически активных веществ и связывании субстратов (рис. 2).
Мембранные интегральные ферменты обладают амфипатической структурой и состоят из гидрофильного и гидрофобного доменов. Гидрофильный домен, составляющий от 90 до 95% массы фермента, несет на себе углеводные остатки и каталитический центр, обращенный в полость тонкой кишки. Такая локализация каталитического центра постулирована нами еще в начале 60-х гг. и окончательно подтверждена в последние годы. Остальная масса фермента относится к гидрофобному домену, который состоит преимущественно из гидрофобных аминокислот и пронизывает насквозь фосфолипидный бислой, в некоторых случаях заканчиваясь небольшим гидрофильным пептидом, экспонированным на внутренней поверхности мембраны (рис. 3). По мнению ряда исследователей, роль гидрофобного домена фермента заключается во взаимодействии с фосфолипидным матриксом мембраны и в фиксации гидрофильного каталитического домена (якорная функция).
В нашей лаборатории в дополнение к якорной функции гидрофобного домена фермента продемонстрированы его некоторые другие жизненно важные функции: 1) поддержание оптимальной конформации гидрофильного каталитического домена; 2) стабилизация структуры фермента при действии различных факторов; 3) реализация регуляторных функций и ряда других. Действительно, при отделении гидрофобного домена от гидрофильного утрачиваются регуляторные свойства фермента. На этом основании мы высказали предположение, что гидрофобные субъединицы ферментов участвуют в передаче регулирующих сигналов из цитоплазмы клетки на внешнюю поверхность мембраны и таким образом выполняют функции не только внешнего, но и внутреннего регулирования. Регулирующими сигналами могут служить пищевые вещества. Благодаря регулируемости многих ферментов происходит саморегуляция естественного пищеварения на молекулярном уровне. Кроме того, гидрофобный домен участвует в температурных адаптациях, как и фосфолипидный матрикс мембраны.
Благодаря системе регулируемых ферментов ферментный пул кишечной поверхности представляет собой систему, легко адаптируемую к различным программам работы в зависимости от состава пищи. Ферментные и транспортные системы обеспечивают высокую приспособляемость ассимиляторного аппарата к условиям функционирования, так как их регулируемость способствует повышению или понижению активности в широких пределах без изменений состава соответствующего пула. В последние годы документировано, что обмен мембранных белков, в частности ферментов и транспортеров, превращает плазматическую мембрану кишечных клеток в поверхность, обладающую высокой динамичностью и способностью к быстрым адаптивным перестройкам.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
7.1. Общая характеристика крови
7.1. Общая характеристика крови Кровь, лимфа и тканевая жидкость являются внутренней средой организма, в которой осуществляется жизнедеятельность клеток, тканей и органов. Внутренняя среда человека сохраняет относительное постоянство своего состава, которое
1. Общая характеристика инфекции
1. Общая характеристика инфекции Инфекция – это совокупность биологических реакций, которыми макроорганизм отвечает на внедрение возбудителя.Диапазон проявлений инфекций может быть различным. Крайними формами проявления инфекций являются:1) бактерионосительство,
1. Общая характеристика и возбудители ПТИ
1. Общая характеристика и возбудители ПТИ Пищевые токсикоинфекции (ПТИ) – обширная группа острых кишечных инфекций, развивающихся после употребления в пищу продуктов, инфицированных возбудителями и их токсинами.Клинически эти болезни характеризуются внезапным
2.1. Общая характеристика сигнала
2.1. Общая характеристика сигнала ССП выделяют при помощи специальных методов из ЭЭГ. Частотный диапазон ССП включает полосу от 0 Гц до 3 кГц и ограничен, с одной стороны, сверхмедленной электрической активностью мозга [Илюхина, 1977], а с другой – спайковой активностью
Общая характеристика
Общая характеристика Общий объем крови у взрослого человека составляет у женщин – 4 л, у мужчин – 5,2 л (примерно 8 % от массы тела). В норме рН крови – 7,36 – 7,7. Относительная плотность цельной крови – 1,050 – 1,065, плазмы – 1,024 – 1,030. Вязкость крови в 4–5 раз выше вязкости воды
Общая характеристика процесса научения
Общая характеристика процесса научения Анализ инстинктивного поведения приводит к выводу, что все богатство и разнообразие полноценного психического отражения связаны с научением, накоплением индивидуального опыта. Поэтому эта категория поведения будет постоянно в
Общая характеристика игры у животных
Общая характеристика игры у животных Как уже отмечалось (см. ч. 2, гл. 1), о ювенильном (или игровом) периоде развития поведения можно говорить только относительно детенышей высших животных, у которых развитие поведения совершается перед половым созреванием в форме игровой
1.1. Общая характеристика
1.1. Общая характеристика К одноклеточным, или простейшим относятся около 30 тыс. видов, которые обитают в морях и океанах, пресных водоемах, в почве. Часть из них (около 3 тыс. видов) – паразиты животных и человека. Необходимым условием для жизни простейших является наличие
2.1. Общая характеристика
2.1. Общая характеристика Многоклеточные животные – организмы, тело которых состоит из многих клеток и их производных (различные виды межклеточного вещества). Характерный признак многоклеточных – качественная неравноценность слагающих их тело клеток, их
10.1. Общая характеристика
10.1. Общая характеристика По данным разнообразных исследований, доминирующими загрязнителями атмосферы являются автомобильный транспорт, предприятия электроэнергетики и многочисленные котельные. Из основных веществ в списке представлены оксиды азота, сероводород,