7.4. Адаптационно-компенсаторные реакция на уровне функциональных блоков
7.4. Адаптационно-компенсаторные реакция на уровне функциональных блоков
Рассмотрим три примера развития адаптационно-компенсаторных реакций на основе концепции универсальных функциональных блоков.
Адаптация поджелудочной железы к качеству пищи. Способность желудочного и панкреатического соков расщеплять растительные и животные белки (протеазная фитолитическая и зоолитическая активность соответственно) находится в зависимости от качества диеты. Предполагалось, что столь тонкие адаптивные изменения протеолитического спектра поджелудочной железы могут зависеть либо от модификации свойств панкреатических протеаз (например, появления разных форм химотрипсина и т.д.), либо от изменения в соотношении трипсина и химотрипсина в панкреатическом соке. Нами выявлено, что в зависимости от типа питания наблюдаются изменения именно сооотношения основных панкреатических ферментов (трипсина и химотрипсина), т.е. изменения соотношения функциональных блоков, а не их свойств.
Адаптация к ионным нагрузкам. Недавно обнаружено, что при хроническом поступлении калия в организм последний становится устойчивым к таким нагрузкам, которые у неадаптированных организмов вызывают смерть. Следовательно, возникает толерантность к калию. Такая адаптация включает в себя множество механизмов, в том числе усиленное выведение ионов калия из внутренней среды почками и слизистой толстой кишки. Анализ функций этих органов показал удивительное сходство реакций. Эпителиальные клетки дистального отдела почечных канальцев и толстой кишки (ее проксимальных и дистальных отделов) отвечают на гиперкалиемию усиленным откачиванием калия в люминальную жидкость. В обоих случаях этот процесс достигается увеличением количества таких насосов, как Na+,K+-ATФaзa, в базолатеральных мембранах клеток.
Таким образом, первоначальное предположение об изменении активности каждого насоса, а не только их количества не подтвердилось. Эта реакция дает убедительный пример того, что адаптация к изменению солевого режима может достигаться путем увеличения или уменьшения числа неизменных функциональных блоков, в данном случае Na+,K+-ATФaз. Этот же эффект, т.е. усиленная функция Na+,K+-ATФaза за счет увеличения количества функционирующих элементов, определяет адаптивный подъем уровня всасывания в тонкой кишке. По-видимому, в качестве регулирующего сигнала используется повышение концентрации альдостерона в крови. Дистальные почечные канальцы и слизистая толстой кишки служат органа-ми-мишенями альдостерона. Усиленная продукция альдостерона при понижении поступления в организм натрия также сопровождается увеличением активности Na+,K+-ATФaзы. Среди деталей этого адаптационного механизма существенную роль играют изменения мембранных потенциалов и использование перицеллюлярных путей.
Одним из экспериментальных подтверждений существования адаптационных перестроек за счет перераспределения функциональных блоков служит недавнее наблюдение. В нем показаны адаптивные перестройки, обеспечивающие высокую проницаемость воды под влиянием антидиуретического гормона в результате встраивания предсуществующих стандартных блоков, транспортирующих воду и ионы натрия (рис. 45).
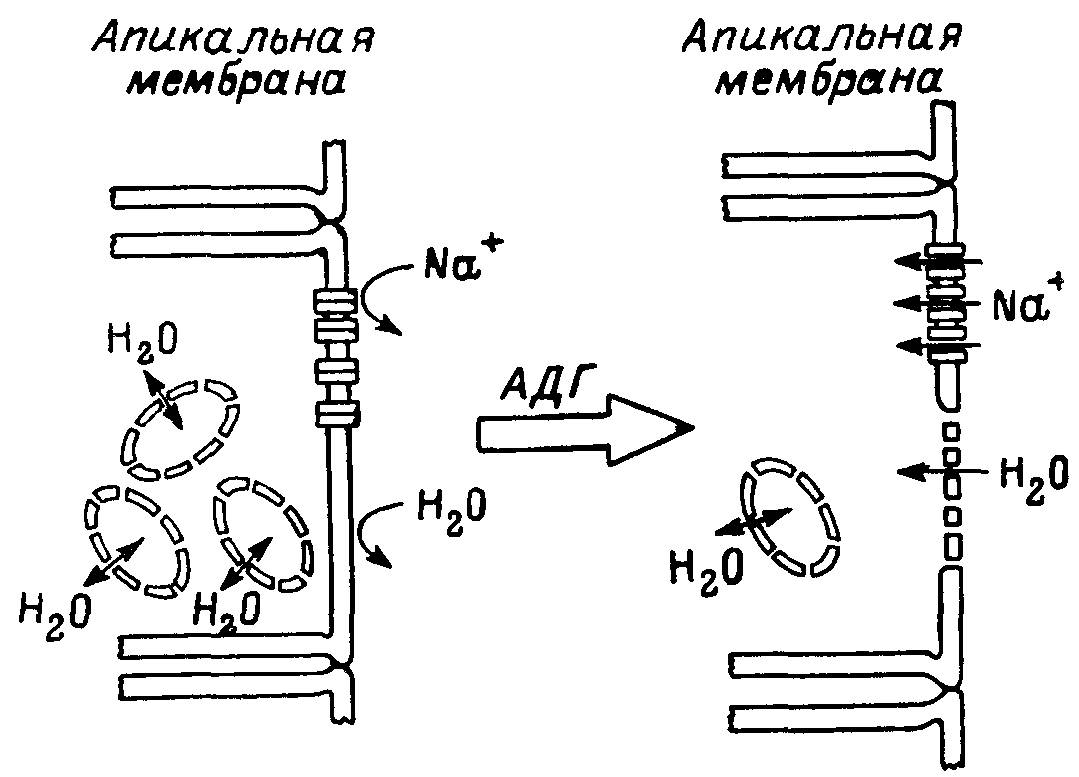
Рис. 45. Возможная схема эффектов антидиуретического гормона (АДГ) на потоки Na+ и воды.
АДГ активирует предсуществующие неподвижные натриевые каналы апикальной мембраны клетки и мобилизует цитоплазматические везикулы, которые сливаются с этой мембраной, увеличивая проницаемость эпителия для воды и транспорт Na+.
Адаптационно-компенсаторные реакции при патологии. Недавно Т. Чаки и Е. Фишер подвергли анализу нерасшифрованный феномен усиления всасывания глюкозы в тонкой кишке при экспериментальном диабете, вызванном аллоксаном или стрептозотоцином. Они установили, что после возникновения диабета у крыс усиленное всасывание глюкозы в тонкой кишке стимулируется не недостатком инсулина, не прямым действием диабетогенных веществ непосредственно на кишечные клетки, а повышением уровня сахара в крови. Существенна обнаруженная высокая специфичность этого процесса. Так, повышение в крови уровня глюкозы после ее внутривенного введения сопровождается преимущественным усилением глюкозного транспорта в тонкой кишке. После введения галактозы наблюдается резкое повышение галактозного транспорта. Транспорт фруктозы также увеличивается после ее внутривенного введения. Транспорт глюкозы усиливается после внутривенпого введения всех других сахаров, что понятно, если учесть, что инфузия всех пх сопровождается повышением уровня глюкозы в крови. Эффект связан, как и в случае адаптации к калиевым нагрузкам, с усиленным синтезом новых транспортных единиц и может быть предупрежден введением циклогексимида.
Анализ природы и локализации транспортеров, вновь синтезированных при адаптации к высокому уровню сахара в крови, показал, что они локализованы, по-видимому, в базолатеральной мембране кишечных клеток и чувствительны не к флоридзину, а к флоретину. Как известно, первый ингибирует преимущественно транспортеры глюкозы, локализованные в апикальной мембране клеток, а второй — в базолатеральной. Хотя, как пишут авторы, природа подобных явлений неизвестна, эти результаты перекликаются с нашими данными о существовании транспортно-метаболических циклов, в частности энтерогематической циркуляции глюкозы. Действительно, нами продемонстрировано, что в тонкой и толстой кишке выделяется и реабсорбируется значительное количество жидкости. Скорость реабсорбции глюкозы такова, что обеспечивает полную реутилизацию этого и, по-видимому, других ценных компонентов крови. При диабете возникает повышенное выделение глюкозы с мочой и вместе с тем индукция реабсорбционных процессов, что, вероятно, предупреждает значительные потери глюкозы. Возможно, этот механизм является общим для всех тканей, я том числе и для почек,
В целом развитие компенсаторных процессов на фоне патологии также подчиняется тем закономерностям перестроек, которые реализуются за счет изменения (увеличения или уменьшения) числа функциональных блоков или их перераспределения.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Реакция на неожиданное
Реакция на неожиданное Способностью реагировать на неожиданное и памятью обладает еще только одна система — центральная нервная система. Основное отличительное свойство иммунной системы состоит в том, что ее клетки (лимфоциты, фагоциты и другие белые кровяные клетки)
Глава 15 Реакция
Глава 15 Реакция Каждый человек вправе высказывать то, что он считает истиной, но каждый другой имеет такое же право разбивать его доводы. Сэмюэл Джонсон Когда мы создаем что-либо низкопробное, коллеги жестоко критикуют нас… Важнейший фактор, который поддерживает
Цепная реакция видообразования
Цепная реакция видообразования Теоретически видообразование может быть самоускоряющимся процессом. Появление новых видов создает новые ниши, которые могут быть освоены следующим «поколением» новых видов. Например, появление нового вида травоядных может
Реакция следования
Реакция следования Феномен этой реакции состоит в том, что зрелорождающиеся детеныши уже вскоре после появления на свет неотступно двигаются вслед за родителями (и одновременно друг за другом). Этот феномен общеизвестен по поведению детенышей домашних животных.
5.1. Концепция универсальных функциональных блоков. Общие положения
5.1. Концепция универсальных функциональных блоков. Общие положения Суть концепции, охарактеризованной мною в 1985 г., сводится к следующему.1. Различные функции, в том числе специализированные, выполняемые клетками различных тканей и органов высших организмов,
5.6. Концепция универсальных функциональных блоков и кишечная гормональная система
5.6. Концепция универсальных функциональных блоков и кишечная гормональная система Недавно, когда среди гормонов, продуцируемых эндокринными клетками тонкой кишки, оказались гормоны, характерные для гипоталамуса, гипофиза, щитовидной железы, коры надпочечников и т.д.,
6.1. Основные принципы эволюции в свете концепции универсальных функциональных блоков
6.1. Основные принципы эволюции в свете концепции универсальных функциональных блоков В какой степени закономерности и принципы функционирования организмов, органов и клеток справедливы для молекулярных и близких к ним структурно-функциональных систем, какими являются
6.2. Формирование универсальных функциональных блоков в филогенезе и механизмы их консервации
6.2. Формирование универсальных функциональных блоков в филогенезе и механизмы их консервации Мы подошли к основному вопросу, касающемуся формирования универсальных функциональных блоков. С одной стороны, в условиях дивергентной эволюции свойства функциональных
6.4. Концепция универсальных функциональных блоков и экология
6.4. Концепция универсальных функциональных блоков и экология Анализ структуры различных экосистем и взаимоотношений ее членов может дать новые доказательства правильности концепции универсальных функциональных блоков. Жизнь возможна лишь как циркуляция веществ и
Глава 7 НЕКОТОРЫЕ СЛЕДСТВИЯ КОНЦЕПЦИИ УНИВЕРСАЛЬНЫХ ФУНКЦИОНАЛЬНЫХ БЛОКОВ
Глава 7 НЕКОТОРЫЕ СЛЕДСТВИЯ КОНЦЕПЦИИ УНИВЕРСАЛЬНЫХ ФУНКЦИОНАЛЬНЫХ БЛОКОВ Каждый функциональный блок (или ограниченное число блоков, так называемые изоблоки), реализующий определенную элементарную функцию, универсален в том смысле, что выполняет соответствующую
7.1. «Синдром общих блоков»
7.1. «Синдром общих блоков» Концепция универсальных функциональных блоков вводит нас в новую область медицины, относящуюся к молекулярным заболеваниям. В настоящее время уже обнаружены заболевания, которые должны быть истолкованы с позиций этой концепции. Такие
Пассивно-оборонительная реакция
Пассивно-оборонительная реакция Пассивно-оборонительная реакция не является чем-то однородным: разные собаки могут проявлять пассивно-оборонительную реакцию на весьма различные раздражители.В настоящей работе учитывался специфический тип пассивно-оборонительной
Активно-оборонительная реакция
Активно-оборонительная реакция При учете собак с активно-оборонительной реакцией мы столкнулись с большим затруднением: выше уже отмечалось, что имеется непрерывный ряд переходов от собак с наличием пассивно-оборонительной реакции к собакам без таковой. Для
1.4. Универсальность строительных и функциональных блоков на различных уровнях организации биологических систем как условие динамического и трофического единства биосферы
1.4. Универсальность строительных и функциональных блоков на различных уровнях организации биологических систем как условие динамического и трофического единства биосферы Длительное существование биосферы как динамической системы невозможно без циркуляции веществ и
1.4. Универсальность строительных и функциональных блоков на различных уровнях организации биологических систем как условие динамического и трофического единства биосферы
1.4. Универсальность строительных и функциональных блоков на различных уровнях организации биологических систем как условие динамического и трофического единства биосферы Длительное существование биосферы как динамической системы невозможно без циркуляции веществ и