Глава 26 Проблемы биологии развития
У организмов, размножающихся половым путем, развитие индивидуума начинается с процесса оплодотворения — слияния яйца со сперматозоидом. Биологический смысл оплодотворения двоякий: 1) активация яйца — воздействие на него сперматозоида, пускающее в ход начальные процессы развития, дробление яйца; 2) кариогамия, т. е. соединение в яйце носителей наследственной информации отцовского и материнского организмов, содержащейся в хромосомах сперматозоида и яйца. Кроме того, в отдельных случаях внедрение сперматозоида вызывает изменение топографии цитоплазматических компонентов яйца, обеспечивающее возникновение гетерогенности его строения или изменение исходной гетерогенности, чем определяется расположение передне-задней и спинно-брюшной осей будущего зародыша, а также появление структур, взаимодействие которых детерминирует последующую дифференцировку.
В изучении различных сторон единого процесса оплодотворения приняли участие цитологи, биофизики, биохимики (а впоследствии и представители молекулярной биологии), эмбриологи и генетики.
После того как Ф. Лилли и Ж. Лёб в первом десятилетии XX в. обнаружили в яйцах и сперматозоидах существование веществ, оказывающих влияние на гаметы того же или противоположного пола, эти вещества детально изучались, однако и до настоящего времени их значение для процессов оплодотворения окончательно не установлено. Вслед за Лилли А. Тайлер (1948) продолжал называть вещество яйца, стимулирующее подвижность сперматозоидов, фертилизином, а М. Гартман — гиногамоном I; вещество, вызывающее агглютинацию сперматозоидов, Гартман называл гиногамоном II. В свою очередь, в сперме было обнаружено вещество, подавляющее движение сперматозоидов, — андрогамон I (Гартман), а также андрогамон II, препятствующий действию агглютинирующего агента. В монографии А.С. Гинзбург (1968) отмечено, что роль агглютинирующего сперматозоиды агента не подтвердилась; не прав оказался и Гартман, утверждавший, что при оплодотворении играет роль взаимодействие андро- и гиногамонов. По мнению Гинзбург, эти вещества имеют лишь вспомогательное значение, облегчая встречу и соединение гамет. Агглютинину, содержащемуся в яйцах иглокожих и рыб, она приписывает роль защиты от проникновения сверхчисленных спермиев.
Активация яйца.
В 70-х годах XIX в. еще не отличали активацию яйца от кариогамии (О. Гервиг, 1875), так как считалось, что именно слияние пронуклеусов (ядер мужской и женской гаметы) и является причиной дробления яйца. Т. Бовери, основываясь на цитологических наблюдениях, возражал против такого понимания источника активации; соображения Бовери подтверждались прежде всего фактами естественного и вызванного экспериментально партеногенеза (развития яйца без оплодотворения), когда активация яйца осуществляется без участия сперматозоида, т. е. независимо от кариогамии, а также возможностью оплодотворения и последующего развития безъядерных фрагментов яйца (О. и Р. Гертвиги, 1887; И. Делаж, 1901).
Исходя из этих соображений, Бовери выдвинул теорию, согласно которой яйцо побуждает к дроблению вносимая сперматозоидом центросома. По мнению Бовери, яйцо содержит все структурные компоненты, необходимые для начала дробления, кроме центросомы, а сперматозоид, в котором имеется центросома, лишен цитоплазмы, которая могла бы реагировать на наличие центросомы образованием ахроматической фигуры деления. Иными словами, яйцо и сперматозоид взаимно дополняют друг друга, и после их соединения образуется система, способная к осуществлению начальных процессов эмбрионального развития.
Встреча сперматозоидов с яйцом обеспечивается анатомическими (при внутреннем оплодотворении) или экологическими условиями — выбрасыванием сперматозоидов в воду поблизости от отложенных яиц. Длительно дискутировался вопрос, существует ли у сперматозоидов хемотаксис по отношению к выделяемым из яйца веществам. Хотя и было показано (Ф. Лилли), что сперматозоиды морского ежа собираются вокруг капель вытяжки из яиц, это не исключало предположения, что скопление сперматозоидов возле яйца осуществляется по принципу «физиологической западни», т. е. что они наталкиваются на яйцо случайно и удерживаются около него в силу физико-химических условий, препятствующих их удалению от яйца. Роль физиологической западни приписывали фертилизину — гипотетическому веществу из студенистой оболочки яйца (Ф. Лилли, 1924), вызывающему агглютинацию сперматозоидов.
В раннем периоде изучения явлений активации яйца попытки выяснить основные компоненты этого сложного процесса страдали односторонностью. Из комплекса относящихся сюда явлений вычленяли отдельные частные моменты и приписывали им ответственность за всю совокупность событий, разыгрывающихся в течение начальных этапов оплодотворения. Эти соображения справедливы, в частности, в отношении классических работ американского зоолога Лёба, пытавшегося выяснить смысл явлений активации во время нормального оплодотворения, исходя из наблюдений над искусственной активацией неоплодотворенного яйца, т. е. при помощи искусственного партеногенеза. После того как было установлено, что дробление неоплодотворенных яиц может быть пущено в ход различными агентами — термическими, электрическими или механическими раздражениями (в том числе уколом), действием гипертонических растворов, жирных кислот (в частности, масляной кислоты) и т. п., выяснилось, что в большинстве случаев эти воздействия приводят к нарушению нормального хода развития, которое рано или поздно останавливается. Все эти агенты вызывают лизис поверхностного слоя яйца за счет освобождающихся протеолитических ферментов и стимуляции окислительных процессов. Лёб показал, что вызванные при этом нарушения нормального состояния яйца могут быть устранены, если яйца морского ежа вслед за воздействием масляной кислотой поместить на некоторое время в гипертоническую морскую воду. По аналогии с наблюдениями, сделанными на искусственно активированных яйцах, Лёб предположил, что и в норме активация начинается с лизиса кортикального слоя яйца и стимуляции его дыхания, за чем следует нормализация нарушенного состояния яйца пока еще неизвестным фактором.
Французский эмбриолог Э. Батайон (1910) видел смысл активации яйца при оплодотворении в том, что накапливающиеся в неоплодотворенном яйце токсические продукты обмена веществ удаляются из него в перивителлиновое пространство, возникающее после оплодотворения. Эта детоксикация яйца и служит, по мнению Батайона, стимулом к дроблению.
Исходя из аналогии с агглютинацией эритроцитов, являющейся реакцией между антигеном и антителом, Лилли высказал предположение, что взаимодействие между яйцом и сперматозоидом при оплодотворении также относится к числу иммунологических процессов и заключается в реакции фертилизина яйца с антифертилизином сперматозоида. А. Дальк (1928) справедливо заметил, что теория Лилли в лучшем случае может объяснить только начальный момент оплодотворения.
Американский цитолог Л. Гейлбрун (1956) пытался сопоставить явления оплодотворения и свертывания крови. Исходя из факта освобождения кальция, Гейлбрун сделал вывод, что желатинизирование цитоплазмы в активированном яйце имеет то же значение, что и в плазме крови 80- время коагуляции.
Автор современной сводки по биохимической эмбриологии бельгиец Ж. Браше (1960) не без основания утверждает, что ни одна из теорий оплодотворения, принимающих частные стороны этого явления за его подлинную сущность, не вскрывает последней. Для этого необходимы новые исследования, распространяющиеся как вширь (с охватом возможно большего числа различных объектов), так и вглубь, позволяющие учесть стороны явления в их взаимной связи.
Активацию яйца в ответ на проникновение сперматозоида связывают с процессами, изменяющими строение кортикального слоя яйца. В свое время эту идею высказал Ж. Лёб (1913); она получила подтверждение в новейших исследованиях. Изменения поверхностной структуры яйца выражаются в выделении содержимого кортикальных гранул, что является отражением зрительно невоспринимаемого импульса активации, который начинается локально, в месте контакта с акросомной нитью сперматозоида, и распространяется по поверхности яйца; скорость распространения этого импульса для яиц осетровых рыб определила Т.А. Детлаф (1961). Детально изучены физико-химические характеристики кортикальной реакции — разыгрывающиеся в кортикальном слое биоэлектрические явления, изменения его проницаемости для различных веществ, его коллоидной структуры, оптических свойств (изменение свечения в темном поле, двойное лучепреломление). Изучались также метаболические и структурные изменения в цитоплазме яйца, выражающиеся в нарушении исходного состава ее белков, ферментативной активности (содержания протеаз, липазы, щелочной фосфатазы), количества липопротеидов, мукополисахаридов и т. д.
Попытки выяснить природу активации яйца в процессе оплодотворения привели к важным сопоставлениям явлений в яйце с процессами, протекающими в мышцах при их сокращении. Для обеих этих систем характерны повышение теплопродукции, увеличение ионной проницаемости, наличие тока покоя, прохождение биоэлектрической волны, обратимая денатурация белков, участие медиаторов возбуждения, образование фосфатов и изменение сложных фосфорных эфиров, уменьшение содержания свободного калия и освобождение кальция, образование молочной кислоты и т. д. Обнаружена также аналогия между процессами, происходящими в кортикальном слое яйца во время активации, и явлениями возбуждения нерва.
Цитологическое изучение оплодотворения.
Проникновение сперматозоида в яйцо осуществляется по-разному — иногда через специальные отверстия (микропиле) в оболочках, например у насекомых, головоногих моллюсков и некоторых рыб, или же в любой точке яйцевой поверхности. Внедрение сперматозоида в яйцо начинается с так называемой акросомной реакции, т. е. с выталкивания из акросомы (верхушечного тельца головки сперматозоида) длинной нити, проникающей в ооплазму в месте соприкосновения головки спермин с поверхностью яйца и вызывающей образование воспринимающего холмика (Л. Колвин и А. Колвин, 1949; Дж. Дэн, 1956). Впервые этот холмик прижизненно наблюдал Г. Фоль (1879), назвав его конусом притяжения. Акросомная реакция является условием, предпосылкой тех процессов, которые приводят к возникновению импульса активации и к проникновению сперматозоида в цитоплазму яйца. С акросомной реакцией связывали явления частичного растворения оболочки яйца под действием лизинов, выделяемых из акросомной гранулы, что было показано при помощи фазово-контрастного (С. Вада с соавторами, 1956) и электронного микроскопов (Р. Морикар и Г. Гийон, 1960). Само проникновение сперматозоида в цитоплазму яйца сначала объясняли фагоцитозом, т. е. активной деятельностью цитоплазмы при поглощении твердых частиц; электронномикроскопические исследования привели к предположению об участии в этом процессе пиноцитоза (Д. Сцоллози и Г. Рис, 1961). До сих пор механизм вхождения сперматозоида в яйцо продолжает оставаться не вполне выясненным. Установлено, что плазматические мембраны гамет в месте проникновения сперматозоида сливаются в единую поверхностную мембрану зиготы.
После погружения сперматозоида в цитоплазму яйца (у разных животных в нее входит только головка сперматозоида с участком шейки, содержащим центросому, или же целиком весь сперматозоид) головка (семенное ядро), поворачиваясь на 180°, начинает двигаться в глубь яйца и приближается к яйцевому ядру. Затем она или сливается с яйцевым ядром, или располагается в непосредственной близости от него.
Первоначально считали, что из центросомы образуется семенная звезда, делящаяся затем на две, образующие амфиастер митоза первого, дробления яйца. У одних животных (например, у морского ежа) по наблюдениям Э. Вильсона, мужской и женский пронуклеусы конъюгируют непосредственно после вхождения сперматозоида, вследствие чего различие в величине между мужским (маленьким) и женским (большим) пронуклеусом сохраняется вплоть до их слияния. У других животных (например, у аскариды и брюхоногих моллюсков, по данным Бовери) соединение пронуклеусов запаздывает; за это время семенное ядро увеличивается, приобретает пузырьковидную форму и становится неотличимым от яйцевого ядра. Еще до начала митоза первого деления дробления в обоих ядрах обособляются хромосомы, причем хромосомы мужского и женского ядер после растворения оболочки обоих ядер иногда располагаются обособленно. Даже во время первого митоза группы отцовских и материнских хромосом иногда остаются раздельными, как это имеет место, например, у циклопа (И. Рюккерт, 1895) или моллюска Crepidula (Э. Конклин, 1901).
Это явление, названное гономерией, представляет исключение, так как обычно отцовское и материнские хромосомы во время оплодотворения перемешиваются, причем гомологичные хромосомы, происходящие от отца и от матери, располагаются попарно.
В цитоплазме яйца пронуклеусы движутся, как правило, не непосредственно навстречу друг к другу. Яйцевое ядро до этой встречи проходит более короткий путь, чем семенное. Последнее сначала перемещается более или менее радиально к центру яйца по так называемой тропе проникновения (не по направлению к яйцевому ядру, обычно располагающемуся эксцентрично); затем направление движения мужского пронуклеуса изменяется, но и теперь он перемещается по так называемой тропе копуляции не к женскому пронуклеусу, а к пункту, где они должны будут встретиться. Только с этого момента начинает двигаться по направлению к пункту встречи и яйцевое ядро. Эти явления впервые изучили на яйцах лягушки В. Ру (1887), а затем на яйцах морского ежа Э. Вильсон (1895). В дальнейшем описанные наблюдения были подтверждены и на других животных, в частности Э. Конклином (1905) на асцидии.
Вместе с семенным ядром в яйцо вносятся митохондрии и центросома. Ф. Мевес (1908, 1914), детально изучавший поведение митохондрий во время оплодотворения, длительное время отстаивал точку зрения, что они являются носителями наследственной информации; Мевес предполагал, что митохондрии (или, как он их называл, пластосомы) сперматозоида конъюгируют с митохондриями яйца. А.Д. Некрасов, подробно изложив наблюдения и выводы Мевеса, пришел к заключению, что «теория пластосом как носителей наследственности держалась только искусной диалектикой Мевеса»[199].
Судьба центросом сперматозоида была предметом длительной дискуссии. Наряду с мнением, согласно которому центросома оплодотворенного яйца происходит из шейки сперматозоида, на чем была основана упомянутая выше теория оплодотворения Бовери, высказывалось утверждение, что центросомы и связанные с ними ахроматические лучистые фигуры имеются и по соседству с яйцевым ядром и что они могут даже образовываться заново в цитоплазме оплодотворенного или искусственно активированного яйца (Ф. Лилли).
Оплодотворение и организация яйца.
Влияние проникающего сперматозоида на структуру яйца, от которой зависит положение первой борозды дробления, было изучено экспериментально. В. Ру (1887) применял локализованное осеменение яиц лягушки, нанося сперматозоиды на произвольный меридиан яйца при помощи шелковой нити или тонкой пипетки. Он установил, что плоскость первого дробления может проходить через любой меридиан яйца, в котором находится точка проникновения сперматозоида. В сущности этот опыт только наглядно подтвердил результаты прямого наблюдения, показывавшего, что борозда первого дробления в норме проходит вблизи места внедрения сперматозоида. Достоверность указанного наблюдения подтверждается тем, что сперматозоид; погружаясь в яйцо, увлекает за собой пигмент кортикального слоя и поэтому оставляет на своем пути в ооплазме окрашенный след. На срезах видно, что борозда первого дробления проходит через этот след или рядом с ним и параллельно ему.
Прохождение первой борозды дробления через место внедрения сперматозоида или поблизости от этой точки было показано и на многих других животных. Это особенно ясно в тех случаях, когда сперматозоид проникает через верхний полюс телолецитальных яиц (у птиц, рептилий и акуловых рыб) или через нижний полюс (у плоских червей, моллюсков, оболочников, ланцетника). Если же сперматозоид проникает не через полярную область яйца, то он оставляет след в виде долго сохраняющегося воспринимающего холмика (например, у морских ежей), и тогда можно видеть, что плоскость первого дробления проходит через этот холмик или рядом с ним. Имеет ли плоскость первого дробления непосредственное отношение к плоскости симметрии будущей личинки морского ежа, с достоверностью не выяснено. На других объектах этот вопрос получил однозначное решение. Так, Э. Джаст (1912), работая на яйцах полихеты Nereis, характеризующихся строгой детерминированностью дробления, показал, что, производя осеменение яиц в морской воде, содержащей взвесь туши, можно видеть передвижение окрашенных частиц и канал, через который проник в яйцо сперматозоид. Отчетливо видно, что плоскость первого дробления проходит через эту, окрашенную тушью, точку внедрения сперматозоида и делит яйцо на две неравные клетки, из которых большая ответственна за образование мезодермы и всего посттрохального отдела будущей личинки. Считается, что этот пример лучше всего демонстрирует зависимость сегрегации эмбрионального материала от местоположения плоскости первого дробления. Наоборот, для яиц хордовых, в частности круглоротых, осетровых рыб и амфибий, отчетливо показана независимость положения первой борозды дробления от места внедрения сперматозоида (П. Ансель, П. Вентанберже, 1948).
Структура яйца, выражающаяся в сегрегации материала будущих частей развивающегося зародыша, как правило, отсутствует до созревания и появляется только в связи с отделением полярных телец и оплодотворением. Какой из этих процессов определяет ооплазматическую сегрегацию, не всегда удается точно установить. Бовери (1901), изучая эмбриональное развитие морского ежа, показал, что в незрелом яйце пигмент расположен в кортикальном слое ооплазмы равномерно. После внедрения сперматозоида в полярную область яйца пигмент располагается в виде полосы, локализованной ниже экватора. Большая часть ооплазмы над пигментным поясом дает начало эктодерме; непигментированный участок ниже пигментного пояса — мезодерме, а из участка, содержащего пигмент, образуется энтодерма. Остается невыясненным, чем обусловлено появление различно окрашенных зон яйца — предшествующим отделением полярных телец или вхождением сперматозоида. Более отчетливые результаты получены на яйцах асцидии (Э. Конклин, 1905) и подтверждены тем яге автором позднее на пресноводных легочных моллюсках. До созревания яйцо асцидии Styela partita почти гомогенно: оно содержит в центре желток, а на поверхности цитоплазму с желтым пигментом. Вслед за проникновением сперматозоида периферическая желтая ооплазма смещается к нижнему полюсу яйца, образуя там скопление в виде шапочки: затем этот материал (будущая мезодерма) вместе с прозрачной ооплазмой (будущая эктодерма) перемещается к заднему концу яйца, а цитоплазма, из которой впоследствии образуется энтодерма, хорда и нервная система, движется вперед и вниз и располагается в нижней части яйца. Из верхней зоны, как у морского ежа, образуется эктодерма, а участки, содержащие желтый пигмент, дают начало мезенхиме и мышцам хвоста личинки.
Сходным образом оплодотворение действует и на сегрегацию у моллюсков и кольчатых червей. В частности, у пиявок зоны яйца, предназначенные для образования различных органов, делаются заметными только после оплодотворения. Э. Вильсон считает, что эта закономерность может быть распространена и за пределы названных типов животных. Например, у бесхвостых амфибий различие между светлым (вегетативным) и темным (анимальным) полушариями яйца существует до оплодотворения, тогда как серый серп — первый признак начинающейся дифференциации — появляется только после осеменения.
Значение кариогамии.
Э. ван Бенеден (1883) впервые на яйцах лошадиной аскариды установил, что каждый из пронуклеусов — мужской и женский содержит гаплоидное число хромосом. Вильсон назвал это открытие законом ван Бенедена. Т. Бовери (1890) установил справедливость этого закона на морских ежах, червях, медузах и брюхоногих моллюсках, подсчитав количество хромосом в семенных и яйцевых пронуклеусах до их слияния.
Закон ван Бенедена подтверждается, кроме того, следующими фактами: число хромосом в зиготе и бластомерах, образовавшихся в результате ее деления, равно сумме числа хромосом, содержащихся в пронуклеусах; при скрещивании форм, обладающих неодинаковым числом хромосом, у гибридов число хромосом в зиготе равно сумме гаплоидных количеств хромосом родительских форм; при оплодотворении безъядерного фрагмента яйца и при развитии в результате искусственного партеногенеза сохраняется гаплоидное число хромосом: в диспермичных яйцах имеется триплоидный набор хромосом; при развитии после разрушения мужского (гиногенез) или женского (андрогенез) ядра число хромосом гаплоидное.
Было установлено, что нормальное (диплоидное) число хромосом после оплодотворения обеспечивается соединением яйцевого ядра только с одним семенным, что имеет место как при физиологической моноспермии, так и при физиологической полиспермии. В физиологически моноспермные яйца входит только один сперматозоид; в случае проникновения в моноспермные яйца сверхчисленных сперматозоидов и включения их в развитие зародыша последнее протекает ненормально и рано прерывается. Предотвращение полиспермии у физиологически моноспермных яиц обеспечивается кортикальной реакцией в ответ на вхождение в яйцо первого сперматозоида; следствием этой реакции становится непроницаемость кортикального слоя яйца для других сперматозоидов (Л. Ротшильд, 1958; Б. Хагстрём и И. Рунстрем, 1959; А.С. Гинзбург, 1968). В физиологически полиспермные яйца проникает несколько сперматозоидов, но в кариогамии участвует только один из них, а остальные элиминируются. Дегенерацию избыточных сперматозоидов связывают с влиянием каких-то веществ, диффундирующих из женского пронуклеуса или из головки сперматозоида, ближе всего находящегося к женскому ядру и уже переходящего в состояние мужского пронуклеуса.
Данные, добытые при изучении поведения ядерных структур в процессе оплодотворения, являются одной из основ хромосомной теории наследственности (см. главу 13). В пользу этой теории говорит также наблюдаемая в процессе кариогамии конъюгация гомологичных хромосом, а также факт сингамного (осуществляющегося в момент оплодотворения) определения пола; у млекопитающих, амфибий и двукрылых насекомых гетерозиготным по половой хромосоме является мужской пол, а гомозиготным — женский, у птиц и бабочек — наоборот.
Изучение явлений, происходящих во время оплодотворения, способствовало решению общих проблем цитологии, а также развитию цитологических основ эмбриологии и цитогенетики.
Современное изучение индивидуального развития, или, как теперь часто говорят, биологии развития, связано прежде всего с выяснением механизмов реализации наследственной информации, проводимым на всех уровнях биологической организации и, в первую очередь, на молекулярном уровне. Поскольку аппарат наследственности передает яйцу и каждой клетке зародыша всю генетическую информацию, а в каждом типе тканей и органов реализуется только ее небольшая часть, главной задачей сегодняшнего дня стало исследование механизма дифференциальной активности генов, т. е. того, как включаются и выключаются отдельные гены, характерные для каждого типа клеток (см. главы 23 и 24). Это направление, получившее также название молекулярной эмбриологии, пользуется сейчас наибольшим вниманием. Ему уделяется основное внимание и в настоящей главе.
Развитие как реализация наследственной информации.
В оплодотворенном яйце с известной условностью можно различать два компонента наследственной информации. Первым и основным носителем этой информации являются хромосомы женского ядра и сперматозоида, содержащие весь набор генов. Цитоплазматические структуры яйца, специально приспособленные для обеспечения процессов развития, особенно на ранних стадиях, можно рассматривать как второй компонент наследственной информации, но уже реализованной. Эти структуры образуются в ходе оогенеза за счет активности части генов материнского генотипа. Основную роль в этом процессе играет собственно ядро ооцита — зародышевый пузырек, но в образовании яйца принимают участие и другие клетки яичника (фолликулярные, питающие и т. д.). В рамках второго компонента можно выделить митохондриальный тип наследственной информации. В онтогенезе ему принадлежит, по-видимому, небольшая роль.
Наиболее убедительные результаты, дающие прямое доказательство ведущей роли ядра в развитии, были получены в опытах Б.Л. Астаурова (1957) по диплоидному андрогенезу и английского исследователя Дж. Гердона (1962) по трансплантации ядер. В первых из них женское ядро в яйцах шелкопряда Bombux mor? инактивировалось нагреванием или рентгеновским облучением и оплодотворялось спермиями другого близкого вида В. mandarina. В ряде случаев два мужских пронуклеуса сливались, образуя диплоидное ядро, что приводило к развитию нормального потомства. По своим признакам оно целиком походило на отцовский вид. Цитоплазма яйца В. mori никаких видовых признаков, очевидно, не передает.
Гердон использовал два подвида африканской шпорцевой лягушки, отличавшиеся по размерам, окраске и другим признакам. В результате пересадки ядра из клетки бластулы одного подвида в энуклеированное яйцо другого подвида развивались нормальные головастики и лягушки, по всем своим признакам похожие на подвид, из которого брались ядра. И в этом случае подвидовые признаки целиком определялись ядром, а не цитоплазмой.
Надо, однако, сказать, что в этих, как и во всех других подобного рода опытах, могут быть использованы только очень близкие виды или подвиды, различающиеся по немногим и обычно второстепенным признакам. Следовательно, только в отношении этих признаков и можно с уверенностью утверждать, что они передаются с ядром. В последние годы было показано, что некоторые цитоплазматические структуры — в первую очередь митохондрии, а у растений и хлоропласты — обладают собственной ДНК, т. е. собственным, обычно небольшим, наследственным аппаратом. Таким образом, описанные ранее редкие случаи цитоплазматической наследственности получили теперь материальную основу. Тем не менее количество генов, способных передаваться ДНК митохондрий, не превышает нескольких десятков, и они не могут, стало быть, играть сколько-нибудь существенной роли. Наследуемые различия, определяемые митохондриями и хлоропластами, установлены пока только у дрожжей и немногих растений.
Реализация генетической информации, т. е. активность определенных генов, синтез на них РНК, определяющей последующий синтез белка, начинается, как уже говорилось, с раннего оогенеза. В последние годы на яйцах амфибий, рыб и иглокожих были получены более детальные биохимические данные об этих процессах. В ядрах ранних ооцитов амфибий происходят два в известной степени независимых процесса. Первый из них получил название амплификации, или умножения генов (Д. Враун, Дж. Дэвид, 1968). Он касается ядрышковых организаторов хромосом, т. е. участков ДНК, на которых образуется ядрышко и происходит синтез рибосомной РНК.
В состав рибосом эукариот (организмов с обособленным ядром) входят три молекулы РНК, отличающиеся по молекулярному весу и константам седиментации и обозначаемые соответственно 26S, 18S и 5S. Участки ДНК, на которых происходит их синтез, можно обозначить через 26S-, 18S- и 5S-ДНК. Д. Браун и Э. Литтна (1964) показали, что 26S- и 18S-участки ДНК находятся в геноме лягушки вместе и, повторяясь приблизительно 450 раз, образуют ядрышковый организатор. 5S-ДНК представлена в геноме лягушки 25–30 тысячами идентичных участков (генов), которые, однако, рассеяны по всему геному (Д. Браун, Э. Литтна, 1966). В раннем оогенезе ДНК ядрышкового организатора многократно удваивается, и эти умноженные (амплифицированные) участки ДНК, содержащие по 450 генов (26S- и 18S-ДНК), отделяются от хромосомы и образуют в зародышевом пузырьке ооцита 1000–2000 дополнительных ядрышек, на которых происходит активный синтез рибосомальной РНК. Возникает вопрос — является ли амплификация рибосомальных генов единственным примером такого рода или и в других случаях активная функция генов может осуществляться за счет размножения участков ДНК.
Синтез 5S-ДНК происходит на соответствующих участках ДНК хромосом, которые не подвергаются амплификации. Так как большое число 5S-генов только частично компенсирует увеличение числа ядрышек, активность этих генов должна быть очень велика. Так в ходе оогенеза происходит накопление рибосомальной РНК и, соответственно, рибосом, которые лишь частично используются для синтеза белка в самом оогенезе, а в основном служат для обеспечения синтеза белка на ранних этапах эмбрионального развития.
Вторым процессом, происходящим в ядрах ранних ооцитов, является характерное преобразование хромосом — их удлинение и образование многочисленных выступающих петель, почему эти хромосомы получили название ламповых щеток. В это время на них происходит интенсивный синтез информационной РНК (иРНК), часть которой используется в самом оогенезе как матрицы для синтеза белков. Большая же часть иРНК остается в зрелом яйце и служит матрицей белкового синтеза после оплодотворения. Таким образом, еще в оогенезе, часто за много месяцев до начала развития начинается реализация генетической информации, в ходе которой создается не только сама яйцеклетка, но и запас иРНК и рибосом, обеспечивающих синтез белков на ранних стадиях эмбрионального развития (Э. Давидсон, 1969). Тем самым возникают условия для того, чтобы самые ранние этапы развития — дробление яйца и образование бластулы — у многих животных (амфибии, рыбы, иглокожие) могли протекать без непосредственного участия ядер. Это было убедительно показано в опытах, когда ядра раннего зародыша инактивировались высокими дозами радиации или химическими агентами (аналоги иприта, актиномицин). Развитие таких яиц с инактивированными ядрами идет внешне вполне нормально до стадии поздней (амфибии, рыбы) или средней (морской еж) бластулы (А.А. Нейфах, 1961).

Схема хромосом типа «ламповых щеток» из ооцита тритона (по Голлу, 1958).
А — при малом увеличении; Б — при большом увеличении. Видны боковые выросты в форме ручки и спирализация хромонем.
Реализация морфогенетической функции ядер, обеспечивающей дальнейшее развитие зародышей, т. е. синтез РНК, начинается на относительно поздних стадиях, специфичных для каждого вида РНК. Резкая интенсификация синтеза иРНК происходит у амфибий только на стадиях средней — поздней бластулы; позже, на стадии гаструляции, начинается синтез транспортной РНК (тРНК) и еще позднее синтез рибосомной РНК. Синтез белка на вновь образованной иРНК осуществляется на более поздних стадиях, определяя еще более отдаленные фазы онтогенеза.
Биохимические исследования процессов реализации наследственности синтеза РНК и белка — развернулись только в последнее десятилетие, совершенствуясь по мере развития соответствующих методов. Особенно важной и методически наиболее сложной оказывается сейчас качественная характеристика синтезирующихся иРНК.
До недавнего времени считалось, что наиболее перспективным в этом отношении является метод гибридизации РНК с ДНК, позволяющий сравнить характер иРНК, образующихся на разных стадиях. Сущность метода состоит в том, что меченая РНК может комплементарно соединяться только с теми участками одиночной нити ДНК, на которой она была синтезирована. В принципе этим методом можно различать РНК, синтезированную на разных генах. Однако в самое последнее время было показано, что этим методом определяются только те виды иРНК, которые синтезируются на многократно повторяющихся генах, составляющих около 50 % всего генома. Функциональная роль повторяющихся генов [кроме генов, определяющих синтез рибосомных РНК (рРНК)] еще не ясна. С достоверностью пока известно лишь следующее: по мере развития происходит смена синтезирующихся иРНК, т. е. смена активно работающих генов; в разных частях зародыша функционируют разные гены, хотя некоторые гены активны во всех клетках; часть генов, активных в оогенезе, оказывается активной и во время эмбрионального развития.
Тотипотентность ядер и их дифференцировка.
В связи с уточнением знаний о механизмах митоза и развитием хромосомной теории наследственности стало очевидно, что идея А. Вейсмана о неравнонаследственных делениях ядер, во всяком случае в ее первоначальной трактовке, не соответствует действительности. Однако тот несомненный факт, что в дифференцированных клетках активна лишь часть генома, сделал возможным прочтение гипотезы Вейсмана в ином варианте: необратимо инактивирована б?льшая часть генома, в результате чего активной остается лишь часть генов, специфичных для каждой ткани. Убедительные данные для решения этого вопроса были получены только после 1952 г., когда американские исследователи Р. Бриггс и Т. Кинг предложили метод пересадки ядер из клеток зародыша в яйцо лягушки, из которого извлекалось ядро. Эти опыты показали, что во всяком случае на стадии бластулы ядра еще не испытывают необратимых изменений: значительная часть пересаженных ядер обеспечивала нормальное развитие. Однако при переходе к более поздним стадиям и использовании ядер все более дифференцированных зачатков процент нормальных зародышей-трансплантантов прогрессивно уменьшался. Далее сами авторы метода установили, что большинство «неудачных» пересадок, приводивших к патологическому развитию, связано с хромосомными аберрациями, возникающими в пересаженных ядрах. Тем не менее, Гердону, несколько модифицировавшему этот метод, удалось получить нормальных половозрелых лягушек из яиц, в которые были пересажены ядра из клеток кишечника питающегося головастика. И хотя процент таких удачных пересадок по-прежнему невелик, в принципе проблему можно считать решенной: ядра дифференцированных клеток сохраняют всю генетическую информацию, которая может быть реализована в соответствующих условиях. Причиной же неудачных экспериментов являются в основном трудности в пересадке неповрежденных ядер. Эта точка зрения принята сейчас большинством исследователей. Следует указать, однако, некоторые факты, противоречащие ей.
1. В ряде опытов Бриггса и Кинга были получены дефектные зародыши, в клетках которых не наблюдалось цитологически заметных хромосомных аберраций.
2. Опыты по пересадке ядер из других тканей (не из кишечника головастика) и от головастиков еще более поздних стадий не привели к успеху.
3. У отдельных видов (аскариды, некоторые насекомые), на ранних стадиях развития происходит закономерная потеря частей (диминуция) или целых хромосом (элиминация), которой избегают только клетки зародышевого пути, дающие начало половым клеткам. Обнаружены специальные цитоплазматические структуры, содержащие РНК и ответственные за сохранение целостности хромосом в будущих половых клетках этих видов. Однако и у видов, для которых ни диминуция, ни элиминация хромосом не описаны (дрозофилы, амфибии), детерминация клотик зародышевого пути также происходит на очень ранних стадиях развития и определяется факторами цитоплазмы, содержащими РНК.
Таким образом, хотя в ядрах дифференцированных клеток сохраняется весь геном, его большая часть остается репрессированной; или правильнее сказать, что в ходе развития в полностью репрессированных ядрах (РНК не синтезируется) дерепрессируется часть генов, специфичных для данной ткани. Следовательно, ядра клеток разных тканей отличаются друг от друга, что и дает основание считать их дифференцированными.
Об этом свидетельствуют и биохимические данные. Опыты по гибридизации ДНК на ДНК и РНК на ДНК показали, что в то время как ДНК разных тканей совершенно тождественны друг другу, синтезирующаяся в них РНК в той или иной степени качественно различна. Однако сам факт дифференцировки ядер не требует таких строгих доказательств. Морфологические особенности ядер из разных тканей, различия в их размерах, форме, сродстве к красителям — все это достаточно хорошо иллюстрирует различия их функций. Некоторые примеры в этом отношении особенно показательны. Одним из таких примеров могут служить уже упоминавшиеся ламповые щетки ооцита. Точных данных о том, какая часть генов активна в этих хромосомах, пока еще нет (по-видимому, она близка к 3 %). Но очевидно, что активны те гены, которые ответственны за синтез белков, необходимых для оогенеза и раннего развития. То обстоятельство, что одно ядро — зародышевый пузырек — вынуждено в этом случае обеспечивать очень большую клетку (в десятки, а иногда сотни тысяч раз большую, чем обычно), и привело к тому, что эти хромосомы так сильно специализированы. Характерно, однако, что эта, казалось бы, крайне узкая специализация полностью обратима — в конце созревания яйца хромосомы зародышевого пузырька преобразуются в обычные хромосомы женского ядра, несущие информацию для всего будущего зародыша и являющиеся звеном зародышевого пути.
Другим, еще более изученным примером ядерной дифференцировки, являются гигантские политенные хромосомы слюнных желез личинок двукрылых насекомых. Их дифференцировка выражается в образовании характерных вздутий — пуффов, в которых происходит усиленный синтез иРНК. Локализация и порядок появления этих пуффов закономерно изменяются в ходе личиночного развития и зависят от тех же факторов, которые определяют развитие — в частности, гормонов линьки и окукливания. На примере этих пуффов удается наблюдать почти непосредственное влияние гормона окукливания — экдизона — на активность генов.
Доказательством дифференциальной активности генов в зависимости, как от времени развития, так и от их локализации в зародыше служат многочисленные наблюдения над проявлением различных мутаций. Одни из них обнаруживаются уже на очень ранних стадиях, другие только во взрослом организме; одни затрагивают целые группы тканей, другие только единственный тип клеток. Таким образом, уже с самого начала функционирования ядер проявляется их дифференцировка, усиливающаяся в ходе развития.
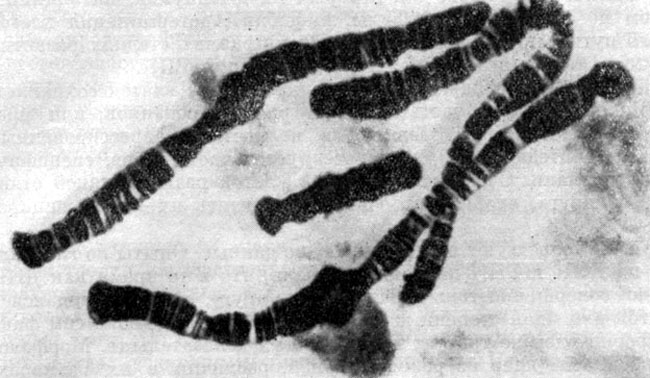
Хромосомный набор клеток слюнных желез хирономуса Chironomus tentants (по Биерману и Клеверу, 1964).
Условно можно различать три группы генов. Первую составляют гены, функционирующие во всех клетках организма. Сюда относятся гены, ответственные за образование ферментов энергетического обмена, синтез макромолекул, образование общих для всех клеток структур и т. д. Ко второй относятся гены, функционирующие в клетках ткани одного типа, например, те, которые определяют синтез миозина во всех мышечных тканях, коллагена во всех опорных тканях и т. д. В третью группу входят гены, специфичные для данного типа клеток. В ряде случаев это само собою очевидно. Так, синтез гемоглобина происходит только в эритробластах и только в них активны соответствующие гены. Также специфичен синтез многих гормонов, трипсина, амилазы и т. д. Однако и внешне одинаковые клетки должны различаться по активности некоторых генов, если клетки эти находятся в разных органах. Например, форма хрящей позвонка отличается от формы хрящевого скелета пальцев потому, что в них активны гены, специфические для этих органов. Это убедительно доказывается, в частности, мутациями, изменяющими число пальцев. Следовательно, в образовании каждого хряща, каждой мышцы должны участвовать свои особые гены, определяющие форму только этого органа и функционирующие только в нем.
Факторы дифференцировки.
Проблема факторов, определяющих направление дифференцировки клеток, поставлена давно. Ее решение было основной задачей механики развития (см. главу 14). Тем не менее, успехи в этой области еще не очень велики: выяснены факторы, определяющие лишь несколько десятков направлений из сотен дифференцировок, составляющих весь процесс развития. Еще меньше данных о химической природе этих факторов. Известные сегодня факторы дифференцировки можно разделить на несколько типов. Первым из них, действующим уже на самых ранних стадиях, следует назвать ооплазматическую сегрегацию.
Неоднородность цитоплазмы яйца у большинства видов обнаруживается еще в оогенезе и внешне выражается в неравномерном распределении желтка, пигмента, положении ядра и др. Эти различия создают одну анимально-вегетативную ось, обычно соответствующую передне-задней оси будущего зародыша. Однако у некоторых животных, например, асцидий, неоплодотворенное яйцо совершенно изотропно, т. е. не имеет никаких видимых отличий, позволяющих определить полюса и оси. Если такое яйцо разрезать пополам в любой плоскости, то из каждой половины после ее оплодотворения разовьется по одному целому зародышу (один нормальный диплоидный из той половины, где окажется женское ядро, другой — гаплоидный). Основные процессы, определяющие разделение цитоплазмы яйца на зоны — ооплазматическую сегрегацию, происходит после оплодотворения перед первым делением дробления. У амфибий это выражается в появлении серого серпа — будущей мезодермальной области — и в обособлении эктодермальной зоны над серпом и энтодермальной под ним. У асцидий образуется несколько таких зон (5–6), у червей и моллюсков создается довольно сложная картина, образованная полярными плазмами и другими участками яйца, имеющими свои особенности. В ходе делений дробления клеточные стенки обособляют ооплазматические зоны друг от друга, как бы фиксируя их сегрегацию, а ядра клеток оказываются окруженными цитоплазмой, несколько отличающейся в разных частях бластулы. Предполагается, что именно эти отличия определяют различия дифференциальной активности генов в этих частях и тем самым направление дифференцировки.
Механизмы ооплазматической сегрегации почти неизвестны. Расположение некоторых ее элементов, например, распределение желтка, вначале определяется положением ооцита в яичнике, а затем удерживается силой тяжести, так как желточные гранулы тяжелее других компонентов яйца. Появление серого серпа после опытов А. Кертиса, пересадившего тонкий поверхностный слой яйца, связывают со структурой поверхности. Многочисленные опыты по центрифугированию яиц также показали, что искусственные перемещения компонентов цитоплазмы обычно обратимы и что наиболее жесткой структурой в яйце является его поверхностный слой — кортекс. Вместе с тем сами различия между зонами яйца, по-видимому, невелики; они могут легко смещаться, восстанавливая каким-то образом искусственно нарушенные количественные соотношения между ними. Так, если из яйца или бластулы лягушки удалить часть эктодермальной зоны, зародыш развивается вполне пропорциональным, хотя и соответственно меньшего размера. Еще более это заметно при разделении бластомеров: из каждого бластомера, если он содержит все три зоны (экто-, мезо- и энтодермальную), хотя бы и в нарушенных пропорциях, также образуется нормальный зародыш.
В пределах каждой из зон можно обнаружить некоторые количественные различия, также влияющие на судьбу клеток, получивших эту цитоплазму. Так, в зоне серого серпа можно выделить центральный участок, с которого начинается гаструляция и который дифференцируется в хорду и оказывает индуцирующее влияние на эктодерму. По сторонам от этой зоны располагаются участки серого, серпа с несколько иными свойствами, которые впоследствии определяют дифференцировку мезодермальных производных.
Допускают, что в яйце морского ежа существует два противоположно направленных градиента — постепенные изменения свойств, идущие от анимального полюса к вегетативному и обратно. И хотя в нем вообще трудно различить обособленные зоны, а о природе ооплазматических различий почти ничего не известно, можно полагать, что последние состоят в различиях концентрации веществ, связанных со структурами цитоплазмы яйца, что и определяет их локализацию. Если действительно будет доказано, что различий в концентрации достаточно, чтобы направить дифференцировку по иному пути, это будет означать, что такие факторы морфогенеза малоспецифичны.
Вторым фактором дифференцировки является индукция — химическое влияние одного зачатка на другой. Примеров индукции сейчас известно довольно много, но ни в одном из случаев точная природа индуцирующего вещества не была установлена. Дольше и тщательнее других изучался механизм первичной индукции — образования нервной ткани воздействием зачатка хордо-мезодермы на эктодерму, причем установлено, что в этом случае индуцирующее влияние может быть осуществлено при помощи веществ, возможно, и близких по своей химической природе, но полученных из источников, весьма далеких от естественного индуктора (см. главу 14).
Недавно Г. Тидеман (1967) выделил из ткани цыпленка белок с молекулярным весом 25 000, обладающий индуцирующим действием на эктодерму лягушки. Весьма вероятно, что действующим началом других индукторов также являются белковые вещества той или иной природы. Можно полагать, что при индукции нервной системы активным оказывается целый класс веществ, имеющих, очевидно, что-то общее с тем естественным индуктором, который синтезируется в клетках зачатка хордо-мезодермы лягушки и действует на ее эктодерму. Биохимические исследования, проведенные различными исследователями за последние десять лет, позволили сделать вывод, что индукционные вещества могут обладать различной природой, а их специфичность не может быть особенно высокой. Раскрытие природы этих веществ и их роли в индукционных процессах — дело ближайшего будущего.
Другие факторы дифференцировки изучены значительно хуже, но и в этих случаях очевидна их невысокая специфичность. Так, по данным Г.В. Лопашева (1963), дифференцировка клеток зачатка глаза на сетчатку и пигментный эпителий может, по-видимому, определяться различными условиями обмена: распластанные клетки, обладающие возможностью свободного обмена со средой, дифференцируются в пигментный эпителий, клетки же, находящиеся внутри зачатка, — в сетчатку. Аналогичным образом на дифференцировку оказывают влияние также такие факторы, как концентрация клеток, наличие волокон коллагена и др.
Гормоны формально нельзя отнести к факторам дифференцировки. Равномерно распределяясь по организму, они сами по себе не могут увеличить дифференцированность, т. е. определить разные направления развития у одинаковых клеток. Выяснилось, однако, что гормоны оказывают свое влияние не на все ткани, а лишь на способные на них реагировать, (так называемые органы-мишени), причем в одном организме могут оказаться ткани, по-разному отвечающие на действие одного гормона. Характер действия гормонов в принципе не отличается от действия других морфогенетических агентов: они также являются причиной перехода клеток к новым этапам развития посредством включения новых генов.
Природа гормонов, как правило, хорошо известна, и механизмы их действия могли бы служить хорошей моделью для изучения механизмов дифференцировки вообще. Однако даже в отношении гормонов нельзя, по-видимому, говорить о едином механизме, ибо сама природа этих веществ крайне разнообразна (от сложных белков до тироксина, имеющего достаточно простое строение). Изучение точек приложения действия гормонов также дало различные результаты. Для одних (белковых) в ряде случаев показано действие на поверхность клетки, для других (стероиды) — на клеточное ядро. Многие из них прямо или косвенно изменяют функции клетки через хромосомный аппарат: их действие обычно сопровождается измопонлом характера синтеза иРНК.
Бели непосредственное влияние факторов дифференцировки на ядра удалось обнаружить не во всех случаях, то зависимость ядра от цитоплазмы установлена сейчас достаточно хорошо. Это особенно четко показано в опытах Дж. Гердона (1968) по трансплантации ядер в ооцит или зрелое яйцо Xenopus laevis.
Из этих опытов следует, что синтез ДНК и начало или прекращение синтеза РНК однозначно определяется цитоплазмой.
Механизмы дифференциальной активности генов.
Таким образом, общая схема реализации наследственной информации кажется в принципе понятной; факторы дифференцировки вызывают дифференциальную активность генов, обусловливающую синтез специфических белков, которые и определяют свойства дифференцирующихся клеток. Одной из самых актуальных проблем оказывается проблема специфического включения генов.
Количество генов в геноме многоклеточных организмов велико, оно достигает порядка десятков и сотен тысяч (если судить по количеству ДНК, то число генов у высших организмов составляет несколько миллионов). В связи с этим выбор одного гена из ста тысяч других — уже достаточно сложная проблема.
Прежде всего, каждый ген (или группа совместно включенных генов — оперон) должен иметь «индекс», по которому он опознается. Для ДНК единственным способом записи информации является порядок нуклеотидов, число которых в таких индексах должно быть не менее десяти. Для того чтобы отличить один индекс от другого, само вещество, которое отыскивает и включает тот или иной ген, должно быть достаточно сложным и нести соответствующее количество информации. По-видимому, это должен быть один класс веществ, способных отличать одну нуклеотидную последовательность от другой. Такими свойствами обладают только сложные белки. Поэтому весьма маловероятно, чтобы разнообразные и обычно не очень специфичные факторы дифференцировки действовали на гены непосредственно. Введение белка-посредника само по себе также еще не решает проблемы, так как количество информации, которое получает клетка от действия малоспецифичного фактора, недостаточно для того, чтобы включить нужные гены.
Основная заслуга в разработке схемы регуляции работы генов принадлежит французским микробиологам Ф. Жакобу и Ж. Моно[200] (см. главы 23 и 24). И хотя она выведена для бактерий, а у многоклеточных пока не описана, ее основные принципы, видимо, общи всему живому, подобно записи наследственной информации в ДНК.
В ходе развития идет прогрессивная дифференцировка, т. е. каждый более общий зачаток под локальным действием факторов дифференцировки делится на более частные зачатки. Каждая дифференцированная клетка проходит, таким образом, ряд последовательных этапов, входя в состав все более мелких зачатков и все более специализируясь.
Способность данной ткани к дифференцировке обозначается термином компетенция. Обычно клетки обладают множественной компетенцией, выбор которой определяется действием того или иного фактора дифференцировки. Один и тот же фактор, например, гормон, в тканях, обладающих разной компетенцией, вызывает совершенно разные дифференцировки. Состояние множественной компетенции, в соответствии со схемой Жакоба и Моно, можно представить как активность нескольких генов-регуляторов и наличие нескольких белков-дерепрессоров. В зависимости от того, какой эффектор действует на данную клетку, она включает ту или иную группу генов, определяющих следующий этап дифференцировки. Переход к новому этапу дифференцировки означает и появление новых компетенций, а это предполагает включение наряду со структурными генами и новых генов-регуляторов (старые при этом, очевидно, выключаются).
Согласно схеме Жакоба и Моно, факторы дифференцировки в целом малоспецифичны, но они могут включить строго специфичные гены, если действуют в качестве эффектора на клетку, компетентную к этой дифференцировке. Действие одного из факторов означает реализацию одной из ранее предопределенных возможностей развития. Дифференцированная клетка является, таким образом, продуктом ряда последовательных действий различных факторов дифференцировки, постепенно приводящих ее к достигнутому состоянию.
Такова в самом общем виде во многом пока гипотетическая схема развития с ее регуляцией на молекулярном уровне. Для окончательного выяснения механизма дифференциальной активности генов потребуются конкретные исследования как каждого из элементов схемы, так и ее общего соответствия действительности.
Последующие этапы реализации наследственной информации.
Хотя проблема дифференциальной активности генов является сейчас центральной в биологии развития, ее решение еще не означало бы, что познаны все механизмы развития. Активность специфических генов и синтез соответствующих иРНК являются только первым этапом реализации генетической информации, за которым следует синтез белка (см. главу 23).
Еще недавно считали, что синтез белка однозначно и целиком определяется появлением соответствующих матриц иРНК. Однако выяснилось, что это не так: для многих случаев было убедительно показано, что синтез белка при дифференцировке происходит иногда через значительный промежуток времени после синтеза РНК. Это особенно хорошо видно, когда синтез РНК прекращается — в таких, например, случаях, как эритропоэз, при котором синтез гемоглобина идет после завершения синтеза РНК и инактивации ядра. В самом раннем развитии, как уже говорилось, синтезы РНК отсутствуют, в то время как синтез белка достаточно активен. Наконец, такая сложная дифференцировка, как сперматогенез, также происходит при полной неактивности ядер, но при постоянном синтезе белков. Существенно, что в этом случае синтез белка не только закономерно распределен во времени и изменяется количественно, но, по-видимому, может изменяться и качественно, т. е. синтез одних белков сменяется синтезом других. Так, показано, что при сперматогенезе в конце дифференцировки начинается и завершается синтез специфических богатых аргинином гистонов, входящих в состав дезоксирибонуклеопротеида (ДНП) головки спермия.
Таким образом, установлено, что после образования иРНК на специфических генах синтез белка (трансляция) также регулируется в ходе дифференцировки по особой программе. Недавно был найден один из элементов механизма такой регуляции. Молекулы иРНК после синтеза, вероятно еще в ядре, образуют комплекс с особым белком и далее длительное время могут находиться в таком связанном состоянии, прежде чем войдут в состав полирибосом (или полисом, как их принято теперь именовать), на которых синтезируется белок. В цитоплазме эти комплексы были названы А.С. Спириным (1966) информосомами (см. также главу 23). О характере их функции пока ничего не известно; очевидно, однако, что их постепенное включение в процесс синтеза белка должно регулироваться особым образом. Совершенно неясными остаются также механизмы, определяющие последовательность синтеза разных белков, так как для этого необходимо, чтобы разные информосомы как-то отличались друг от друга и вовлекались в; процесс трансляции в определенном порядке.
Синтез специфических белков еще не означает завершения процесса дифференцировки. Появление соответствующих белков-ферментов определяет лишь метаболические свойства клеток. Но дифференцированные клетки характеризуются также рядом морфологических свойств — формой, размерами, характером внутриклеточных структур, взаимодействием с окружающими клетками. Образование ряда внутриклеточных структур, таких, как миофибриллы, коллагеновые волокна и т. д., может быть сведено к синтезу соответствующих белков, хотя и в этих случаях образование надмолекулярной организации этих структур требует специального объяснения.
Сложнее образование таких клеточных органелл, как рибосомы и клеточные мембраны (см. также главы 10 и 23). В некоторых случаях известно, например, что формирование этих надмолекулярных структур происходит путем самосборки. Такие процессы описаны для рибосом (А.С. Спирин, Л.П. Гаврилова, 1968), некоторых элементов митохондриальных структур и клеточных мембран. Это означает, что белки, входящие в состав этих субклеточных структур, обладают не только способностью нести свою функциональную нагрузку, но и способностью к самосборке. Однако у некоторых органелл, например, митохондрий, самосборка не обнаружена. Наоборот, известно, что эти структуры делятся и растут. Эта способность митохондрий хорошо увязывается с их частичной автономностью — способностью к синтезу ДНК, РНК и белка. Однако механизм их удвоения и способы увеличения размеров до сих пор являются нерешенной проблемой.
Особенно существенным для понимания морфогенеза представляются межклеточные взаимодействия, определяющие взаимное расположение клеток и их закономерные перемещения в ходе развития. Поведение этих клеток может быть объяснено через свойства их клеточных мембран. Изменение состава белков, входящих в состав этих мембран, может рассматриваться как путь генетического контроля над морфогенезом. Имеются довольно убедительные данные о том, что именно свойства клеточных мембран определяют межклеточные взаимоотношения. Что же касается того, как белки модифицируют клеточную мембрану и каковы механизмы межклеточных контактов, то эти вопросы остаются еще совершенно открытыми.
* * *
Обозревая будущее современной биологии развития, следует указать основные направления исследований на ближайшие годы. Первым направлением явится, безусловно, изучение механизмов регуляции функции генов (природа факторов дифференцировки, активирующих гены; механизмы непосредственного действия на хроматин; структура межгенных связей в ядре; природа генетической компетенции; системы, поддерживающие стабильность дифференцировки в ряду поколений клеток). Именно от этого направления можно ожидать наибольших результатов, так как в его русле работают сейчас десятки лабораторий во многих странах мира.
Вторым актуальным направлением является исследование механизмов клеточной дифференцировки на посттрансляционном уровне, т. е. процессов, посредством которых вновь синтезированные белки определяют форму, функцию и поведение клеток. Можно думать, что то внимание, которое уделяется таким образованиям, как микротрубочки и мембраны, обеспечит успех и этого направления.
Третьей и, вероятно, наиболее трудной проблемой биологии развития является проблема становления формы отдельных органов и всего организма. Достижения здесь пока еще очень невелики и недостаточно ясны те пути, на которых можно ожидать решения этой проблемы.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК