Возникновение и развитие учения о вирусах бактерий
Открытие вирусов бактерий было подготовлено развитием микробиологии в конце XIX в. Идеи Л. Пастера о бактериальной этиологии инфекций, разработанные в 80-х годах методы культивирования бактерий на плотных и жидких питательных средах, утверждение в микробиологии идей мономорфизма — все это способствовало изучению морфологических и физиологических особенностей бактерий. Среди других феноменов роста бактерий было описано явление их спонтанного лизиса.
Впервые спонтанное растворение бактериальной культуры было обнаружено в 1892 г. В. Крузе и С. Пансини при изучении роста пневмококка. Спустя четыре года русский бактериолог М. Ганкин (1896) сообщил о бактерицидном действии воды Джамны и Ганга на холерного вибриона. Автор обнаружил сохранение бактерицидных свойств воды этих рек после ее пропускания через бактериальный фильтр. Растворение сибиреязвенных палочек в дистиллированной воде описал в 1898 г. Н.Ф. Гамалея, назвавший это явление бактериолизом. Он объяснил его выделением бактериями специфического вещества — бактериолизина. Исследования многих бактериологов показали, что лизис бактерий может быть обусловлен различными факторами (протеолизом, образованием аутотоксинов и др.).
Открытие вирусов бактерий принадлежит английскому бактериологу Ф. Туорту. В 1915 г. он установил, что выделенный им литический агент способен проходить через бактериальный фильтр, оказывать патогенное действие и длительно пассироваться, т. е. отвечал основным критериям вируса, выдвинутым Д.И. Ивановским (1892, 1902). Спустя два года аналогичное открытие сделал канадский бактериолог Ф. д’Эрелль (1917), высказавший со всей определенностью, в отличие от Туорта, гипотезу о живой природе агента и назвавший его бактериофагом.
Второй периодов изучении вирусов бактерий (1917–1938) связан с развитием вирусной теории бактериофагов и формированием представлений о лизогении. Гипотеза д’Эрелля, согласно которой бактериофаг является ультрамикробом (вирусная гипотеза), определила дальнейшее развитие учения о вирусах бактерий. Она поставила два вопроса — какими свойствами живых организмов обладают вирусы бактерий и какие химические и структурные особенности этих вирусов обусловливают их воспроизведение в бактериях?
Идея о паразитарной природе фага, о возможности его применения для лечения и профилактики инфекционных болезней (д’Эрелль, 1919) привлекла к бактериофагу внимание микробиологов всего мира.
Особенно интенсивно исследования по использованию фагов[195] в медицинских целях развернулись в СССР. Так, первый в мире Научно-исследовательский институт бактериофагии был организован в 1935 г. в Тифлисе, а проблемы бактериофагии широко изучались в большинстве микробиологических институтов и лабораторий нашей страны (В.П. Крестовникова, 1930; Н.Ф. Гамалея, 1930; Е.И. Коробкова 1937; 3.В. Ермольева, 1939 и др.).
Наряду с исследованиями, направленными на практическое использование бактериофага, проводились работы по выяснению его природы. Особенно упорно изучал свойства бактериофага Ф. д’Эрелль (1921). Он описал два способа определения числа частиц бактериофага: путем лизиса бульонных культур бактерий при внесении прогрессивно уменьшающихся концентраций бактериофага, вплоть до разведения лизата, когда вносятся единичные частицы фага («конечное разведение»), и по числу образуемых «стерильных» пятен при посеве разведения лизата на бактериальный газон на плотной питательной среде (метод «стерильных» пятен). Этот второй метод в модификации А. Грациа (1936) широко применяется и сейчас. Изучая взаимодействие бактериофага и бактерий, д’Эрелль отметил ряд этапов в этом процессе: прикрепление фага к поверхности клетки, внедрение его внутрь клетки и размножение в ней, завершающееся лизисом клетки и выходом из нее 15–25 частиц бактериофага. Ему удалось наблюдать в темном поле микроскопа лизис бактериальной клетки и появление 15–25 мельчайших «блестящих» точек. Число их точно соответствовало количеству стерильных пятен, образуемых при высеве лизата на бактериальный газон. На основании этого д’Эрелль сделал верный вывод, что эти «блестящие» точки являются частицами бактериофага. Он привел также ряд других доказательств корпускулярности бактериофага: способность его проходить через бактериальные фильтры определенной пористости, осаждение в жидкости при длительном стоянии и др. Д’Эрелль отметил изменчивость бактериофага (объясняя ее способностью фага к адаптации), а также автономность антигенного состава фага. Д’Эрелль считал, что существует только один вид бактериофага — Bacteriophagum intestinale, являющийся внутриклеточным паразитом бактерий.
Представления д’Эрелля разделялись далеко не всеми микробиологами. Они противоречили господствовавшей в биологии концепции, согласно которой клетка является минимальной единицей жизни. Зависимость размножения фага от роста бактерий, обнаружение у фага нечувствительности к действию антисептиков, отсутствие у него обмена веществ привело к появлению гипотез о неживой природе фага. Вирусной гипотезе фага был противопоставлен ряд других: «неживой экзогенной природы агента» (Т. Кабешима, 1920; А. Кутнер, 1921), «неживого агента бактериального происхождения», «извращенного обмена веществ» (Ж. Борде, М. Чиука, 1920; В. Дэвисон, 1922; Р. Дерр, 1922; Е. Джоруп, 1925). Развернулись острые и продолжительные научные дискуссии между сторонниками живой и неживой природы бактериофага, стимулировавшие экспериментальные исследования.
Наибольшее значение для развития вирусной теории фагов имели работы австралийского бактериолога Ф. Бернета (1929–1936) и венгерского биохимика М. Шлезингера (1932–1936). Вернет установил, что существуют различные фаги, отличающиеся по своим физическим, физиологическим и серологическим свойствам. Он показал, что адсорбция фага на бактерии является специфическим процессом и что фаг может адсорбироваться только определенным участком поверхности клетки (рецептором). Поэтому каждый фаг активен только в отношении ограниченного круга штаммов бактерий. Вернет (1936) описал мутанты бактериофагов. Он разработал также метод определения размножения бактериофага в отдельных бактериальных клетках и доказал, что в зараженной бактериальной клетке накапливаются бактериофаги, которые при лизисе клетки внезапно выделяются в окружающую среду. Шлезингер (1932) путем определения скорости осаждения частиц фагов при центрифугировании определил их размеры (20–90 нм). Сходные величины были установлены У. Элфордом и К. Эндрюсом (1932) при пропускании фагов через бактериальные фильтры с градуированным диаметром пор. Шлезингер (1933) первым установил, что бактериофаг представляет собой нуклеопротеид, состоящий из примерно равных количеств белка и нуклеиновой кислоты, которую он в 1936 г. идентифицировал с помощью реакции Фёльгена как ДНК. Шлезингер (1936) отметил сходство состава активного препарата фага и Хроматина.
Таким образом, к концу 30-х годов было установлено, что бактериофаги характеризуются автономностью, строго определенными размерами, отличаются от бактерий физиологическими, серологическими свойствами, химическим составом (нуклеопротеиды) и в этом отношении сходны с вирусами растений и животных. Выделение ВТМ в виде кристаллов, обладающих всеми свойствами вируса (У. Стенли, 1935), и выявление его нуклеопротеидной природы (Ф. Боуден, Н. Пири, 1936) указывало на то, что способность вирусов к размножению связана с последней.
Развитие представлений о лизогении.
Открытие лизогенных бактерий, способных подвергаться спонтанному лизису, привело к появлению гипотез о бактериальном происхождении фага. Д’Эрелль и другие сторонники вирусной природы фага отрицали существование лизогенных бактерий, считая, что они лишь загрязнены фагом. Однако вскоре были установлены факты, свидетельствующие о существовании лизогенных бактерий. В 1921 г. О. Байль обнаружил спонтанный лизис бактериальной культуры, ранее не проявлявшей признаков лизиса. Из единичных колоний Е. coli были выделены клоны, одни из которых продуцировали фаг, а другие не обладали этим свойством (О. Байль, 1925; Ж. Борде, 1925). Наконец, Е. Мак-Кинли (1925) установил сохранение лизогенными бактериями способности образовывать фаг даже после продолжительного выращивания в присутствии антифаговой сыворотки. Это доказало независимость спонтанного лизиса от наличия в культуре фага.
Мысль об отсутствии противоречия между существованием лизогенных бактерий и вирусной природой фага впервые высказал Вернет (1929). Стойкое сохранение признака лизогенности в культурах лизогенных бактерий в условиях, исключающих существование свободного фага, а также установленный им факт отсутствия инфекционных частиц фага в разрушенных лизогенных клетках он объяснил тем, что в лизогенных клетках фаг находится в неинфекционной форме в виде зачатка, способного под действием невыясненных причин превращаться в фаг. Оставалась неясной природа «зачатка»: является ли он латентным вирусом или структурой, связанной с генетическим аппаратом клетки. Ответ на этот вопрос дали исследования голландца Л. Доорен де Ионга (1931), установившего, что споры лизогенной культуры Вас. megaterium сохраняют свойство лизогенности при 100°. Поскольку фаги инактивируются уже при 75°, Доорен де Ионг высказал мысль, что «зачаток» не может быть латентным вирусом и что фаг образуется в лизогенных бактериях de novo. Однако правильный вывод Доорен де Ионга был поставлен под сомнение в связи с выявлением терморезистентности обезвоженных фагов (А. Веддер, 1932).
Изучение лизогении послужило отправным пунктом для формирования гипотез о наследственной природе этого явления. Первая из них была высказана Ж. Борде[196] в 1923 г., который пришел к идее «инфекционной наследственности» лизогенных бактерий. Однако он не связывал с понятием наследственности определенные материальные структуры, а подразумевал под этим явлением «динамическое равновесие» протекающих в бактериях процессов.
Хромосомная теория наследственности нашла свое отражение в гипотезах О. Байля (1925) и особенно Е. Вольмана (1928). Развивая идеи Борде об инфекционной наследственности, Вольман впервые связывает лизогению с наличием материальных носителей «наследственных факторов», характеризующихся простотой организации и способных передаваться во внешней среде. Он постулирует наряду с хромосомным механизмом передачи наследственных факторов существование особого механизма их передачи — посредством окружающей клетку среды («инфекционная наследственность»). Гипотеза инфекционной наследственности, связавшая такие различные феномены, как наследственность и инфекция, привела в дальнейшем к концепции эписом. В 1933 г. супруги Е. и Е. Вольман высказали гипотезу, что фаг существует в двух формах — инфекционной и неинфекционной. По их мнению, при литической реакции происходит чередование инфекционной и неинфекционной фаз в цикле размножения фага. Они предполагали, что фаги в лизогенных бактериях образуются при каждом делении клетки из структур, их не содержащих. Сохранение способности образовывать фаг в лизогенных бактериях осуществляется, по мнению авторов, благодаря наследственному аппарату клетки.
Гипотеза чередования инфекционной и неинфекционной фаз в отношении лизогенных бактерий не подтвердилась, но она способствовала открытию неинфекционной фазы в цикле размножения фага. В 1938 г., американский биохимик Дж. Нортроп, прославившийся своими работами по получению протеолитических ферментов в кристаллической форме (Нобелевская премия, 1946), на основании произвольной аналогии между бактериофагом и ферментом желатиназой, секретируемым культурой лизогенной бактерии, высказал гипотезу, что фаги выделяются лизогенными бактериями в процессе их роста (гипотеза «секреции»). Эта гипотеза вследствие высокого научного авторитета Нортропа получила признание у большинства его современников.
Удобство экспериментов с фагами и такое же высокое содержание ДНК в их нуклеопротеиде, как и в хромосомах высших организмов (М. Шлезингер, 1936), вызвало огромный интерес к репродукции фагов как модели для выяснения природы гена. Именно удобство такой модели побудило физика-теоретика М. Дельбрюка заняться в 1939 г. изучением вирусов бактерий.
С деятельностью Дельбрюка связан третий период в изучении фагов (1939–1953), который характеризуется формированием основ современного учения о вирусах бактерий. Этот период ознаменован фундаментальными исследованиями размножения фагов, их генетических свойств, морфологии частиц, раскрытием природы лизогении, разрешением противоречий между вирусной и генной теориями, а также открытием генетической роли ДНК фагов.
В 1939 г. М. Дельбрюк совместно с Э. Эллисом разработали метод изучения одиночного цикла размножения фагов, который лег в основу их современных количественных исследований. Применение этого метода позволило выявить в цикле размножения фага три этапа: адсорбцию фага бактерией, скрытый период и период лизиса («взрыва» клетки), сопровождающийся выделением нескольких десятков частиц фага. Было доказано, что обязательным условием высвобождения фага из бактериальной клетки является ее лизис. Но оставалось неясным, что происходит в зараженной бактериальной клетке в скрытый период.
Применение генетических методов дало возможность обнаружить рекомбинанты в потомстве фагов, полученном при заражении бактерий мутантами двух близкородственных фагов (М. Дельбрюк, В. Бейли, 1946; А. Херши, 1946)[197]. А. Дёрман установил, что после заражения клетки фаг переходит в неинфекционную форму, интенсивно размножаясь и давая рекомбинанты, которые он назвал вегетативным фагом.
Открытие рекомбинантов у фагов положило начало новому направлению — генетике фагов. Применение генетических методов позволило А. Херши и Р. Ротман (1948, 1949) построить первую генетическую карту фага Т2, представленную тремя группами сцепления.
Важное значение имело применение при исследовании фагов электронной микроскопии, меченых атомов и других методов микроанализа. Электронномикроскопические исследования (С. Луриа, Т. Андерсон, 1942) вскрыли сложное строение частицы фага Т2, состоящей из головки и отростка. Присоединение фага к поверхности клетки только отростком (Т. Андерсон, 1952) указывало на то, что он представляет собой структуру, обеспечивающую адсорбцию фага. О локализации ДНК в головке фага и ее значении свидетельствовали опыты по образованию «теней» — пустых белковых оболочек фага, освобожденных от ДНК осмотическим шоком (Р. Херриот, 1951) и способных убивать клетки хозяина беи размножения в них.
Роль белка и ДНК фага при инфицировании бактерий была установлена при помощи изотопов С14 и N15 А. Херши и М. Чейз (1952). Авторы выявили в механизме заражения бактерий фагом два основных принципа. Первым этапом размножения фага является освобождение его ДНК из белкового чехла, который в дальнейшем перестает функционировать. Одной ДНК достаточно, чтобы вызвать инфекцию. Тем самым было показано, что фаг как таковой не проникает в бактерию и что размножению фага дает начало не родительская частица, а ее ДНК.
Эта работа явилась вехой в развитии учения о вирусах бактерии. Она раскрыла функциональную роль компонентов частицы фагов, механизм заражения бактерий вирусом и убедительно доказала генетическую роль ДНК вирусов бактерий. Хотя значение ДНК как наследственного вещества было установлено еще в 1944 г. при изучении трансформирующего агента пневмококка, только эта работа привела к резкому изменению взглядов на природу гена. Она поставила также ряд важнейших вопросов, определивших последующее развитие вирусологии: каков механизм репликации ДНК вирусов бактерий, каким образом вирусная ДНК определяет синтез специфических вирусных белков?
Расшифровка природы лизогении.
Несоответствие гипотезы «секреции» Нортропа фактам, установленным в 40-х годах Дельбрюком, привело к дискредитации не только этой гипотезы, но и самого феномена лизогении, задержав развитие этой проблемы на 10 лет. Изучение лизогении было возобновлено в 1949 г. в институте Пастера французскими учеными А. Львовым и А. Гутман. В 1950 г. они установили сохранение у единичных клеток лизогенного штамма бактерий в отсутствие бактериофага признака лизогенности в течение 19 генераций, доказав тем самым наследственную природу лизогении. Этот факт нельзя было отнести за счет адсорбированных частиц фага, так как в этом случае их число составило бы 219 и они заняли бы объем, во много раз превышающий размеры клетки. Львов и Гутман раскрыли также механизм образования фага лизогенными бактериями, показав, что фаг всегда выделяется только в результате лизиса клетки-хозяина. В том же году А. Львов, Л. Симинович и Н. Кьелдгаард установили способность ультрафиолетовых лучей индуцировать лизис лизогенных бактерий. В 1953 г. Львов создал унитарную концепцию лизогении, в которой он, так же как и ранее Вернет, объяснял все свойства лизогении бактерий наличием в них неинфекционного зачатка, названного им профагом (Нобелевская премия, 1965). Принципиально новым в гипотезе Львова является взгляд на профаг как генетический компонент фага, способный индуцироваться под действием ультрафиолетовых лучей. Профаг интегрирован с генетическим аппаратом клетки и продуцируется координированно с ним. Качественное различие в поведении профага и неинфекционной формы фага в случае продуктивной реакции (гонофага) состоит в том, что первый никогда не размножается, а гонофаг размножается, переходя в вегетативную фазу жизненного цикла, завершающуюся образованием инфекционных частиц фага. Различие в поведении профага и гонофага автор связывает с блокированием в профаге генов, ответственных за продуктивную реакцию. При лизогенизации происходит редукция генома фага в определенном участке хромосомы бактерии. Превращение профага в гонофаг при индукции Львов объясняет разрывом слабой связи между профагом и бактериальной хромосомой. Все фаги по их способности вызывать продуктивную или лизогенную реакцию он подразделяет на вирулентные и умеренные. Концепция Львова была по существу эвристической.
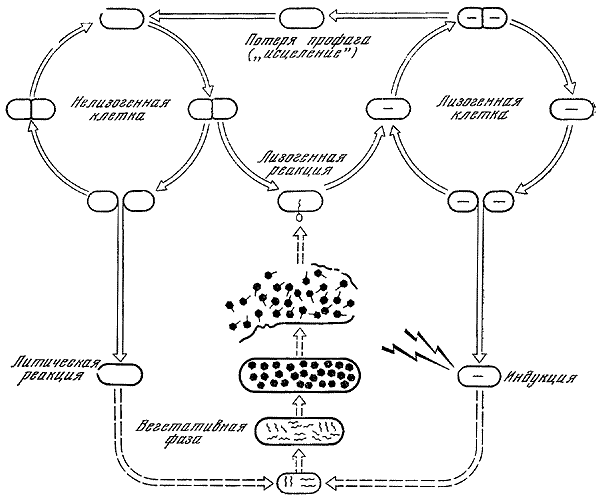
Общая схема лизогении (по А. Львову).
Экспериментальная проверка этой концепции стала возможна в результате открытия Э. Ледерберг (1951) лизогенности у штамма К12 Е. coli, способного осуществлять конъюгацию, сопровождающуюся образованием рекомбинантов (Дж. Ледерберг, Э. Тейтум, 1946)[198] и выделением ею умеренного фага, названного лямбда (фаг ?). Это открытие создало основу для систематического изучения лизогении.
В 1951 г. В. Фримен обнаружил явление лизогенной конверсии — образование токсигенных штаммов дифтерийной палочки из нетоксигенных после контакта последних с умеренными дифтерийными фагами. Приобретение бактерией новых наследственных признаков в результате лизогенной конверсии связано, видимо, с внесением новой генетической информации фага, поскольку при утрате профага клетка теряет приобретенные признаки (см. также главу 7).
В 1952 г. Н. Циндер и Дж. Ледерберг открыли феномен трансдукции — направленного переноса умеренным фагом генетической информации от бактерии-донора к бактерии-реципиенту. При трансдукции происходит перенос одного из признаков бактериальной клетки — способности синтезировать какую-либо аминокислоту или сбраживать тот или иной углевод. Приобретение трансдуцированной бактерией только селективных признаков указывало на способность фага захватывать лишь незначительную часть генома бактерии-донора (см. также главу 7).
В 1953 г. Б. Стокер, Н. Циндер и Дж. Ледерберг выявили возможность переноса у сальмонелл трансдуцирующим фагом от одной бактерии к другой двух генов, один из которых определяет наличие жгутике, а другой — его антигена. Трансдукция двух рядом расположенных генов указывает на их тесное сцепление и, наоборот, обособленный перенос генов свидетельствует о расположении их в хромосоме относительно далеко друг от друга. Таким образом, феномен трансдукции явился важным инструментом определения локализации генов в хромосомах бактерий и построения их генетических карт.
Четвертый период (с 1953 г.) характеризуется появлением новых направлений — молекулярной биологии и молекулярной генетики вирусов бактерий. Открытие генетической функции ДНК стимулировало исследования ее структуры. Предложенная Дж. Уотсоном и Ф. Криком (1953) модель строения молекулы ДНК в виде двойной спирали и установление принципа комплементарности ее оснований объяснили генетические свойства ДНК фагов — способность к репликации, мутированию и рекомбинации — и позволили сделать важные предсказания, определившие развитие молекулярной биологии вирусов бактерий. Так, на основании принципа комплементарности оснований ДНК Уотсон и Крик постулировали полуконсервативный механизм ее репликации (см. главу 24). Репликация ДНК фагов Т-серии, как показала А. Роллер (1961), осуществляется при помощи ферментов ДНК-полимераз (А. Корнберг, 1959). Точный механизм ее еще не известен. Р. Окасаки и другие (1968) указывают, что при репликации образуются короткие отрезки ДНК, которые сшиваются между собой ферментом ДНК-лигазой.
Открытие фага ?Х174, содержащего однонитчатую ДНК (Р. Синсхеймер, 1959), не только не опровергло, но, наоборот, подтвердило универсальность полуконсервативного механизма репликации ДНК у вирусов бактерий. Оказалось, что после проникновения в клетку одноцепочечной ДНК фага ?Х174, так называемой «плюс»-цепи, на ней формируется комплементарная ей «минус»-цепь и в результате образуется двухцепочечная репликативная форма. «Минус»-цепь и служит матрицей для синтеза информационной РНК фага ?Х174 (Р. Синсхеймер, 1968).
В 1968 г. М. Гулиан, А. Корнберг и Р. Синсхеймер, используя препараты ДНК-полимеразы и лигазы из Е. coli, осуществили репликацию ДНК фага ?Х174 de novo.
Генетические исследования с использованием большого числа различных мутаций фагов Т2 и Т4 показали, что все их гены имеют одну группу сцепления (Р. Стрейзингер, В. Брюс, 1960). В 1963 г. Р. Стрейзингер, Р. Эдгар и Г. Денхардт при тригибридном скрещивании различных мутантов фага Т4 обнаружили, что между генетическими локусами, расположенными в крайних точках линейной карты, рекомбинанты не образуются. Отсюда они сделали вывод, что генетическая карта этого фага представляет кольцо. Применение условно-летальных мутантов, открытых у фага Т4, соответствующие мутации которых располагаются во всех секторах карты, позволило получить более точное представление о генетической карте фага Т4.
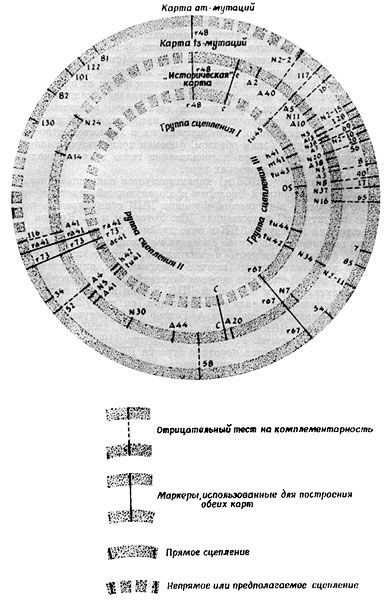
Кольцевая генетическая карта фага Т4 (по Г. Стенту, 1971).
Построена на основе сравнительного анализа сцепления на «исторической карте» и на картах условнолетальных am- и ts-мутаций.
Важное значение для развития молекулярной генетики вирусов бактерий имели работы С. Бензера (1955), установившего тонкое строение гена rII фага Т4. Он показал, что этот ген состоит из двух функциональных участков, названных им цистронами А и В, которые содержат по 1000-15 000 нуклеотидов. Каждый цистрон состоит из большого числа единиц мутаций (мутонов) и рекомбинаций (реконов). Мутон, по мнению автора, соответствует одному нуклеотиду, а рекон — шести.
Таким образом, работы Бензера позволили представить ген и его компоненты в виде определенного числа нуклеотидов. Обнаружение в гоне rII фага Т4 двух рядом расположенных цистронов привело к изменению представлений о природе связи между геном и определяемым им признаком. Вместо установленной биохимической генетикой зависимости «один ген — один фермент» получает признание формула «один геи — один полипептид», согласующаяся с данными о наличии в ряде активных белков нескольких полипептидных цепей. Выявление определенного порядка локализации цистронов в области rII фага Т4, контролирующего синтез активного белка, пролило свет на механизм связи между геном и ферментом: линейный порядок расположения цистронов обусловливает последовательный синтез соответствующих полипептидов, входящих в состав активного белка.
Работы Бензера способствовали решению проблемы генетического кода и познанию механизма мутаций. Именно используя область гена rII фага Т4 в качестве модели, Ф. Крик, Л. Барнет, С. Бреннер и Р. Уоттс-Тобин (1961) установили общую природу записи генетической информации для белков, а Э. Фриз (1961), С. Бреннер, Л. Барнет и Л. Оргель. (1961) выяснили природу точечных мутаций (см. главу 24).
В 1961 г. Н. Циндер и Т. Лёб открыли новый класс вирусов бактерий. Они выделили фаги f1 и f2, размножающиеся только в мужских штаммах бактерий (F+ и Hfr). Подобное ограничение обусловлено тем, что для адсорбции этих фагов необходимы F-пили, находящиеся только на поверхности мужских бактерий. Детали механизма проникновения фагов f1 и f2 не выяснены. Вскоре были открыты другие фаги, специфичные к мужским штаммам; многие из них напоминают f1 или f2. С фагом f1 оказались сходны фаги fd, М13 и F12, с фагом f2 — фаги MS2, fr и R27. Поэтому эти два семейства фагов условно обозначают символами f1 и f2.
Фаг f1 оказался мелким фагом, содержащим одноцепочечную ДНК, как и фаг ?Х174. Но в отличие от последнего он содержит вдвое больше белка и имеет форму длинной изогнутой палочки. Механизм репликации ДНК фага f1 такой же, как у фага ?Х174.
Фаг f1 отличается от всех вирусов бактерий способом его выделения из зараженной клетки-хозяина: секретирующие его клетки Е. coli продолжают расти и размножаться и никакого лизиса при этом не происходит. Так, спустя более 20 лет после того, как в опыте с одиночным циклом размножения фага было доказано высвобождение фагов только путем лизиса клетки, оказалось, что сторонники гипотезы «секреции» не так уж сильно ошибались.
Лёб и Циндер (1961) установили, что фаг f2 является мелкой сферической частицей, содержащей одноцепочечную РНК. Знание механизма репликации одноцепочечной молекулы ДНК фага ?Х174 навело авторов на мысль, что в зараженных фагом f2 клетках РНК может находиться в двухцепочечной репликативной форме, что было установлено при помощи меченых атомов и седиментационного анализа. Авторы предложили следующую схему механизма репликации РНК фага f2. Одноцепочечная родительская цепь РНК, так называемая «плюс»-цепь, используется в качестве матрицы для синтеза комплементарной «минус»-цепи; в результате образуется двухцепочечная репликативная форма, «минус»-цепь которой служит матрицей для синтеза «плюс»-цепей РНК. До окончания синтеза первой дочерней «плюс»-цепи на репликативной форме начинается синтез второй, третьей, четвертой дочерних «плюс»-цепей. В итоге репликативная форма превращается в так называемый репликативный промежуточный продукт, состоящий из двухнитчатой РНК и нескольких однонитчатых РНК. На поздних этапах латентного периода содержание репликативной формы и репликативного промежуточного продукта достигает окончательного уровня, число частиц увеличивается, пока процесс репродукции не завершается лизисом клетки.
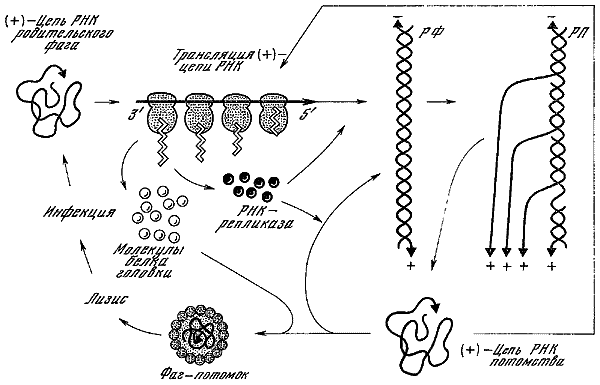
Общая схема внутриклеточного развития РНК-содержащего фага и его репликации (по Г. Стенту, 1971).
РФ — двухцепочечная репликативная форма, состоящая из «плюс»- и «минус»-цепей, синтезируется под действием фермента РНК-репликазы; РП — репликативный промежуточный продукт, состоящий из «минус»-цепи РНК и нескольких «плюс»-цепей, синтезирующихся друг за другом на матричной «минус»-цепи.
В экстрактах клеток Е. coli, зараженных фагом f2, был обнаружен фагоспецифичный фермент РНК-репликаза. Этот фермент оказался способным осуществлять синтез «плюс»- и «минус»-цепей фаговой РНК in vitro в реакционной смеси, содержащей фаговую РНК-матрицу и четыре рибонуклеозидтрифосфата (АТФ, ГТФ, УТФ и ЦТФ).
В 1965 г. И. Харуна и С. Спигельман очистили от нуклеаз ферментный комплекс РНК-репликазы, выделенный ими из экстрактов клеток Е. coli, зараженных фагом Q? (этот фаг близок фагу f2), что позволило им наблюдать репликацию вирусной РНК in vitro. Вновь синтезированная РНК была не только идентична родительской РНК по физическим и химическим свойствам, но и обладала инфекционностью. Проникнув в клетку, она вызывала образование в ней интактных инфекционных частиц фага Q?. Эти исследования позволили понять механизмы репликации РНК-содержащих вирусов растений и животных.
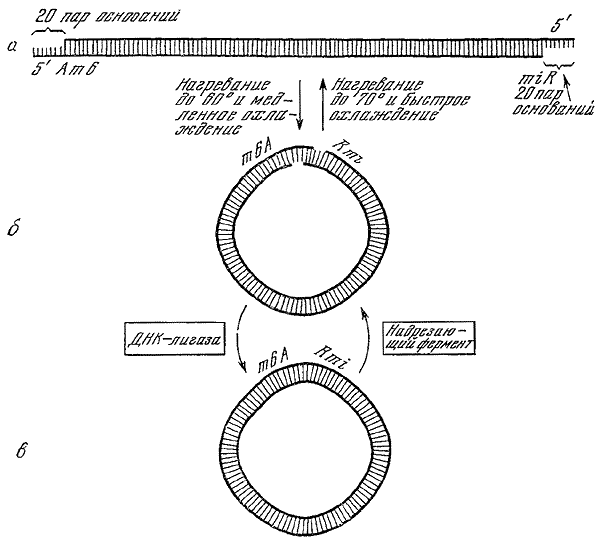
Образование кольцевой формы и «липких концов» ДНК фага % (по Э. Кэмпбеллу, 1969).
а — хромосома инфекционной частицы фага ?. Слева находится ген А, справа — ген R; б — при нагревании раствора ДНК фага до 60° и медленном охлаждении «липкие концы» соединяются друг с другом. При нагревании до 70° «липкие концы» плавятся, и быстрое охлаждение восстанавливает линейную структуру молекулы ДНК фага ?; в — в зоне соединения «липких концов» имеется разрыв в двойной спирали ДНК, который «сшивает» фермент ДНК-лигаза. При вхождении колец дочерней ДНК в головку фага-потомка специальный «надрезающий фермент» делает разрыв в каждой цепи; в результате образуется линейная хромосома с «липкими концами».
В 50-х годах тщательному изучению подвергся фаг ?. Во многих отношениях он оказался сходным с Т-четными фагами. Частица его состоит из головки и длинного отростка. По составу ДНК фаг ? также близок Т-четным фагам (в его ДНК не содержится только гликолизированного оксиметилцитозина). Наибольший интерес представляет открытие «липких концов» — одноценочечных участков длиной в 20 нуклеотидов на каждом из 5’-концов ДНК фага ? (А. Херши, Е. Буржи, Л. Ингрем, 1963). Эти участки комплементарны и поэтому позволяют молекуле ДНК свертываться в кольцо. ДНК внутриклеточного фага представляет собой замкнутое ковалентной связью кольцо, образованное путем «скрепления» липких концов (Е. Янг, Р. Синсхеймер, 1964). В 1967 г. Р. Ву и А. Кайзер расшифровали нуклеотидную последовательность липких концов фага ?. При созревании фаговых частиц кольцевая вегетативная ДНК «перекусывается» ферментом по двум специфическим межнуклеотидным связям в разных полинуклеотидных цепях, что восстанавливает линейную структуру ДНК с липкими концами, которая и служит хромосомой для дочерних инфекционных фаговых частиц.
В 1961 г. Э. Кэмпбелл выделил большое число условно-летальных мутантов фага ?(мутации могут располагаться в разных частях хромосомы). Скрещивая их между собой, а также другие выделенные к этому времени мутанты фага ?, Кэмпбелл построил генетическую карту фага ?, на которой ему удалось идентифицировать 18 генов. Он показал, что гены от А до F ответственны за синтез белка фагового отростка, гены от G до J — за формирование головки, ген R — за синтез лизоцима. Все эти гены в отличие от гена N, контролирующего репликацию ДНК, относятся к «поздним генам».

Генетическая карта вегетативного фага ? (по Э. Кэмпбеллу, 1961).
Гены A-R необходимы для воспроизводства фага в продуктивном цикле. Гены СI, СII и СIII связаны с репрессией продуктивного цикла.
Как показали в 1967 г. К. Тейлор, 3. Храдечна и В. Шибальски, разные гены транскрибируются с одного или другого конца цепи, и транскрипция может идти в противоположных направлениях. В 1969 г. Шибальски установил, что обе цепи ДНК фага ? являются генетически активными. В 1954 г. Ф. Жакоб и Е. Вольман при скрещивании лизогенных мутантов Hfr с нелизогенной бактерией-реципиентом F’ установили так называемое явление зиготной индукции профага. Ее не наблюдалось в случае, когда бактерия-реципиент была лизогенной. На этом основании Г. Бертани (1958) сделал заключение, что зиготная индукция определяется свойствами цитоплазмы клетки-реципиента и что иммунитет лизогенных бактерий к гомологичному умеренному фагу контролируется цитоплазматическим фактором (веществом «иммунности»). В 1957 г. А. Кайзер открыл у фага ? с-мутанты (от англ. слова clear), утратившие лизогенность и поэтому образующие прозрачные стерильные пятна (умеренные фаги образуют мутные стерильные пятна из-за вторичного роста лизогенизированных бактерий). Эти мутанты сыграли важную роль в выяснении механизма лизогении. Кайзер скрестил большое число с-мутантов с другими мутантами по типу стерильных пятен и установил, что все с-мутации расположены в одной области генетической карты фага С, определяющей иммунитет. Он показал, что с-мутации распределяются по трем генам — CI, СII и СIII. Способность лизогенизировать чувствительные клетки в первую очередь контролируется геном СI. Мутация СI блокирует цепь реакций, приводящих к превращению генома фага в профаг. При смешанном заражении чувствительных бактерий фагами ? дикого типа (?с+) и их мутантом CI (?CI) удавалось выделить лизогенные клоны, содержащие оба профага (?с+ и ?CI). Из этого следует, что ген с+ доминирует над CI и что мутанты гена CI имеют какой-то дефект, из-за которого нарушен синтез специфического иммунного репрессора. В 1961 г. Жакоб и Моно предположили, что лизогения является примером регуляции активности гена под действием репрессора. Согласно их взгляду, умеренный фаг продуцирует репрессор, специфически блокирующий функции ранних генов этого фага. Поскольку поздние гены могут функционировать только в присутствии некоторых соединений, контролируемых ранними генами, индукция профага возможна только при разрушении репрессора под действием ультрафиолетовых лучей. Эта гипотеза получила экспериментальное подтверждение. Репрессор фага ?, как показали М. Пташне (1967), и В. Пирота и М. Пташне (1969), является белком, способным in vitro присоединяться к двум операторам (ОЕ, ОR), расположенным на генетической карте фага ? в области иммунитета. Мутации в этих операторах снижают их сродство к репрессорам и позволяют функционировать оперонам, считывающимся в противоположных направлениях, начиная с промоторов PL и РR. Считывающийся влево оперон включает ген N, другой содержит гены, необходимые для репликации ДНК и регуляции синтеза репрессора. Репрессия этих двух оперонов продуктом гена CI предотвращает активность всех генов литического фага, поскольку продукт гена CI требует проявления активности гена Q, который в свою очередь нуждается в транскрипции поздних генов (Н. Хопкинс, 1970; Б. Батлер, X. Эколс, 1970) (см. главу 24). Таким образом, фаг ? явился первым биологическим объектом, у которого были раскрыты механизмы регуляции активности генов, определяющие его развитие.
Гипотеза Львова о включении профага в хромосому клетки-хозяина была подтверждена многочисленными данными. Скрещивая лизогенные и нелизогенные клоны E. coli К12, Е.Л. Вольман (1953) и П. Фредерик (1954) выявили у рекомбинантов расщепление по признаку лизогенности, показав тем самым, что профаг ? ведет себя как ген бактерий. В 1954 г. Р. Эпплярд, скрещивая два родительских штамма Е. coli К. 12, лизогенных по разным мутантам фага ?, доказал, что генетическим детерминантом лизогенности является сам профаг и что он локализован рядом с геном gal4. Локализация профага на хромосоме бактерии была установлена независимо с помощью мутантов Hfr, передающих при конъюгации с бактерией-реципиентом свою хромосому строго ориентированно, начиная с определенного конца (Е.Л. Вольман, Ф. Жакоб, 1951). Профаг ? поступал в зиготу сразу после локуса gal, но перед локусом trp, что указывало на расположение профага между этими локусами. В 1961 г. Г. Келленбергер, М. Зичичи и Дж. Уйгл нашли, что фаг ? с делецией b2 не способен включаться в хромосому бактерий, но может вызывать продуктивную реакцию. Они показали, что область b2 участвует в генетическом обмене между хромосомой фага ? и участком хромосомы бактерии между генами gal и trp. Этот участок получил название локуса прикрепления (локус att?). Мутанты фага ?, не имеющие локуса b2, не могут включиться в хромосому бактерий. В 1962 г. Э. Кэмпбелл предложил модель физического включения (интеграции) хромосомы фага в хромосому клетки-хозяина. Между областью b2 хромосомы фага ?, замкнутой в кольцо, и локусом att? бактериальной хромосомы происходит синапс. Затем хромосома фага разрывается между генами h и с (в области b2), а хромосома бактерии — между генами gal и trp, поело чего гетерологические участки воссоединяются. В результате кроссинговера образуется одна непрерывная генетическая структура с геномом фага ? между генами gal и trp. Таким образом, генетическая карта профага представляет собой перестановку карты вегетативного фага. Модель интеграции профага, предложенная Кэмпбеллом, была подтверждена генетически (Р. Ротман, 1965).
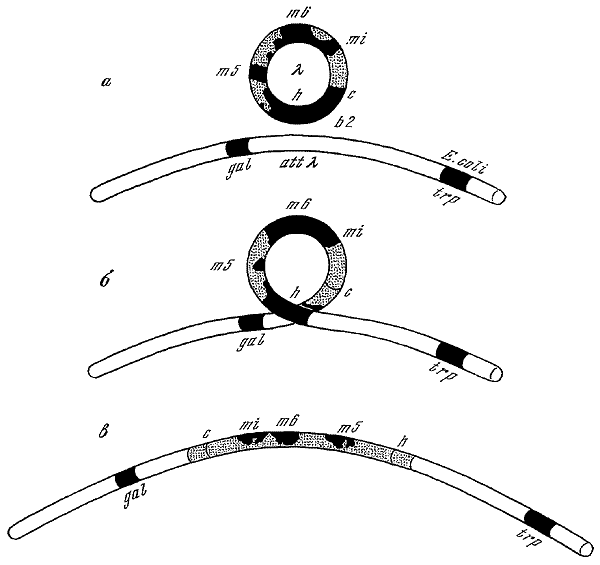
Модель Кэмпбелла (1962) интеграции профага.
a — кольцевая хромосома фага образует синапс с местом прикрепления фага ? (att?) на хромосоме бактерии; б — хромосома фага разрывается между генами h и с (в области b2), а хромосома бактерии разрывается между генами gal и trp; в — в результате кроссинговера образуется одна непрерывная генетическая структура, содержащая геном фага между генами gal и trp.
Исследования лизогении и трансдукции, показавшие изменения свойств клетки-хозяина в результате физического включения в хромосому клетки генома умеренных лизогенирующих и трансдуцирующих фагов, навели на мысль, что вирусный канцерогенез также может быть связан с включением генома онкогенного вируса в хромосому клетки (Р. Дюльбекко, 1960, Л.А. Зильбер, 1961). Это привело к интенсивным исследованиям в последние годы онкогенных ДНК- и РНК-содержащих вирусов.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК