Глава 24 Молекулярная генетика
Исследователями классического периода развития генетики были выяснены основные закономерности наследования и доказано, что наследственные факторы (гены) сосредоточены в хромосомах. Дальнейший прогресс в изучении закономерностей хранения и реализации генетической информации сдерживался по двум причинам. Во-первых, из-за слишком объемных экспериментов, связанных с более глубоким изучением генов, во-вторых, ввиду невозможности понять работу генов без углубленного исследования превращения молекул, вовлеченных в генетические процессы. Достаточно напомнить, например, что для установления дробимости гена исследователям понадобилось только в одном эксперименте просмотреть несколько сотен тысяч дрозофил. Поэтому переход к генетическим исследованиям микроорганизмов, позволивший избежать указанных трудностей, был вполне закономерен. Такой переход к изучению генетических закономерностей на молекулярном уровне осуществился в 50-х годах.
В 1941 г. Дж. Бидл и Э. Тейтум опубликовали короткую статью «Генетический контроль биохимических реакций у Neurospora», в которой сообщили о первых генетических экспериментах на микроорганизмах (см. об этом в главе 7).
В послевоенные годы эти исследования получили широкий размах и проводятся на самых различных биологических объектах.
Тонкая структура гена.
Одно из наиболее существенных достижений молекулярной генетики заключалось в установлении минимальных размеров участков гена, передающихся при кроссинговере[188] подвергающихся мутации и осуществляющих одну фракцию. Оценки этих величин были получены в 50-е годы С. Бензером при изучении так называемых rII-мутаций бактериофага Т4, поражающего кишечную палочку — Е. coli. Эти мутанты дают быстро формирующиеся негативные колонии (бляшки) на бактериальном газоне (отсюда и происхождение термина r-мутанты — от английского слова rapidly).
Бензер разработал удобный тест для разделения r-мутантов на три группы (rI, rII и rIII) по способности образовывать бляшки определенной формы на различных линиях Е. coli. В частности, те r-мутанты, которые дают большие, круглые, прозрачные бляшки на линии Е. coli В и не дают бляшек вовсе на Е. coli К12 (?), являются rII-мутантами. Очевидно, это позволяет предельно просто выделять из популяции rII фагов все обратные мутанты, т. е. восстановившие свою способность лизировать клетки Е. coli К12 (?).
Выделив несколько сотен rII-мутантов, Бензер для построения генетических карт предпринял всевозможные скрещивания их между собой. Основой для картирования служил широко применяемый в классической (а теперь и в молекулярной) генетике метод трехфакторного скрещивания (метод трех точек). В результате Бензеру удалось с большой точностью расположить в пределах одного rII-гена несколько сотен различных мутаций.
Среди различных внутригенных мутаций Бензер выделил два класса: точечные мутации (мутации минимальной протяженности) и делеции (мутации, занимающие достаточно широкую область гена). Одно из предположений о природе делеций (нехваток) основывалось на признании возможности выпадения последовательности нуклеотидов в молекуле той или иной длины. То, что делеции на самом деле обусловлены выпадением участков ДНК, было доказано впоследствии различными способами (Е. Буржи, В. Шибальский и др.). Если в классической генетике считалось, что делеции могут возникать только на хромосомном уровне, то теперь стало ясно, что такие мутации существуют и на внутригенном уровне. Кстати, именно делеции и позволили Бензеру резко ускорить процесс картирования мутаций.
Имея набор делеций, отражающих выпадение участков молекулы ДНК, имеющих разную длину, Бензер пользовался ими как своеобразными линейками для определения локализации картируемого гена.
Установив факт существования точечных мутаций, Бензер задался целью определить минимальную длину участка ДНК, передаваемую при рекомбинации. Оказалось, что эта величина составляет не более нескольких нуклеотидов, т. е. нескольких мономеров полимерной молекулы ДНК. Бензер назвал эту величину реконом. В дальнейшем Ч. Яновский (1964) показал, что рекомбинации могут происходить между смежными парами нуклеотидов в цепях ДНК. Следующим этапом было установление минимальной длины участка, изменения которого достаточно для возникновения мутации, иными словами, определение минимального размера точечной мутации (мутона). По мнению Бензера, эта величина равна нескольким нуклеотидам. Однако последующими тщательными определениями было выявлено, что длина одного мутона не превышает размеров одного нуклеотида.
Оставалось выяснить, что представляет собой на молекулярном уровне третья характеристика гена — управление одной функцией. Для решения этого вопроса Бензер воспользовался ранее разработанным цис-транс-тестом, применив его к вирусам. Этот метод состоит в следующем. Требуется узнать, одинаковые или разные функциональные единицы затронуты у двух мутантов. Для этого первый раз мутации используются в транс-положении, т. е. когда каждая из них расположена в разных гомологичных хромосомах, а второй раз — в цис-положении, когда обе находятся в одной гомологичной хромосоме и вторая при этом нормальна. Если при транс-положении обе мутации принадлежат одной функциональной единице, то эти единицы в обеих хромосомах будут повреждены. Указанные явления могут быть проиллюстрированы при помощи таблиц, заимствованных из работ Бензера (см. стр. 476 и 477).

Генетическая карта спонтанных rII мутаций, выделенных и картированных С. Бензером (1963).
Каждый квадратик представляет собой отдельный мутант.
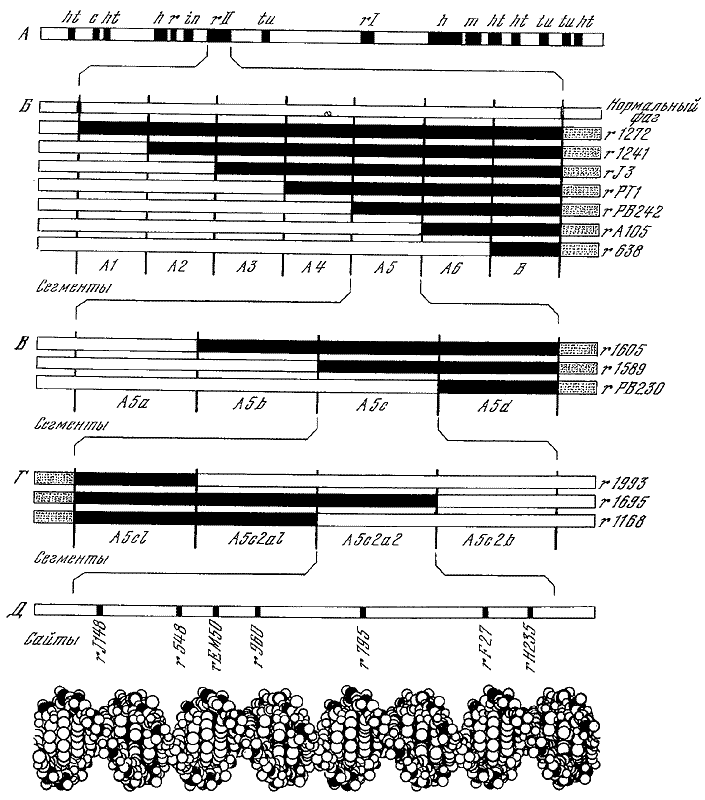
Метод картирования мутаций с помощью делеций различной длины по Бензеру (1961).
А — генетическая карта фага Т4 с указанием отдельных генов; Б — использование семи больших делеций (так называемые «замечательные делеции») для выделения большого сегмента, заключающего искомую мутацию; В — дальнейшее ограничение области, заключающей мутацию, в пределах более мелкого сегмента; Г — дальнейшее сушение области, заключающей мутацию, с помощью менее протяженных мутаций; Д — точное картирование мутаций, попавших в сегмент А5с2а2, с помощью рекомбинационного анализа (методом трехфакторного скрещивания).
Если же мутации принадлежат двум разным функциональным единицам, то на первой хромосоме будет работать не затронутая мутацией вторая функциональная единица, а на второй хромосоме будет работать нормальная первая функциональная единица:

Пользуясь этим методом, можно вывести заключение о функциональных единицах, участвующих в формировании данного признака. Сравнивая результаты, полученные в обоих случаях, с результатами экспериментов с мутациями в цис-положении, можно точно сказать, затронута ли мутацией одна и та же или же разные функциональные единицы. Данный метод позволил Бензеру охарактеризовать все обнаруженные им rII-мутанты и доказать, что они относятся к двум функциональным единицам. Сами единицы он назвал цистронами. Расчет показал, что в цистрон может входить около тысячи нуклеотидов.
Следующим важным этапом в изучении организации генетического материала было подразделение всех генов на два типа: регуляторные гены, т. е. гены, дающие информацию о строении регуляторных белков (репрессоров) и структурные гены, кодирующие строение остальных полипептидных цепей. Эта идея, а также ее экспериментальное доказательство были разработаны французскими исследователями Ф. Жакобом и Ж. Моно (1961) (см. ниже раздел «Регуляция генной активности»).
Функциональная структура генов.
В 1961 г. Жакоб и Моно доказали, что все гены можно подразделить на структурные и регуляторные. После выделения репрессора — продукта, синтезируемого под контролем гена-регулятора (М. Пташне, 1967; В. Гильберт и Б. Мюллер-Хилл), вопрос о структурной организации генов стал особенно актуальным. Мутационная дробимость гена и определение минимального размера участка ДНК, подвергающегося мутированию (мутона), выяснение минимального отрезка ДНК, на границах которого может произойти перекрест (рекона), а также определение функциональной единицы генетической активности (цистрона) было важным шагом в познании структурной организации генетического материала.
Однако в самые последние годы появились новые данные, позволяющие значительно расширить наши представления о структурной организации генов. Было открыто явление многократной повторяемости генов, по крайней мере, у некоторых, а возможно, и у всех представителей высших организмов.
Было найдено, что количество ДНК в хромосомах некоторых растений (роды Lilium, Lupinus, Vicia, Thyantha) и насекомых, имеющих одинаковое число хромосом и близких в систематическом отношении, различается в 4-60 раз. Для объяснения столь резких различий Г. Кэллен в 1967 г. предложил гипотезу 6 существовании многих копий одних и тех же генов (гипотеза «хозяев и рабов»). Согласно представлениям Кэллена, наличие серий повторяющихся последовательностей генов, из которых в любой данный момент работает лишь одна копия («хозяин»), а остальные копии находятся в репрессированном состоянии («рабы»), дает возможность объяснить не только большие различия в содержании ДНК в ядре близких видов, но и стабильность генетического материала в эволюции. Перед началом репликации ДНК может проходить процесс коррекции (унификации) основной и подчиненных копий генов. Предполагается, что в ходе такой коррекции соответствующие ферменты могли бы «сверить» структурные совпадения нуклеотидов по длине каждой из копий генов и устранить несовпадающие участки.
Пока трудно судить о том, насколько справедлива эта гипотеза, пег уже накапливаются факты, подтверждающие ее основные положения[189].
Генетический код.
Постановка проблемы молекулярной природы генетического кода стала возможной после установления строения материального носителя генетической информации — молекул дезоксирибонуклеиновой кислоты. Гипотеза о строении ДНК, полностью подтвержденная последующими экспериментами, была предложена в 1953 г. Ф. Криком и Дж. Уотсоном (см. также главу 23).
Многочисленные эксперименты биохимиков и генетиков дали убедительные доказательства в пользу того, что основная функция генов заключается в кодировании белков. Это было предсказано еще Бидлом и Тейтумом (1944), провозгласившими правило: «один ген — один фермент». Данная формула получила подтверждение, но в нее было внесено одно уточнение. Так как один фермент может состоять из нескольких белковых молекул (полипептидных цепей), то следует считать, что один ген определяет одну полипептидную цепь.
Выяснение основной функции гена как хранителя информации о строении определенной полипептидной цепи поставило перед молекулярной генетикой вопрос исключительной важности: каким образом осуществляется перенос информации от генетических структур (ДНК) к морфологическим структурам, иначе говоря, каким образом записана генетическая программа и как она реализуется в клетке.
Согласно модели Уотсона-Крика, генетическую информацию в ДНК несет последовательность расположения оснований. Таким образом, в ДНК заключены четыре элемента генетической информации. В то же время в белках было обнаружено 20 основных аминокислот. Необходимо было выяснить, как язык четырехбуквенной записи в ДНК может быть переведен на язык двадцатибуквенной записи в белках. Решающий вклад в разработку этого механизма был внесен Г. Гамовым (1954, 1957). Он предположил, что для кодирования одной аминокислоты используется сочетание из трех нуклеотидов ДНК[190]. Эта элементарная единица наследственного материала, кодирующая одну аминокислоту, получила название кодона.
Хотя предположение Гамова о тринуклеотидном составе кодона выглядело логически безупречным, доказать его экспериментально долгое время не удавалось. На протяжении семи лет со времени публикации первой работы Гамова (1954) проблему организации генетического кода пытались чисто теоретически разрешить многие исследователи.
Не вдаваясь в подробности, все тиры предложенных кодов (за небольшим исключением) можно разделить на три типа: сплошной перекрывающийся код, сплошной неперекрывающийся код и код с запятыми. В конце 1961 г., когда многим стало казаться, что эта проблема вряд ли будет в ближайшие десятилетия разрешена, была опубликована работа кембриджской группы исследователей (Ф. Крик, Л. Барнет, С. Бреннер и Р. Ваттс-Тобин), выяснивших тип кода и установивших его общую природу. Важным моментом в их работе было то, что они с самого начала строго поставили вопрос о роли начальной, стартовой точки в гене. Их основной постулат, который они блестяще доказали, заключался в том, что в каждом гене есть строго фиксированная начальная точка, с которой фермент, синтезирующий РНК, начинает «прочтение» гена, причем читает его в одном направлении и непрерывно. Экспериментальная часть работы базировалась на модели rII-мутантов фага Т4. Использовав эту модель, авторы доказали, что размер кодона действительно равен трем нуклеотидам и что наследственная информация, записанная в ДНК, читается от начальной точки гена «без запятых и промежутков».
Доказательство свелось к получению точечных rII-мутантов, супрессоров этих мутантов и различных рекомбинантов. Крик с сотрудниками воспользовались свойством весьма интересных мутагенов — красителей акридинового ряда — вызывать вставку или выпадение одного нуклеотида в ДНК. Исходя из гипотезы, что чтение генетической матрицы осуществляется с фиксированной точки тройками оснований, авторы резонно предположили, что при вставке и выпадении нуклеотидов, начиная с измененной точки, чтение ДНК будет осуществляться неверно:
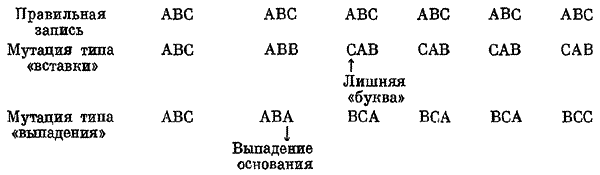
Очевидно, что при обоих повреждениях можно добиться возвращения к правильной фазе чтения единственным образом: в первом случае при выпадении либо самой лишней буквы, либо буквы, расположенной рядом с ней; во втором случае при вставке вместо выпавшей буквы находящейся по соседству с ней. В обоих случаях произойдет восстановление нормального (дикого) генотипа и фенотипа, если буква, исправляющая чтение, появится где-то рядом по соседству с измененной точкой:
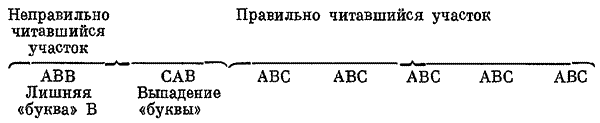
Получив под действием аналога акридина — профлавина — ряд rII-мутантов, потерявших нормальную фазу чтения на всем протяжении гена, и осуществив затем вторую мутацию противоположного знака по соседству с первым повреждением (супрессоры первых мутаций), авторы получили фаги с псевдодиким фенотипом.
Доказательство трехбуквенного состава генетического кода было получено в дальнейших экспериментах, когда при помощи рекомбинации авторы совместили в одном геноме три мутации одного знака. Были получены фаги, несшие по три мутации вставки или по три мутации выпадения. Так как изменение чтения на три буквы должно было сместить чтение на число букв, кратное величине кодона, следовало ожидать восстановления псевдодикого фенотипа:
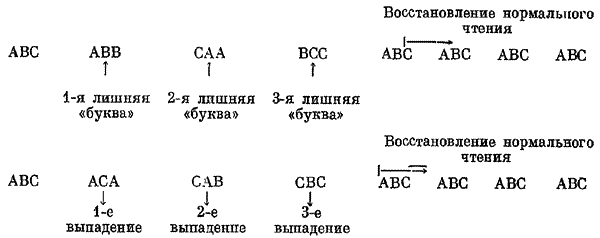
Именно этот результат и был зарегистрирован в эксперименте. Фаги псевдодикого фенотипа возникали только при сочетании трех повреждений одного знака, а не при сочетании двух или четырех одинаковых повреждений.
Репликация ДНК.
Причиной быстрого признания гипотезы Уотсона и Крика послужило то, что авторы не только предложили модель строения ДНК, но и рассмотрели механизм ее репликации. Согласно их гипотезе, последовательность оснований в одной нити ДНК однозначно задавала последовательность оснований в другой нити. Следует подчеркнуть, что абсолютно та же идея репликации в общем виде (без указания на ДНК-овую природу генетической информации) была предложена задолго до этого советским ученым Н.К. Кольцовым (1928).
Уотсон и Крик далее предположили, что две нити ДНК раскручиваются и на каждой из них в соответствии с правилами комплементарности синтезируются дочерние нити. Таким образом, каждая новая молекула ДНК должна содержать одну родительскую нить и одну дочернюю. Этот тип (полуконсервативный) репликации к концу 50-х годов был экспериментально обоснован в опытах на бактериях (М. Мезельсон, Ф. Сталь, Д. Рольф). Опыты на высших организмах также косвенно говорили о правильности этого вывода (Д. Тейлор и др.). В это же время А. Корнберг выделил фермент, который, как он считал, осуществлял синтез ДНК (Нобелевская премия, 1959). Для работы фермента было необходимо наличие затравочной ДНК и всех четырех предшественников ДНК (дезоксирибонуклеозидтрифосфатов). В последующем десятилетии биохимики получили огромное количество фактов о характере протекания репликационного процесса. Было выделено и охарактеризовано несколько типов ферментов, осуществляющих репликацию (ДНК-полимераз).
В конце 60-х годов было установлено, что наряду с процессом нормальной полуконсервативной репликации в клетках всех без исключения организмов (в том числе и человека) осуществляется еще один процесс репликации ДНК, протекающий во время репарации ДНК. Если ДНК оказывается поврежденной после воздействия на нее ряда физических и химических факторов, специальные репарирующие ферменты (пуклеазы) вырезают эти поврежденные участки, после чего бреши заделываются специальными репарирующими ДНК-полимеразами. Не исключено, что выделенный Корнбергом фермент как раз относится к этому виду полимераз.
Воспользовавшись репарирующими ферментами, А. Корнберг, Р. Синсхеймер и М. Гулиан в 1969 г. смогли в бесклеточной системе воспроизвести синтез инфекционной фаговой ДНК для одного из мельчайших фагов — ?Х174. Авторы использовали готовую родительскую нить ДНК этого фага и на ней синтезировали копии ДНК.
Заново синтезировать ген удалось в 1968–1971 гг. американскому исследователю Г. Коране (Нобелевская премия, 1968). Он чисто химически собрал ген для одной из транспортных РНК, последовательно добавляя к синтезируемой молекуле новые нуклеотиды.
Принципиально новый тип репликации ДНК был доказан в конце 1970 г. в лабораториях С. Шпигельмана (на лимфоцитах человека) и Г. Темина (на фибробластах цыпленка и крысы, зараженных вирусом саркомы Рауса). Эти исследователи установили, что имеется особый фермент ДНК-полимераза, использующий в качестве матрицы не ДНК, а РНК. Сама идея о том, что РНК может послужить шаблоном для синтеза ДНК, была высказана в 1961 г. советским генетиком С.М. Гершензоном и в 1964 г. американцем Теминым. После выделения этого фермента (получившего название обратной транскриптазы) сразу в трех лабораториях в США в 1972 г. удалось синтезировать гены, кодирующие гемоглобин животных и человека (Шпигельман и соавторы; Д. Балтимор и соавторы и Ф. Ледер и соавторы). Затем обратная транскрипция была обнаружена у широкого круга объектов.
Новым моментом в схеме репликации ДНК было установление того, что репликация осуществляется, по-видимому, участками размером около 1000 нуклеотидов (Р. Оказаки, 1968 и позднее). Прерывистый синтез ДНК («фрагмента Оказаки») был обнаружен как в микробных клетках и у фагов, так и в клетках растений и животных. Правда, окончательного доказательства, что репликация ДНК происходит фрагментами, до сих пор не получено.
Генетический контроль синтеза белков.
Важнейшим достижением молекулярной генетики было выяснение цепи реакций, обеспечивающих передачу информации от ДНК к белку. Цитохимически было доказано, что ДНК локализована главным образом в ядре клеток. Синтез же белка, как показали исследования начала 50-х годов, происходит в основном в цитоплазме (Ж. Браше, Б.В. Кедровский). Каким образом ядро может осуществлять контроль за синтезом белка в цитоплазме? В настоящее время эта проблема полностью решена.
Еще в 30-х годах XX в. было установлено, что в клетках наряду с ДНК содержится второй класс нуклеиновых кислот — рибонуклеиновые кислоты (РНК). В отличие от ДНК в РНК вместо сахара дезоксирибозы содержится также пятичленный углевод — рибоза, а одно из пиримидиновых оснований — тимин — заменено на урацил. Кроме того, было показано, что РНК, как правило, не двуспиральна, а однонитчата.
Уже в опытах Браше (1942) и Кедровского (1951), а затем в обширных экспериментах ряда лабораторий (Т. Касперсон, А. Мирский, В. Олфри, П. Замечник и др.) было показано, что интенсивный синтез белка происходит в тех участках клетки, где сосредоточено много РНК. Методы цитохимического анализа и электронной микроскопии позволили в начале 60-х годов четко подтвердить этот вывод. Само собой напрашивалось предположение, что именно РНК, близкая по своему составу к ДНК, переносит информаций с ДНК на белок (см. также главу 23). Это предположение, высказывавшееся в устной и печатной форме многими учеными (Ф. Крик, С. Шпигельман, А.Н. Белозерский и А.С. Спирин и др.), было воплощено в четкую гипотезу лишь в 1961 г. Ф. Жакобом и Ж. Моно. Они предсказали свойства такой РНК (высокий молекулярный вес, сравнимый с весом участка ДНК, содержащего один ген; комлементарность к генам; быстрый синтез и высокая метаболическая активность), назвав ее «информационной РНК». После работ Жакоба и Моно в кратчайший срок (в том же 1961 г.) в ряде американских и японских лабораторий было доказано существование информационной РНК, или сокращенно иРНК (Ф. Гро, С. Шпигельман и многие другие). Р.Б. Хесин-Лурье и М.Ф. Шемякин (1962) в СССР впервые показали, что при размножении фага Т2 в бактериальной клетке синтезируются различные по времени иРНК (так называемые «ранние» и «поздние»). В 1964–1965 гг. Г.П. Георгиев и одновременно с ним А.С. Спирин развили представление о том, что в клетках высших организмов существуют особые формы «запасания» считанной с ДНК генетической информации в форме так назывемых «информоферов», или «информосом». В 1965 г. Спирин и Георгиев экспериментально доказали существование этих структур в клетках.
Несколько ранее открытия и изучения свойств иРНК было обнаружено существование в клетках другого типа РНК, получивших название «транспортные РНК» [М. Хогланд, Д. Стефенсон и другие (лаборатория П. Замечника, США); Огата, Нахара и Морито (Япония), 1957]. Основное затруднение в понимании механизма передачи генетической информации от ДНК к белку заключалось в том, что прямой синтез белка на РНК был невозможен из-за чисто стерических несоответствий: молекулы аминокислот по своей величине не совпадают с размерами кодонов и надо было искать какой-то иной способ передачи команд от ДНК относительно порядка выстраивания аминокислот в строящейся молекуле белка. Ф. Крик (1954) предложил так называемую адапторную гипотезу, согласно которой функцию перевода языка нуклеиновых кислот на язык белков должны выполнять особые молекулы нуклеиновых кислот — адапторные РНК. Это предположение блестяще подтвердилось. Было выделено более 20 типов низкомолекулярных РНК, которые сначала были названы растворимыми, а затем переименованы в транспортные РНК (тРНК).
Выяснилось, что молекулы тРНК содержат два активных центра. На одном конце тРНК имеется одинаковая для всех изученных сортов тРНК последовательность нуклеотидов, к цепи которых прикрепляется молекула аминокислоты. Прикрепление осуществляется при помощи особых активирующих ферментов, число которых также близко к 20 (по числу типов аминокислот). В результате образуется комплекс аминоацил-тРНК. Второй активный центр в аминоацил-тРНК остается свободным, В этом центре содержится так называемый антикодон, т. е. последовательность оснований, комплементарная к кодону в иРНК. Таким образом, спаривание антикодона аминоацилированной тРНК с кодоном иРНК приведет к тому, что напротив данного кодона поместится соответствующая аминокислота.
Точное строение кодонов.
Гамов рассчитал, что если каждая аминокислота кодируется тройкой нуклеотидов, то из четырех сортов нуклеотидов можно составить 64 сочетания. Долгое время казалось, что этот расчет не более чем гипотеза, которую в обозримом будущем вряд ли удастся доказать экспериментально. Но успехи молекулярной генетики оказались настолько значительными, что в короткий срок удалось не только определить состав кодонов, но и выяснить точное расположение оснований в пределах всех 64 кодонов.
Для изучения состава кодонов весьма плодотворным оказался метод, предложенный М. Ниренбергом и Дж. Маттеи (1961), заключавшийся во введении искусственно синтезированных РНК в систему для бесклеточного синтеза белка. Так как использовались искусственно синтезированные РНК известного состава, то, определив, какие аминокислоты преимущественно включаются в белок при тех или иных сочетаниях оснований, можно было получить информацию о том, кодоны какого суммарного состава кодируют различные аминокислоты. Такая работа была проведена в основном в лабораториях М. Ниренберга (Нобелевская премия, 1968) и С. Очоа (Нобелевская премия, 1959).
Но оставался открытым главный вопрос — каков точный порядок оснований во всех 64 кодонах. Метод его решения был разработан М. Ниренбергом и Ф. Ледером (1961). Эти исследователи искусственно синтезировали короткие отрезки РНК, содержавшие всего несколько нуклеотидов. При этом удавалось получать молекулы не среднестатистического состава, а совершенно точного строения. Это достигалось подсаживанием к синтезируемой искусственно молекуле олигонуклеотида (соединенных в цепь нескольких нуклеотидов) по одному точно известному нуклеотиду. Затем они определили, какой минимальной длины олигонуклеотид может быть использован для того, чтобы присоединить к себе хотя бы одну молекулу тРНК, несущую аминокислоту. Оказалось, что тринуклеотид, т. е. олигонуклеотид, равный по длине кодону, сорбирует на себе аминоацил-тРНК. Кроме того, было выяснено, что такое соединение строго специфично: каждый кодон присоединяет к себе только соответствующую тРНК и, скажем, присоединение тРНК, несущей триптофан, происходит только к тринуклеотиду УГГ (напомним, что в РНК в отличие от ДНК вместо пиримидинового основания — тимина имеется урацил) и никакие другие типы тРНК к этому кодону не присоединяются. Приготовив всевозможные кодоны, авторы изучили присоединение к ним различных тРНК, несущих разные аминокислоты. Аминокислоты метились радиоактивными изотопами, и по этой метке судили о присоединении аминоацил-тРНК. В результате этих и последующих работ ряда авторов (Г. Корана, Г. Виттман, Ч. Яновский и др.) к 1966 г. удалось получить данные о полном строении генетического кода.
Использование синтетических полинуклеотидных матриц в бесклеточных белоксинтезирующих системах позволило в течение пяти лет после открытия Ниренберга и Маттеи расшифровать природу практически всех кодонов.
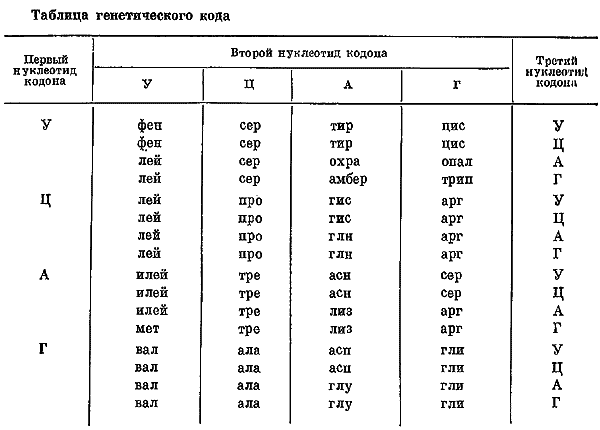
Примечание. Фен означает фенилаланин; лей — лейцин; илей — изолейцин; мет — метионин; вал — валин; сер — серин; про — пролин; тре — треонин; ала — аланин; тир — тирозин; гио — гистидин; глн — глутамин; асн — аспарагин; асп — аспарагиновая кислота; лиз — лизин; глу — глутаминовая кислота; цис — цистеин; трип — триптофан; арг — аргинин; гли — глицин; охра; амбер и опал — бессмысленные кодоны.
Не последнюю роль в деле расшифровки генетического кода сыграли также работы немецкого биохимика Г.Г. Виттмана, который в течение 1961–1965 гг. изучал аминокислотные превращения в белке ВТМ, вызванные химической модификацией вирусной РНК. В 1965–1967 гг. С. Бреннер, Дж. Беквит и другие уточнили смысл некоторых кодонов, которые служат для прекращения синтеза белковой цепи (они получили название терминирующих кодонов: амбер, охра и опал).
Следует упомянуть об установлении двух моментов, связанных с генетическим кодом. Первое — вырожденность кода, означающая, что одна аминокислота может кодироваться несколькими кодонами. Из таблицы кода видно, что одной и той же аминокислоте нередко соответствует несколько кодонов. Это немаловажное обстоятельство позволяет иметь разным организмам несколько различающиеся «диалекты». Действительно, перекодировка сообщений, записанных языком нуклеотидов в ДНК в язык аминокислотных последовательностей в белках, происходит в рибосомах с участием РНК. Отсутствие тРНК, узнающей некоторые из кодонов одной и той же аминокислоты, приведет к тому, что эти кодоны не будут узнаны и останутся бессмысленными в этой клетке. Экспериментальное доказательство правильности такой трактовки вырожденности генетического кода было дано в работе Ф. Чэпевилла с соавторами (1961). По-видимому, этот механизм действует при размножении ряда вирусов, активно размножающихся в одних видах организмов и не способных к размножению в других.
Второй интересный момент — универсальность генетического кода. Приведенные выше данные получены в основном на клетках Е. coli и на фагах. Проверка правильности кодонов in vivo была проведена на фагах и ряде вирусов. О справедливости данных, приведенных в таблице, свидетельствовали также отдельные опыты с высшими организмами. Поэтому признается, что генетический код в природе универсален. Насколько справедливо такое заключение и нет ли из пего исключений, покажет будущее.
Молекулярные механизмы рекомбинации.
С момента открытия Т.Г. Морганом в 20-х годах процесса обмена участками хромосом (кроссинговера) исследователи не раз пытались представить механизм, объясняющий последовательность протекающих при рекомбинации реакций. Все гипотезы, высказанные и в рамках классической и в современной молекулярной генетике, можно разделить на два класса: обменные и контактные гипотезы. Согласно представлениям одних исследователей, хромосомы сначала претерпевали разрыв нитей, а затем происходило замыкание концов одной нити с концами нити от другой хромосомы; согласно другим гипотезам, процесс начинался с пространственного примыкания хромосом в каких-то участках, после чего в этих точках происходили разрыв нитей и «неправильное» их соединение. Поскольку в настоящее время установлено, что стабильность хромосом высших организмов в большой степени зависит от непрерывности молекул ДНК, входящих в хромосомы, стало возможным, по аналогии с тем, как это делалось в микробной генетике, перенести вопрос о молекулярных основах процесса рекомбинации в сферу изучения поведения молекул ДНК, не затрагивая вопроса о поведении молекул хромосомных белков, окружающих ДНК (Г. Вайтхауз, 1965; Р. Холлидей, 1970).
В настоящее время окончательной схемы, объясняющей механизм рекомбинации, не существует. Для иллюстрации направления поисков такого механизма можно привести две схемы — Г. Вайтхауза и П. Говард-Фландерса, получившие наибольшее признание.
В механизме, предложенном Вайтхаузом (1963–1965), рекомбинация начинается с возникновения однонитевых разрывов в молекулах ДНК (этап 2). Затем однонитевые участки ДНК отходят от неповрежденных нитей ДНК (этап 3), создавая условия для начала рекомбинационного синтеза ДНК. Этот синтез происходит по матрице неразрезанной однонитевой ДНК (этап 4). Поскольку синтезированные участки комплементарны к противоположным им участкам, ранее отошедшим по местам разрывов, то, естественно, что между ними может произойти спаривание, в результате чего образуются участки гибридных молекул (этап 5): вновь синтезированный участок одной хромосомы соединится со старым участком другой хромосомы, ранее отошедшим от нее, а участок, вновь синтезированный на второй хромосоме, соединится со старым участком первой хромосомы. Тем самым будет положено начало образованию рекомбинантных молекул, но сами хромосомы еще будут соединены перекрестно. Чтобы отсоединить их, нужно разрезать оставшиеся пока неповрежденными старые нити обеих молекул (этап 6). Воссоединение участков в новом порядке завершит образование рекомбинантных молекул.
По сути дела, тот же механизм учитывается в схеме П. Говарда Фландерса (1965, 1966). Эта схема также весьма сходна со схемой том новой репарации. Как и в случае последней, при рекомбинации долги мы сначала осуществиться разрывы сахаро-фосфатного остова молекул (этап 1), затем разрушение однонитевых участков (этап 2). Следующим, третьим этапом рекомбинации должно быть комплементарно спаривание молекул на ограниченном участке (зона синапса). Затем и образовавшейся молекуле (гетеродуплексе), соединяющей фрагменты обоих рекомбинирующих молекул, должна произойти застройка однонитевых участков (этап 4) и, наконец, их воссоединение (этап 5).
До сих пор не ясно, что является причиной возникновения однонитевых разрывов в двунитевых молекулах ДНК. По нашему мнению, начало такому разрыву могут положить нарушения или изменения оснований в структуре ДНК, возникающие либо под действием квантов лучистой энергии, либо различных химических агентов как внутриклеточной, так и внешней по отношению к клетке природы. Эта точка зрения[191], высказанная нами в 1969 г., получила в настоящее время экспериментальное подтверждение в опытах на микроорганизмах.
Важным и пока еще также не получившим должного разрешения является вопрос о том, как происходит объединение нитей друг с другом во время рекомбинации. В настоящее время в результате исследования Э. Баутца (1967–1971) в США и Ю.П. Винецкого (1970) в СССР установлено, что зона синапса захватывает не менее 500-1000 нуклеотидов.
Мутации и генетический код.
В таблице кода указаны три кодона УАА, УАГ и УГА, которые не кодируют никаких аминокислот и потому называются нонсенс-кодонами, или терминирующими кодонами. Открытие этих кодонов было важным шагом в понимании механизма синтеза белка. Выше упоминалось о том, что иРНК может быть считана сразу с нескольких цистронов. Возник вопрос о том, каким образом при синтезе белков с такой полицистропной иРНК происходит обрыв чтения на конце одного цистрона и начинается чтение следующего цистрона. Обнаружение нонсенс-кодонов дало ответ на первый вопрос. К тому же стало понятным поведение некоторых мутантов, выделенных до этого у вирусов и бактерий. Это касается прежде всего так называемых амбер-мутантов фагов, которые могли размножаться в клетках одних линий бактерий и оказывались не способными к этому в других. Анализ этих мутантов показал, что в тех линиях бактерий, где развитие амбер-мутантов фагов не происходило, дефект был связан с неполным прочтением мутировавших генов. Под их контролем формировались не целые молекулы белка, а обрывки полипептидной цепи одинаковой длины. Такие амбер-мутанты удалось выделить практически для всех генов фага Т4 (Р. Эпштейн, 1963; Р Эдгар Г. Денхардт и Р. Эпштейн, 1964; Р. Эдгар, 1965, и др.), а также для гена щелочной фосфатазы кишечной палочки (лаборатория А. Герена в США, 1962 1964), а сам метод изучения амбер-мутантов оказал большую услугу ученым, позволив описать неизвестные ранее гены. Весьма примечательным было и то, что свойства амбер-мутантов фагов проявлялись только при заражении такими фагами определенных видок бактерий. При заражении же других видов дефект исправлялся, и синтезировались молекулы белка нормальной длины, хотя нередко и с измененными свойствами.
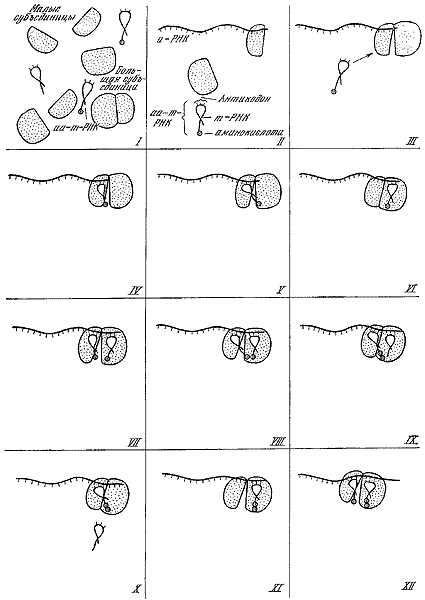
Последовательность реакций при матричном биосинтезе белков (по А.С. Спирину Л.П. Гавриловой, 1963).
I — свободные субъединицы рибосом, отдельные транспортные РНК и аминоацил-тРНК в клетках перед началом синтеза белка; II — присоединение индивидуальной молекулы иРНК к малой субъединице рибосомы; III — присоединение большой субъединицы рибосомы к малой субъединице, заряженной иРНК. Этот комплекс в нормальных условиях остается стабильным до конца считывания матрицы иРНК; IV — присоединение к малой субъединице рибосомы аминоацил-тРНК (первой всегда присоединяется формилметиониновая аминоацил-тРНК); V — конец аа-тРНК, несущий аминокислоту, присоединяется к большой субъединице рибосомы; VI — конец иРНК с присоединенной к нему формилметиониновой тРНК «вдвигается» в большую субъединицу рибосомы; VII — начало следующего цикла в работе рибосомы. Снова к малой субъединице присоединяется аа-тРНК, соответствующая очередному кодону иРНК, вошедшему в рибосому; VIII — конец аа-тРНК, несущий аминокислоту, присоединяется к большой субъединице. Теперь две аминокислоты (формилметиониновая и очередная, вошедшая в рибосому) оказываются в пространственной близости; IX — формилметионин перебрасывается на очередную аминокислоту: начался синтез полипептидной цепи; X — транспортная РНК, освободившаяся от аминокислоты формилметионина, покидает рибосому, уступая место для очередного акта «протягивании» иРНК в рибосому; XI — нить информационной РНК продвигается в рибосому еще ни один кодон; XII — начало третьего цикла работы рибосомы: в малую субъединицу вошла новая аминоацил-тРНК.
Спустя некоторое время удалось выделить так называемые охра мутанты (УАА-кодон) (С. Бреннер, А. Стреттон и С. Каплан, 1965; М. Вейгерт и А. Герен, 1965) с точно такими же свойствами, а затем и мутанты, у которых обрыв чтения иРНК происходил на кодоне УГА (опал-кодон), (С. Бреннер, Л. Барнет, Е. Кац и Ф. Крик, 1967), И охра-мутанты, и мутанты, несшие нонсенс-кодон УГА, удалось искра вить (супрессировать) в специальных линиях, имевших так называемы о гены-супрессоры. Все гены-супрессоры относились к трем классам: амбер-супрессоры (su-1, su-2 и su-3), восстанавливавшие чтение иРНК, оборванное на амбер-кодоне; охра-супрессоры (su-4 и su-5), подавлявшие амбер- и охра-кодоны; супрессоры кодона УГА.
Свойство супрессии оказалось связанным с наличием в клетках, несущих супрессорные гены, молекул тРНК, способных узнавать нонсенс-кодон (Г. Броуди и Ч. Яновский, 1963; Дж. Беквит, 1964; Ч. Яновский, 1966; Г. Корана и др., 1966). Такие мутантные тРНК могут спариваться с нонсенс-кодоном и таким образом подставлять против них аминокислоту. Анализ подстановок, осуществляемых в супрессорных линиях, показал, что в su-1-линиях Е. coli тРНК подставляют против амбер-кодона серил; в su-2-глутамин, в su-3-тирозин. В результате обрыва чтения не происходит и формируются полные молекулы белка. Чаще всего они имеют измененные свойства, так как на месте возникшей амбер-мутации подставляется не та аминокислота, которая была до возникновения амбер-кодона.
Анализ природы различных мутаций привел к выводу, что все точечные мутации можно разделить на три основных класса:
1. Миссенс-мутации — мутации, при которых изменяется смысл кодона; в этом случае против него встает неверная аминокислота, и свойства синтезируемого белка меняются. К миссенс-мутациям относится большинство мутаций, описанных ранее.
2. Нонсенс-мутации — мутации, при которых возникает нонсенс-кодон, не кодирующий никаких аминокислот, и на нем обрывается чтение иРНК в рибосомах. К таким нонсенс-кодонам относится кодон УАГ (амбер-кодон), кодон УАА (охра-кодон) и кодон УГА (опал-кодон).
3. Мутации со сдвигом чтения (или, как их часто называют, мутации сдвига рамки). Эти мутации, изученные Криком и его сотрудниками, позволили доказать трехбуквенность генетического кода. Мутации сдвига чтения возникают после того, как одно или несколько оснований выпадут из молекулы ДНК или внедрятся в нее. Интересно отметить, что сдвиг чтения чаще всего приводит к тому, что в какой-то точке он заканчивается нонсенс-кодоном и на нем чтение обрывается вообще.
В последнее время был решен также вопрос, как начинается синтез белка. Мы уже начали описывать этот процесс с того момента, когда к пептидильному центру рибосомы была присоединена молекула строящегося белка и ее дальнейшее наращивание осуществлялось за счет переброса пептидной цепи на аминокислоту, присоединенную к аминоацильному центру. Но в самом начале цистрона, когда пептидильный центр еще не занят, переброска на аминокислоту произойти не может, и, даже если аминоацетил-тРНК войдет в аминоацильный центр и спарится с кодонами иРНК, сдвига рибосомы по молекуле иРНК не произойдет, ибо первый кодон так и останется пустым.
Эта загадка была решена после открытия особого типа тРНК — так называемой формилметиониновой тРНК. Оказалось, что тРНК метионина может присоединять в результате ферментативной реакции формильную группу к аминокислоте:
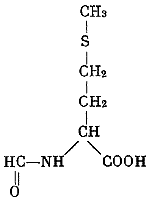
Такая формилметиониновая тРНК может присоединиться к двум кодонам АУГ и ГУГ, если только они расположены в начале цепи иРНК. В случае, когда эти кодоны располагаются в середине иРНК, АУГ кодирует метионин, а ГУГ — валин.
Только формилметиониновая тРНК может войти в пептидильный центр рибосомы в начале синтеза. После этого может произойти переброс формилметионина к аминокислоте, присоединенной к аминоацильному центру. В результате все цепи белка начинаются с одной и той же аминокислоты — формилметионина. После того как построенная цепь белка отсоединится от рибосомы, формильная или даже метиониновая группы могут быть ферментативно отщеплены от белка. Таким образом, установлено, что роль иницирующих кодонов играют АУГ и ГУГ, если они располагаются в начальном участке иРНК, а окончание синтеза происходит на нонсенс-кодонах.
Выяснение природы, строения и функционирования генетического кода явилось огромным достижением современной биологии. Последние успехи в искусственном синтезе белка, нуклеиновых кислот, особенно тех, которые обладают способностью к программированию живых вирусных частиц (работы лаборатории А. Корнберга в Стэнфордском университете, США), позволяют надеяться, что одна из основных проблем современной биологии — искусственный синтез живого с нужными человеку свойствами — будет, в конце концов, разрешена.
Регуляция генной активности.
Функциональная неравнозначность клеток и связанная с ней репрессия и активация генов давно привлекали внимание генетиков, но до последнего времени реальный механизм контроля генной активности оставался неизвестным.
Первые попытки объяснить регуляторную активность генов были связаны с изучением гистонных белков. Еще супруги Стэдман в начале 40-х годов нашего века высказали мысль, что именно гистоны могут выполнять роль контролеров активности генов. В своих дальнейших работах они получили первые четкие результаты о различиях в химической природе гистонных белков. Обобщая полученные данные, они писали: «Физиологические функции ядер являются, вероятно, следствием присутствия генов, которые они содержат. Они (гены — В.С.) должны поэтому быть идентичными во всех ядрах данного организма. Если, однако, предположить, что ядра содержат некоторый механизм для подавления активности отдельных генов или групп генов и что этот механизм специфичен для каждого типа клеток, эти трудности исчезнут. Продемонстрированные нами данные, что некоторые основные белки, имеющиеся в клеточных ядрах, являются, несомненно, клеточно-специфичными, приводят к гипотезе, что одна из физиологических функций заключается в том, чтобы действовать в качестве репрессоров генов»[192]. Эта догадка получила некоторое подтверждение в более поздних работах Дж. Боннера, Ру-Чи-Хуанга, Тсьо и других.
Сейчас несколько коллективов исследователей интенсивно работает в этой области. Объем данных, свидетельствующих в пользу этой гипотезы, довольно велик, и можно полагать, что она получит экспериментальное подтверждение.
В то же время все большее количество фактов говорит за то, что регуляция генной активности гораздо более сложный процесс, нежели простое взаимодействие участков генов с молекулами гистонных белков. Об этом в первую очередь свидетельствуют эксперименты по регуляции генов у микроорганизмов (см. также главу 23).
В 1960–1962 гг. в лаборатории Р.Б. Хесина-Лурье удалось выяснить, что гены фагов начинают считываться не одновременно. Было показано, в частности, что гены фага Т2 можно разделить на ранние, работа которых падает на первые минуты заражения бактериальной клетки, и поздние, начинающие синтезировать иРНК после завершения работы ранних генов.
Четкая координированность действия генов и их своеобразная иерархия была доказана Ф. Жакобом и Ж. Моно (1961). Они показали, что гены бактерий можно условно разделить на два различных типа — структурные гены, дающие информацию о синтезе определенных белков (ферментов), и регуляторные гены, следящие за включением и выключением отдельных генов или их блоков в зависимости от метаболических потребностёй клетки. По представлениям Жакоба и Моно, регуляторные гены должны детерминировать особые молекулы репрессоров, которые, соединяясь с другими генами регуляторной системы — генами-операторами, управляют работой последних. Тем самым Жакоб и Моно разделили гены регуляторной системы в свою очередь на два типа — гены-регуляторы и гены-операторы[193]. В экспериментах с кишечной палочкой они смогли дать принципиальное доказательство существования этих типов. По их данным, ген-регулятор находится на некотором отдалении от структурных генов, управляемых им, а оператор непосредственно к ним примыкает. Авторы ввели в генетику новое понятие, определив блок структурных генов и управляющий ими оператор, как единую функциональную единицу — оперон.
В последние годы были получены данные о наличии еще одной управляющей ячейки генной активности — промоторе. Оказалось, что по соседству с операторным участком, к которому присоединяется продукт — белковое вещество репрессор, синтезированный на гене-регуляторе, имеется другой участок, который также следует отнести к членам регуляторной системы генной активности. К этому участку присоединяется молекула фермента РНК-полимеразы. В этом промоторном участке должно произойти взаимное узнавание уникальной последовательности нуклеотидов в ДНК и специфической конфигурации белка РНК-полимеразы. От эффективности узнавания будет зависеть осуществление процесса считывания генетической информации с данной последовательности генов оперона, примыкающего к промотору.
Таким образом, схема взаимодействия гена-регулятора, оператора, промотора, ферментов и рибосом, участвующих в синтезе специфических белков, может быть представлена следующим образом (см. рисунок): на гене-регуляторе синтезируется вещество белковой природы — репрессор. Последний может воздействовать на операторный участок — выключать (или в некоторых случаях включать) его. Репрессор, кроме того, может взаимодействовать с метаболитами, синтезируемыми под контролем специфических генов. Если метаболиты накопились в достаточном количестве, они, взаимодействуя с репрессором, изменяют его конфигурацию, и он отсоединяется от операторного участка. В том случае, когда оператор находится в состоянии, при котором он и находящиеся под его контролем структурные гены могут функционировать, к промоторному участку присоединяется молекула РНК-полимеразы, начинающая считывать информацию с данного оперона. Информация считывается в виде последовательности оснований в молекуле иРНК. К концу этой иРНК присоединяется рибосома и, продвигаясь вперед, считывает информацию с иРНК, в результате чего синтезируется полипептидная цепь. Вслед за первой рибосомой присоединяется вторая, за ней третья и т. д. Таким образом осуществляется взаимно скоординированное функционирование частей белок-синтезирующего аппарата.
Такова картина синтеза белка в бактериальных клетках. В клетках высших организмов она оказалась несколько иной: молекулы иРНК после окончания их синтеза отделяются от матрицы ДНК и скапливаются в цитоплазме. Предполагают, что они переходят в цитоплазму соединенными со специальными белками (возможно, близкими к гистонным белкам).
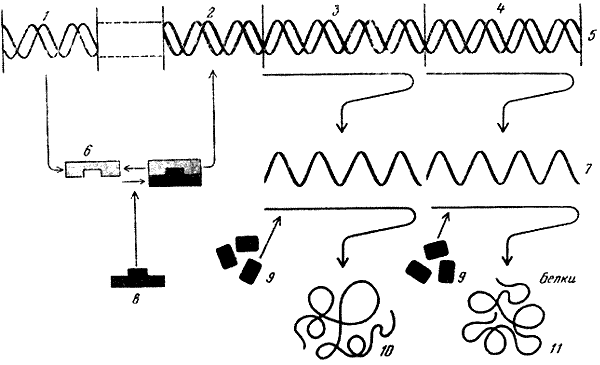
Схема генетической регуляции белкового синтеза, по Жакобу и Моно (1961).
1 — регуляторный ген; 2 — оператор; 3 — структурный ген А; 4 — структурный ген В; 5 — ДНК; 6 — репрессор; 7 — РНК; 8 — регуляторный метаболит; 9 — аминокислоты; 10 — фермент А; 11 — фермент В.
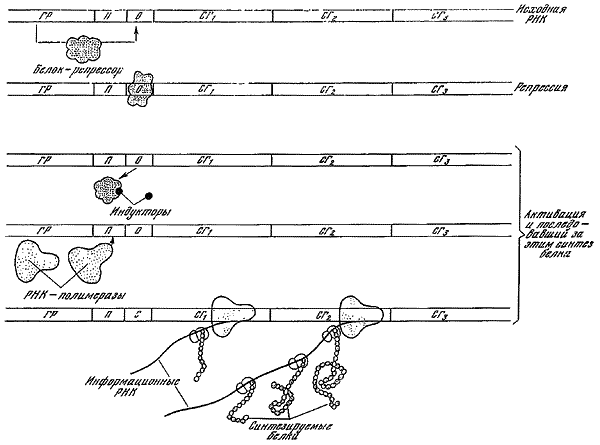
Схема, поясняющая взаимодействие регуляторных и структурных генов при синтезе белка (по Жакобу и Моно, 1961).
ГР — ген-регулятор; П — промоторный участок; О — операторный участок; СГ1, СГ2 и СГ3 — первый, второй и третий структурные гены, входящие в данный оперон.
Репарация генетических повреждений.
Новой главой в развитии молекулярной генетики стало учение о системе репарирующих ферментов, исправляющих повреждения генетических структур, вызванные облучением или обработкой химическими агентами. Первоначально репарирующие системы были найдены только у бактерий и фагов. В настоящее время получены данные, свидетельствующие о том, что репарация активно осуществляется у грибов, водорослей, а также в клетках высших животных и растений.
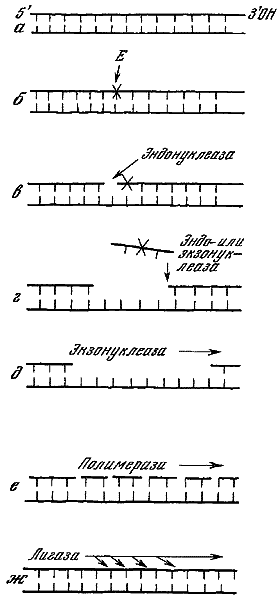
Схема темновой репарации (по Сойферу, 1969).
а — исходная ДНК; б — повреждение ДНК, нанесенное каким-либо мутагеном, дающим репарабельные повреждения; в — надрез нити ДНК вблизи повреждения ферментом эндонуклеазой; г — выщепление из ДНК поврежденного фермента с помощью другой эндонуклеазы или же экзонуклеазы; д — расширение бреши экзонуклеазой; е — застройка бреши полимеразой; ж — соединение застроенных концов репарирующей лигазой.
Ранее всего изученным типом репарации является фотореактивация, впервые описанная А. Кельнером и В.Ф. Ковалевым (1949). Под фотореактивацией понимают восстановление нормальной жизнедеятельности клеток (возобновляется синтез отдельных ферментов, способность к делению и размножению, снижается частота мутаций и т. д.), облученных ультрафиолетовым светом, после их пребывания на видимом свете. Обязательным условием реакции фотореактивации является наличие специального фотореактивирующего фермента. В настоящее время он выделен и очищен (К. Руперт, А. Мухаммед).
Было установлено также, что репарация может происходить не только при освещении облученных ультрафиолетом клеток видимым светом, но и в темноте (А. Герен, Н. Зиндер, 1955; Р. Бойс, П. Говард-Фландерс, 1964; Р. Сетлоу, В. Кэррир, 1964; и др.). Этот вид реактивации, происходящий без участия квантов видимого света, был назван темновой репарацией. Оказалось, что молекулярный механизм этого вида репарации совершенно отличен от фотореактивации. Если при фотореактивации репарирующий фермент восстанавливает исходную структуру ДНК путем разъединения связей, возникших после ультрафиолетового облучения, то процесс темновой репарации протекает гораздо сложнее (см. рисунок). Прежде всего при помощи эндонуклеаз, а затем экзонуклеаз происходит вырезание поврежденного участка ДНК (из одной ее нити), затем полимераза застраивает вырезанный участок в соответствии с правилами комплементарности. Тем самым восстанавливается первоначальная структура ДНК. Процесс заканчивается соединением вновь синтезированного участка с концом старой нити ДНК. Последняя реакция связана с участием вновь открытого фермента — полинуклеотидлигазы.
Оказалось, что реакция темновой репарации распространена в органическом мире гораздо шире. Так, в последнее время темповая репарация была найдена и в растительном мире — у синезеленых водорослей (С.В. Шестаков и др., 1974), у целостных высших растений (В.Н. Сойфер и К.К. Циеминис, 1973) и в протопластах растительных клеток (Г. Хоуленд, 1975). Это объясняется многими причинами. Во-первых, при темновой репарации могут восстанавливаться повреждения, нанесенные агентами как лучевой, так и химической природы. Есть основания полагать, что репарирующие ферменты системы темновой репарации узнают любые изменения в структуре ДНК, нарушающие правильность ее двойной спирали (нарушения вторичной конфигурации ДНК), вырезают их и восстанавливают исходную структуру. Во-вторых, некоторые из ферментов, принимающие участие в акте темновой репарации, например полинуклеотидлигаза и полимераза, проявляют свою активность и в других важнейших жизненных процессах — репликации ДНК (Р. Оказаки, 1968–1970), рекомбинации (П. Говард-Фландерс, 1966; Томизава, 1968), мутагенезе (Ш. Ауэрбах, А. Назим, 1967; Э. Виткин, 1968; В.Н. Сойфер, 1969, 1970). О широком распространении систем темновой репарации свидетельствует и описание большого числа генов, обусловливающих протекание этой реакции.
В настоящее время описано большое число других систем репарации, приводящих к тому же результату, но отличающихся друг от друга по молекулярным механизмам. В числе этих реакций следует, прежде всего, упомянуть пострепликативную репарацию, осуществляющуюся в ходе репликации ДНК и после ее окончания. Ныне широко исследуется ультрафиолетовая реактивация, осуществляющаяся при слабом облучении бактериальных клеток УФ-лучами, и затем инфицированных фагами, облученными высокими дозами УФ. Описаны тепловая, каталазная реактивации, реактивация в жидкой среде и другие виды репараций.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК