Дифференциальная экспрессия генов в процессе развития
Дифференциальная экспрессия генов в процессе развития
Один из главных и общепризнанных догматов современной эмбриологии состоит в том, что, за исключением нескольких особых случаев, все клетки данного организма, независимо от того какими они становятся в дифференцированном состоянии, содержат в геноме одну и ту же ДНК. Тем не менее экспрессия генов в клетках одного типа явно отличается от их экспрессии в клетках другого типа. Дифференцированные клетки каждого типа обладают свойственной им одним морфологией и поддерживают свой собственный набор синтезируемых белков. Содержащиеся в клетках разного типа матричные РНК (мРНК) также неидентичны. На основе всех этих данных ученые пришли к единодушному мнению, высказанному, например, в 1976 г. Дэвидсоном (Davidson), что дифференцировка обусловливается изменениями дифференциальной экспрессии генов в различных клеточных линиях развивающегося зародыша.
У бактерий экспрессия генов контролируется исключительно регуляторными механизмами, действующими на уровне транскрипции генов, т.е. синтеза мРНК. У эукариот регуляция действия генов более сложная. Регуляция происходит на уровнях транскрипции, процессинга, в результате которого в ядре из большого и сложного первичного РНК-транскрипта образуется соответствующая мРНК, а также на уровне транспорта мРНК из ядра в цитоплазму. Трансляция мРНК после того, как она попадет в цитоплазму, также регулируется разнообразными механизмами. Мы пользуемся достаточно неопределенным термином «генная экспрессия», имея в виду множественность регулирующих механизмов, которые могут здесь действовать.
Начальная детерминированность бластомеров к дифференцировке в определенных направлениях обеспечивается взаимодействием ядерного генома с информацией, находящейся в цитоплазме. Эту гипотезу впервые четко сформулировал Т. Морган (Т. Morgan) в 1934 г. в своей книге «Эмбриология и генетика»:
«Известно, что протоплазма в разных участках яйца несколько различна и что эти различия выявляются более четко в процессе дробления - благодаря происходящему при этом перемещению материалов. Протоплазма поставляет материалы, необходимые для увеличения количества хроматина и для синтеза веществ, вырабатываемых генами. Можно предполагать, что первоначальные различия между участками протоплазмы оказывают влияние на активность генов. Затем гены в свою очередь воздействуют на протоплазму, что приводит к возникновению новой последовательности реципрокных реакций. Такой нам представляется картина постепенного усложнения и дифференцировки различных участков зародыша».
Информационные элементы гипотетического зародыша схематически представлены на рис. 4-3, на котором изображен срез оплодотворенного яйца, содержащего ядро и локализованные цитоплазматические макромолекулы двух типов, показанные мелкими и крупными точками. Цитоскелетный матрикс яйца изображен в виде решетки. Следует указать, что решетка - это просто статичное изображение цитоскелетной системы, которая сама, по-видимому, изменяется с течением развития. После того как началось дробление, каждая клетка зародыша получает ядро, равноценное по содержанию ДНК каждому из других ядер, однако эти ядра оказываются в разном цитоплазматическом окружении. Стрелками на рис. 4-3 показаны потоки информации. Таким образом каждое из ядер, находящихся в различных бластомерах, получает особый сигнал от определенных локализованных макромолекул. Ответ ядра на полученный сигнал зависит от вида макромолекул, локализованных в данном бластомере. Это взаимодействие приводит к инициации ядрами специфичных типов генной экспрессии (изображенной стрелками, выходящими из ядер). Избирательная транскрипция, процессинг и трансляция специфичных частей ядерного генома ведет к биохимической и морфологической дифференцировке клеток зародыша. Еще одно важное взаимодействие изображено стрелками, идущими от одной клетки к другой; это пример индукционного взаимодействия, возникающего между группами клеток зародыша, при котором какое-то вещество, вырабатываемое одной группой клеток, индуцирует в определенное время специфическую дифференцировку другой группы клеток. У хордовых, например, хорда индуцирует дифференцировку вышележащей эктодермы в нервную ткань.
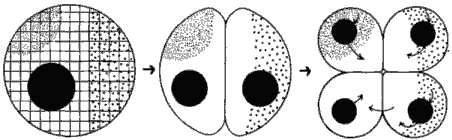
Рис. 4-3. Регионализованные информационные системы яиц и зародышей. Цитоскелет изображен в виде решетки, ядра черные, а регионализованные детерминанты морфогенеза показаны мелкими и крупными точками. Стрелками изображен поток информации. Эта модель чересчур статична, потому что в большинстве случаев детерминанты морфогенеза не бывают локализованы заранее, но перемещаются к своим конечным местоположениям в ходе нескольких первых дроблений (Raff, 1977; с изменениями).
Убедительные примеры локализованности информации, приводящей к специфичной экспрессии генов в разных участках клетки, встречаются редко, однако мы опишем один такой превосходный пример. Примитивные родичи хордовых - асцидии - во взрослом состоянии не особенно примечательны: это мешковидные сидячие формы, по способу питания относящиеся к фильтраторам. Однако личинки большинства видов асцидии не только подвижны, но и обладают неожиданной и интересной морфологией. Строение этих головастикообразных личинок, как показано на рис. 4-4, соответствует основному плану строения тела, типичному для хордовых, т.е. у них имеется спинной нервный тяж и хорда, или примитивный позвоночник. В туловище заключены зачатки половозрелой асцидии, но единственные функциональные эмбриональные структуры туловища - это три сосочка прикрепления на переднем конце тела, сенсорный пузырек, содержащий одноклеточный отолит, и глазок, в котором имеются три клетки хрусталика, пигмент и десяток ретинальных клеток. Эти сенсорные структуры дают личинке возможность ориентироваться по отношению к направлению силы тяжести и к источнику света. Подвижный хвост содержит хорду, состоящую из 40-42 вакуолизированных клеток. Над хордой лежит нервная трубка, а по обе стороны от нее - тяжи, состоящие из поперечнополосатых мышечных клеток, по 18 в каждом тяже. Вся личинка одета оболочкой из эпидермальных клеток. Личинка не питается; она плавает в течение всего нескольких часов, после чего находит себе подходящий субстрат, прикрепляется и претерпевает метаморфоз, превращаясь во взрослую особь, которая ведет сидячий образ жизни и добывает себе пищу путем фильтрации воды.
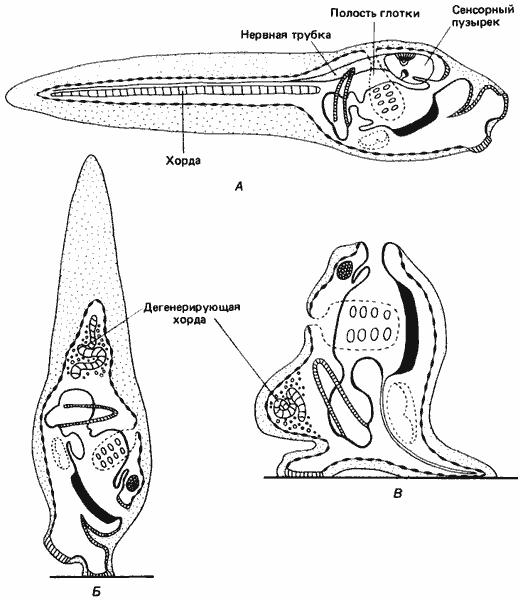
Рис. 4-4. Головастикоподобная личинка асцидий и ее метаморфоз. А. Свободно плавающая личинка. Б. Личинка, прикрепившаяся к субстрату и начавшая метаморфоз. В. Завершение метаморфоза, сопровождающееся утратой подвижности и сенсорных структур (Korschelt, Heider, 1900).
В 1973 г. Уиттейкер (R. Whittaker) опубликовал исследование по регуляции появления у асцидии Ciona двух ферментов, место синтеза которых в зародыше было установлено. Это ацетилхолинэстераза, появляющаяся только в мышечных клетках на стадии хвостовой почки, и тирозиназа, появляющаяся на этой же стадии только в двух пигментных клетках нервного узла. Подавляя дробление в разные сроки, Уиттейкер получал зародыши, прекратившие развитие на стадии 2, 4, 8, 16 или 32 клеток (нормальный зародыш к моменту появления двух названных ферментов, т. е. спустя 9-12 ч после оплодотворения, состоит примерно из 1000 клеток). Зародыши, дробление которых было прекращено, оставались живыми и синтезировали тирозиназу и ацетилхолинэстеразу в то же самое время, что и нормальные зародыши. Самый важный результат этих экспериментов состоял в том, что синтез ферментов у зародышей с подавленным дроблением был пространственно локализован. Если дробление приостанавливали на стадии двух бластомеров, то оба они синтезировали ацетилхолинэстеразу, но при остановке развития на более поздних стадиях дробления синтез ее все более ограничивался клетками, из которых в норме образуется хвостовая мышца. Уиттейкер пришел к выводу, что способность к синтезу тирозиназы и ацетилхолинэстеразы локализуется в определенных участках цитоплазмы на ранних стадиях развития. Этот вывод подтвердили результаты более поздней работы того же автора, в которой он и его сотрудники хирургическим путем удаляли у 8-клеточных зародышей Ciona ту пару бластомеров, из которых развиваются мышцы. Затем эти клетки помещали в морскую воду, где они синтезировали ацетилхолинэстеразу, тогда как в остальных клетках зародыша этот фермент не синтезировался.
Пуромицин - один из ингибиторов белкового синтеза - препятствовал появлению тирозиназы и ацетилхолинэстеразы, и это доказывает, что молекулы фермента действительно синтезируются в то самое время, когда выявляется ферментная активность. Далее, обработка актиномицином D, подавляющим синтез РНК, также препятствовала появлению ферментов, если ее производили за 2 ч до появления ферментативной активности. Эти результаты позволяют считать, что мРНК, необходимые для синтеза этих ферментов, не запасаются заранее, а продуцируются незадолго до синтеза. Регионально-специфичный синтез мРНК - результат действия макромолекул, локализованных в определенных участках цитоплазмы, как это показано на рис. 4-3.
Описанные здесь эксперименты можно было бы, вероятно, подвергнуть критике на том основании, что актиномицин подавляет синтез фермента, отравляя клетки каким-то неспецифическим образом. Однако другая серия экспериментов, проведенных Уиттейкером на другом ферменте, который появляется только в энтодерме личинки, а именно на щелочной фосфатазе, показала, что это не так: появление этого фермента не подавляется актиномицином. Необходимая для синтеза щелочной фосфатазы мРНК, по-видимому, уже содержится в яйце и в ходе развития сама становится все более локализованной.
С такой локализацией информационных детерминантов, определяющих появление ацетилхолинэстеразы у личинок оболочников, связано одно интересное и поучительное явление. Уиттейкер изучал также некоторые виды оболочников, относящихся к роду Mogula, у которых личинки не развиваются до головастикоподобной стадии. У одного из них, М. arenata, несмотря на то что у него не образуется ни хвостовых мышечных клеток, ни даже самого хвоста, происходит локальный синтез ацетилхолинэстеразы в том участке зародыша, где должны были бы находиться мышечные клетки хвоста. Итак, несмотря на утрату способности к морфогенезу хвоста, локализованные детерминанты синтеза ацетилхолинэстеразы сохранились. У некоторых других (возможно, более древних) видов Mogula, у которых личинки также лишены хвостов, способность синтезировать этот фермент утрачена. Важное значение несопряженности клеточной дифференцировки, о которой можно судить по синтезу ферментов или других белков, с морфогенезом как механизмом эволюции рассматривается более подробно в гл. 5.
Работы Уиттейкера по оболочникам вскрывают два важных аспекта этой проблемы: 1) дифференциальная экспрессия генов, обусловленная действием локализованных в определенных участках детерминантов, играет решающую роль в дифференцировке; 2) существует, по-видимому, несколько механизмов, обеспечивающих хранение и экспрессию локализованной морфогенетической информации.
Зародыши активно синтезируют белки, используя мРНК-матрицы, происходящие из двух источников: мРНК одного класса синтезируются в процессе оогенеза и хранятся в яйце до тех пор, пока не используются в процессе развития; мРНК другого класса синтезируются в результате транскрипции, происходящей в ядрах самого зародыша. мРНК обоих классов содержат большое число последовательностей и транслируются на ранних стадиях развития. Для того чтобы представить себе количество мРНК, синтезируемой при оогенезе, и степень ее разнообразия (ее сложность), следует понаблюдать, до какого уровня может дойти развитие зародышей морского ежа, если блокировать транскрипцию в их клетках. Такие зародыши достигают стадии бластулы, что требует значительного уровня морфогенетической активности, в том числе клеточных делений, изменений формы клеток, сборки ресничек и синтеза фермента вылупления. Если блокировать транскрипцию в клетках зародыша, то гаструляции не происходит. Дифференцировка на более поздних стадиях, чем бластула, в значительной степени зависит от действия генов данного зародыша.
Галау (Galau) и его соавторы изучали вопрос о числе структурных генов, которые должны экспрессироваться в процессе развития зародышей морского ежа. По мнению этих исследователей, величина набора генов, которые должны экспрессироваться в клетках одного типа, чтобы отдифференцировать их от клеток другого типа в том же организме, еще не установлена. Неизвестно также, какое число генов необходимо для обеспечения основных жизненных функций («housekeeping»), общих для всех клеток. Используя метод гибридизации нуклеиновых кислот, Галау и др. определяли число структурных генов, представленных в виде активной мРНК на разных стадиях зародышевого развития и в различных тканях взрослого организма. Далее они определяли, какая доля конкретных генов, представленных в мРНК гаструлы, была представлена также в мРНК других изучавшихся ими стадий и тканей. Оказалось, что во время развития очень большое число генов экспрессируется в виде мРНК. Например, на стадии гаструлы в процессе трансляции в белки находятся мРНК, представляющие от 10 до 15 тысяч генов. Большое число структурных генов экспрессируется аналогичным образом на других стадиях развития и в тканях взрослого организма. Некоторые из них являются общими для всех изученных стадий и тканей, но большинство экспрессируется лишь на отдельных стадиях и в определенных тканях. Авторы данной работы пришли к выводу, что эти глубокие различия между разными стадиями развития или разными тканями в отношении экспрессии генов лежат в основе их функциональной дифференцировки. Таким образом, в дифференцировке, происходящей в процессе развития, участвует дифференциальная экспрессия тысяч генов в виде мРНК, и эта экспрессия сопровождается изменением состава мРНК, синтезируемых ядрами клеток, претерпевающих дифференцировку.
Если дифференциальное действие генов должно вызываться факторами, локализованными в цитоплазме, то должны существовать доказательства в пользу того, что компоненты цитоплазмы действительно способны направлять функцию ядра. Такие доказательства получены в экспериментах по трансплантации ядра из клетки одного типа в клетку какого-либо другого типа. Ярким примером такого подхода служат эксперименты по введению ядер клеток головного мозга взрослой лягушки в лягушачьи клетки-реципиенты трех типов, проведенные Грэхемом с сотрудниками (Gracham et al.) и Гёрдоном (J. Gurdon) в лаборатории последнего. Ядра из клеток головного мозга взрослой лягушки обычно не синтезируют ДНК и не претерпевают митоза. Эти ядра вводили:
1) в незрелые ооциты, синтезирующие РНК, но не ДНК; 2) в овулировавшие ооциты, завершающие мейоз и содержащие уплотненные хромосомы на веретенах мейоза; 3) в яйцеклетки сразу после активации, синтезирующие ДНК, но не РНК. Во всех случаях введенные ядра изменяли свою активность, так чтобы она соответствовала характеристикам клеток-реципиентов. Так, например, в ядрах, введенных в созревающие ооциты, хромосомы уплотнялись и ассоциировались с веретенами, а в ядрах, введенных в активированные яйца, начинался синтез ДНК. Поскольку ни та ни другая активность несвойственны ядрам клеток мозга, эти новые активности, очевидно, вызывались цитоплазмой клеток-реципиентов. Сходные эксперименты по пересадке ядер показали также, что транскрипция определенных генов в пересаженных ядрах (а именно, генов рибосомной РНК) регулируется цитоплазмой клетки-хозяина.
Влияние цитоплазмы на ядро достигает такой степени, что оно определяет специфические типы синтеза мРНК. Де Робертис и Гёрдон (De Robertis и Gurdon) вводили ядра клеток шпорцевой лягушки (Xenopus), выращивавшихся в культуре ткани, в ооциты тритона Pleuradeles. Используя высокое разрешение с помощью двумерного гель-электрофореза, они могли отличать синтез белков, характерных для Xenopus, от белков, характерных для культивируемых клеток Pleurodeles, а также синтеза белков, характерных для культивируемых клеток Xenopus, от белков, характерных для ее ооцитов. При пересадке ядер из культивируемых клеток Xenopus в ооциты Pleurodeles в них начинали синтезироваться белки, свойственные ооцитам Xenopus, но не культивируемым клеткам. Эти изменения состава синтезируемых белков можно было предотвратить при помощи ?-аманитина - вещества, подавляющего синтез РНК. Таким образом, воздействие цитоплазматической среды ооцитов Pseudourodeles на ядра Xenopus заключалось в инактивации экспрессии одного набора генов и активации экспрессии другого набора, характерного для ооцитов.
Цитоплазма оказывает свое регулирующее действие на ядерную активность, скорее всего, на уровне транскрипции; известны случаи специфической транскрипции генов при дифференцировке. Один такой пример связан с кольцами Бальбиани в политенных хромосомах двукрылых. У мух и других двукрылых клетки некоторых тканей (слюнные железы, мальпигиевы сосуды, средняя кишка) содержат гигантские политенные хромосомы, в которых при окраске на ДНК выявляются четко выраженные поперечные полосы (диски). Показано, что многие отдельные полосы соответствуют местоположению отдельных генов и что можно установить корреляцию между генетической картой, с одной стороны, и характером и относительным физическим расположением полос, с другой. В некоторых дифференцированных клетках ограниченное число определенных полос образуют вздутия, выступающие за пределы хромосомы (пуфы). Особенно большие пуфы - кольца Бальбиани возникают в тех участках, в которых находятся гены, необычайно активные в отношении транскрипции. Кольца Бальбиани обладают четырьмя важными свойствами.
1. Клетки разного типа содержат разные кольца Бальбиани. Так, в слюнных железах двукрылого Acricotopus имеются клетки трех типов, которые все содержат одни и те же три гигантские хромосомы, но хромосомы из разных клеток различаются по характеру пуфов и их распределению.
2. Изменения, происходящие в клетках некоторых типов в процессе развития, коррелируют с изменениями в характере пуфов. У некоторых мух гигантские клетки подушечек на лапках в процессе развития претерпевают сложные изменения, сопровождающиеся упорядоченными последовательными изменениями пуфов политенных хромосом.
3. Кольца Бальбиани в политенных хромосомах служат местами активной транскрипции. Дэйнхолту (Daneholt) удалось изолировать единственную в своем роде высокомолекулярную РНК, транскрибированную в одном из колец Бальбиани мотыля Chironomus.
4. Существует прямая корреляция между наличием данного кольца Бальбиани и синтезом определенного белка. Гроссбах (Grossbach) изучал два близкородственных вида: Chironomus tentans и С. pallidivittatus, слюнные железы которых вырабатывают большие количества секреторных белков. В слюнных железах С. tentans синтезируется пять белков, а в железах С. pallidivittatus - те же пять белков и еще один. Синтез этого шестого белка коррелирует с наличием в 4-й хромосоме С. pallidivittatus определенного пуфа, отсутствующего у С. tentans. Скрещивая эти два вида и изучая полученные гибриды, Гроссбах показал, что синтез шестого белка у гибридов зависит от наличия у них 4-й хромосомы С. pallidivittatus с этим особым пуфом.
До недавнего времени такого рода данные рассматривали как доказательство того, что дифференциальная экспрессия генов в процессе развития обусловлена главным образом дифференциальной транскрипцией генов, как это ясно видно в случае колец Бальбиани. Однако некоторые недавние наблюдения заставили отнестись к этому заключению с некоторой осторожностью, поскольку может оказаться, что столь же важную роль играет регуляция экспрессии генов и на других уровнях.
Сложность или число различных уникальных последовательностей ДНК, представленных в виде РНК, обычно в 5-10 раз выше в ядерной РНК, чем в мРНК. Ядерные РНК, представляющие собой непосредственные продукты транскрипции, длиннее, чем мРНК, и содержат предшественники последних. Простая модель дифференциальной транскрипции требует, чтобы две стадии развития с сильно различающимися популяциями матричных РНК, подобные тем, которые изучал Галау, существенно различались и по своим ядерным РНК. Клин и Хамфри (Kleene, Humphreys) сравнивали ядерные РНК, имеющиеся у морского ежа на двух разных стадиях развития, и столкнулись с неожиданностью: число уникальных последовательностей ДНК, транскрибируемых в ядерные РНК, было очень велико (транскрибировалась примерно треть всех этих последовательностей), а последовательности ядерных РНК, присутствующие на этих двух стадиях, были идентичны. Такое сходство между ядерными РНК наблюдается на всех стадиях жизненного цикла. Уолд и др. (Wold et al.) отмечают, что лишь немногие из последовательностей мРНК, транслируемых в белки у зародышей морского ежа на стадии бластулы, присутствуют также в цитоплазме клеток взрослых особей, тогда как в ядрах эти же последовательности содержатся как у зародышей, так и у взрослых особей. Создается впечатление, что в ядрах на всех стадиях развития транскрибируется одно и то же очень большое число структурных генов, но что лишь определенные подмножества этих транскриптов подвергаются процессингу с образованием специфичных мРНК, транслируемых на каждой отдельной стадии.
Наличие транскрипционных, а также посттранскрипционных механизмов, регулирующих дифференциальную экспрессию генов, определяемую ядром, в конечном итоге затрудняет понимание факторов, регулирующих действие генов, однако существование этих механизмов не меняет вытекающий из всего нашего обсуждения основной эмбриологический вывод. Суть гипотезы, схематически изображенной на рис. 4-3, состоит в том, что определенные макромолекулы, локализованные в цитоплазме и распределенные по некоторым бластомерам зародыша, вызывают в этих бластомерах специфичную экспрессию генов, определяемую ядром.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава 12. Фенотипы хозяев как экспрессия генов паразитов
Глава 12. Фенотипы хозяев как экспрессия генов паразитов Давайте бегло осмотримся в точке, которой мы достигли на нашем марше во внешний мир. Фенотипическая экспрессия гена может простираться за пределы клетки, в которой проявляется его непосредственное биохимическое
ДИФФЕРЕНЦИАЛЬНАЯ СЕНСОРНАЯ ЧУВСТВИТЕЛЬНОСТЬ
ДИФФЕРЕНЦИАЛЬНАЯ СЕНСОРНАЯ ЧУВСТВИТЕЛЬНОСТЬ Дифференциальная сенсорная чувствительность основана на способности сенсорной системы к различению сигналов. Важная характеристика каждой сенсорной системы – способность замечать различия в свойствах одновременно или
2.12. Дифференциальная чувствительность зрения
2.12. Дифференциальная чувствительность зрения Если на освещённую поверхность с яркостью I падает добавочное освещение dI, то, согласно закону Вебера, человек заметит разницу в освещённости только если dI/I = К, где К – константа, равная 0,01–0,015. Величину dI/I называют
Дифференциальная выживаемость необходима для видообразования
Дифференциальная выживаемость необходима для видообразования Еще один принцип эволюционного видообразования путем искусственного или естественного отбора — дифференциальная выживаемость. При искусственном отборе это означает, что селекционер одним животным дает
Роль племенного кобеля в процессе спаривания
Роль племенного кобеля в процессе спаривания Как только кобель будет достаточно стимулирован сукой и захочет ее повязать, он взбирается на нее и крепко охватывает ее передними ногами, кончик полового члена выходит из препуция и после серии сильных попыток приникает в
Гибель клеток в процессе нормального развития
Гибель клеток в процессе нормального развития Дегенерация вольфовых протоков в процессе развития особей женского пола и мюллеровых каналов у особей мужского пола - примеры наличия структур, которые вначале развиваются, а затем подвергаются некрозу. Эти процессы,
Гены, вступающие в действие на более поздних стадиях развития и в процессе роста
Гены, вступающие в действие на более поздних стадиях развития и в процессе роста Ясно, что мутации генов, непосредственно определяющих морфогенетические пути, в особенности тех генов, которые действуют на ранних стадиях, могут вызывать чрезвычайно резкие изменения
Глава 10 Адаптации экспрессии генов в процессе развития
Глава 10 Адаптации экспрессии генов в процессе развития Жизнь -это сила, которая проделывает бесчисленное множество экспериментов, пытаясь организовать себя ... мамонт и человек, мышь и мегатерий, мухи и отцы церкви - все это результаты более или менее успешных попыток
Сколько генов необходимо для развития?
Сколько генов необходимо для развития? К счастью, существуют методы, позволяющие оценить количество генетической информации, имеющейся у высших организмов. Один из самых тонких таких методов - классическая менделевская генетика. Главная трудность, связанная с этим
Роль племенного кобеля в процессе спаривания
Роль племенного кобеля в процессе спаривания Как только кобель будет достаточно стимулирован сукой и захочет ее повязать, он взбирается на нее и крепко охватывает ее передними ногами, кончик полового члена выходит из препуция и после серии сильных попыток приникает в
ЗНАЧЕНИЕ АКВАРИУМА В УЧЕБНОМ ПРОЦЕССЕ
ЗНАЧЕНИЕ АКВАРИУМА В УЧЕБНОМ ПРОЦЕССЕ Аквариумы всегда привлекают детей разного возраста, вызывают их удивление, возбуждают любознательность. Но в условиях школы, когда ставится задача использовать аквариум на уроках ботаники, зоологии, общей; биологии, его
Дифференциальная диагностика, прогноз и лечение пороков сердца
Дифференциальная диагностика, прогноз и лечение пороков сердца Шумы, возникающие при пороках сердца, имеют особое значение для установления диагноза.Электрокардиография играет вспомогательную роль.В дифференциальном диагнозе необходимо исключить эндокардит и
5. Теория стадийного развития и особенности развития животных
5. Теория стадийного развития и особенности развития животных В основе управления развитием организмов лежит теория стадийного развития, которую сформулировал академик Т. Д. Лысенко, исходя из работы И. В. Мичурина и многочисленных собственных исследований.Несмотря на
Состояние больных в процессе лечения
Состояние больных в процессе лечения На основании клинических наблюдений и лабораторных исследований в динамике клинического состояния больных в процессе лечения можно было отметить 6 стадий, из которых 3 относятся к разгрузочному периоду и 3 — к восстановительному.Эти