Морфологическая и молекулярная рекапитуляция. «Треснувшее зеркало»
Морфологическая и молекулярная рекапитуляция. «Треснувшее зеркало»
Джордж Уолд (G. Wald) начинает свое обсуждение молекулярной рекапитуляции со следующего утверждения: «Живые организмы представляют собой сильно увеличенные выражения тех молекул, из которых они слагаются». Такое утверждение - одновременно и трюизм, и преувеличение, но в нем выявлен некий общий принцип, приложимый как к молекулярным системам, так и к зародышам. В системах, в которых происходят сложные взаимодействия, эволюционные изменения сдерживаются необходимостью сохранения функциональной интегрированности. Это проявляется на самых фундаментальных уровнях генной экспрессии: от бактерий до млекопитающих генетический код остается почти неизменным. Лишь обратившись к митохондриям, этим во многом загадочным продуктам эволюции, можно обнаружить хоть какие-то изменения смысла кодонов. Такие сложные надмолекулярные структуры, как рибосомы, также глубоко консервативны, и их строение в своей основе одинаково у про- и эукариот. Аналогичные ограничения эволюционных модификаций процессов развития существуют в ситуациях, связанных с индукционными взаимодействиями между развивающимися структурами внутри зародыша. Если, как это часто случается, индукционные взаимодействия образуют сложный каскад, то он сохраняется на протяжении всей чрезвычайно длительной истории той крупной группы, у которой он имеется. Результатом является морфологическая рекапитуляция.
Если в основе морфологической рекапитуляции лежат конкретные механизмы, то не представляет ли собой последовательность активирующихся генов, участвующих в развитии, аналогичную молекулярную рекапитуляцию? Вопрос этот совершенно закономерен, потому что морфологические преобразования, например метаморфоз, обычно сопровождаются включением и выключением генов, и это может свидетельствовать о наличии связи между морфогенетическим событием и сопутствующими ему биохимическими изменениями. И наоборот, если в какой-либо последовательности процессов развития можно продемонстрировать отсутствие рекапитуляции в последовательности молекулярных процессов, то это могло бы свидетельствовать о разобщенности путей морфологической и молекулярной эволюции. Как и в случаях диссоциаций, рассмотренных в гл. 5, разобщение биохимических событий от консервативной последовательности морфогенетических процессов открывает реальные возможности для эволюционной модификации онтогенеза.
Главная задача при экскреции азотсодержащих конечных продуктов обмена веществ у позвоночных состоит в удалении из организма аммиака - высокотоксичного продукта реакций дезаминирования, осуществляющих начальные этапы катаболизма аминокислот. Водные животные, и в том числе большинство рыб, просто выделяют аммиак через жабры в окружающую воду. Для наземных животных такой способ непригоден, потому что они не переносят высокого содержания аммиака в организме и не могут позволить себе расходовать большие количества воды, которые потребовались бы для выделения разбавленного аммиака непосредственно с мочой. Наземным животным приходится превращать аммиак в менее токсичное соединение, которое может накапливаться в организме в концентрированной форме, а затем выделяться. У кистеперых предков амфибий в процессе эволюции выработался так называемый цикл мочевины, в процессе которого происходило превращение аммиака и двуокиси углерода в относительно нетоксичное соединение - мочевину. Кистеперые, которые, подобно своим ныне живущим родичам - двоякодышащим, дышали при помощи легких, совершили переход к наземной жизни во время длительного периода засухи, охватившей большую территорию. Когда реки и пруды, в которых они обитали, пересохли, кистеперые смогли, неуклюже перемещаясь по суше, отправиться на поиски других водоемов. Последствия такого рода активности для выделения азота можно до сих пор наблюдать у ныне живущих двоякодышащих Protopterus и Lepidosiren, которые при нормальной жизни в водной среде являются аммониотелическими (т.е. выделяют аммиак). Однако в сезон засухи эти рыбы впадают в летнюю спячку, забираясь в трещины, образующиеся в затвердевшем иле при высыхании водоемов. Летняя спячка представляет собой еще одну стратегию, позволяющую пережить период засухи; она отличается от стратегии, к которой прибегали древние кистеперые, но приводит к тому же результату - к невозможности выделения в таких условиях аммиака. Во время летней спячки выделение аммиака у двоякодышащих прекращается и они превращают аммиак в мочевину, которая накапливается в организме, а затем при наступлении сезона дождей выделяется. Коэн и Браун (Cohen, Brown) высказали предположение, что кистеперые были преадаптированы к уреотелии (выделению мочевины) тем, что ферменты, участвующие в цикле мочевины, уже существовали и, возможно, использовались при синтезе аминокислоты аргинина. Уреотелию кистеперых унаследовали амфибии. Ныне живущие амфибии повторяют в своем развитии переход от водного к наземному образу жизни, совершенный их предками. У них наблюдается также интересный, очевидно рекапитуляционный, переход в отношении способа выделения азота. Головастики выделяют его в виде аммиака, но при метаморфозе у них происходит переход к уреотелии. Коэн и Браун изучили ферментную основу этого перехода. Активности отдельных ферментов, участвующих в цикле мочевины, резко повышаются в процессе метаморфоза. Они считают, что в этом случае имеет место рекапитуляция, потому что переход к уреотелии совершается до того, как головастик действительно выходит из воды.
Не все амфибии после метаморфоза переходят к наземному образу жизни. Как указывают Андерхей и Болдуин (Underhay, Baldwin), для Xenopus laevis, постоянно живущей в воде, на стадии головастика характерна аммониотелия, но во время метаморфоза начинается переход к уреотелии. Однако по завершении метаморфоза лягушка вновь становится аммониотелической, хотя ферменты, участвующие в цикле мочевины, у нее имеются и функционируют. Является ли этот переход к уреотелии рекапитуляцией или адаптацией? Возможно, и тем и другим. Xenopus, как правило, обитает в воде и вполне может обходиться без выделения мочевины. Но во время засушливого сезона эта лягушка может впадать в спячку, что было бы невозможно, если бы она не обладала способностью переходить от аммониотелии к уреотелии, подобно тому как это делают двоякодышащие рыбы. Сохранение аммониотелии у взрослых особей Xenopus типично для других водных амфибий, в том числе для педоморфных хвостатых амфибий, которые фактически никогда не претерпевают метаморфоза. Концепция рекапитуляции снова привлекла к себе внимание в связи с обнаружением любопытного вторичного метаморфоза у американского тритона Notophthalmus (Triturus) viridescens. Этот тритон начинает личиночную жизнь как неприметное оливково-зеленое водное животное, снабженное жабрами. Как и следует ожидать, он выделяет аммиак. Спустя несколько месяцев этот тритон метаморфизирует в полностью наземную уреотелическую форму с ярко-красной окраской и легочным дыханием. Через два-три года достигший дефинитивных размеров тритон претерпевает вторичный метаморфоз, возвращаясь к водному образу жизни в качестве половозрелой формы. В результате этого вторичного метаморфоза тритон вновь приобретает некоторые личиночные признаки - зеленую окраску, плавниковую складку на хвосте и функционирующие органы боковой линии. Жабры не восстанавливаются. При вторичном метаморфозе происходят также биохимические изменения. Например, в главном зрительном пигменте происходит переход от витамина A1 к витамину А2. Уолд показал, что наличие витамина A1 типично для наземных позвоночных, а витамина А2 - для пресноводных форм. Так, тритон в личиночном состоянии использует витамин А2, при первом метаморфозе переключается на витамин A1, а затем при вторичном метаморфозе вновь возвращается к витамину А2. Подобным же образом Наш и Фанкхаузер (Nash, Fankhauser) обнаружили, что в то время как половозрелый тритон остается главным образом уреотелическим, после второго метаморфоза 25% азота выделяется у него в виде аммиака.
Как показано на рис. 6-8, цикл мочевины сохранился у млекопитающих, но у большинства рептилий и у всех птиц он утрачен. Один из наиболее часто приводимых примеров возможной молекулярной рекапитуляции связан с наблюдениями, которые первоначально сделал Нидхем (Needham), изучая выделение азота у куриных зародышей. Однако в этом случае изменения в развитии, которые на первый взгляд кажутся рекапитуляционными, на самом деле при более подробном изучении происходящих при этом молекулярных событий оказываются иными. По данным Нидхема, куриный зародыш в первые несколько дней развития выделяет аммиак, затем мочевину и наконец мочевую кислоту. Мочевая кислота представляет собой пурин, и ее образование никак не связано с циклом мочевины. У взрослых кур цикл мочевины отсутствует и азот выделяется исключительно в виде мочевой кислоты. Все эти изменения путей выделения азота в процессе развития очень сходны с их изменениями в процессе эволюционного развития птиц. Однако подробное изучение последовательности реакций, участвующих в выделении азота, позволяет предполагать лишь самую поверхностную рекапитуляцию. Как показало решающее исследование этой проблемы, проведенное Фишером и Икином (Fischer, Eakin), содержание аммиака в яйце мало изменяется в процессе развития и активного выделения его не происходит. Содержание мочевины действительно повышается, и она экскретируется в аллантоис. Но цикл мочевины отсутствует; мочевина образуется в результате распада аргинина желточного происхождения под действием фермента аргиназы. Активность аргиназы - единственного концевого фермента цикла мочевины - ограничена не только печенью, как это можно было ожидать для уреотелического организма, а, по-видимому, присутствует во всех тканях организма.
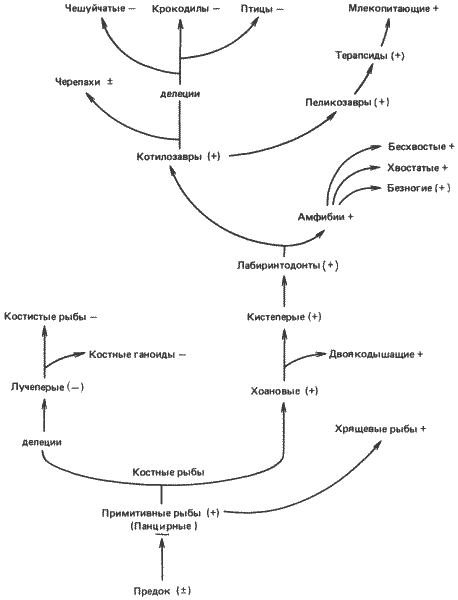
Рис. 6-8. Цикл мочевины и филогения позвоночных. Группы со значком «плюс» обладают функционирующим циклом мочевины; у групп со значком «минус» такой цикл отсутствует. Эти же значки в скобках означают постулированные наличие или отсутствие цикла мочевины. «Делеция» указывает на утрату одного или нескольких ферментов цикла мочевины (Brown, Cohen, 1960).
Аналогичный комплекс изменений метаболизма азота потенциально рекапитуляционного характера происходит в процессе развития змей. Взрослые змеи - урикотелические организмы, и у них нет цикла мочевины, хотя в их организме имеется аргиназа. Однако у зародышей змей выделение азота происходит совершенно иначе, чем у взрослых особей. Как установили Кларк (Clark) и его сотрудники, зародыши и черного полоза (Coluber constrictor), развивающиеся в типичном для рептилий яйце, и обыкновенной подвязочной змеи (Thamnophis sirtalis), развивающиеся в теле матери, прикрепившись к плаценте, выделяют большие количества мочевины. К сожалению, остается неизвестным, действительно ли у этих зародышей имеется цикл мочевины или же мочевина образуется у них, как у куриных зародышей, под действием одной лишь аргиназы.
Если в развитии путей выделения азота у куриного зародыша рекапитуляция отсутствует, то в морфологическом развитии самой почки у него наблюдается явно выраженная рекапитуляция. У позвоночных существуют три главных типа почек: пронефрос, мезонефрос и метанефрос. Почка позвоночных образуется из мезодермы, расположенной на каждой стороне тела. Передняя часть нефрогенной ткани дифференцируется в несколько канальцев, расположенных посегментно; от каждого канальца отходит трубочка; все вместе они образуют проток пронефроса, открывающийся на поверхности задней части тела животного. Пронефрос, или предпочка, функционирует у личинок рыб и амфибий и связан с выделением аммиака. В процессе развития у некоторых видов рыб пронефрос дополняется, а у всех остальных позвоночных замещается сдвинутым дальше от переднего конца тела мезонефросом, или первичной почкой. По мере дегенерации канальцев пронефроса проток пронефроса переходит в проток мезонефроса, или вольфов проток. Мезонефрос служит дефинитивной почкой у рыб и амфибий, у которых через нее выделяется аммиак или мочевина. У рептилий, птиц и млекопитающих развитие почки протекает сложнее. Сначала образуются нефункционирующие канальцы пронефроса, которые замещаются функциональным мезонефросом. Мезонефрос в свою очередь замещается развивающимся позднее метанефросом, или вторичной почкой, которая становится дефинитивной почкой взрослого организма. У млекопитающих метанефрос выделяет мочевину, а у рептилий и птиц - мочевую кислоту.
В процессе развития курицы эти три почки последовательно сменяют друг друга. Пронефрос появляется на второй день развития, и его канальцы никогда не становятся функциональными. Однако проток пронефроса, из которого образуется вольфов проток, имеет важное значение для дальнейшей дифференцировки почки. Как показано на рис. 6-9, вольфов проток индуцирует развитие части репродуктивной системы, мюллерова канала, а также канальцев мезо- и метанефроса. Мезонефрос начинает функционировать примерно на 4-й день развития куриного зародыша, а к 14-му дню достигает максимальной активности. Затем он дегенерирует. Его функции принимает на себя метанефрос, который начинает функционировать на 11-й день. Если молекулярная рекапитуляция протекала бы в этой системе в соответствии с морфологической рекапитуляцией, то мезонефрос должен был выделять мочевину, а не мочевую кислоту.
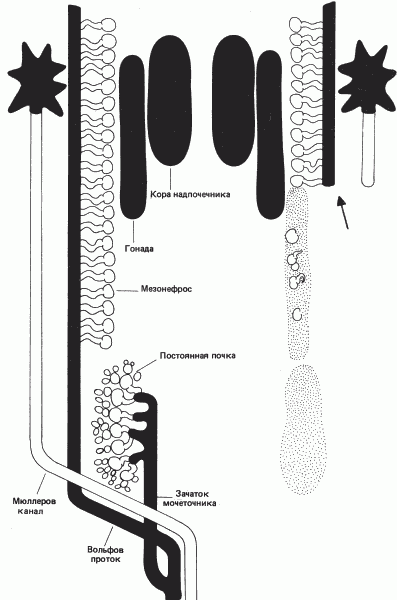
Рис. 6-9. Схема развития куриной почки. Нефункционирующие канальцы пронефроса (на схеме не показаны) появляются на второй день развития. Развитие почки продолжается, когда примерно на 4-й день появляется функционирующий мезонефрос, а примерно на 11-й день-постоянная почка (метанефрос). Вольфов проток возникает как проток пронефроса. Он необходим для индукции развития почечных канальцев и роста мюллерова канала. Как схематически показано на правой стороне рисунка, если разрушить вольфов проток, то образования этих других структур не происходит (Gruenwald, 1952).
Второй возможный тип молекулярной рекапитуляции Цуккеркандль (Zucherkandl) сформулировал следующим образом: «Не являются ли полипептидные цепи, функционирующие в зародыше, эволюционно более древними, чем полипептидные цепи взрослого организма?» Имеются данные, позволяющие проверить, существует ли рекапитуляция такого типа. Цуккеркандль создал очень простой тест для проверки этого явления. Основываясь на гемоглобинах, для которых последовательность аминокислот установить легко, Цуккеркандль предположил, что достаточно лишь сравнить последовательности гемоглобина плода и гемоглобина взрослого типа с общей для них предковой последовательностью. Если глобин плода рекапитулируется, то он должен дивергировать от предковой последовательности меньше, чем соответствующий глобин взрослого типа. Поскольку у ?-глобинов (включая фетальную ?-цепь) и ?-глобинов человека имеется общая предковая последовательность, можно проводить прямые сравнения последовательностей ?- и ?-глобинов и ?- и ?-глобинов человека (рис. 6-10). Оба отличаются от ?-последовательности примерно по 55 замещениям. Таким образом, между скоростями эволюции ?-и ?-цепей нет разницы. У коровы обнаружена такая же степень сходства между «?»- и ?-цепями и ?-глобином, причем «?»-цепь коровы даже ближе к ?-цепи, чем к ?-цепи человека.
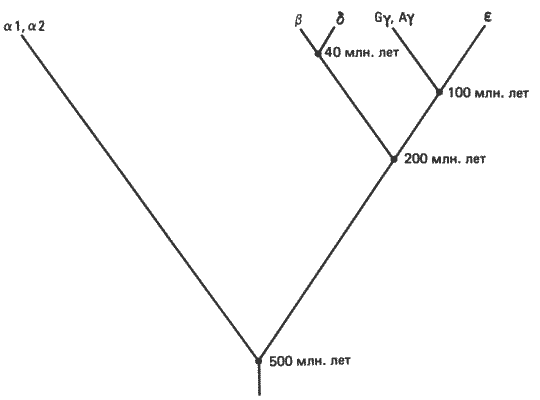
Рис. 6-10. Эволюционное древо генов человека, определяющих ?-подобные глобины. Дивергенция между генами ?- и ?-глобинов произошла примерно 500·106 лет назад. Эфстратиадис и др. предполагают, что дивергенция гена ?-глобина взрослого типа от предкового гена эмбрионального глобина произошла в ранний период эволюции млекопитающих от звероподобных рептилий, а дивергенция гена эмбрионального ?-глобина от генов эмбриональной цепи - в начале радиации плацентарных млекопитающих (Efstratiadis et al., 1980).
Цуккеркандль не только не подтвердил наличия рекапитуляции в последовательности ?-цепи фетального гемоглобина, но и упорно настаивает, что ?-цепь гемоглобина человека возникла сравнительно недавно. Он приводит следующие доводы: судя по скорости замены аминокислот, типичной для глобинов, и по различиям в последовательностях ?- и ?-цепей, общий предок ?- и ?-цепей человека не может быть старше примерно 200 млн. лет, или, грубо говоря, относится к концу триаса. Примитивные млекопитающие того времени происходят от рептилий, происхождение которых можно проследить еще на 100 млн. лет назад, а затем еще на 150 млн. лет назад, до древней формы, послужившей предком всех позвоночных. Эмбриональные гемоглобины имеются у рептилий, амфибий и рыб, и вполне вероятно, что они имелись и у их предков. У форм, составлявших эволюционную линию, ведущую к человеку, эмбриональные гемоглобины имелись задолго до возникновения нынешней ?-цепи. Таким образом, фетальные «не-?-цепи», по-видимому, возникли в результате независимых генных дупликаций и сменяли одна другую в процессе эволюции гемоглобина.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава 2. Молекулярная архитектура белков
Глава 2. Молекулярная архитектура белков Не будем скрывать: покончив с первой главой, авторы (а возможно, и читатель) испытали некоторое облегчение. В конце концов цель ее заключалась лишь в том, чтобы дать читателю сведения, необходимые для понимания последующих глав,
ДНК — МОЛЕКУЛЯРНАЯ ОСНОВА ГЕНОМА
ДНК — МОЛЕКУЛЯРНАЯ ОСНОВА ГЕНОМА Сколько истин, признаваемых нами в настоящее время бесспорными, в момент провозглашения их казались лишь парадоксами или даже ересями! Екатерина II Что мыслимо — то возможно, что возможно — то мыслимо. Г. Лейбниц Тонкое устройство
ДНК — МОЛЕКУЛЯРНАЯ ОСНОВА ГЕНОМА
ДНК — МОЛЕКУЛЯРНАЯ ОСНОВА ГЕНОМА Сколько истин, признаваемых нами в настоящее время бесспорными, в момент провозглашения их казались лишь парадоксами или даже ересями! Екатерина II Что мыслимо — то возможно, что возможно — то мыслимо. Г. Лейбниц Тонкое устройство
Глава 13 Молекулярная биология. протеин
Глава 13 Молекулярная биология. протеин Энзимы и коэнзимЫXX в. открывал все новые и новые детали метаболизма клетки. Каждая метаболическая реакция, как выяснилось, катализируется каким-то определенным энзимом. Для того чтобы понять природу метаболизма, нужно исследовать
Глава 14 Молекулярная биология. нуклеиновые кислоты
Глава 14 Молекулярная биология. нуклеиновые кислоты Вирусы и геныКак только молекулы протеина вошли под контроль науки, неожиданно обнаружилось, что на роль первородных кирпичиков жизни претендуют совсем иные, нежели предполагали ученые, структуры. Эти структуры вышли
Рекапитуляция, или повторение признаков предковых форм
Рекапитуляция, или повторение признаков предковых форм Особенностью раннего развития является так называемая рекапитуляция предковых стадий, когда организм в течение своего зародышевого развития как бы проходит в общих чертах основные этапы развития всего ряда
Глава 6. Молекулярная генетика
Глава 6. Молекулярная генетика Поиски причин – занятие, не имеющее конца. У каждой причины есть своя причина, и нам приходится изучать все более и более отдаленные моменты в прошлом. Н. Тинберген (1907–1988), выдающийся голландский биолог, один из основателей этологии, лауреат
Онтогенез, филогенез и рекапитуляция
Онтогенез, филогенез и рекапитуляция В «Зазеркалье» Белая Королева сообщает Алисе, что в иные дни она успевала поверить в целых шесть невозможных вещей еще до завтрака. Для современного читателя история развития представлений о связи между онтогенезом и эволюцией носит
Глава 3 Морфологическая и молекулярная эволюция
Глава 3 Морфологическая и молекулярная эволюция Я думаю, что отец наш небесный выдумал человека, потому что разочаровался в обезьяне. Марк
Древесные саламандры и лягушки без головастиков. Гетерохрония и морфологическая адаптация
Древесные саламандры и лягушки без головастиков. Гетерохрония и морфологическая адаптация Почему гетерохрония может служить таким обычным способом эволюции? Ответ на этот вопрос, по-видимому, заключен в характеристике, которую дал эволюции Ф. Жакоб (F. Jacob). По его словам,
Тема 6. Молекулярная генетика
Тема 6. Молекулярная генетика Кто ясно мыслит, тот ясно излагает. А. Шопенгауэр (1788–1860), немецкий философ Молекулярная генетика изучает молекулярные основы наследственности и изменчивости. Основное положение молекулярной генетики связано с признанием ведущей роли
Глава 5. Нуклеиновые кислоты и молекулярная репликация
Глава 5. Нуклеиновые кислоты и молекулярная репликация Теперь, когда мы в несколько абстрактных выражениях описали требования к живой системе, мы должны подробнее рассмотреть, как осуществляются различные процессы в тех организмах, которые мы видим повсюду. Как мы уже
МОЛЕКУЛЯРНАЯ ЭКОЛОГИЯ
МОЛЕКУЛЯРНАЯ ЭКОЛОГИЯ В прессе часто появляются заметки о том, что торговцы дикими животными пытаются продавать запрещенные виды или продукты, изготовленные из вымирающих видов животных, прикрываясь торговлей вполне легальным товаром.Один из способов разрешения
Как молекулярная биология высадилась на Луну
Как молекулярная биология высадилась на Луну Передавая свой геном по наследству, человек тем самым вручает потомству сохраненные в ДНК тексты, которые определяют большую часть структуры и свойств его жизни. Это обстоятельство объясняет, почему в июне 2000 года генетики