Интеграция
Интеграция
В своем анализе переворотов в науке Томас Кун (Thomas Kuhn) высказал мнение, что главная отличительная черта этих переворотов - изменение взгляда на мир, или то, что Кун называл парадигмой. Наблюдения, которые прежде было трудно истолковать, укладываются теперь в рамки связной теории, способной делать предсказания и давать объяснения. Биология пережила свою долю переворотов, в том числе тот из них, который вызвала дарвиновская теория эволюции, оказавшая в разных формах самое глубокое влияние не только на биологию, но и на общество в широком смысле. Один из крупных недавних переворотов произошел в 1961 г., когда Франсуа Жакоб и Жак Моно (Francois Jacob, Jaques Monod) опубликовали свою модель оперона, контролирующего экспрессию генов у бактерий. Эта модель позволила связать экспрессию структурных генов с контролирующей активностью некоего белка, кодируемого регуляторным геном, локализованным в каком-то другом участке генома; она позволила также объяснить, каким образом проникающие в клетку малые молекулы могут взаимодействовать с регуляторным белком, координируя экспрессию структурных генов, участвующих в отдельных метаболических процессах. Модель оперона положила начало периоду увлекательных и плодотворных исследований генной регуляции у бактерий. Не удивительно, что успешность предсказаний, сделанных с помощью этой модели, и ее огромная эвристическая ценность неизбежно привели к ее приложению к организации геномов Metazoa. После того как геномы Metazoa были лучше изучены, первоначальные оптимистические попытки непосредственного приложения к ним модели оперона пришлось признать наивными. Тем не менее от этих попыток осталось некое наследство в виде концепции о регуляции экспрессии структурного гена продуктами удаленных от него регуляторных элементов, которые взаимодействуют с регуляторным сайтом, примыкающим к этому структурному гену. Как и у прокариот, генная регуляция у Metazoa в значительной мере состоит, по-видимому, в регуляции структурных генов, необходимых для дифференцировки, поддержания существования и метаболизма клеток. В отличие от прокариот Metazoa образуют клетки многих разных типов, организованные в различные дискретные и стабильные ткани. Для регуляции экспрессии структурных генов в этих разных клетках или тканях необходима координированная экспрессия набора генов, специфичных для клеток каждого типа, а также экспрессия более обширного набора генов, активных в клетках многих или даже всех типов. Широко известная модель для такого рода цитоспецифичной координации регуляции генных комплексов была предложена Бриттеном и Дэвидсоном (Britten, Davidson) в 1969 г.; она схематически изображена на рис. 12-2. Интеграция обеспечивается в результате активации сенсорных последовательностей, реагирующих на воздействия извне, которым подвергается клетка (например, гормоны или индукционные сигналы от соседних клеток). Эти последовательности в свою очередь активируют особые гены-интеграторы, каждый из которых продуцирует молекулы специфичного активатора. Активаторы в свою очередь вступают во взаимодействие с соответствующими регуляторными последовательностями, примыкающими к структурным генам, и включают их, допуская их транскрипцию. Бриттен и Дэвидсон полагают, что активаторы - это транскрипторы умеренно повторяющихся последовательностей ДНК и что они непосредственно взаимодействуют, благодаря своей комплементарности с соответствующими повторяющимися последовательностями, действующими как примыкающие к генам контролирующие элементы. Очевидно, в этой формальной модели активаторами могут служить и белки.
В более позднем описании своей модели Дэвидсон и Бриттен указывают, что в таких случаях, как у зародышей морских ежей, у которых во всех клетках или на всех стадиях, по-видимому, содержатся одни и те же ядерные транскрипты, но различные наборы мРНК, интеграция может осуществляться при помощи транскриптов повторяющихся последовательностей, воздействующих на процессинг транскриптов, содержащих комплементарные копии данной повторяющейся последовательности. Однако, как показали Дермен и др. (Derman et al.), в исследованных ими тканях млекопитающих разнообразие мРНК зависит от дифференциальной транскрипции. Несмотря на потенциальную важность процессинга РНК для регуляции генной репрессии, первоначальная модель регуляции транскрипции, предложенная Бриттеном и Дэвидсоном, может служить разумным приближением к тому, как может происходить тканеспецифичная интеграция действия генов.
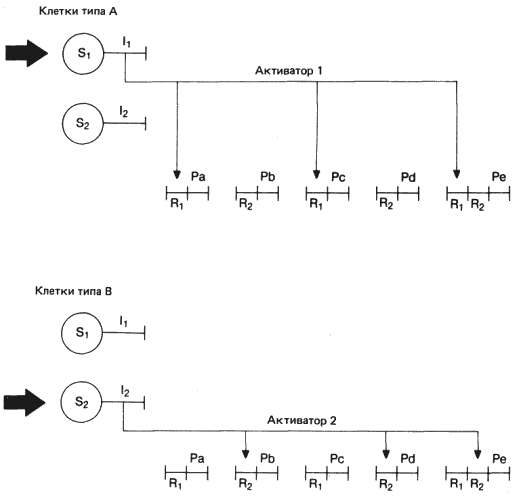
Рис. 12-2. Функции тканевой интегрирующей системы, регулирующей характер экспрессии батарей генов в клетках двух разных типов. Толстыми стрелками показаны индукционные или гормональные сигналы, поступающие в клетку извне. Эти сигналы вступают во взаимодействие с соответствующим сенсором, активируя определенный ген-интегратор. Продукт этого гена взаимодействует со специфическими регуляторными генами (R), примыкающими к структурным генам (Р). (Схема основана на модели Бриттена и Дэвидсона.)
Следует обратить внимание на некоторые особенности этой модели. Во-первых, гены могут использоваться в различных сочетаниях, образуя характерные тканеспецифичные батареи активных генов. Во-вторых, в такие батареи может входить большое число генов и, как указывает Кауфман (Kauffman) крупномасштабные взаимодействующие сети стабильны. Стабильность их может быть усилена наличием петель обратной связи, в которых продукт активированного структурного гена, являющегося членом такой батареи, может в свою очередь поддерживать активность соответствующих генов-интеграторов. В результате образуется усилительный контур, поддерживающий тканевую дифференцировку даже в отсутствие первоначального индукционного сигнала. В-третьих, для активации сложной батареи генов, определяющих биохимическую дифференцировку какой-либо ткани, необходим всего лишь простой набор сигналов, поступающих извне. Это согласуется с простотой химического строения гормонов и индукторов.
Установлено существование регуляторных элементов, обладающих некоторыми свойствами, постулированными для регуляторов тканевой интеграции. Абрахам и Доан (Abraham, Doane) на очень выразительном примере показали, что локализованная экспрессия структурного гена, кодирующего ?-амилазу в заднем участке средней кишки дрозофилы, контролируется регуляторным геном, активным в транс-положении. Как обнаружил Диккинсон (Dickinson), ген альдегидоксидазы у дрозофилы контролируется как удаленным от него регуляторным элементом, активным в транс-положении, так и, по-видимому, примыкающим элементом, активным в цис-положении. Контролирующее действие тканеспецифично. Оказалось, например, что один интересный вариант регулятора вызывает повышение уровня альдегидоксидазы в придаточных половых железах самца, но не оказывает действия на уровень этого фермента в других тканях. Этот аллель расположен вблизи структурного гена и действует, находясь в цис-положении. Диккинсон и Карсон (Dickinson, Carson) обнаружили также регуляторные элементы, активные в цис-положении, которые регулируют экспрессию гена алкогольдегидрогеназы в процессе развития у гавайских Drosophilidae. Интересно отметить, что, согласно Рабинау и Диккинсону (Rabinow, Dickinson), активный в цис-положении регуляторный элемент гена алкогольдегидрогеназы контролирует экспрессию этого гена на уровне синтеза мРНК.
В соответствии с нашими прежними обобщениями относительно регуляции развития, модель Бриттена и Дэвидсона выявляет функции переключения. Однако содержащихся в ней интегрирующих регуляторов недостаточно для управления морфогенезом. Например, передние и задние конечности позвоночных образованы из одних и тех же тканей: поперечнополосатых мышц, кожи, нервной и соединительной тканей и т. п. Если провести тонкий анализ тканей руки и ноги, то окажется, что они идентичны по характеру генной экспрессии, обладают одинаковыми тканеспецифичными батареями генов и тканевыми интегрирующими системами. Интеграция на уровне ткани действительно существует и играет важную роль в развитии, но для морфогенеза необходима интеграция иного рода, с участием иерархических систем, способных производить двоичный выбор в ответ на пространственно детерминированные типы информации. Такую интеграцию на уровне организма мы называем организменной интеграцией.
Природа организменной интеграции и ее генная регуляция наиболее четко выступают в регуляции индивидуальности сегментов у дрозофилы. Средне- и заднегрудь дрозофилы состоят в основном из одних и тех же тканей, но расположение тканей в этих двух сегментах сильно различается. Для подпрограмм, определяющих становление морфологии отдельных структур сегментов, необходима генетическая информация, детерминирующая клеточные морфогенетические процессы, перемещения клеток, изменения их формы, типы деления клеток и сродство между ними. Эти подпрограммы, обеспечивающие перевод генетической информации в морфологические структуры, пока еще мало изучены, хотя Гарсиа-Беллидо и Риполл (Garcia-Bellido, Ripoll) обсуждают некоторые мутации, оказывающие влияние на эти процессы. Это позволяет надеяться, что в будущем удастся провести более глубокий генетический анализ. Мы все еще не в состоянии установить подлинные механизмы морфогенеза, однако уже стало возможным обрисовать систему генных переключателей, при помощи которых первоначально устанавливается индивидуальность отдельных сегментов.
Существенный элемент модели, предложенной Гарсиа-Беллидо, состоит в том, что зародыш на стадии бластодермы содержит систему позиционной информации, определяющей положение по переднезадней и дорсовентральной оси. Степень экспрессии генов-активаторов, которые, возможно, соответствуют регуляторным генам extra sex comb и Poly comb, детерминируется локальным уровнем позиционной информации в небольшом участке поверхности бластодермы. Ширина полоски бластодермы, дающей начало одному сегменту, примерно соответствует диаметру трех или четырех клеток (Lohs-Schardin et al.). Уровень экспрессии гена-активатора в каждой узкой полоске клеток бластодермы детерминирует, какой из генов-селекторов (членов комплексов Bithorax или Antennapedia) должен быть в данный момент включен или выключен. Комбинация генов-селекторов, активных в каждом просегменте, регулирует экспрессию наборов генов, ответственных за реализацию подпрограмм, которые определяют морфологию отдельных сегментов. Продукты генов-активаторов действуют как репрессоры. Когда гены-селекторы комплексов ВХ-С (Bithorax) почти полностью репрессированы, активируется следующий набор генов, специфицирующих характер морфогенетических событий, ведущих к образованию структур среднегруди. По мере включения дополнительных членов комплекса ВХ-С активируются все более дивергентные наборы генов, действующих на уровне фенотипической реализации. Все это приводит к прерывистому морфологическому развитию от «исходного состояния», которым для сегментов, управляемых комплексом ВХ-С, является морфология среднегруди. Так, передне-грудь по многим признакам сходна со среднегрудью, тогда как брюшные сегменты отличаются от нее очень сильно. Наиболее резкие отклонения от исходного состояния наблюдаются в восьмом брюшном сегменте, в котором гены-активаторы бездействуют, а все члены комплекса ВХ-С активны.
Эта модель генетической регуляции обрисовывает иерархическую контролирующую систему, действующую при помощи каскада генов-переключателей. Гены-активаторы участвуют в ней в качестве контролеров, уровни активности которых детерминируются характеристиками позиционной информации в данном сегменте. Гены-селекторы дифференцированно активируются в зависимости от положения клетки в бластодерме и сами действуют как комбинаторные переключатели в завершающем наборе морфологических подпрограмм. Эта система не занимается интеграцией на тканевом уровне. Экспрессия структурных генов, входящих в те батареи, которые детерминируют ткани, несомненно, координирована с экспрессией генов, контролирующих морфогенез; однако, ввиду того что в тканях различных компартментов экспрессируются одни и те же или очень сходные генные батареи, они, вероятно, регулируются тканевыми интегрирующими системами, обособленными от организменной интегрирующей системы. Кутикулы средне- и заднегруди идентичны по составу, но различаются по морфологии. В самом общем смысле тканевые интегрирующие системы, очевидно, обеспечивают образование основных типов клеток, тогда как организменная интегрирующая система определяет становление формы. Существование этих координированных, но раздельных систем интеграции подтверждается многочисленными примерами, свидетельствующими о диссоциации между цитодифференцировкой и морфогенезом.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
5. ИНТЕГРАЦИЯ ЗНАНИЙ ОБ ИНДИВИДУАЛЬНОСТИ
5. ИНТЕГРАЦИЯ ЗНАНИЙ ОБ ИНДИВИДУАЛЬНОСТИ В конце 80-х гг. с целью формирования новой стратегии исследования природы индивидуально-психологических различий между людьми В. М. Русалов разработал методику опросного типа для оценки ведущих параметров темперамента –
Взаимодействие и интеграция
Взаимодействие и интеграция В наши дни посетители музеев воспринимают выставленные в них смонтированные скелеты огромных вымерших животных как нечто само собой разумеющееся. Однако так было не всегда. Научные сведения о таких импозантных формах, как мамонты и