Мутации, воздействующие на развитие определенных органов
Мутации, воздействующие на развитие определенных органов
В то время как локус Т оказывает, по-видимому, самые разнообразные воздействия на все развитие эктодермы, существуют мутации, вызывающие более специфические дефекты. Примером служит мутация cardiac lethal (с) у аксолотля Ambystoma mexicanum. Эта мутация была впервые обнаружена и исследована Хэмфри (Humphrey). Хэмфри установил, что мутация с наследуется как простой аутосомный рецессивный признак, так что при скрещивании двух гетерозиготных особей (с/+) 25% потомков гибнет на ранних личиночных стадиях, вскоре после вылупления. Эти мутантные особи плавают, как нормальные личинки, но они раздуты переполняющей их жидкостью, а пищеварительная система и жабры у них недоразвиты (рис. 7-13). Первичная причина этих дефектов - нарушение развития сердца и его неспособность к сокращениям. Поэтому у мутантных личинок отсутствует кровообращение, а дышат они, вероятно, путем диффузии через кожу, что дает им возможность просуществовать лишь в течение ограниченного периода времени. Как показал Хэмфри путем сращивания нормального и мутантного зародышей, это нарушение развития сердца носит автономный характер.
Эксперимент Хэмфри схематически представлен на рис. 7-14. У мутантного и нормального зародышей, взятых до закладки сердца, удаляли по кусочку ткани с боковых поверхностей тела. Затем зародышей соединяли по месту раны и давали им срастись. В тех случаях, когда такие сросшиеся особи завершали развитие, было установлено, что нормальный партнер ослаблял раздутость и другие дефекты зародыша с/с, давая ему возможность выжить. Однако сердце мутантного партнера навсегда оставалось простой трубкой, неспособной к сокращениям, и кровообращение мутанта целиком обеспечивал нормальный партнер.
Установлено, что у позвоночных многие органы, в том числе сердце, развиваются в результате определенных индукционных взаимодействий, происходящих во время развития. В частности, Джекобсон и Дункан (Jacobson, Duncan) показали, что у хвостатых амфибий развитие сердца из мезодермальных зачатков индуцируется головным участком энтодермы. Причиной того, что особям с/с не удается образовать сердце, может быть неспособность головного участка энтодермы индуцировать этот процесс или же неспособность сердечной мезодермы реагировать на индуктор. Для того чтобы выяснить, какая из этих двух причин вызывает нарушение развития,
Хэмфри пересаживал нормальную сердечную мезодерму с/с-реципиентам, а мезодерму с/с-мутантов - нормальным реципиентам. Оказалось, что мезодерма с/с способна образовать сокращающееся сердце под индукционным воздействием нормального головного участка энтодермы, тогда как мутантные зародыши не могут обеспечить развитие нормального сердца. Эти результаты можно интерпретировать как указание на отсутствие индукционной активности головного участка энтодермы у мутанта с/с. Однако возможно также, что мутантные особи активно подавляют формирование сердца. Эксперименты, проведенные Лемански (Lemanski) и его сотрудниками, делают последнее предположение менее вероятным. Эти авторы выращивали in vitro мезодермальные зачатки сердца мутантных и нормальных зародышей. В использованных ими условиях в нормальной сердечной мезодерме происходили сильные сокращения, а в мутантной их не было. Если считать, что сокращения мутантной ткани подавлялись in situ, то выращивание in vitro должно было снять это воздействие. Более того, при совместном культивировании мезодермы мутанта с/с и головного участка энтодермы нормального зародыша в мутантной ткани начинались сокращения; это показывает, что мутантная мезодерма способна нормально реагировать на соответствующее индукционное воздействие. Таким образом, ген «cardiac lethal», очевидно, обусловливает неспособность головного участка энтодермы обеспечить индукционный сигнал, запускающий дифференцировку сердца из его мезодермального зачатка.

Рис. 7-13. Нормальная личинка аксолотля Ambystoma mexicanum (А) и мутантная личинка (Б), гомозиготная по аллелю с. Тело мутантной личинки раздуто вследствие накопления избыточной жидкости (Kulikovski, Manasek, 1978).
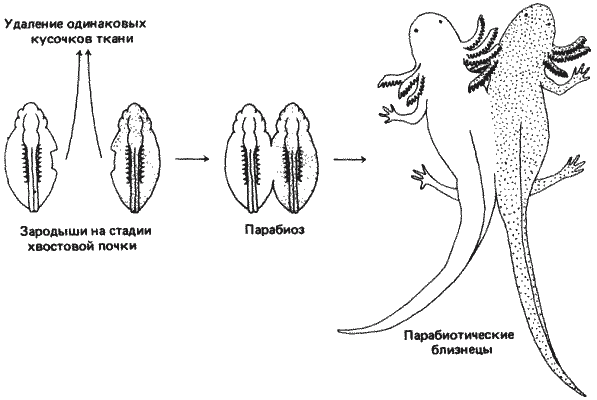
Рис. 7-14. Схема метода парабиоза. Двух аксолотлей, различающихся по генотипу (показано наличием или отсутствием точек), сращивают на ранних стадиях эмбриогенеза. Как показывает дальнейшее развитие, нормальная особь способна «спасти» своего мутантного партнера.
Исследования, проведенные на другой аутосомной рецессивной мутации аксолотля - eyeless (e), дали результаты, прямо противоположные полученным на cardiac lethal. Как показывает ее название, особи, гомозиготные по этой мутации (е/е), лишены глаз. Она вызывает также два других плейотропных дефекта - темную пигментацию и стерильность. Основной дефект возникает на самых ранних стадиях развития глаз, которое блокируется в начале формирования глазных пузырей или до этого. Подобно сердцу, глаз формируется в результате индуктивного взаимодействия, происходящего между передним участком нейральной эктодермы в презумптивном переднем мозге (передняя медуллярная пластинка) и хордомезодермой, располагающейся под этим участком во время гаструляции. Индуцированная нервная ткань образует боковые выросты, которые в конце концов инвагинируют, образуя глазные бокалы. Ван Дейзен (Van Deusen) исследовал природу дефекта, обусловливаемого мутацией е, пересаживая прехордальную мезодерму из спинной губы бластопора мутантных и нормальных зародышей в бластулы. При пересадке мезодермы е/е в нормальные бластулы она индуцировала развитие глазных пузырей, пересадка же нормальной мезодермы в бластулы е/е не приводила к индукции раннего развития глаза. Такие же результаты были получены при реципрокных трансплантациях, если кусочки мезодермы брали в более поздние сроки ранней гаструляции, но до формирования глазных пузырей: нормальная эктодерма была способна образовать глазные пузыри под действием как нормальной, так и е/е-мезодермы, а эктодерма е/е не индуцировалась ни той, ни другой мезодермой. Поэтому можно полагать, что дефект eyeless вызывается, очевидно, неспособностью эктодермы реагировать на мезодермальный индуктор. В пользу такого заключения свидетельствует также то, что если пересадить морфологически дифференцированный глаз от нормальной особи к е/е-особи, то он приживается и функционирует. Таким образом, после того как глазной пузырь индуцирован, генотип е/е способен поддерживать полностью сформированный глаз. Однако два других плейотропных дефекта мутантов е/е - пигментация и стерильность - все еще требуют объяснения. Избыточно пигментированный фенотип можно без труда создать экспериментально, удалив у нормальной особи глазные пузыри; это приводит к развитию у слепой личинки очень сильной пигментации. И наоборот, если пересадить развивающейся особи е/е зачаток нормального глаза, то ее пигментация становится нормальной. Это показано на рис. 7-15, на котором представлены фотографии нормальной личинки, мутанта е/е и одноглазой личинки е/е. Избыточная пигментация - следствие одного лишь наличия или отсутствия глаз, а поэтому она обусловлена относительной плейотропией.
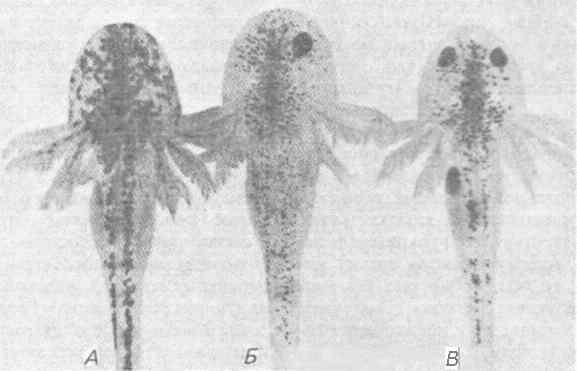
Рис. 7-15. Личинки аксолотля: мутант eyeless (А), особь с генотипом eyeless, которой был пересажен глаз от нормальной особи (Б), и нормальная особь (В). Пересадка привела к ослаблению пигментации по сравнению с мутантной особью (А) и приблизила ее к нормальному фенотипу (В) (Ерр, 1978).
Некоторые особи, использованные для пересадок и операций с глазными пузырями, достигали половозрелости. Это позволило установить, что экспериментально ослепленные особи фертильны, тогда как особи е/е, которым пересаживали нормальные глаза, оставались стерильными. Следовательно, стерильность не вызывается просто отсутствием глаз. Кроме того, ван Дейзен сумел показать, что в яичниках мутантных особей (е/е), пересаженных нормальным особям, происходил оогенез. Дальнейшими экспериментами по пересадке было установлено, что стерильность обусловлена дефектом мутантного гипоталамуса и его неспособностью индуцировать выделение передней долей гипофиза гонадотропных гормонов. Зачаток гипоталамуса, находящийся в головной нейральной эктодерме, непосредственно примыкает к зачатку глаза. Возможно поэтому, что нарушение функции этого эктодермального органа вызвано той же неспособностью реагировать на индукцию, которая обнаружена при образовании глаз и представляет собой результат прямой плейотропной активности гена eyeless в эктодермальных клетках, дающих начало и глазу, и гипоталамусу.
В обоих описанных выше случаях заключение о существовании индуктора и его воздействии на реагирующую ткань выводится на основании морфогенетических особенностей каждой системы. К сожалению, конкретных данных о природе индукторов и о способах их действия очень мало. Однако в одном случае мы располагаем более определенной информацией. Речь идет о мутантном гене, оказывающем влияние на развитие половых признаков у млекопитающих, - о локусе Tfm (Testicular feminization locus). У человека, мышей и крыс этот ген наследуется как сцепленный с полом. Есть также данные о поведении этого гена у собак и быков. Самки, гетерозиготные по мутантному гену, т. е. Tfm/+ , по существу, нормальны, но половина их генотипически мужских потомков (Tfm/Y) имеют женский фенотип и при этом стерильны. Для того чтобы понять механизм действия этого гена, следует вспомнить, что у всех млекопитающих пол зародыша в начале развития еще не детерминирован. До того как произойдет развитие гонад и у зародышей XX, и у зародышей XY, имеются системы как вольфова протока (мужская), так и мюллерова канала (женская), а также недифференцированный мочеполовой синус. У зародыша с генотипом XX вольфовы протоки дегенерируют, мюллеровы каналы образуют фаллопиевы трубы, матку и влагалище, а мочеполовой синус - женские наружные половые органы. Эта морфогенетическая программа представляет собой, так сказать, исходный этап, который имеет место даже в отсутствие яичников, например у кастрированного самца. В отличие от этого у зародышей XY из зачатка гонады быстро развиваются семенники, которые рано начинают синтезировать и секретировать тестостерон. Затем этот гормон активно способствует развитию первичных мужских половых признаков, индуцируя образование из вольфова протока семявыносящего протока, семенных пузырьков и семяизвергающего канала, а из мочеполового синуса - образование наружных мужских половых органов. Кроме того, имеющиеся в семенниках клетки Сертоли секретируют фактор, вызывающий регрессию мюллерова канала. Изучение развития «самцов» Tfm-мышей, проведенное Оно (Ohno), а также Лайон (Lyon) и ее сотрудниками, показало, что мутация Tfm подавляет способность всех тканей самца реагировать на андрогены и таким образом, из-за устранения влияния андрогенов, развитие идет по пути самки. Установлено, что в крови мышей Tfm/Y содержится достаточное количество тестостерона и что их семенники продуцируют фактор, вызывающий рассасывание мюллерова канала. Поэтому такие особи не просто имитируют кастрированных самцов. Кроме того, введение им больших доз экзогенного тестостерона не ослабляет нарушения развития, вызываемого мутацией Tfm. Оно и Лайон показали также, что, вводя нормальным и кастрированным самцам мышей тестостерон, можно заставить их почки продуцировать в больших количествах фермент алкогольдегидрогеназу, тогда как у почек Tfm-«самцов» такую реакцию вызвать не удается. Следовательно, отсутствие реакции на андроген не ограничено лишь половыми органами, а затрагивает и те органы, которые одинаковы у обоих полов. Дальнейшим подтверждением этому служит тот факт, что у «мужчин» с мутацией Tfm при половом созревании не вырастают волосы в подмышечных впадинах и на лобке, как это обычно происходит у человека в качестве нормальной реакции на повышение уровня гормонов на этой стадии развития.
Как показали Оно, а также Мейер (Meyer) и его сотрудники в основе этого дефекта лежит отсутствие специфического белка, служащего рецептором тестостерона, который, по-видимому, содержится во всех тканях особей как мужского, так и женского пола. У особей Tfm/Y этот рецептор не синтезируется. Известно, кроме того, что у самок Tfm/+ этот рецептор продуцируется только в половине клеток вследствие инактивации Х-хромосомы, описанной Лайон. Очевидно также, что, хотя у особей женского пола рецептор андрогена образуется, для их нормального полового развития наличие его необязательно. Лайон создала самца мыши, происходящего от четырех родительских особей, сращивая бластоцисты +/Y и Tfm/Y по методу, изображенному на рис. 4-17. Некоторые из полученных таким образом химерных самцов оказались фертильными и передавали своим потомкам Х-хромосому, несущую мутацию Tfm. Благодаря этому Лайон смогла создать гомозиготных самок Tfm/Tfm. Такие самки нормальны во всех отношениях и фертильны, свидетельствуя тем самым, что нормальное половое развитие самки может происходить в отсутствие продукта гена Tfm.
Примеры мутаций Testicular feminization у млекопитающих и eyeless и cardiac lethal у аксолотлей демонстрируют неразрывную связь генов с морфогенезом отдельных органов и систем органов на ранних и относительно поздних стадиях развития. Важная роль генов этого типа в эволюции была проиллюстрирована в гл. 6 на примере слепой рыбы, обитающей в пещерах. Генетические изменения, вызывающие слепоту пещерной рыбы и отсутствие глаз у аксолотлей, негомологичны, и это служит иллюстрацией еще одной особенности генетической регуляции развития. Развитие любого органа или системы органов определяется не одним геном, а группой генов - заключение, выведенное также в результате изучения у дрозофилы мутаций Notch и shibire, вызывающих почти идентичные нарушения на сходных стадиях онтогенеза. Кроме того, экспрессия подобного рода генов, обладающих широким спектром действия, может модифицироваться разнообразными генетическими изменениями, в том числе изменениями генетического фона и включением в развивающуюся систему новых генов. Таким образом, формирование организма и входящих в него органов - результат координированных комплексов активностей и взаимодействий генов. Эволюционный процесс может использовать возникающие в разных пунктах этих комплексов пертурбации, каждая из которых может привести к морфологическому изменению. Следует также указать, что, хотя в сумме все эти комплексы генных активностей образуют гармоничное целое, связь между ними может и нарушаться. Мутации могут изменять один процесс развития независимо от других, создавая диссоциабельность, столь необходимую для морфологической эволюции.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Спонтанные мутации
Спонтанные мутации О внезапных изменениях наследственности знал еще Дарвин. Взгляните на рисунок, где изображены овцы. Слева овца нормальная, в центре и справа овца и баран с сильно укороченными ногами. Сперва появилось одно-единственное такое животное. Изменение
Микробы и мутации
Микробы и мутации Рассказ о трансформации, трансдукции и конъюгации должен был убедить читателя, что микроорганизмы действительно могут изменять свою природу. Во всех рассмотренных случаях микробиологи использовали влияние генетического материала (ДНК) одних микробов
Мутации вирусов в лаборатории
Мутации вирусов в лаборатории Мы говорили о мутантах ВТМ, созданных природой. Сегодня нам известны уже и его лабораторные мутанты. Первые из них увидели свет в лаборатории Г. Шрамма.Шрамм в своих опытах исходил из возможности замены аминогруппы (—NH2) в молекуле цитозина
4.9. Развитие половых органов ребенка. Период полового созревания
4.9. Развитие половых органов ребенка. Период полового созревания Биологической зрелости организм человека достигает в течение периода полового созревания. В это время происходит пробуждение полового инстинкта, поскольку дети не рождаются с развитым половым рефлексом.
Хромосомные аномалии и мутации
Хромосомные аномалии и мутации Факты, которые мы приводили выше, известны ученым уже довольно давно. Сопоставлением и изучением этих фактов и занимается генетика — наука о явлениях наследственности и изменчивости. Основное положение менделевской генетики — учение о
Полезные мутации переключателей
Полезные мутации переключателей Устойчивость к ядам, вирусам, бактериям и прочим паразитам, защитная окраска, превращение опадающих семян в неопадающие — все это примеры простых адаптаций, для развития которых бывает достаточно одной-двух удачных мутаций, поддержанных
5.1. Мутации
5.1. Мутации Теория мутаций составляет одну из основ генетики. Ее основные положения были разработаны голландским ученым Г. де Фризом еще в начале XX в.Мутации – это наследственные изменения генетического материала. Они характеризуются как редкие, случайные,
1.3. РАЗВИТИЕ ПОЛОВЫХ ОРГАНОВ И ОСОБЕННОСТИ ОВО- И СПЕРМАТОГЕНЕЗА
1.3. РАЗВИТИЕ ПОЛОВЫХ ОРГАНОВ И ОСОБЕННОСТИ ОВО- И СПЕРМАТОГЕНЕЗА В процессе эмбрионального развития у индивидуума одновременно закладываются мужские и женские половые органы. Индифферентная половая система состоит из первичных гонад, мезонефральных (вольфовых) и
Развитие систем органов плода собаки
Развитие систем органов плода собаки Обмен веществ между плодом и матерью происходит в плаценте. Питание плода осуществляется за счет поступления в его кровь питательных веществ из крови матери и за счет секрета эпителия слизистой оболочки. Некоторое количество
Мутации
Мутации Мутация — внезапное изменение гена. Она проявляется в первом же поколении потомков, если мутантный ген будет доминантным. Но рецессивный ген — мутант может скрытно наследоваться в течение нескольких поколений до тех пор, пока в родительскую пару не подберутся
8.2. Мутации
8.2. Мутации Если бы организмы развивались поколение за поколением в одних и тех же окружающих условиях и передавали своему потомству все время одни и те же гены, сочетание эффектов генетической наследственности и морфического резонанса привело бы к бесконечному
ГЛАВА I РАЗВИТИЕ ГОЛОВЫ И ОРГАНОВ РОТОВОЙ ПОЛОСТИ СОБАКИ
ГЛАВА I РАЗВИТИЕ ГОЛОВЫ И ОРГАНОВ РОТОВОЙ ПОЛОСТИ СОБАКИ В основе ветеринарной стоматологии должны лежать знания развития, строения и физиологии головы, и ротовой полости в частности. Это позволяет ветеринарному врачу представлять картину не только