Анализ времени и места действия генов
Анализ времени и места действия генов
Методы, используемые для определения первичного места действия гена, сходны с применяемыми в классической эмбриологии и, в сущности, заимствованы из нее. В своей простейшей форме эти методы состоят в пересадке органа или кусочка ткани от мутантной особи нормальному реципиенту. Производят также и реципрокные пересадки. Эта операция обычно проделывается до проявления того или иного мутантного эффекта. Затем можно определить судьбу развивающегося органа или ткани в их новом окружении. Если генетический дефект рассматриваемого органа или ткани автономен для этой структуры, т. е. если она является первичным местом действия данного гена, то следует ожидать, что мутантная ткань будет продуцировать аномальный фенотип (даже и у нормального хозяина). Эксперименты сходного типа можно проводить на тканях или органах, выращиваемых в культуре, примерно таким же образом, как в описанных в гл. 5 экспериментах по совместному выращиванию дермы и эпидермиса мыши, ящерицы и курицы, только вместо соединения тканей от животных разных видов соединяют ткани или органы мутантных и немутантных особей.
Создание мозаичных особей проводилось в еще более широких масштабах Минц (Mintz) и ее сотрудниками. Этим исследователям удалось сращивать in vitro целых мышиных зародышей на стадии морулы. Таких «гибридных» зародышей имплантируют затем псевдобеременной самке. Получающиеся в результате мыши, происходящие от четырех родительских особей, состоят из смеси клеток двух разных генотипов, причем активны оба генотипа. Этот метод можно также использовать для анализа автономности экспрессии мутантных генов, сращивая мутантных и нормальных зародышей на стадии морулы.
Следует упомянуть еще об одном методе такого типа - о парабиозе. Он состоит в сращивании целых животных, а не просто органов или тканей. Необходимо указать, однако, что при таком сращивании не получается действительно интегрированных мозаичных особей. При всех этих методах необходимо, чтобы трансплантируемые ткани, органы или сращиваемые зародыши были совместимы. У низших позвоночных, таких как амфибии, это не представляет серьезной проблемы; однако у млекопитающих дополнительное осложнение возникает в связи с возможностью отторжения трансплантата, так что следует сначала убедиться в том, что мутантная и нормальная особи иммунологически совместимы.
Остается привести еще два метода, специфичные для генетики развития и применяемые почти исключительно при работе с Drosophila melanogaster. Это создание гинандроморфов и индукция мозаичных особей путем митотической рекомбинации. Гинандроморфами называют взрослых мух, тело которых состоит как из мужских, так и из женских тканей. Используя тип дробления, характерный для двукрылых, и их особую кольцевую Х-хромосому, таких мозаичных особей можно постоянно получать в лабораторных линиях. В норме X-хромосома дрозофилы имеет форму палочки, на одном конце которой находится центромера. Одна из мутантных форм этой хромосомы представляет собой замкнутое кольцо. Кольцо это обладает интересной особенностью: при нескольких первых делениях дробления оно нестабильно. Эта нестабильность может привести, в частности, к утрате кольцевой хромосомы одним из двух дочерних ядер, образующихся при первом делении дробления. Если утрата происходит на этой стадии, то в результате дальнейших делений дробления создается популяция ядер, одна половина которых содержит кольцевую Х-хромосому, а другая не содержит ее. Если зигота, начиная делиться, представляет собой гетерозиготную самку - палочка-Х/кольцо-Х, то после такой утраты половина ее ядер окажется женскими и будет содержать две Х-хромосомы - кольцо-Х/палочка-Х, а другая половина - мужскими и будет содержать только одну Х-хромосому - палочка-Х/О (пол у дрозофилы определяется соотношением Х-хромосом и аутосом, а не Y-хромосомой, как у млекопитающих). После восьми синцитиальных делений в яйце образуется скопление ядер. Это скопление, однако, не представляет собой случайной смеси типов ХО и XX. Ядра этих двух типов образуют две пространственно разделенные группы, расположение которых определяется плоскостью первого деления дробления. Поэтому, когда такая популяция ядер мигрирует к периферической цитоплазме, с тем чтобы образовать клеточную бластодерму, она мигрирует в виде двух соприкасающихся, но обособленных групп мужских и женских ядер. Взрослая муха, развивающаяся из такого гинандро-морфного зародыша, также будет мозаичной. Как показано на рис. 7-3, количество и расположение взрослой ткани мужской или женской природы непостоянно. Это происходит потому, что плоскость первого деления дробления располагается случайным образом по отношению к осям яйца. Поэтому если плоскость первого дробления делит яйцо по длинной оси на правую и левую половины, то из него разовьется билатеральный гинандроморф. Вариации этого простого случая приведут к большей или меньшей доле мужской ткани в зависимости от того, сколько ядер ХО находится в тех участках бластодермы, которым суждено сформировать взрослые ткани. Если мутантный ген локализован в X-хромосоме, то его эффекты можно проанализировать в мозаичной особи просто при помощи палочковидной Х-хромосомы, содержащей мутантный аллель (рис. 7-3). У образующегося в результате гинандроморфа часть клеток будет иметь нормальный женский генотип XX, а остальные клетки - мутантный мужской генотип ХО.
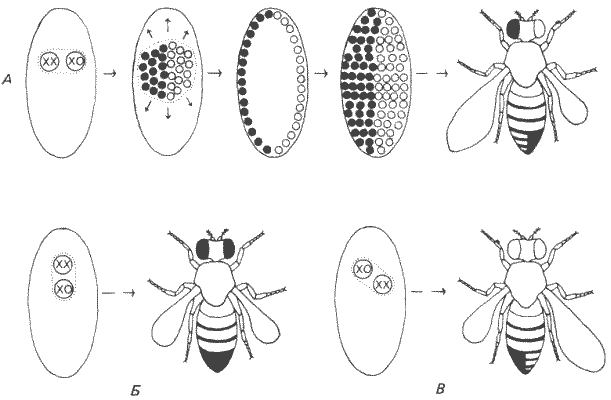
Рис. 7-3. Образование гинандроморфов у Drosophila melanogaster. Утрата нестабильной кольцевой Х-хромосомы при одном из ранних делений дробления приводит к образованию двух генотипически различных популяций ядер: XX (темные кружки) и ХО (светлые кружки). Если в клеточной бластодерме эти две популяции разделены по среднесагиттальной плоскости, то образуется мозаичная взрослая муха, у которой одна половина имеет мужскую, а другая - женскую морфологию. Если некольцевая Х-хромосома несет рецессивные гены-маркеры, то они экспрессируются в мужской ХО-половине. На это указывают укороченное крыло и белый глаз (муха в ряду А). Две мухи в нижнем ряду иллюстрируют результаты утраты кольцевой Х-хромосомы, за которой следует разделение либо в передне-заднем (Б), либо в косом (В) направлении (Strickberger, 1976).
Последний метод - индуцированная соматическая рекомбинация - не ограничивается анализом Х-хромосомы, а поэтому имеет несколько более широкое применение. Если данная муха гетерозиготна по какому-либо мутантному гену и его нормальному аллелю, то в результате нормальных митотических делений ядра всех ее клеток будут идентичны и также гетерозиготны. Если, однако, подвергнуть развивающийся организм воздействию рентгеновских лучей, то можно вызвать в его клетках кроссинговер между гомологичными хромосомами (подобно кроссинговеру при мейозе). Клеточное деление, происходящее после такого обмена, может привести к разделению двух кроссоверов (рис. 7-4). Получающиеся в результате дочерние клетки уже не будут гетерозиготными по мутантному гену; одна из них будет гомозиготна по данной мутации, а другая гомозиготна по нормальному аллелю. В дальнейшем дочерние клетки, происходящие от каждого из этих двух реципрокных типов, составят отдельные клоны и в зависимости от своего местоположения в организме животного и времени появления в процессе онтогенеза образуют мозаичные участки разного размера, находящиеся в разных местах тела взрослой особи. Следует указать, что, в сущности, такой мозаичный организм состоит из клеток трех разных типов, потому что два гомозиготных клона возникают на фоне гетерозиготной ткани (рис. 7-4). В этой ситуации можно также определить выживание мутантной ткани по сравнению с нормальной или относительные скорости их роста, потому что если расположить соответствующим образом маркеры в исходной гетерозиготной клетке, то единичный кроссинговер приведет к образованию участков-двойников, т.е. примыкающих одна к другой полосок тканей двух типов. Описанные выше методы создания мозаичных особей позволяют получить данные о специфичности места действия гена для любого дефекта, вызванного мутацией. То или иное морфологическое отклонение, обусловленное каким-либо мутантным геном, может быть результатом непосредственного воздействия данного гена на аномальную ткань как таковую или же результатом неспособности другой, морфологически незатронутой ткани поставлять какой-то компонент, необходимый для нормального развития этой аномальной структуры. Хорошим примером служит сцепленный с полом ген vermilion (v) у дрозофилы. У мух с мутацией v глаза ярко-красные в отличие от темно-красных глаз мух дикого типа. Это отклонение от нормы обусловлено тем, что у v-мутантов не синтезируются коричневатые пигменты - оммохромы, обычно содержащиеся в глазу. При помощи метода анализа мозаичных особей можно показать, что нарушение синтеза пигмента локализовано не в самом глазу. Например, у гинандроморфных мух с мужскими, а следовательно, v-мутантными головой и глазами и женским v+ - туловищем глаза имеют нормальную пигментацию. Создавая мозаиков, содержащих нормальные и мутантные ткани в различных соотношениях, удалось установить, что на самом деле одна из стадий синтеза недостающего пигмента происходит в жировом теле личинки. Затем продукт, создаваемый на этой стадии, очевидно, переносится в развивающийся глаз, где он используется для образования глазного пигмента. Таким путем действительно можно различать истинные и относительные плейотропные эффекты любого генетического повреждения.
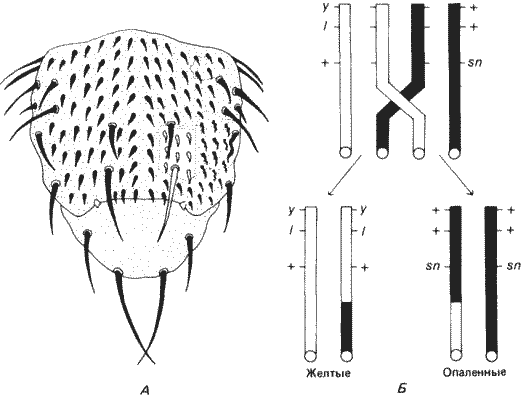
Рис. 7-4. Тест на выявление клеточной автономии летального фактора, основанный на соматическом кроссинговере, индуцированном рентгеновскими лучами. А. Вид грудного отдела D. melanogaster со спинной стороны. Два клона клеток, возникшие в результате соматического кроссинговера, образовали два участка-двойника, из которых один несет желтые, а другой - опаленные (singed) щетинки. Наличие «желтого клона» показывает, что летальный фактор неавтономен в своем действии. Б. Генотип по Х-хромосоме из гетерозиготной клетки, которая после кроссинговера дает начало двум гомозиготным дочерним клеткам, у - желтая окраска тела; l - летальный фактор; sn - опаленные щетинки (Hadorn, 1961).
Сочетая эти наблюдения с определением самых ранних отклонений от нормы, выявляемых в мутантном организме, иногда удается установить вероятные причинно-следственные зависимости и начать понимать природу данного генетического дефекта. Если, однако, наблюдаемая летальная фаза наступает на очень ранних стадиях развития, прежде чем сформируются обособленные структуры или органы, то определение точного места действия рассматриваемого гена затрудняется. Ранняя летальность может быть вызвана двумя разными причинами: отсутствием у зародыша какой-то необходимой биохимической функции (например, одного из элементов механизма белкового синтеза) или нарушением какой-либо ранней, но определенной морфогенетической активности. Как же нам различать дефекты этих двух типов? Один из способов состоит в определении времени действия изучаемого гена. Отсутствие функции, без которой совершенно невозможно обойтись и которая необходима всем клеткам, должно приводить к летальному исходу на всех стадиях развития и в тканях всех типов. Тот или иной конкретный ген, определяющий морфогенез, должен обладать более точным местом и временем действия.
В идеале нам хотелось бы иметь возможность как-то обойти раннюю летальную фазу, а затем восстановить рассматриваемый генетический дефект. Этого можно достигнуть двумя способами. Первый из них - метод соматической рекомбинации, который дополняется тем, что мутантные клоны индуцируются на разных стадиях онтогенеза. Если анализируемый ген действительно кодирует какую-то совершенно необходимую метаболическую функцию, то мутантные клоны не смогут выжить или создать нормальный фенотип независимо от времени или места их возникновения. Если, однако, этот ген активен в течение какого-то дискретного отрезка времени, то только мутации, возникшие после этого времени, смогут дать клоны клеток, которые выживут и у которых будет происходить нормальный морфогенез. Аналогичным образом мутантные гены, функционирующие только в определенной ткани или органе, не могут обеспечить развитие в этих структурах жизнеспособных клонов или клонов дикого типа. Возможны и такие случаи, когда активность данного гена ограничена дискретным отрезком времени и определенным местом. Мутация такого гена, если она возникла до этого времени, приведет к неспособности соответствующих клонов выжить или образовать нормальные структуры в определенной ткани. Однако мутации, возникшие на последующих стадиях развития, не затронут клетки этой ткани.
Наконец, наиболее информативный, хотя и ограниченный в своей применимости, метод состоит в выявлении условных мутаций, т. е. мутаций, проявляющихся при определенных условиях, например при повышенной температуре. В этом случае, изменяя температурный режим, можно сдвигать начало проявления мутационного эффекта на любой момент развития. (Конечно, при работе с гомойотермными животными мутации такого тина довольно бесполезны.) Рассмотрим в качестве примера температурочувствительный летальный ген дрозофилы, который приводит к гибели особи при 29°С (непермиссивная температура). Если выращивать мух при этой температуре, то мутантные особи гибнут на стадии куколки, тогда как при 20°С развитие протекает нормально. Культуры мутантных мух выращивают сначала при высокой температуре, а затем снижают температуру и наблюдают за судьбой насекомых. В реципрокных экспериментах мух сначала выращивали при низкой температуре, а затем повышали ее. В экспериментах с понижением температуры самый ранний срок проявления летального синдрома означает начало так называемого температурочувствительного периода (ТЧП). В реципрокных экспериментах с повышением температуры определяли самый поздний срок, после которого мутантный фенотип уже не экспрессируется. Этот срок соответствует окончанию ТЧП. Если удается обнаружить дискретный ТЧП, то это может быть подтверждено путем кратковременных воздействий (pulses) на культуры мутантных особей температур, подавляющих их развитие. Кроме того, можно воздействовать кратковременными изменениями температуры только на отдельные отрезки ТЧП, с тем чтобы определить, можно ли частично улучшить фенотип или же устранить некоторые плейотропные эффекты. Зависимость между ТЧП и фактическим временем гибели также может дать ценную информацию, особенно если ТЧП отделен от летальной фазы существенным промежутком времени. Сопоставив такого рода результат с ранними деталями и жизненно необходимыми функциями, можно убедиться, что если данный ген и его продукт необходимы организму постоянно, то ТЧП оказывается не дискретным, а непрерывным. Если же, однако, данная ранняя функция необходима зародышу только на ранних стадиях развития, то, после того как этот период пройден, воздействие непермиссивной температуры не окажется гибельным. Некий жизненно важный путь в необратимом процессе развития завершен. («Судьба мой путь предначертала, он только след ее пера» - Омар Хайям.) Каждый из описанных здесь методов может быть использован для выяснения отдельных вопросов, касающихся характера важных для процесса развития генетических повреждений. Кроме того, при совместном применении нескольких из этих методов можно получить действительно ценные сведения о том, каким образом нормальные гены участвуют в процессе развития. В полезности этого подхода можно убедиться на ряде примеров, таких как результаты, полученные Сузуки (Suzuki) и его сотрудниками при анализе двух температурочувствительных леталей у Drosophila melanogaster.
Первый из этих генов был впервые обнаружен как простой рецессивный сцепленный с полом летальный признак, который к тому же оказался чувствительным к температуре. Если мух выращивали при 29°С, то на стадии куколки они погибали, если же их выращивали при 22°С, они развивались нормально. Эксперименты со сдвигами температуры показали, что ТЧП непосредственно предшествует летальному периоду. Во время этих исследований у некоторых из выживающих особей был обнаружен измененный цвет глаз. Последующие генетические тесты показали, что температурочувствительный летальный ген представляет собой аллель уже описанного ранее локуса, названный ras (от raspberry - малиновый) по цвету глаз у мутантов. Известно, что эта мутация оказывает плейотропное действие на пигментацию, изменяя не только цвет глаз, но и пигментацию семенников взрослых особей и малъпигиевых сосудов личинок. Дальнейшие исследования с воздействием сдвигов температур на температурочувствительную мутацию ras позволили Грильятти (Grigliatti) и Сузуки определить, что ТЧП для пигментации мальпигиевых сосудов приходится на ранние личиночные стадии, а ТЧП для пигментации как глаз, так и семенников - на конец стадии куколки, наступая на четыре дня позднее. Следовательно, действие этого гена необходимо в течение двух отдельных периодов в процессе развития. Однако все еще оставалось невыясненным, является ли это относительным плейотропным эффектом или истинной плейотропией? Ответ на этот вопрос был получен путем определения автономности дефекта пигментации. Если отсутствие пигментации вызвано неспособностью одной ткани вырабатывать некий общий пигмент, который затем переносится к семенникам, мальгипиевым сосудам и глазам, то эти дефекты опосредованы или относительны. Однако, используя метод с кольцевой Х-хромосомой для создания гинандроморфов, удалось показать, что дефекты пигментации глаз и мальпигиевых сосудов автономны и специфичны для этих двух тканей; т. е., для того чтобы экспрессировать мутантный фенотип, данная ткань должна нести в своих клетках мутантный аллель. Поэтому создается впечатление, что один и тот же ген ras детерминирует синтез пигмента в трех разных тканях в течение двух различных периодов онтогенеза дрозофилы. Этот результат принципиально отличается от относительной плейотропии, наблюдаемой при синдроме серповидноклеточной анемии, и свидетельствует о существовании как истинной (прямой), так и относительной (опосредованной) плейотропии.
Еще более яркой иллюстрацией этого положения служит вторая мутация, проанализированная Сузуки и его сотрудниками. Эта мутация была названа shibire (что в переводе с японского означает «парализованная»); ее первоначально выделили как сцепленное с полом температурочувствительное поражение паралитического характера. Взрослые самцы и самки мух, несущие эту мутацию, при 22°С сохраняют нормальную подвижность. Если же повысить температуру до 29°С, то полностью парализованные мухи сейчас же падают на дно пробирки. Если вновь вернуть их в прежние условия (22°С), то через несколько минут они начинают двигаться и вскоре кажутся совершенно нормальными. Физиологическую основу этого дефекта установили Икеда (Ikeda) и его сотрудники; вводя микроэлектроды в летательные мышцы нормальных мух и мутантов shibire, они измеряли синаптический потенциал и потенциал действия, вызываемые раздражением двигательного нерва, иннервирующего эти мышцы. При нагревании до 29°С мышечные волокна мутантов никак не реагировали на раздражение, тогда как у мух дикого типа сохранялись нормальные реакции. Если, однако, мышцу раздражали непосредственно, а не через нерв, то у мутантов shibire удавалось вызвать ее сокращение даже при 29°С. Более того, Икеда и др. показали способность нервного волокна мутанта передавать импульсы при этой температуре. Таким образом, создается впечатление, что паралитическое поражение локализовано в нервно-мышечном синапсе, который теряет способность к проведению раздражения при температуре 29°С.
Это, однако, не единственный дефект, наблюдаемый у мутантов shibire. Пудри, Холл и Сузуки (Poodry, Hall, Suzuki) изменяли температуру, в которой содержались развивающиеся зародыши и личинки мух, с тем чтобы выяснить, не вызывает ли это у личинок паралича и каких-либо нарушений развития. Оказалось, что повышение температуры до 29°С на любой стадии развития приводит к параличу и гибели; отсюда следует, что для развития дрозофилы, по-видимому, необходимо нормальное функционирование локуса shibire. В экспериментах с кратковременными воздействиями (pulses) высокой температуры было показано, что переноса на 18 ч в температуру 29°С было достаточно, чтобы убить развивающихся личинок и зародышей. Более кратковременные тепловые воздействия (2, 4 и 6 ч) вызвали совершенно неожиданные дефекты развития. Шестичасовое воздействие выявило шесть критических периодов, в течение которых для нормального развития совершенно необходим ген shibire или его продукт, а в случае их отсутствия наступает смерть. Один период высокой чувствительности приходится на гаструляцию; в это время достаточно двухчасового теплового воздействия, чтобы убить насекомое. В этом случае гибель наступает не от необратимого паралича, как при 18-часовом воздействии, а, по-видимому, в результате какого-то другого нарушения.
Эксперименты с кратковременными тепловыми воздействиями выявили также ТЧП для нескольких внешне заметных дефектов у взрослых мух (рис. 7-5). Наиболее резко выраженный из них - вертикальный «рубец» на глазу, вызванный разрушением фасеток (рис. 7-6). Рубец возникает после кратковременного теплового воздействия в течение 3-6 ч, которое начинали примерно за 48 ч до наступления стадии куколки и прекращали сразу же после того, как куколка сформировалась (рис. 7-5). При соответствующем распределении этих воздействий во времени можно получить муху с двумя рубцами на глазу и показать, что в течение ТЧП положение рубца перемещается с заднего края глаза к переднему. Интересно отметить, что в этот период направление перемещения и расположение рубца на глазу соответствует волне клеточных делений, проходящих по развивающемуся глазу аналогичным образом.
Тепловое воздействие оказывает также влияние на образование щетинок и волосков на груди и на голове мухи, однако ТЧП для этих структур наступает несколько позднее, чем для глаза (рис. 7-5). Тепловые воздействия, оказываемые в начале ТЧП, приводят к дупликации щетинок, тогда как более поздние воздействия приводят к отсутствию щетинок этих же типов. Как и в случае рубцов на глазу при более поздних в течение ТЧП кратковременных воздействиях эти эффекты сдвигаются в направлении от заднего края глаза кпереди.
Возникновение у мутантов shibire дефектов во многих разных тканях показывает, что функция этого гена далеко не специфична и не ограничивается нарушением в области нервно-мышечного синапса. Это, возможно, лучше всего проявляется в том, что у зародышей, мутантных по данному гену, гаструляция - событие, происходящее задолго до того, как у зародыша можно обнаружить нервы или мышцы или же выявить их функцию, - крайне чувствительна к температуре.
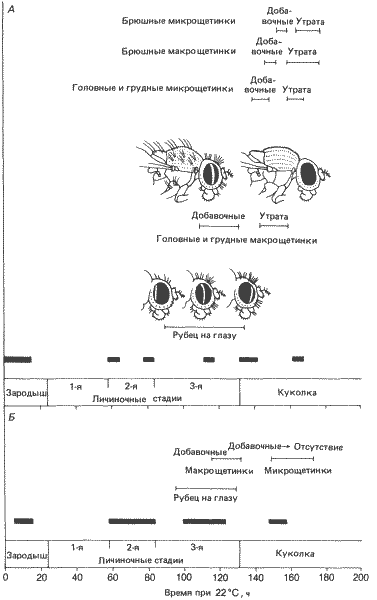
Рис. 7-5. Периоды чувствительности к температуре, соответствующие различным генетически обусловленным нарушениям развития. Толстые черные полоски - периоды особенно высокой чувствительности мутантных особей к воздействию непермиссивных температур. Более длительные воздействия, чем те, которые необходимы для того, чтобы вызвать указанные на рисунке аномалии, приводят к гибели насекомых. А. Нарушения, вызываемые мутацией shibirets (Poodry, Hall, Suzuki, 1973). Б. Нарушения, вызываемые мутацией Notshts (Shellenbarger, Mohler, 1978; с изменениями).
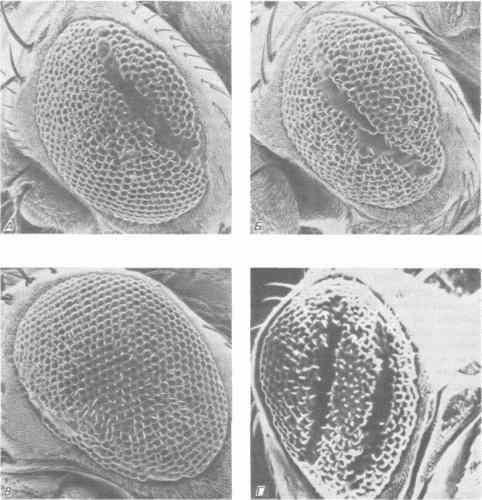
Рис. 7-6. Микрофотографии (сделанные с помощью сканирующего электронного микроскопа) глаз взрослых мух shibirets, подвергавшихся температурному воздействию в период, когда это воздействие вызывает образование рубцов на глазах. А. Воздействие в начале периода - рубец сдвинут к заднему краю глаза. Б. Воздействие в середине периода - рубец проходит через центр глаза. В. Воздействие в конце периода - рубец сдвинут к переднему краю глаза. Г. Двукратное воздействие - образование двух рубцов (Фото А-В - Poodry, Hall, Suzuki, 1973; фото Г - Suzuki, 1973).
Предварительное заключение, которое можно вывести из этих исследований, состоит в том, что ген shibire вырабатывает какой-то компонент мембраны, необходимый для некоторых типов взаимодействия или обмена информацией между клетками. Этот компонент, по-видимому, необходим для различных процессов, связанных с его главной функцией-коммуникацией между клетками, - но каждый отдельный ТЧП с соответствующим ему дефектом отражает, возможно, то, в чем именно состоит роль данной специфичной функции на данной стадии развития. Здесь снова перед нами случай истинной плейотропии, демонстрирующий способность одного гена оказывать воздействие на несколько, казалось бы, в корне различных морфогенетических событий. Другой вывод, вытекающий из этих результатов, - полезность изучения температурочувствительных аллелей. Независимая от температуры мутация shibire вызвала бы просто гибель зародыша, едва приступившего к клеточной дифференцировке, и не дала бы никаких сведений ни о характере генного продукта, ни о многообразии его действия.
При интерпретации результатов анализа температурочувствительных мутаций следует, однако, учитывать ряд моментов, затрудняющих применение этого метода. Принято считать, что ТЧП позволяет установить, в какое время используется данный генный продукт, т. е., если речь идет о ферменте, тот период, в течение которого необходима его метаболическая функция. Это, однако, относится не ко всем случаям. Иногда чувствительность к температуре бывает обусловлена аномальным синтезом конкретного белка в процессе трансляции. Образующийся при этом белок неактивен даже при пермиссивной температуре. Кроме того, этот белок, если он был синтезирован при пермиссивных условиях, в дальнейшем уже нечувствителен к повышению температуры. Поэтому ТЧП для этого нарушения отражает не время действия гена, а время синтеза генного продукта. Зависимость между временем транскрипции гена, временем использования генного продукта и ТЧП данного чувствительного к температуре нарушения развития может быть определена только путем более глубокого изучения характера продукта рассматриваемого гена или же независимой оценки времени транскрипции этого гена. Поэтому, для того чтобы получить полное представление о роли какого-либо гена в процессе онтогенеза, необходимо применить несколько экспериментальных стратегий, заимствованных из разных областей науки.
Используя методы генетики развития, можно продемонстрировать существование обширного ряда генетических дефектов, возникновение которых приурочено к определенным периодам онтогенеза. Ниже мы рассмотрим гены разного типа, которые могут быть использованы эволюционным процессом для создания морфологических изменений.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Выбор места
Выбор места Для посадки клематисов необходимо учитывать некоторые особенности. Прежде всего, клематисы светолюбивы и предпочитают солнечное местоположение, но в южных районах (например, ЧПК) с жарким климатом хорошо растут и в полутени. Для посадки надо выбирать
Знаменитые места в Восточной Африке, где обнаруживаются остатки гоминидов
Знаменитые места в Восточной Африке, где обнаруживаются остатки гоминидов Разыскивая ключ к прошлому человека, экспедиция Ричарда Лики преодолевает солончаки в пустыне Чолби на пути к озеру РудольфГоминидные предки человека развивались в узкой полосе обрамленных
МЕСТО ДЕЙСТВИЯ — АФРИКА
МЕСТО ДЕЙСТВИЯ — АФРИКА Заглянем в 1924 год и выясним, что так внимательно рассматривает профессор Раймонд Дарт, стоя возле только что распакованных ящиков, которые привезли его ученики из известкового карьера Таунг, что в Бечуаналенде. В руках у профессора из
Механизм действия нервной системы
Механизм действия нервной системы Теперь, вероятно, следует присмотреться к механизму действия этой сложной структуры, начав с простого примера. Если направить в глаза яркий свет, зрачок человека сужается. Эта реакция зависит от целой серии событий, которые начинаются в
4.2. Генетический анализ
4.2. Генетический анализ Совокупность методов изучения наследственности получила название «генетический анализ». Его основа – гибридологический метод, разработанный Г. Менделем. С открытия законов наследования Г. Менделем и начинается история генетики. Не меньшая
ГЕНЕТИЧЕСКИЙ АНАЛИЗ
ГЕНЕТИЧЕСКИЙ АНАЛИЗ В 1980 годах профессор Алек Джеффрис из Лестерского университета доказал наличие многочисленных участков ДНК, которые не следует считать кодом аминокислот. Эти участки назвали минисателлитные ДНК. Тысячи ДНК разбросаны по всем хромосомам; возможно,
На новые места
На новые места Опять мужчины вернулись с охоты с пустыми руками. Целый день бродили они, обошли чуть ли не половину своих владений, но так и не встретили зверя. Женщины, с нетерпением ожидавшие их возвращения, притаились по темным углам пещеры, грустно глядя на голодных
Механизм действия ферментов
Механизм действия ферментов В любой ферментативной реакции выделяют следующую стадийность:E + S ? [ES] ?E + Pгде Е – фермент, S – субстрат, [ES] – фермент-субстратный комплекс, Р – продукт.Механизм действия ферментов может быть рассмотрен с двух позиций: с точки зрения изменения
Специфичность действия ферментов
Специфичность действия ферментов Ферменты обладают более высокой специфичностью действия по сравнению с неорганическими катализаторами. Различают специфичность по отношению к типу химической реакции, катализируемой ферментом, и специфичность по отношению к
Глава 13. Особенности действия гормонов
Глава 13. Особенности действия гормонов Гормоны гипоталамуса ЦНС оказывает регулирующее действие на эндокринную систему через гипоталамус. В клетках нейронов гипоталамуса синтезируются пептидные гормоны двух типов. Одни через систему гипоталамо-гипофизарных сосудов
Диапазон действия экологических факторов
Диапазон действия экологических факторов Все живые организмы способны воспринимать только определенный диапазон интенсивности воздействий любого экологического фактора, что определяется нормой реакции генотипа. Этот диапазон выработался в процессе
Программа действия
Программа действия Выбор или создание программы действия непосредственно предшествует двигательному акту. В подавляющем большинстве случаев ни человек, ни животные не разрабатывают программу действия, а используют ту, которая уже применялась ранее при схожей
Колорит места
Колорит места 872 Первое проявление колорита обнаруживается в природе одновременно с расположением в пространстве, ибо воздушная перспектива покоится на учении о мутных средах. Небо, удаленные предметы, даже близкие тени мы видим синими. Одновременно светящиеся и
НА НОВЫЕ МЕСТА
НА НОВЫЕ МЕСТА
На новые места
На новые места Советские люди стремятся всё улучшить вокруг себя.Наши мичуринцы выводят новые прекрасные сорта растений: пшеницу, которая дает богатый урожай, сладкие, как мед, груши, яркие, пышные цветы.Какие кони красуются на Всесоюзной сельскохозяйственной выставке,