Становление локализации и пространственной организации
Становление локализации и пространственной организации
Во время оогенеза происходит чрезвычайно активная транскрипция генов и накопление ооцитами мРНК. Накапливающиеся в ооцитах мРНК столь разнообразны по своим последовательностям, что, как только после начала развития зародыша мРНК приступают к синтезу белков, с этих матриц могут транслироваться буквально тысячи видов различных белков. В наиболее хорошо изученном случае - у морского ежа - белковый синтез протекает очень вяло в неоплодотворенном яйце, но резко возрастает через несколько минут после оплодотворения. Это начальное усиление белкового синтеза (в сущности, весь белковый синтез), во всяком случае до наступления стадии бластулы, обеспечивает мРНК, синтезируемая во время оогенеза. Как корректирующий белок, устраняющий воздействие аллеля о у аксолотля, так и полярная плазма дрозофилы, обсуждавшаяся выше, обнаружены уже в ооцитах. Бриггс (Briggs) установил, что корректирующий белок синтезируется во время оогенеза и что его можно обнаружить в активной форме в самом начале этого процесса. Илмензе и его сотрудники предприняли поиски активной полярной плазмы в ооцитах дрозофилы. При помощи электронного микроскопа они сумели идентифицировать полярные гранулы на заднем полюсе ооцита в середине процесса вителлогенеза, т. е. во время максимального накопления желтка, но функциональную полярную плазму удается выявить лишь на поздних стадиях созревания ооцитов. Поэтому Илмензе и его сотрудники высказали мнение, что, хотя полярные гранулы, появляющиеся во время вителлогенеза, морфологически сходны с полярными гранулами яиц, они представляют собой, возможно, матрикс, к которому затем прикрепляются функциональные компоненты. Наконец, Домен и Вердонк (Dohmen, Verdonk) выявили на такой ранней стадии оогенеза, как вителлогенез, богатые РНК структуры, сходные с теми, которые позднее появляются в полярных лопастях брюхоногих моллюсков.
Таким образом, почти несомненно, что в яйцах детерминанты накапливаются во время оогенеза. Однако вопрос о том, когда эти материалы локализуются там, где им предстоит функционировать, остается открытым. В модели локализации, изображенной на рис. 4-3, сделано упрощающее допущение, что характер локализации уже установлен в яйце еще до того, как начинается дробление. В некоторых случаях это действительно так, но в других изменения локализации продолжаются и, возможно, завершаются лишь после того, как дробление зашло уже достаточно далеко.
Классическим примером событий, связанных с цитоплазматической локализацией, которые инициируются оплодотворением, служит перемещение пигментных гранул у асцидий Cynthia (Styela) partita, описанное Конклином (Conklin) в 1905 г. Последовательные перемещения цитоплазмы, происходящие после оплодотворения, показаны на рис. 4-8, взятом из этой статьи. Неоплодотворенное яйцо имеет равномерную сероватую окраску, но почти сразу же после проникновения в него сперматозоида начинается быстрая реорганизация цитоплазмы. Наиболее впечатляющее изменение - это быстрое перетекание желтых гранул к вегетативному полюсу яйца. Затем этот желтый материал постепенно распространяется в стороны от вегетативного полюса, пока не покроет все вегетативное полушарие. При перемещении ядра сперматозоида к одной стороне вегетативного конца за ним увлекается значительная часть желтого материала, из которого образуется желтый серп. Локализация желтого серпа, определяемая перемещением ядра сперматозоида и связанной с ним звезды, обозначает местоположение заднего конца развивающегося зародыша. Другие материалы цитоплазмы также занимают определенное место, так что ко времени первого дробления яйцо содержит четко выраженный желтый серп (3), темно-серый желток (4) и участки прозрачной цитоплазмы (5), а также три менее четко различимых окрашенных участка. Локализация всех этих веществ указывает на то, что судьбы участков, в которых они содержатся, предопределены; так, из материала желтого серпа образуются только мышечные клетки головастикоподобной личинки, темно-серый материал дает энтодерму, а прозрачная цитоплазма - эктодерму. Это, конечно, не означает, что детерминантами являются сами окрашенные материалы: просто они служат хорошо различимыми индикаторами перемещений цитоплазмы, определяющих локализацию детерминантов.
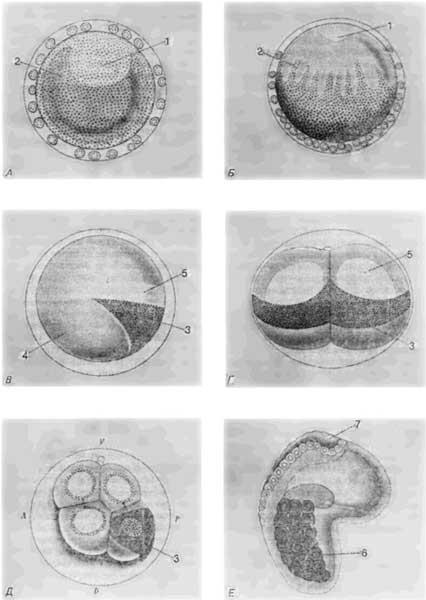
Рис. 4-8. Становление цитоплазматической локализации у зародыша асцидии Styela partita (Conklin, 1905). А. Яйцо с еще интактным зародышевым пузырьком (1). Б. Разрушение зародышевого пузырька и перемещение цитоплазмы. В и Г. Зародыш на стадии двух бластомеров (в двух разных ракурсах) с хорошо выраженным желтым серпом. Д. Стадия 8 бластомеров. Е. Ранняя личинка, у которой материал желтого серпа сосредоточен вокруг мышечных клеток хвоста (6).
1-зародышевый пузырек; 2-желточные гранулы; 3-желтый серп; 4-желток; 5-прозрачная цитоплазма; 6-мышечные клетки; 7-нервная пластинка.
У ряда организмов становление локализации происходит лишь после того, как дробление достаточно продвинулось. Изучение зародыша гребневика Mnemiopsis, проведенное Фриманом (Freeman), дало один из наиболее хорошо документированных примеров этого явления. Гребневики составляют небольшую группу прозрачных животных, несколько сходных по виду с медузами. Они обладают двулучевой симметрией и обычно снабжены восемью рядами гребных пластинок; каждая пластинка состоит из длинных слившихся между собой ресничек, при помощи которых гребневики плавают. Если потревожить животное, то можно наблюдать волнообразные вспышки зеленоватого света, испускаемого особыми клетками-фотоцитами, находящимися в меридиональных каналах, которые расположены под рядами гребных пластинок. Как ресничные клетки гребных пластинок, так и фотоциты уже имеются на личиночной стадии, и дифференциация как тех, так и других обусловлена действием локализованных детерминантов зародыша.
Развитие Mnemiopsis происходит по мозаичному типу. Если отделить друг от друга бластомеры двуклеточного зародыша, то из каждого бластомера разовьется неполный зародыш, содержащий структуры одной из сагиттальных половинок нормального зародыша. При разделении бластомеров 4-клеточного зародыша образуются четвертушки нормального зародыша, содержащие покрытые ресничками гребные пластинки и фотоциты. Восьмиклеточные зародыши состоят из бластомеров двух типов: четырех клеток E и четырех клеток М. Если отделить их друг от друга и дать им возможность развиваться, то из клеток E образуются неполные зародыши, содержащие покрытые ресничками гребные пластинки, но лишенные фотоцитов, а из клеток M - неполные зародыши, содержащие фотоциты, но лишенные гребных пластинок. При следующем делении, в результате которого получается 16-клеточный зародыш, бластомеры E и бластомеры M делятся неравномерно. Из каждого бластомера E получается один макромер (клетка Е) и один микромер (клетка е); каждый бластомер M аналогичным образом дает макромер M и микромер m. Цитоплазматические детерминанты распределяются между этими клетками таким образом, что после дальнейшего развития наблюдается следующая картина дифференцировки:
Микромеры е — ресничные гребные пластинки
Макромеры Е — ресничных гребных пластинок нет
Микромеры m — фотоцитов нет
Макромеры M — фотоциты
Фримен проделал ряд микрургических экспериментов, чтобы выяснить, на какой стадии дробления устанавливается характер локализации детерминантов. С этой целью он нанес на карту те участки бластомеров 2- и 4-клеточного зародыша, из которых на 8-клеточной стадии должны образоваться клетки Е и М. Если локализация детерминантов наступает на ранних стадиях дробления, как это показано на рис. 4-3, то удаление цитоплазмы из участка Е или из участка М бластомера 2-клеточного зародыша должно приводить к таким же результатам, как и удаление всех бластомеров Е или всех бластомеров М на 8-клеточной стадии. Иными словами, удаление Е-участка цитоплазмы из бластомера 2-клеточного зародыша приведет к тому, что клетки, образующиеся в процессе дальнейшего развития этого бластомера, утратят способность к формированию ресничных гребных пластинок, тогда как удаление М-участка приведет соответственно к утрате способности к формированию фотоцитов. В действительности, как установил Фримен, это предсказание не подтверждается. Локализация этих двух потенций в бластомерах едва намечается на 2-клеточной стадии, но почти полностью выражена у 4-клеточного зародыша; из этого следует, что, хотя цитоплазматические материалы, детерминирующие дифференцировку гребных пластинок и фотоцитов, уже присутствуют в яйце в начале дробления, они окончательно локализуются лишь к третьему дроблению.
Сроки локализации детерминантов у дробящихся зародышей подвержены регуляции. Работы Фримена и Герье (Freeman, Guerrier), а также Дэна и Икеда (Dan, Ikeda) и других авторов показывают, что события, связанные с локализацией и ранней детерминацией морфогенеза, сопряжены с регуляцией сроков митотических делений дробления - с так называемыми часами дробления. Эти часы представляют собой мало изученный механизм, при помощи которого зародыш отсчитывает в реальном времени число проделанных циклов дробления и определяет параметры следующего дробления. Существование этих часов было продемонстрировано в экспериментах, в которых одно из ранних делений дробления подавляли, а затем дроблению давали возможность возобновиться. Так, например, у зародышей морского ежа четвертое деление дробления бывает неравномерным, приводя к образованию как микромеров, так и более крупных бластомеров. Если подавить один из ранних циклов деления, а затем допустить дальнейшее дробление, то последующие деления происходят в ладлежащие сроки, несмотря на то что они запаздывают на один цикл. Таким образом, в срок, соответствующий четвертому дроблению нормального зародыша, экспериментальный зародыш образует только 8 клеток вместо 16. Важно отметить, что, хотя экспериментальный зародыш образует только 8 клеток, дробление у него происходит неравномерно, как и у нормального зародыша в эти сроки, и образуются микромеры. Стало быть, сроки наступления неравномерного дробления, при котором возникают микромеры, регулируются внутренними часами, отсчитывающими абсолютное время, а не числом фактически предшествовавших ему циклов дробления. Начало хода часов, по-видимому, сцеплено с формированием звезды. У некоторых зародышей часы приводятся в действие при завершении мейоза, у других - при инициации первого деления дробления.
Сопряженность локализации детерминантов с часами дробления можно продемонстрировать в экспериментах с подавлением дробления. Возможность отделения этой локализации и типа дробления от числа циклов дробления создает значительный эволюционный потенциал, потому что если эти параметры ранних стадий развития контролируются разными генами, то в таком случае мутации могут вызвать существенные изменения в соотношениях между этими событиями. Изменения такого типа и в самом деле возникали при эволюционных модификациях в развитии как Spiralia, так и хордовых. Соответствующие примеры рассматриваются далее в этой главе.
На пространственную регуляцию локализованных детерминантов оказывает влияние ориентация звезд или веретен митоза, которые определяют расположение осей зародыша (Связь между ориентацией звезд и веретен в первых делениях и расположением осей зародыша не является общим правилом и не обнаруживается в развитии многих животных.- Прим. ред.). Эта ориентация контролируется генами, как можно прекрасно показать на примере регуляции направления закручивания спирального завитка раковины у брюхоногих. Обычно особи прудовика Limnaea peregra бывают правовращающими, т.е. раковина и сама улитка закручены в правую сторону. Однако время от времени в природных популяциях попадаются левовращающие особи; они представляют собой как бы зеркальное отображение правовращающей формы, т. е. раковина и тело закручены у них в левую сторону. Как показано на рис. 4-9, левосторонняя или правосторонняя симметрия выявляется у улиток в начале дробления и направление спирального дробления устанавливается при втором дроблении по ориентации митотических веретен. Ориентация веретена в делящейся клетке определяет местоположение борозды дробления, а тем самым и границу между бластомерами, образующимися при данном делении. Симметрия у Limnaea, по-видимому, контролируется парой аллелей одного гена, причем этот ген наследуется по типу материнского эффекта. Тип симметрии потомков зависит только от генотипа матери. Аллель правозакрученности (L) доминирует над аллелем левозакрученности (l). Но из яиц, отложенных особью, гомозиготной по аллелю левозакрученности (ll), развиваются левозакрученные улитки, даже если эти яйца были оплодотворены спермой особи, гомозиготной по аллелю правозакрученности (LL). Это происходит потому, что ген, контролирующий тип симметрии, оказывает свое действие во время оогенеза, т. е. тогда, когда в наличии имеется только аллель левозакрученности. Однако фенотипически левозакрученные потомки от этого скрещивания имеют генотип Ll, и из всех отложенных ими яиц разовьются правозакрученные улитки вследствие экспрессии в ооците доминантного аллеля (L).
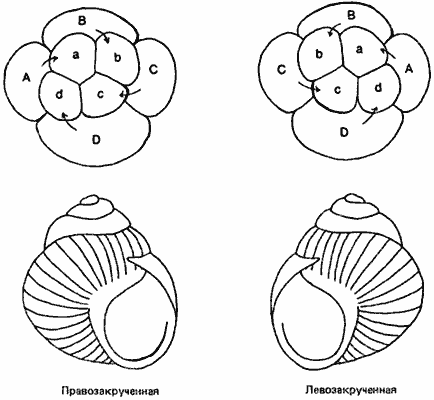
Рис. 4-9. Правосторонняя или левосторонняя закрученность раковины у прудовика Limnaea peregra как следствие направления спирального дробления на ранних стадиях развития (Morgan, 1927).
Детерминация симметрии закручивания у Limnaea служит примером того, как довольно резкий сдвиг морфогенеза - решение о формировании право- или левозакрученной раковины - определяется действием одного гена во время образования яйца. Кроме того, очевидно, что этот ген оказывает действие на компоненты матрикса цитоскелета. Цитоскелет - это динамичное трехмерное переплетение нитевидных элементов, ответственных за перемещения материалов внутри клетки и за изменения формы клетки, т.е. за процессы, играющие решающую роль в характере локализации-разметке раннего зародыша. Среди элементов цитоскелета преобладают структуры двух типов. Первые, микротрубочки, - это длинные полые трубочки диаметром около 25 нм, состоящие из родственных белков-тубулинов. Наиболее хорошо известны микротрубочки, образующие нити веретена, которые обеспечивают перемещения хромосом при митозе. Но микротрубочки образуют также и другие совокупности компонентов в цитоплазме. Второй основной класс нитевидных элементов составляют микрофиламенты; это прочные нити диаметром около 5 нм, состоящие из актина - одного из главных компонентов мышечных клеток. Сложные переплетения микротрубочек и микрофиламентов в цитоплазме клеток, выращенных в культуре, изображены на рис. 4-10. Эти клетки были выращены на предметных стеклах, зафиксированы формальдегидом, а затем обработаны антителами, специфичными к актину или тубулину. Связавшиеся антитела делают флуоресцентными и исследуют в УФ-микроскопе в темном поле. Совокупности микротрубочек и микрофиламентов хорошо различаются по внешнему виду, локализации и ориентации.
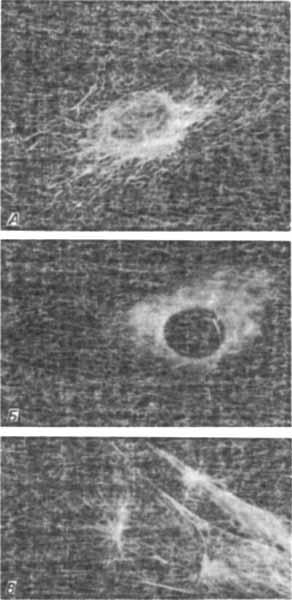
Рис. 4-10. Расположение микротрубочек в клетках мышей из культуры ткани, выявляемое методом непрямой иммунофлуоресценции с антителами, специфичными к тубулину. A. Сеть микротрубочек в цитоплазме интерфазной клетки. Б. Клетка после обработки колхицином, разрушающим микротрубочки. Обратите внимание, что на микрофотографиях А и Б видно, что структуры, организующие микротрубочки, примыкают к ядру. B. Делящаяся клетка, в которой видны микротрубочки, образующие звезды и веретено (Osborn, Weber, 1976).
Распределение основного вещества цитоскелета регулируется как в пространстве, так и во времени. Сборка микротрубочек зависит от наличия центров нуклеации (организации), которые определяют местоположение пучков трубочек, и от других пока еще недостаточно хорошо установленных регуляторов, определяющих сроки этого процесса. У Limnaea выявлена генетическая регуляция местоположения центров нуклеации, хотя следует отметить, что даже и в этом случае имеются некоторые осложняющие обстоятельства. Фримену удалось вызвать реверсию действия аллеля, детерминирующего закручивание раковины влево, вводя в яйца, отложенные материнскими особями, гомозиготными по аллелю левозакрученности, цитоплазму из яиц, дающих правозакрученные раковины. Эксперименты противоположного типа не приводят к изменению типа симметрии. Можно предполагать, что у Limnaea местоположение центров нуклеации или функциональный выбор между ними регулируется каким-то растворимым компонентом яйца.
Осборн и Вебер (Osborn, Weber) непосредственно наблюдали за центрами организации трубочек в клетках из культуры ткани, применяя метод флуоресцирующих антител. Как видно на рис. 4-10, это цилиндрическая полярная структура, содержащая тубулин и расположенная по соседству с ядром. Каждая клетка, по-видимому, содержит одну или две таких структуры. Легче всего их увидеть, если уничтожить микротрубочки, обработав клетку перед фиксацией колхицином или подвергнув ее действию низких температур. Восстановление микротрубочек после созревания клеток или удаления колхицина начинается в организационном центре, причем микротрубочки растут с одного конца организационного центра и радиально распространяются к краям клетки. Харрис, Осборн и Вебер при помощи того же метода флуоресцирующих антител наблюдали в яйцах морского ежа микротрубочки, образующие веретено и звезды, а также любопытное временное спиральное расположение микротрубочек в кортексе зиготы.
Микрофиламенты, подобно микротрубочкам, несут определенные функции, связанные с процессами локализации детерминантов в зародышах. Микрофиламенты нередко принимают участие в изменении формы клетки: сократимость представляет собой основное свойство входящего в их состав белка актина. Так, например, микрофиламенты обеспечивают цитокинез при дроблении. К концу митоза под клеточной мембраной, в плоскости метафазной пластинки, микрофиламенты образуют кольцо, которое, сжимаясь, отделяет две дочерние клетки одну от другой. Рэфф (R. Raff), а также Конрад (Conrad) и его сотрудники показали, что подобным же образом микрофиламенты вызывают сужение шейки полярной лопасти у моллюсков, принимая тем самым непосредственное участие в определении локализации. Местоположение микрофиламентов частично зависит от расположения пучков микротрубочек. Центры, организующие микротрубочки, обнаружены в яйцах и зародышах, однако, как это ясно видно из недавнего обзора Э. Рэфф (Е. С. Raff), регуляция их местоположения продолжает оставаться главной и нерешенной проблемой.
Местоположение организационных центров в зародышах хотя бы частично контролируется генами, однако на него оказывают влияние и другие факторы. Например, у амфибий место проникновения сперматозоида в яйцо определяет плоскость первого дробления и устанавливает дорсо-вентральную ось зародыша. Как показали недавние исследования Киршнера (Kirschner) и его сотрудников, инициация локализационных перемещений событиями, происходящими при оплодотворении, по-видимому, процесс сложный. Это (вместе с обсуждавшимися выше зависимостями между локализацией детерминантов и дроблением) указывает на то, что окончательная их локализация зависит как от организации яйца во время оогенеза, так и от событий, приводимых в движение оплодотворением.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
2.1. Становление и основные положения синтетической теории эволюции
2.1. Становление и основные положения синтетической теории эволюции Эволюционизм возник как альтернатива учению о неизменности видов. Вопросы, связанные с возникновением и развитием жизни, прошли через всю интеллектуальную историю человечества. Количество литературы,
3.2. Становление этологии и вопросы эволюции поведения
3.2. Становление этологии и вопросы эволюции поведения Этология возникла в середине 1930-х гг. как наука, изучающая поведение животных в естественной среде обитания. Эта наука дала миру целую плеяду талантливых ученых, однако даже на таком ярком фоне выделяются имена ее
4.1. Типы социальной организации
4.1. Типы социальной организации В этологических исследованиях был обнаружен широкий диапазон различных видов социальной организации. У высших животных их социальные структуры и социальное поведение в процессе эволюции достигают исключительной степени сложности и
10.1. Становление взглядов на проблему когнитивных способностей животных
10.1. Становление взглядов на проблему когнитивных способностей животных Первые систематизированные данные по исследованию когнитивных способностей животных получил английский ученый, ученик Ч. Дарвина Дж. Романес (1848–1894). В 1883 г. выходит его книга «Интеллект животных».
11.1. Становление психологии
11.1. Становление психологии В дословном переводе «психология» означает «наука о душе». В научной терминологии вместо слова «душа» стали употреблять слово «психика», что, однако, не прибавило определенности этому понятию. Сложность, неопределенность, «неуловимость»
О значении внимания в отношении локализации и развития галлюцинаторных образов
О значении внимания в отношении локализации и развития галлюцинаторных образов Уже давно в отдельных случаях психических заболеваний обращала на себя внимание своеобразная локализация галлюцинаторных образов. Особенно поразительно, что больные, в развитии
Эволюционные изменения в организации яиц хордовых
Эволюционные изменения в организации яиц хордовых Для Spiralia характерно развитие, при котором отдельные бластомеры на ранних стадиях дробления уже запрограммированы к дифференцировке в определенном направлении, не изменяющемся даже в том случае, если изолировать их от
Глава 9 Становление пространственной организации
Глава 9 Становление пространственной организации Пространственная организация и происхождение формы Главная проблема, стоящая перед биологами, занимающимися изучением развития, - объяснить механику процессов, в результате которых из одноклеточной зиготы образуется
Становление пространственной организации и спецификация местоположения
Становление пространственной организации и спецификация местоположения Презумптивную область ноги, которую пересаживал Гаррисон, можно рассматривать как эмбриональное поле. В более общем смысле поле - это участок зародыша или группа клеток, в пределах которых может
Становление пространственной организации и полярные координаты
Становление пространственной организации и полярные координаты Хадорн (Hadorn) и его ученики обнаружили, что если у личинки третьего возраста дрозофилы удалить один из имагинальных дисков и пересадить его путем инъекции новой личинке-реципиенту, то он будет
4.2. Возникновение клеточной организации
4.2. Возникновение клеточной организации Учеными было доказано, что после испарения воды из реакционного объема в амфифильных липидоподобных и липидных молекулах формируются жидкокристаллические агрегаты, в которых молекулы расположены периодическими слоями, как в
Становление ученого
Становление ученого Его жизнь прошла в беспрерывной борьбе и беспримерных дерзаниях. Десятилетиями длилась эта борьба. Трудно было поверить, что он обнаружит так много сил, найдет в себе столько решимости. Безудержная мысль Александра Васильевича Вишневского и на