Мутации с материнским эффектом
Мутации с материнским эффектом
У таких разных организмов, как морские ежи и лягушки, события, происходящие на ранних стадиях дробления, и, в сущности, большая часть, если не все развитие, предшествующее гаструляции, не зависят от генома зиготы. Информацию, необходимую для выполнения этих начальных и решающих этапов онтогенеза, определяет материнский геном при образовании яйцеклетки. Как было показано в гл. 4 на примере закручивания раковины у Limnaea, такое заключение подтверждается существованием у широкого круга различных организмов так называемых генов с материнским эффектом. Мутации этих генов передаются по наследству чрезвычайно своеобразным способом. При скрещивании двух особей, гетерозиготных по какому-либо рецессивному признаку, следует ожидать, что этот признак проявится у 25% потомков. Однако в случае материнских (mat) мутаций особи mat/mat развиваются нормально. Более того, мужские особи с таким генотипом фертильны и при скрещивании с нормальными женскими особями дают нормальных потомков. В отличие от этого гомозиготные самки дают аномальных потомков. Это объясняется тем, что у таких самок образуются аномальные яйцеклетки, которые не могут завершить нормальное развитие (рис. 7-7). Самка mat/mat выживает, потому что она происходит от гетерозиготной (mat/+) матери, способной продуцировать нормальные яйца. Хотелось бы сделать вывод, что гены, дающие такие мутации, продуцируют какие-то «морфогены», которые образуются в развивающемся ооците в качестве «инструкции» для раннего развития. Однако возможно также, что яйцо неспособно развиваться просто вследствие какого-то общего нарушения метаболизма. Подходящим примером служит группа из пяти различных дефектов, наследуемых по материнскому типу и определяемых генами, локализованными в Х-хромосоме Drosophila melanogaster: tin (cinnamon), dor (deep orange), amx (almondex), fu (fused) и r (rudimentary). Все эти признаки, помимо того что они наследуются по материнскому типу, вызывают у взрослых особей заметные морфологические отклонения, по которым они и получили свои красочные названия. Гемизиготные самцы, обладающие любой одной из этих мутаций, жизнеспособны и фертильны, так же как и гетерозиготные самки. Скрещивая мутантных самцов с гетерозиготными самками, можно получить гомозиготных самок, которые при скрещивании с мутантными самцами оказываются совершенно стерильными. Например, самки dor/dor продуцируют яйца, развитие которых прекращается на стадии гаструляции. Остальные четыре мутации также вызывают гибель зародышей, но на несколько другой стадии, чем мутации dor. В характере наследования всех этих пяти мутаций есть еще одна аномальная особенность. Скрещивая гомозиготных мутантных самок с нормальными самцами, можно получить некоторое число потомков. Все это - гетерозиготные самки, развившиеся из яиц, оплодотворенных сперматозоидом, несущим Х-хромосому. Ни один самец не выживает. По-видимому, присутствие аллеля дикого типа рассматриваемого гена может несколько снизить дефектность яйца, даже если этот аллель вносится сперматозоидом. Это, конечно, подразумевает, что по крайней мере часть генома зиготы активна во время гаструляции.
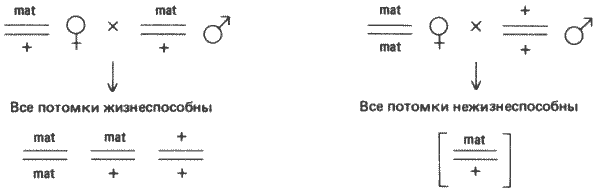
Рис. 7-7. Передача летальной мутации, наследуемой по материнскому типу. Гомозиготность по гену mat (mat/mat) сама по себе нелетальна, если материнская особь была гетерозиготна по этому гену (mat/ +). Если же материнская особь была гомозиготна (mat/mat), то все ее потомки гибнут независимо от их фенотипа.
Как показал Геринг (Gehring), введение цитоплазмы яйца дикого типа зародышам dor спасает этих мутантных зародышей, восстанавливая их жизнеспособность. При дальнейшем анализе Курода (Kuroda) разработал проводимый in vitro тест на вещество dor+. Используя культуры клеток, выделенных из зародышей с мутацией dor, он обнаружил у мутантных мышечных клеток такие аномалии, как отсутствие способности к слиянию, которой обладают клетки нормальных зародышей. Если к культуре мутантных клеток добавляли экстракт из нормальных яиц, то этот дефект устранялся. Кроме того, используя цитоплазму зародышей dor разного возраста, спасенных при помощи сперматозоидов dor+, Курода показал, что dor+- вещество продуцируется во время гаструляции и после, но не до нее. С помощью этого теста он показал также, что спасающее вещество неустойчиво к нагреванию, а поэтому, возможно, представляет собой белок.
Остается, однако, неясным, в чем состоит нормальная функция гена dor+. Мы можем приступить к этому вопросу, рассмотрев, во-первых, плейотропный эффект мутации dor, вызывающей аномальную пигментацию глаз, а во-вторых, характер продукта другого мутантного гена - rudimentary, наследуемого по тому же типу. Аномальная пигментация глаз у мутантов dor связана с синтезом птеридинов - группы гетероциклических соединений, родственных нуклеиновым кислотам. Ген rudimentary, как показали Норби, Джарри и Фальк (Norby, Jarry, Falk), а также Роулс и Фристром (Rawls, Fristrom), кодирует первые три фермента, участвующие в биосинтезе пиримидинов. Об участии гена dor в метаболизме нуклеиновых кислот свидетельствует также то, что стерильность самок dor/dor можно частично ослабить, добавляя в среду, на которой выращиваются эти мухи, дополнительное количество пуринов. Поэтому возникает мысль, что аномалии, обусловливаемые мутацией dor, а возможно, и другими сходными с ней мутациями, возникают в результате нарушения синтеза или распада нуклеиновых кислот. На примере таких мутаций видно, как трудно отличать неспецифичные генетические мутации от мутаций, специфически воздействующих на механизмы, которые относятся только к морфогенезу.
Более вероятный кандидат на роль мутации, вызывающей недостаток фактора, необходимого для морфогенеза, - мутация oocytedeficient (о) у аксолотля (см. гл. 4). Пересаживая яичники от особей с мутацией о нормальным особям, Хамфри (Humphrey) показал, что влияние этого гена автономно, т.е. ограничено яичниками мутантных особей. Такой автономности нельзя ожидать, если дефект вызван недостаточностью какого-либо низкомолекулярного метаболита, способного распространяться путем диффузии. Однако, несмотря на обширные исследования Бриггса (Briggs) и его сотрудников, в результате которых было идентифицировано некое белковоподобное спасающее вещество, содержащееся в нормальных зародышах и ооцитах, точная природа этого дефекта неизвестна. Весьма любопытно, однако, что спасающий белок локализуется в зародышевом пузырьке (ядре ооцита), позволяя думать, что этот белок каким-то образом взаимодействует с генетическим материалом. В связи с такой возможностью интересно рассмотреть одну мутацию, обнаруженную недавно у дрозофилы. Мортен и Лефевр (Mortin, Lefevre) описали сцепленную с полом доминантную мутацию, локализованную в Х-хромосоме и названную ими Ultrabithoraxlike (Ubl). У самок, гетерозиготных по этой мутации (Ubl/+ ), жужжальца, или органы равновесия, имеющиеся у всех двукрылых, увеличены по сравнению со своими обычными размерами. Жужжальца расположены на третьем грудном сегменте и в эволюционном смысле представляют собой зачаточные крылья, играющие роль стабилизаторов во время полета. Мутация Ubl похожа на другую доминантную мутацию в третьей хромосоме, названную Ultrabithorax (Ubx), которая гомеозисна по своей природе. Более полное обсуждение этого и других гомеозисных локусов дается в гл. 8.
Увеличение жужжальца указывает на преобразование этого органа в направлении полностью дифференцированного крыла. Это проявляется в фенотипе самок мух, гетерозиготных по гену Ubl в Х-хромосоме (Ubl/ +) и по гену Ubx в третьей хромосоме (Ubx/+). Жужжальца таких мух снабжены маргинальными волосками и щетинками, характерными для крыла, а также крылевыми жилками; ни тех ни других структур на маленьких луковицеобразных жужжальцах обычно не бывает. Еще одно открытие Мортена делает мутацию Ubl очень подходящим объектом для обсуждаемого здесь вопроса: она обладает материнским эффектом (в отличие от Ubx). У гомозиготных самок и гемизиготных самцов аллель Ubl летален. Однако, снабдив муху дупликацией, содержащей нормальный аллель Ubl, можно получить взрослых самок с генотипом Ubl/Ubl/+ . При скрещивании с нормальными самцами эти самки фертильны и дают гетерозиготных потомков Ubl/+ . Если же скрещивать их с самцами Ubl/Y/+ (которые жизнеспособны благодаря той же самой дупликации), то эти самки оказываются совершенно стерильными и неспособны производить даже потомков Ubl/+ . Этот пример обладает одной любопытной особенностью, отличающей его от случая сходной стерильности, которая обнаружена у самок dor и которую можно устранить введением цитоплазмы мух дикого типа; она касается природы генного продукта локуса Ubl. Гринлиф (Greenleaf) и его сотрудники обнаружили в этом локусе еще одну мутацию, определяющую устойчивость к ?-аманитину, который специфически подавляет РНК-полимеразу II эукариотических организмов. Эта полимераза - тот фермент, который осуществляет транскрипцию генов, кодирующих мРНК, т. е. структурных генов. Кроме того, подобно мутации Ubl в данном локусе, аллель, устойчивый к ?-аманитину, во взаимодействии с геном Ubx детерминирует формирование крылоподобных жужжалец.
Как это разбирается в гл. 8, Гарсиа-Беллидо (Garcia-Bellido) и его сотрудники показали, что активность локуса Ubx необходима уже на стадии бластодермы, где он участвует в первичных детерминационных событиях, регулирующих сегментацию. Этот факт в сочетании с материнским эффектом мутации Ubl указывает на то, что для этих начальных событий, возможно, необходима полимераза, поставляемая с материнской стороны. Остается, однако, недоказанным, является ли взаимодействие измененной полимеразы с этими гомеозисными генами специфичным для этих локусов или же такая специфичность измененной полимеразы в действительности больше кажущаяся, чем реальная. Изменения в одной из субъединиц полимеразы II могут повлиять на связывание голофермента с промоторами многих или всех генов; так это взаимодействие, возможно, выявляет различную «силу» промоторов, причем промотор гена Ubx может быть очень слабым и чрезвычайно чувствительным к изменениям фермента. Так или иначе, установлено, что активность гена Ubx, правильное функционирование которого на ранних стадиях эмбриогенеза имеет решающее значение для нормального морфогенеза, может в значительной степени зависеть от материнского фермента, необходимого для генной транскрипции.
Непосредственная и чрезвычайно своеобразная роль описанных выше генов в морфогенезе остается проблематичной, однако Райс (Rice) и Герен (Garen) выделили из 3-й хромосомы Drosophila melanogaster группу мутаций с материнским эффектом, обладающих, по-видимому, специфическим действием на морфогенез. Три из них вызывают очень характерные и специфичные дефекты на стадии бластодермы у зародышей, происходящих от гомозиготных матерей. Первая мутация mat(3)1 не допускает образования нормальной разделенной на клетки бластодермы после начальных синцитиальных делений дробления. Однако на заднем конце зародыша все же образуются полярные клетки. В нормальном зародыше эта группа клеток - клетки зародышевого пути - предназначена для образования гамет. Поэтому создается впечатление, что у такого мутанта развиваются клетки зародышевого пути и несколько соматических клеток. Интересно, что, несмотря на отсутствие нормальной бластодермы, полярные клетки пытаются инвагинировать, как при нормальных обстоятельствах они сделали бы при гаструляции; это показывает, что по крайней мере некоторые из ранних перемещений клеток зародыша не нуждаются в межклеточных взаимодействиях или адгезиях.
Вторая мутация mat(3)6 также образует только частичную бластодерму. Ядра синцития мигрируют в кортикальную цитоплазму, как у нормальных зародышей; однако целлюляризация происходит только на переднем и заднем концах зародыша. Распределение клеток у этих двух мутантов на стадии бластодермы показано на рис. 7-8. У мутанта mat(3)6 опять-таки, как и у мутанта mat(3)1, полярные клетки пытаются инвагинировать и зародыш предпринимает абортивную попытку к гаструляции. В дальнейшей работе с зародышами mat(3)6 Райс и Герен определяли потенциальные возможности образуемых ими клеток. Как уже было показано Герингом (Gehring), если на стадии бластодермы разрезать зародыш пополам и инъецировать половинки взрослым самкам дрозофилы, то можно получить культуры клеток. Затем, пересаживая эти клетки из брюшка самки в метаморфизирующую личинку, можно испытать их способность к образованию имагинальных структур. Когда личинка превратится во взрослую особь, такая же дифференцировка произойдет и у всех инъецированных клеток, способных к образованию имагинальных тканей. Используя этот метод, Чен и Геринг (Chan, Gehring) продемонстрировали, что на стадии бластодермы передний конец зародыша уже детерминирован на образование только структур, располагающихся на переднем конце взрослой особи, а задний конец - только задних структур. Раис и Герен применяли этот метод к своим мутантным зародышам и обнаружили у них образование только самых передних, т. е. головных, и задних - брюшных - структур. Никаких элементов груди не возникало. Таким образом, создается впечатление, что у этих мутантов формируются лишь очень специфичные части клеточной бластодермы и что продукты материнских генов принимают участие в целлюляризации определенных частей раннего зародыша.
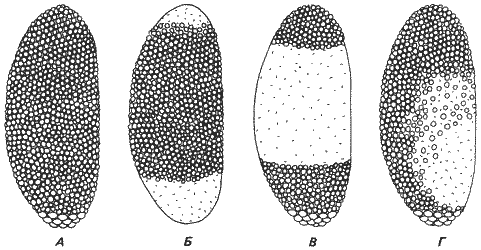
Рис. 7-8. Характер целлюляризации бластодермы у потомков трех самок дрозофилы, несущих мутации с материнским типом наследования. Зародыши расположены таким образом, что их передние концы находятся вверху, а дорсальная поверхность справа. Полярные клетки, расположенные на заднем конце зародыша, крупнее соматических клеток. А. Нормальная самка. Б. Мутант gs. В. Мутант mat (3)6. Г. Мутант mat (3)1 (Rice, Garen, 1975; Mahowald, Caulton, Gering, 1979).
Третью материнскую мутацию этого типа изучал Маховалд (Mahowald) со своими сотрудниками на другом виде - Drosophila subobscura. Это мутация gs (grandchildless), наследуемая по материнскому типу, но несколько иначе, чем мутации, которые изучали Раис и Герен. Самки, гомозиготные по рецессивному аллелю (gs/gs), фертильны и дают жизнеспособных потомков. Однако все их потомки как мужского, так и женского пола стерильны. Таким образом, исходная самка gs неспособна произвести F2 (т.е. «внуков»). В основе этого явления лежит тот факт, что у зародышей, происходящих от матерей gs/gs, не образуются полярные клетки, а следовательно, достигнув взрослого состояния, они неспособны производить гаметы. Более точная причина этой их неспособности состоит в том, что ядра полярных клеток, которые у нормального зародыша мигрируют во время дробления на самый задний его конец, у мутантного зародыша не проделывают этого в нужные сроки. Илмензе и Маховалд (Illmensee, Mahowald) показали, что этот участок зародыша содержит «детерминанты», с помощью которых определяется судьба этих полярных клеток, предназначенных для образования клеток зародышевого пути. Мутация gs, по-видимому, препятствует взаимодействию между ядром и цитоплазмой. Интересно, что у gs-зародышей ко времени образования бластодермы нарушается целлюляризация не только на заднем, но и на переднем конце зародыша. Это показано на рис. 7-8, на котором можно сравнить три мутации, нарушающие образование бластодермы. Любопытный момент состоит в том, что пространственное распределение целлюляризации у gs-зародышей реципрокно ее распределению у mat(3)6-зародышей.
Последняя и, вероятно, самая удивительная мутация, наследуемая по материнскому типу, - это мутация bic (bicaudal) у Drosophila melanogaster. Этот дефект, обусловленный аутосомным рецессивным геном, был впервые обнаружен Баллом (Bull), а позднее был проанализирован Нюсслейн-Фольгардом (Nusslein-Volgard). Гомозиготные самки bic/bic продуцируют зародышей, у которых при гаструляции обнаруживаются два задних конца и ни одного переднего. Удивительно, что, хотя потомки мутантов bic не могут вылупиться из яйцевой оболочки, эти двухвостые уроды, прежде чем погибнуть, завершают эмбриональное развитие и достигают личиночной стадии. Как показывает рис. 7-9, все нормальные кутикулярные структуры заднего конца тела образуются у этих зародышей на обоих концах. Их фенотип поразительно сходен с фенотипом, созданным экспериментально Кальтгоффом (Kalthoff) у двукрылого Smittia, обсуждавшегося в гл. 4. Поэтому разумно предположить, что локус bic ответствен за синтез какого-то продукта, локализованная активность которого сходна с активностью морфогенетического фактора, экспериментально разрушенного Кальтгоффом.
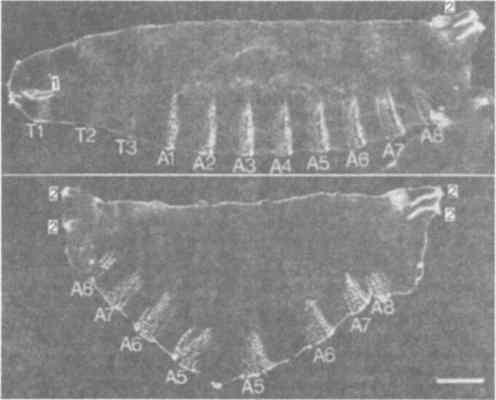
Рис. 7-9. Кутикулы личинок (вид сбоку) дрозофилы, происходящих от нормальной самки (вверху) и самки, гомозиготной по мутации bic (внизу). Микрофотографии сделаны методом темнопольной микроскопии. Личинки повернуты передним концом влево и дорсальной стороной вверх. У мутантных личинок на вентральной поверхности имеются только обильные брюшные зубчики. Форма и расположение этих зубчиков зеркально-симметричны по обе стороны от передне-задней средней линии. 1 - ротовые части; 2 - заднее дыхальце (Nusslein-Volhard, 1977).
Описанные выше примеры показывают участие материнского генома и его продуктов в событиях, происходящих на ранних этапах развития. Существование таких генов, как dor и r, демонстрирует влияние ферментов, поставляемых материнским организмом, на метаболизм раннего зародыша, тогда как дефекты, обнаруженные в результате исследования аллелей mat и bic, показывают, что материнский организм во время оогенеза передает также информацию, касающуюся расположения и организации структур. И наконец, эффекты, вызываемые мутацией Ubl у дрозофилы и мутацией о у аксолотля, вскрывают роль исходящей от материнского организма информации, необходимой для надлежащей активации генома зиготы.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Спонтанные мутации
Спонтанные мутации О внезапных изменениях наследственности знал еще Дарвин. Взгляните на рисунок, где изображены овцы. Слева овца нормальная, в центре и справа овца и баран с сильно укороченными ногами. Сперва появилось одно-единственное такое животное. Изменение
Глава 5 СОМАТИЧЕСКИЕ МУТАЦИИ
Глава 5 СОМАТИЧЕСКИЕ МУТАЦИИ В гл. 4 мы высказали предположение, что соматические мутации V-генов играли важную роль в эволюции иммунной системы позвоночных. Сформулируем теперь несколько вопросов и постараемся ответить на них. Вопрос первый: каким образом создается
Микробы и мутации
Микробы и мутации Рассказ о трансформации, трансдукции и конъюгации должен был убедить читателя, что микроорганизмы действительно могут изменять свою природу. Во всех рассмотренных случаях микробиологи использовали влияние генетического материала (ДНК) одних микробов
ВТМ помогает изучать мутации
ВТМ помогает изучать мутации Вирус табачной мозаики, который уже не раз помогал нам разгадать многие загадки жизни, предлагается и в качестве модели для изучения мутаций. ВТМ содержит рибонуклеиновую кислоту, которая, как мы увидим далее, выполняет ту самую генетическую
Мутации вирусов в лаборатории
Мутации вирусов в лаборатории Мы говорили о мутантах ВТМ, созданных природой. Сегодня нам известны уже и его лабораторные мутанты. Первые из них увидели свет в лаборатории Г. Шрамма.Шрамм в своих опытах исходил из возможности замены аминогруппы (—NH2) в молекуле цитозина
ОПЕЧАТКИ В ДНКовом ТЕКСТЕ (полиморфизм и мутации)
ОПЕЧАТКИ В ДНКовом ТЕКСТЕ (полиморфизм и мутации) Изменчивость — источник всех отрад, суть музыки и вечности уклад. Джон Донн Как великий художник, природа умеет и с небольшими средствами достигать великих эффектов. Г. Гейне Каждый человек уникален, следовательно,
Хромосомные аномалии и мутации
Хромосомные аномалии и мутации Факты, которые мы приводили выше, известны ученым уже довольно давно. Сопоставлением и изучением этих фактов и занимается генетика — наука о явлениях наследственности и изменчивости. Основное положение менделевской генетики — учение о
Полезные мутации переключателей
Полезные мутации переключателей Устойчивость к ядам, вирусам, бактериям и прочим паразитам, защитная окраска, превращение опадающих семян в неопадающие — все это примеры простых адаптаций, для развития которых бывает достаточно одной-двух удачных мутаций, поддержанных
5.1. Мутации
5.1. Мутации Теория мутаций составляет одну из основ генетики. Ее основные положения были разработаны голландским ученым Г. де Фризом еще в начале XX в.Мутации – это наследственные изменения генетического материала. Они характеризуются как редкие, случайные,
Мутации
Мутации Мутация — внезапное изменение гена. Она проявляется в первом же поколении потомков, если мутантный ген будет доминантным. Но рецессивный ген — мутант может скрытно наследоваться в течение нескольких поколений до тех пор, пока в родительскую пару не подберутся
Мутации и изменения, происходящие в онтогенезе
Мутации и изменения, происходящие в онтогенезе Если морфология представляет собой проявление сложного комплекса процессов развития, то эти процессы в свою очередь представляют собой проявление действия целого созвездия генов. Таково важное допущение, положенное в
Мутации, затрагивающие органогенез
Мутации, затрагивающие органогенез Как мы убедились выше, события, происходящие на ранних стадиях развития, в значительной степени зависят от информации, поставляемой материнским организмом. Однако примерно ко времени гаструляции важную роль в дальнейшем развитии
Гомеозис и гомеозисные мутации
Гомеозис и гомеозисные мутации Действие генов теснейшим образом связано с онтогенезом, и эта их связь выявляется при возникновении мутаций, которые резко прерывают развитие организма. Существуют, однако, мутации другого класса, которые изменяют процесс онтогенеза, но
8.2. Мутации
8.2. Мутации Если бы организмы развивались поколение за поколением в одних и тех же окружающих условиях и передавали своему потомству все время одни и те же гены, сочетание эффектов генетической наследственности и морфического резонанса привело бы к бесконечному