Игольное ушко
Игольное ушко
Эволюции организмов присущи величественность и прогрессивное совершенствование морфологии и адаптации, что заставляет предполагать, как это произошло с Геккелем и с Осборном, существование всеобщих управляющих принципов. Однако в то же время именно диапазон эволюционных явлений привел к описанию такого большого числа принципов, которое возможно только в воображении тех, кто их описывает. В этой книге мы пытались документально показать существование характерных особенностей органической эволюции, отражающих те критические изменения эмбриогенетических систем, которые лежат в основе морфологических изменений. Скорости морфологической эволюции сильно варьируют. Морфология брадителических двоякодышащих рыб, в жизни которых периоды оцепенения чередуются с периодами активности в соответствии с бесконечными годичными циклами засухи и ливневых дождей, по существу, не изменилась со времен карбона. Прямо противоположным примером служат тахителические Drosophilidae Гавайских островов, претерпевшие широкую радиацию на этом геологически юном архипелаге. Чрезвычайно низкие скорости мало что говорят нам; они лишь свидетельствуют о том, что определенные морфологические типы и создающие их процессы могут сохраняться, как в случае лягушек, изучавшихся Вилсоном (Wilson) и его сотрудниками, даже на фоне значительной молекулярной эволюции, неуклонно изменяющей гены, кодирующие белки, из которых создается данная консервативная морфология. Низкие скорости эволюции организмов отражают, возможно, действие мощного стабилизирующего отбора, поддерживающего удачные морфологические адаптации. Модификации в пределах данного основного типа онтогенеза, наблюдаемые у медленно эволюционирующих организмов, могут требовать лишь постепенной замены вариантных аллелей в соответствии с представлениями классической теории эволюции. Морфологический застой, достигающий крайнего выражения у живых ископаемых, таких как мечехвост, лингула (брахиоподы) или двоякодышащие рыбы, достаточно обычен. Многие (а возможно, и большинство) виды сохраняют стабильную морфологию на протяжении очень большой части своей истории. Стабильные морфологии и создающие их развивающиеся системы-это, воспользовавшись словами Томаса Харди,
Things mechanized
By coils and pivots set to foreframed codes...
(Механизированные системы с помощью пружин и стержней настроенные для работы по заранее заданному коду)
Объяснения требуют быстрые прерывистые события, и в этих случаях надо менять коды и упомянутые пружины и стержни. Перестраивается морфология, появляются новые структуры, и тем не менее сохраняется внутренняя интегрированность. Как в метафоре Фразетты, машину следует перестраивать, не прерывая ее работы.
Скорость, с которой может происходить морфологическая эволюция, имеет прямые и важные следствия для других характеристик эволюции организма в целом. Любое изменение морфологии требует соразмерного изменения течения развития; это аксиома. Это было очевидно со времени работ Мюллера и Геккеля, хотя значение развития не составляло преобладающей темы эволюционной теории, а создание адекватной концепции эмбриогенетических механизмов становится возможным только теперь. Открытие генов-переключателей, управляющих сегментацией насекомых или детерминирующих дифференцировку зародышевых листков у зародышей млекопитающих, служит несомненным доказательством существования генов, специфическая функция которых состоит в регуляции процессов развития. Возможность различать такие гены имеет решающее значение, поскольку гены могут быть выявлены лишь по фенотипам, экспрессируемым мутантными аллелями. Мутации в большинстве случаев прерывают развитие и обладают плейотропным действием, а поэтому их эффекты трудно проанализировать. Мутация может прервать развитие, потому что продукт мутировавшего гена специфичен для той или иной стадии развития и ген действительно участвует в регуляции соответствующего морфогенетического процесса; или же прекращение развития может быть результатом нарушения одного из общих метаболических путей. В последнем случае воздействие мутации на развитие в феноменологическом плане вполне очевидно, однако его специфичность остается неясной. Несомненными регуляторными элементами развития служат гены, мутантные аллели которых всегда вызывают не остановку развития, а переключение его с одного специфичного и вполне определенного пути на другой, как это столь ярко выражено в случае гомеозисных мутаций. Таким образом, вторая главная черта эволюции организмов состоит в том, что эволюционное изменение происходит путем модификации генетически детерминированной программы развития, имеющейся у каждого организма. Это заключение не следует воспринимать как модель полного генетического детерминизма. Нам известны такие работы, как исследования М. Катца (М. J. Katz) и его сотрудников, свидетельствующие о существовании негенетической пластичности развития. Онтогенетические буферные механизмы имеют большое значение, потому что они делают возможным восприятие генетических модификаций с минимальным нарушением развития.
В реализации программы развития участвует не весь геном. Фактически большая часть ДНК данного организма не несет явных генетических функций, в том смысле, что она не кодирует информацию, экспрессируемую путем транскрипции. Кроме того, сравнения между человеком и его ближайшим эволюционным родичем, шимпанзе, проведенные Кингом и Вилсоном (King, Wilson), показали, что эволюция структурных генов, быть может, мало связана с морфологической эволюцией. Существенную роль в эволюции морфологических признаков играют гены, регулирующие программу развития. Это - важное заключение, поскольку оно ниспровергает широко распространенную концепцию, согласно которой эволюция организмов представляет собой продолжение процессов, приводящих к точковым мутациям в структурных генах, что в свою очередь приводит к аминокислотным замещениям в белках. Это предубеждение наложило отпечаток на большую часть эволюционных построений: эволюционные часы, или постепенное замещение в популяции аллеля, кодирующего один вариант данного фермента, на аллель, кодирующий другой его вариант, ошибочно считали эволюцией.
В 1963 г. Льюис (Е. В. Lewis) высказал мнение об эволюционной роли одного набора регуляторных генов-переключателей у дрозофилы - комплекса bithorax. Переход от сходного с многоножками предка, имевшего большое число конечностей, к примитивному шестиногому насекомому был связан с приобретением первых членов этого комплекса - генов bxd (bithoraxoid) и iab (infra-abdominal). Эти гены подавляют развитие конечностей на брюшных сегментах. Для дальнейшей эволюции Diptera от крылатых насекомых понадобилась эволюция гена bx (bithorax), а также других генов современного комплекса ВХ-С (Bithorax Complex), участвующих в превращении второй пары крыльев, отходящих от заднегруди, в жужжальца. Интересно, что типичные для Diptera признаки возникли до превращения второй пары крыльев в жужжальца, поскольку Рик (Riek) описал четырехкрылого ископаемого представителя Diptera из перми. Такое замороженное состояние в эволюции регуляторного гена служит убедительным аргументом в пользу предположения Льюиса о последовательном возникновении комплекса ВХ-С.
Регуляторные гены, управляющие сегментацией головы и передних сегментов груди, также возникали последовательным образом. Подробное изложение гипотезы о роли комплексов ВХ-С (Bithorax) и ANT-C (Antennapedia) в эволюции головы членистоногих и сегментарной организации, приведшей к насекомым, было дано в гл. 8. Однако эта гипотеза основана на анализе мутаций, которые, хотя и позволяют понять функцию нормальных аллелей генов, входящих в названные комплексы, недостаточны для рекапитуляции предковых форм. Дело в том, что гомеозисные мутации сами по себе не приводят к эволюционным изменениям, - важный момент, который часто недопонимается. Голова, несущая ноги вместо антенн, - это не «перспективный монстр», а лишь констатация функции гена, сформулированная в эксцентричных и вызывающих выражениях. У нее нет эволюционного будущего.
Можно ли доподлинно показать, что мутации регуляторных генов, действуя как переключатели, создают основу для морфологической эволюции? Как уже было сказано, имеются очень веские данные о существовании генов, контролирующих характер закручивания раковины у моллюсков, или генов, контролирующих события, связанные с определением числа амбулакров у иглокожих или числа пальцев у морских свинок; однако об отношении этих генов к эволюционным процессам (что так часто бывает, когда речь идет об эволюции) можно лишь строить предположения. По счастью, Стернберг и Хорвитц (Sternberg, Horvitz) провели очень тонкое исследование, позволяющее недвусмысленно ответить на вопрос об эволюционной роли переключателей.
Стернберг и Хорвитц изучали эмбриогенетическую основу морфологических различий между двумя мелкими видами нематод. Нематода Caenorhabdites elegans за последние годы внезапно приобрела популярность в качестве экспериментального объекта, потому что, будучи довольно сложно организованным представителем Metazoa, она содержит всего около 2000 генов (примерно столько же, сколько Escherichia coli), ограниченное и постоянное число соматических клеток и очень удобна для изучения генетической регуляции развития. Эти ценные качества, С. elegans прекрасно описаны в кратком обзоре Эдгара (Edgar). Указанные выше три особенности этого организма обеспечили Стернбергу и Хорвитцу предпосылки, необходимые для подробного сопоставления в эволюционном аспекте линий клеток, образующих гонады у С. elegans и у представителя того же отряда, но другого семейства - Panagrellus redivivus. Тело взрослой нематоды состоит из небольшого числа клеток (у С. elegans - из 808); судьба каждой клетки строго детерминирована, и это дает возможность точно проследить за соответствующими друг другу клеточными линиями у двух сравниваемых видов.
Яичники Caenorhabdites elegans и Panagrellus redivivus изображены на рис. 12-1. У P. redivivus только один яичник, лежащий ближе к переднему концу тела по отношению к вульве, а у С. elegans - два яичника, открывающиеся в общую вульву. Исходная программа развития клеточной линии, дающей яичники, у этих двух видов в основном одинакова, если не считать некоторых модификаций, наложившихся на более поздних стадиях эволюции. Зачаток гонады состоит из четырех клеток, лежащих вдоль передне-задней оси (клетки Z1, Z2, Z3 и Z4, показанные на рис. 12-1). Две центральные клетки (Z2 и Z3) дают начало клеткам зародышевого пути, а две концевые клетки (Z1 и Z4) однозначно предопределены к образованию соматических структур гонады. На рис. 12-1 представлены схемы раннего развития линий клеток Z1 и Z4 у двух сравниваемых видов. Деление клеток протекает у них одинаково, и судьба образующихся в конечном итоге клеток идентична, за исключением одного важного различия. У С. elegans клетки Z1 и Z4 образуют в зачатке яичника по одной клетке, называемой дистальной концевой клеткой (ДКК), тогда как у P. redivivus образуется лишь одна такая клетка - в линии Z1, а соответствующая клетка в линии Z4 гибнет, причем эта гибель запрограммирована. Это единственное изменение в клеточной судьбе приводит к очень резким и поучительным морфологическим последствиям.
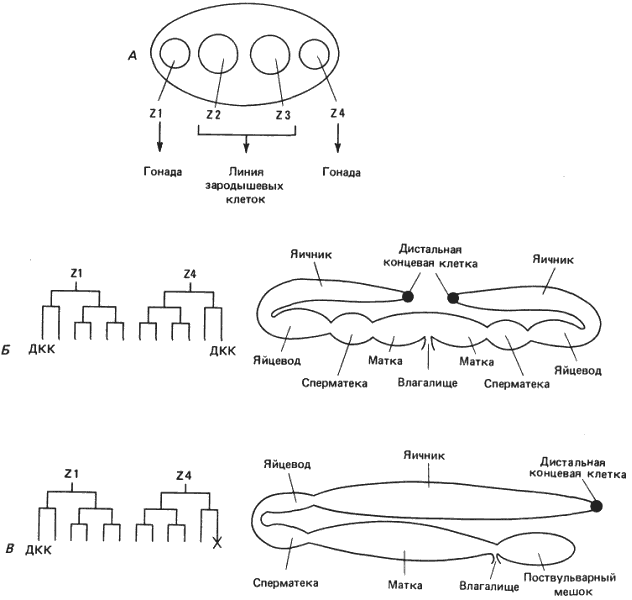
Рис. 12-1. Изменение в процессе эволюции клеточных линий, участвующих в развитии гонад у нематод Caenorhabdites elegans и Panagrellus redivims. А. Зачаток гонады, состоящий из четырех клеток - Zl, Z2, Z3 и Z4; этот зачаток одинаков у обоих видов. Б. Парные гонады С. elegans и схема (слева) клеточных линий Z1 и Z4, из которых образуются соматические структуры гонады. В. Единственная гонада P. redivims и схема (слева) клеточных линий Z1 и Z4. Обратите внимание на запрограммированную гибель (X) дистальных концевых клеток (ДКК), происходящих от линии Z4, в результате чего задняя ветвь гонады не развивается. (Рисунок сделан на основании фотографий и схем, любезно предоставленных Р. V. Sternberg и Н. R. Horwitz.)
Парный яичник Caenorhabdites elegans, по-видимому, соответствует примитивному типу строения, тогда как непарный яичник независимо возникал в процессе эволюции нематод несколько раз. Кимбль и Уайт (Kimble, White), разрушая ДКК у С. elegans с помощью лазерного микролуча, показали, что эта клетка необходима для развития одной из половых трубок. Разрушение ДКК вызывает прекращение митозов в клетках зародышевого пути. Поскольку рост яичника зависит от митозов в клетках зародышевого пути, ветвь, лишенная ДКК, прекращает рост. У С. elegans, лишенной задней ДКК, происходящей из клетки Z4, развивается только передняя половая трубка, и его яичник становится таким как у Panagrellus redivivus. Для эволюции непарного яичника могло бы потребоваться лишь одно мутационное изменение в судьбе одной клетки - запрограммированная гибель клетки, прежде запрограммированной на превращение в ДКК. Мутации в одном гене, вызывающие переключения развития клетки с одного пути на другой, у С. elegans хорошо документированы. Известны мутанты, у которых наблюдаются специфические переключения на запрограммированную гибель в норме жизнеспособных клеток, и один такой мутантный ген, действующий как внутренний разрушитель ДКК, вызывает развитие у С. elegans непарного яичника. Стернберг и Хорвитц полагают, что если переключения происходят в регуляторной клетке (которую они определяют как клетку, осуществляющую контроль над другими клетками), то тем самым создается возможность для прерывистых эволюционных переходов. Так, среди генетических изменений, происходивших в процессе филогенеза P. redivivus, изменения в судьбе клеточной линии Z4 почти наверное возникли в результате изменения одного гена и тем не менее привели к радикальным морфологическим последствиям.
Стернберг и Хорвитц при своем детальном сравнении Caenorhabdites elegans и Panagrellus redivivus обнаружили три класса превращений в клеточных линиях, для которых у С. elegans имеются мутационные эквиваленты. К первому классу относятся переключения, изменяющие судьбу клеток, примером которых служит линия Z4. К двум другим относятся изменения числа клеточных делений, характерного для данной клеточной линии, и изменение сегрегации, приводящее к тому, что потенции развития, обычно характерные для одной клетки, переносятся на ее сестринскую клетку. Благодаря существованию у С. elegans мутаций, которые экспрессируются в виде превращений, эквивалентных наблюдаемым при эволюции, эта нематода служит системой, позволяющей получить много сведений о генетике генов-переключателей, управляющих этими явлениями. В этом смысле нематоды создают возможность для генетического подхода к проблеме клеточной детерминации, так хорошо изученной на классических объектах - моллюсках со спиральным дроблением и оболочниках, которые оказались непригодными для генетических исследований. Остается выяснить, не эквивалентны ли гены-переключатели нематод гомеозисным генам-переключателям дрозофилы.
Среди всех способов изменения онтогенеза в процессе эволюции наибольшее внимание уделяется изменениям сроков. Зародышевое развитие связано с широким разнообразием перемещений и структурных усложнений во времени.
Этот процесс носит характер неизбежности, напоминая исполнение хорошо отрепетированной программы, в которой все события сменяют друг друга в точно установленные сроки. Такое сравнение в большинстве случаев допустимо, однако известны многочисленные случаи диссоциации во времени одного онтогенетического процесса от другого, и, как показывает обширный ряд эволюционных примеров, гетерохрония действительно представляет собой обычный фактор эволюции. Этому есть веская причина - необходимость сохранения интегрированной программы развития. Гетерохрония обычно приводит к неразрушительным модификациям данного пути развития. Существующие интегрированные процессы лишь сдвигаются друг относительно друга, но общая функциональная интегрированность сохраняется. В результате зрелый в репродуктивном отношении организм с личиночной морфологией сохраняет комплекс адаптации к среде и способное функционировать строение тела. Другие более тонкие гетерохронии компенсируются имеющимися системами морфогенетического гомеостаза. Если такой процесс, как рост, инициируется несколько раньше или позже, чем в норме, он может в конечном итоге привести к изменению относительных пропорций каких-либо двух структур, однако если это изменение не нарушает некого необходимого взаимодействия с какой-нибудь третьей тканью, то уже установившиеся морфогенетические процессы будут иметь место. К модификации пропорций, происходящей на относительно поздних стадиях развития, организм может легко приспособиться, если она окажется селективно выгодной в тех условиях среды, в которых обитает данное животное.
Несмотря на то что было идентифицировано лишь несколько мутаций, воздействующих на сроки наступления различных событий, исследований, пытающихся выяснить генетическую основу временных регуляторов развития, проводится удивительно мало. Отсутствие знаний по этой проблеме - лишь часть более крупного пробела в биологии, охватывающего широкий диапазон явлений, связанных со сроками, - от регуляции во времени синтеза ДНК в клетках до регуляции суточных ритмов у животных. Небольшое число выявленных до сих пор мутаций, которые изменяют сроки различных событий, происходящих в процессе развития, позволяют считать, что существуют отдельные гены, специфически регулирующие эти сроки. Некоторые из них, такие как гены, от которых зависит, пойдет ли развитие личинки аксолотля по пути метаморфоза или неотении, по-видимому, аналогичны обсуждавшимся ранее дизруптивным мутациям. У аксолотля неотения представляет собой результат недостаточного образования тироксина и вытекающих из этого последствий для всех тканей. Другие гены привлекают к себе внимание тем, что они обладают свойствами специфичных переключателей. К этому классу принадлежит, возможно, мутация anemic аксолотля, задерживающая начало синтеза глобина взрослого типа. Идентифицированы генетические элементы, контролирующие сроки экспрессии ферментов в онтогенезе нескольких организмов. Эти элементы, которые К. Пейджен (К. Paigen) назвал «временнЫми генами», тесно сцеплены со структурными генами, которые они контролируют, и активны в цис-положении.
В настоящее время наиболее доступны для изучения гены гетерохронии, действующие на переключатели, которые определяют направление развития клеточных линий у нематоды С. elegans. Шалфи (Chalfie) и его сотрудники проанализировали первый из них - мутантный аллель lin-4, вызывающий в клеточных линиях повторение, в результате чего эти линии не могут обеспечить образование дефинитивных клеток, характерных для взрослого организма. Вместо этого вновь и вновь образуются клетки, характерные для личинок первого возраста. Таким образом, в отличие от нематоды дикого типа, проходящей в своем развитии через ряд стадий
зародыш ? L1 ? L2 ? L3 ? L4 ? взрослый червь,
у мутантов lin-4 наблюдается крайне аномальная последовательность личиночных клеточных линий
зародыш ? L1 ? L1 ? L1 ? L1 ? L1 .
To есть вместо обычной смены личиночных стадий у них повторяется стадия L1. Аллель lin-4 действует только на эктодермальные линии, не затрагивая многие другие соматические линии и развитие гонад, так что после последней линьки у личинки имеется половозрелая гонада. На каждой личиночной стадии кутикула обладает характерной, специфичной для данной стадии морфологией и белковым составом. Согласно Коксу, Стапрансу и Эдгару (Сох, Staprans, Edgar), существует, по-видимому, до 30 различных коллагеноподобных белков, экспрессирующихся на разных стадиях на протяжении личиночного развития. Кутикула реитеративного мутанта lin-4 сходна по своей морфологии с кутикулой нормальной личинки стадии L2 и имеет соответствующий белковый состав. Этого и следовало ожидать, потому что одна из функций нормальной личинки стадии L1 состоит в том, чтобы при первой линьке образовать кутикулу для личинки L2.
Второй сходный, но иной ген в настоящее время изучают Амброс и Хорвитц (Ambros, Horvitz). Некоторые мутантные аллели в этом локусе обусловливают выпадение делений, характерных для клеточных линий в течение стадии L1, что приводит к ускорению морфологического развития. Переходы из одной личиночной стадии в другую у С. elegans, возможно, соответствуют метаморфозам, главным переходным стадиям, на которых происходят существенные переключения. Хорвитц, Стенберг и Амброс, а также Эдгар считают, что эти стадии можно рассматривать как «временные компартменты», аналогичные пространственным компартментам дрозофилы, обнаруживаемым частично благодаря функциям генов-переключателей Antennapedia и bithorax. Таким образом временные переключатели, возможно, имеются у С. elegans.
Последняя и крайне существенная характеристика органической эволюции состоит в том, что морфогенез, по-видимому, управляется относительно небольшим числом регуляторных генов. У Drosophila melanogaster - наиболее хорошо изученной генетической системы среди Metazoa - общее число генов достигает примерно 5000. Значительная доля этих генов необходима для развития, но только для небольшой их части установлено, что они необходимы для принятия решений при выборе направления морфогенеза. Эта тема неоднократно возникала в нашей книге при рассмотрении отдельных примеров. Всего лишь 10 генов должны были измениться, чтобы возникли значительные различия в морфологии головы, наблюдаемые между гавайскими дрозофилидами D. heteroneura и D. silvestris (см. рис. 3-8). Неясно, в чем заключается действие именно этих морфогенетических генов; вероятнее всего, они влияют на весьма разнообразные процессы, в том числе на спецификацию позиционной информации, сроки развития и индукционные события. Для того чтобы выявить природу модификаций, происходящих в программе развития, необходимо провести подробный анализ развития. Возможно, что эти 10 генов составляют лишь небольшую долю генов, участвующих в морфогенезе головы, - ту их долю, которая участвует в каком-то частном эволюционном изменении. Тем не менее это небольшое число соответствует результатам других исследований, на основании которых выводилось число регуляторных генов.
Наилучшими примерами генов, контролирующих морфогенез, служат гены, регулирующие положение, число и индивидуальность головных, грудных и туловищных сегментов у дрозофилы. Гены, определяющие сегментарное строение, можно разделить на два больших класса: гены, которые активны во время оогенеза и создают в яйце позиционную информацию, и гены, которые активны во время эмбриогенеза и участвуют в интерпретации позиционной информации. Лишь два гена, участвующие в установлении позиционной информации, хорошо изучены. Существование этих генов было выявлено благодаря двум мутациям с материнским эффектом, - bicaudal и dorsal, изученным Нюсслейн-Фольгардом (Nusslein-Volhard). Были открыты также другие гены с материнским эффектом и аналогичными функциями. Согласно Вишаузу (Wieschaus), частота обнаружения таких мутаций указывает, что общее число этих генов, вероятно, не намного выше 20.
Существуют два подкласса генов, активных во время эмбриогенеза, которые можно выявить по их мутациям, нарушающим сегментацию. Считается, что члены первого подкласса кодируют продукты, функция которых состоит в интерпретации получаемой от материнского организма позиционной информации, необходимой для детерминирования местоположения сегментов и их числа. В то же время члены второго подкласса интерпретируют позиционную информацию, необходимую для детерминирования индивидуальности (т.е. специфических особенностей) каждого сегмента. В результате проведенных Нюсслейн-Фольгардом и Вишаузом систематических поисков было обнаружено 15 разбросанных по геному мутантных локусов, которые обусловливают отклонения в числе сегментов и их полярности. Позднее было выявлено еще семь таких генов. Мутантные аллели распадаются на три обособленные категории: гены, оказывающие влияние на большой участок зародыша; гены, влияющие на пары сегментов; гены, влияющие на отдельные сегменты. Возможно, что существование этих категорий указывает на постепенность в установлении сегментации, а, судя по числу выявленных мутантов, 22 обнаруженных гена составляют преобладающее большинство генов этого типа.
Интерпретация позиционной информации, необходимая для детерминирования индивидуальности сегментов, связана с функционированием генов Рс (Polycomb) и esc (extra sex comb), которые, как указывают Льюис и Штруль (Lewis, Struhl), служат регуляторами комплексов Antennapedia и Bithorax. Примерно 15 генов, входящих в эти два комплекса, экспрессируются в течение зародышевого развития и детерминируют индивидуальные особенности отдельных сегментов и последующую морфологическую дифференцировку каждого из них. Таким образом, примерно 50-60 генов, активных во время оогенеза и зародышевого развития, достаточно для создания основной морфогенетической программы сегментации. Нет сомнений, что на последующих стадиях морфогенеза функционирует ряд других генов. Однако представляется вероятным, что, хотя для всей совокупности подпрограмм, определяющих морфогенез структур в пределах одного сегмента, может понадобиться большое число генов, для каждой отдельной структуры, возможно, требуется лишь несколько основных команд. Это заключение еще нуждается в подтверждении; однако в пользу того, что для каждой отдельной подпрограммы достаточно наличия ограниченного числа переключателей, свидетельствуют данные об участии в детерминировании числа пальцев на лапах морской свинки всего лишь четырех генов.
Все это имеет глубокие последствия для эволюции. В онтогенезе принимают участие многочисленные гены, экспрессирующиеся в целом комплексе очень стабильных процессов. У дрозофилы примерно треть общего числа генов, поддающихся выявлению, экспрессируется специфичным для развития образом и необходима для успешного завершения определенных стадий развития. Тем не менее число переключателей невелико и изменения в переключаемых функциях могут оказывать глубокое влияние на морфогенез. Важно отметить, однако, что эволюция - процесс многоступенчатый. Главное значение изменений генов, несущих регуляторные функции, состоит, возможно, в создании изменений онтогенеза, которые затем служат сырьем для дальнейших изменений в каком-либо новом направлении. Дальнейшее изменение и консолидация этого нового направления происходят путем возникновения мутаций в генах, модифицирующих главный регуляторный ген. В процессе всех этих эволюционных переходных стадий морфогенеза могут сохраняться канализация и интеграция.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК